Похожие презентации:
Третья группа ПС
1.
III Группа ПС («короткий» вариант ПС)Главная подгруппа: бор, алюминий и элементы подгруппы галлия
Побочная подгруппа: подгруппа Sc + лантаноиды + актиниды
p d (f) f f
f
f
f
f Особенности группы в целом:
-самая элементоемкая группа (37
B
элементов);
-самая «аномальная группа»;
«аномальные» элементы: B, Ga, Tl – в
Al
Sc
главной подгруппе,
Sc, Ce, Tb, Eu, Yb – в побочной.
Ga
(Элементы, у которых заполнение
Y
электрона впервые происходит на
In
La Ce Pr Nd Pm Sm Eu новые оболочки: B, Sc, Ce)
Gd Tb Dy Ho Er Tm Yb Следствие «аномальностей»:
Lu
аналогии – особенно в главной
Tl
Ac Th Pa U Np Pu Am подгруппе проследить более сложно,
Cm Bk Cf Es Fm Md No чем в других подгруппах;
Lr
2.
III Группа ПС («короткий» вариант ПС)Главная подгруппа: бор, алюминий и элементы подгруппы галлия
Побочная подгруппа: подгруппа Sc + лантаноиды + актиниды
p d (f) f f
f
f
f
f Особенности группы в целом
(продолжение):
B
-разница между элементами III главной
и III побочной подгрупп минимальна в
Al
ПС (в максимальной степени окисления
Sc
+3 элементы подгруппы скандия
Ga
приобретают структуру sp элементов
Y
(s2p6), а элементы подгруппы галлия –
структуру d– элементов d10, т.е.
In
La Ce Pr Nd Pm Sm Eu главная и побочные подгруппы как бы
Gd Tb Dy Ho Er Tm Yb
меняются местами).
Lu
Tl
Ac Th Pa U Np Pu Am
Cm Bk Cf Es Fm Md No
Lr
3.
Особенности химии бора и его соединений:- для впервые появившегося на p- орбитали
электрона потенциал ионизации очень велик (по
этой причине преобладающими становятся
неметаллические свойства);
-появляется диагональная аналогия с кремнием;
-реализуются соединения с дефицитом электронов
(например, диборан B2H6 и другие бораны),
которые не трактуются в МВС;
-изоэлектронная углероду пара B-N может давать
огромное многообразие «псевдоорганических»
соединений и, возможно, быть альтернативой
известной нам углеродной жизни.
4.
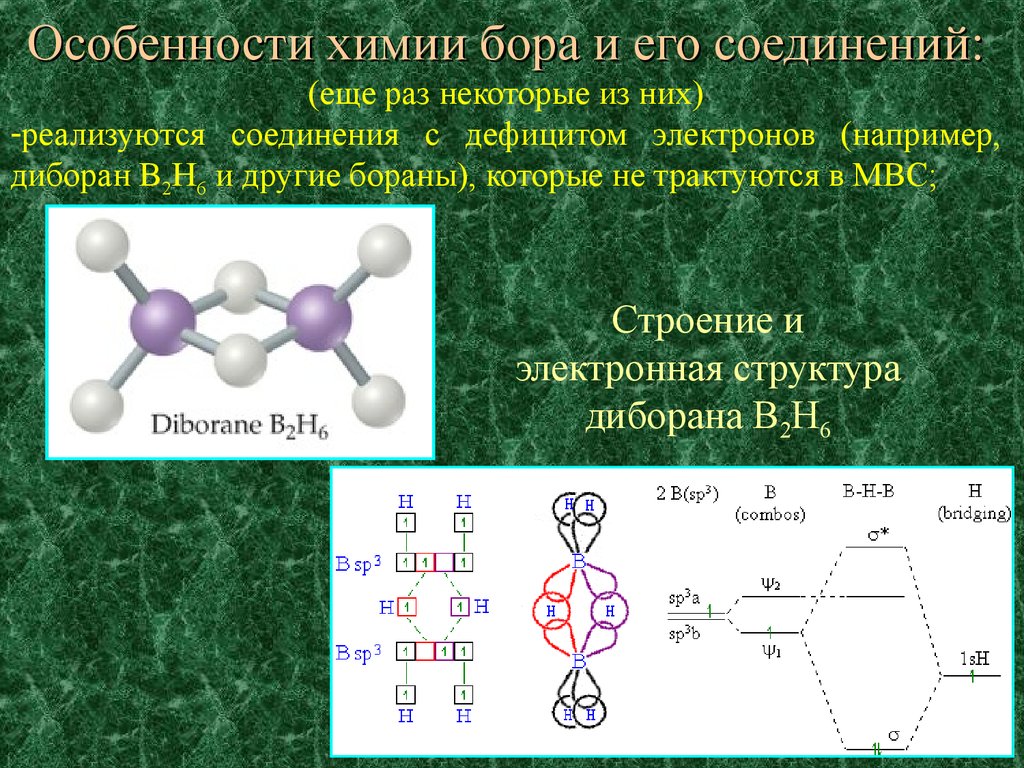
Особенности химии бора и его соединений:(еще раз некоторые из них)
-реализуются соединения с дефицитом электронов (например,
диборан B2H6 и другие бораны), которые не трактуются в МВС;
Строение и
электронная структура
диборана B2H6
5.
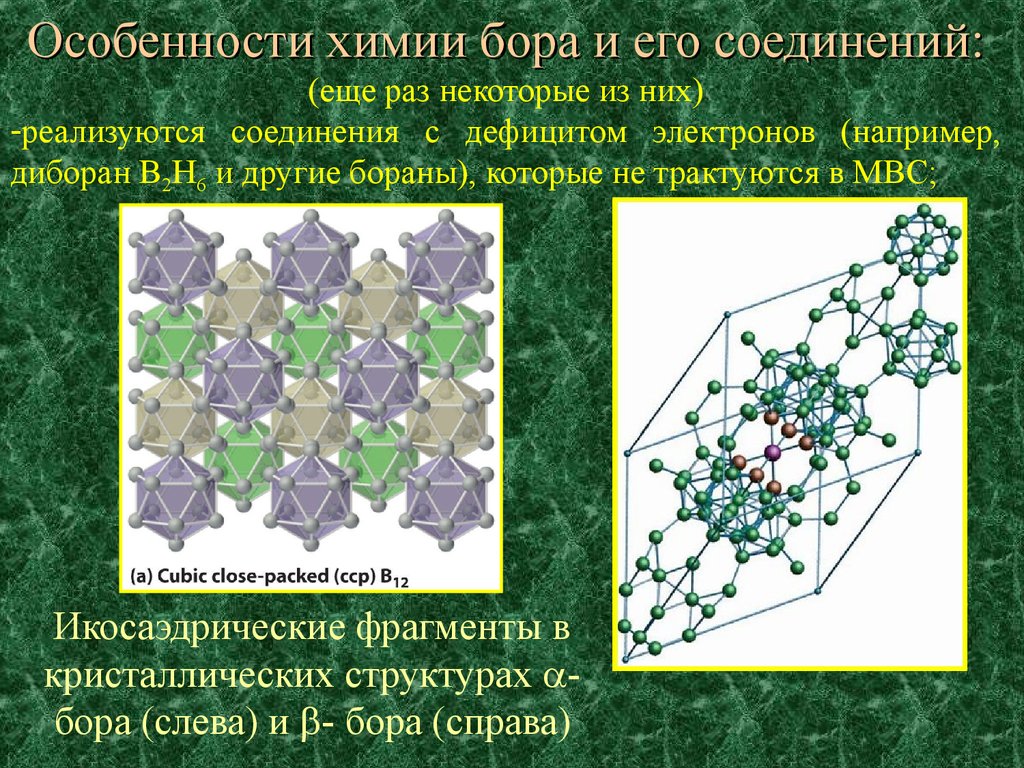
Особенности химии бора и его соединений:(еще раз некоторые из них)
-реализуются соединения с дефицитом электронов (например,
диборан B2H6 и другие бораны), которые не трактуются в МВС;
Икосаэдрические фрагменты в
кристаллических структурах бора (слева) и - бора (справа)
6.
Особенности химии бора и его соединений:(еще раз некоторые из них)
-изоэлектронная углероду пара B-N может давать огромное многообразие
«псевдоорганических» соединений и, возможно, быть альтернативой известной
нам углеродной жизни.
Структура “неорганического
бензола”
Li[BH4] + NH4Cl = =B3N6H6 + 3LiCl + 9H2
(HC-CH)(BH)10 - трехмерное
высокоароматическое соединение – орто-караборан
7.
Свойства бора (продолжение)1.Единственный неметалл в 13 группе
2.Очень высокие т.пл. (2573 оС) и т.кип. (3660 оС)
3. = 2.35 г/см3 – черный, кристаллический бор;
= 1.73 г/см3 – коричневый, аморфный бор
4.Кристаллический бор очень твердый (9.5 по шкале
Мооса)
5.Кристаллический бор – полупроводник,
Еg = 1.55 эВ
6.Бор имеет 2 стабильных изотопа 10В, 11В
10
В + 1n = 4He + 7Li – замедление нейтронов
7.Бор – восстановитель, Е0(Н3ВО3/В) = -0.87 В
8.
Химические свойства бора1.Бор химически инертен. Не реагирует с водой,
кислотами и щелочами при н.у.
2.При нагревании реагирует с неметаллами
4B + 3O2 = 2B2O3
700oC
2B + 3Cl2 = 2BCl3
800oC
2B + N2 = 2BN
900oC
3.При Т>1000оС реагирует со многими металлами и
оксидами
2B + Al = AlB2
10B + 2P2O5 = P4 + 5B2O3
2B + 3H2O = 3H2 + B2O3
4. Окисляется кислотами-окислителями и в щелочных
расплавах
B + 3HNO3 конц = H3BO3 + 3NO2
∼100oC
2B + KClO3 + 2KOH = 2KBO2 + KCl + H2O
9.
Прочие особенности химии бора и его соединений:соединений
•Преобладание кислотных свойств над основными для
оксида и гидроксида бора:
B2O3 + 2NaOH(расплав) = NaBO2 + H2O
B2O3 + 3H2O 2B(OH)3 ; при нагревании борная кислота (
B(OH)3 H3BO3 ) разлагается;
B(OH)3 + H2O H[B(OH)4] H+ + [B(OH)4]
(сильно смещено влево!);
B(OH)3 – амфолит с преобладанием кислотных свойств:
•B(OH)
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O.
Но:
2 B(OH)3 + 3H2SO4 (б/в) = B2(SO4)3 + 3H2O
•Склонность бора к формированию ковалентности, равной
4 (одна из связей сформирована по д/а механизму): LiH +
B2H6 = 2Li[BH4]
•Склонность к образованию сложных эфиров со спиртами:
10.
Прочие особенности химии бора и его соединений (продолжение):(продолжение)
• Образование изополикислот (или их солей)
при поликонденсации борной кислоты
(запишем B(OH)3 как (HO)2-B-OH):
(HO)2-B-OH + HO-B-(OH)2
HOH + (HO)2-B-O-B(OH)2
и далее:
HO-B-O-B-OH + HO-B-O-B-OH
OH
OH
HOH + HO-B-O-B-O-B-O-B-OH и т.д.
OH
OH
Анион, входящий в
структуру буры
Na2B4O7∙xH2O
x = 2;7;10
11.
Подробнее о:о
диагональной аналогии с кремнием. Проявляется в
•стеклах: боратные стекла – наиболее близкие аналоги
силикатных стекол;
•высокой устойчивости фторидных комплексов; это
проявляется, в частности, в способности боратных и
силикатных стекол растворяться в плавиковой кислоте:
B2O3 + 8HF = 2H[BF4] + 3H2O = 2H+ + 2[BF4] + 3H2O;
SiO2 + 6HF = H2[SiF6] + 2H2O = 2H+ + [SiF6]2 + 2H2O;
•полупроводниковых св-вах простых крист. B и Si;
•способности формировать соли – производные изо- и
гетерополикислот.









 Химия
Химия