Похожие презентации:
Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции
Окислительновосстановительные реакции2.
Окислительно-восстановительные процессыосуществляются
с
переносом электронов от одного
реагирующего вещества к другому
и сопровождаются изменением степеней
окисления этих веществ.
Частица (атом, ион, молекула), принимающая
электрон – окислитель;
отдающая электрон - восстановитель
3.
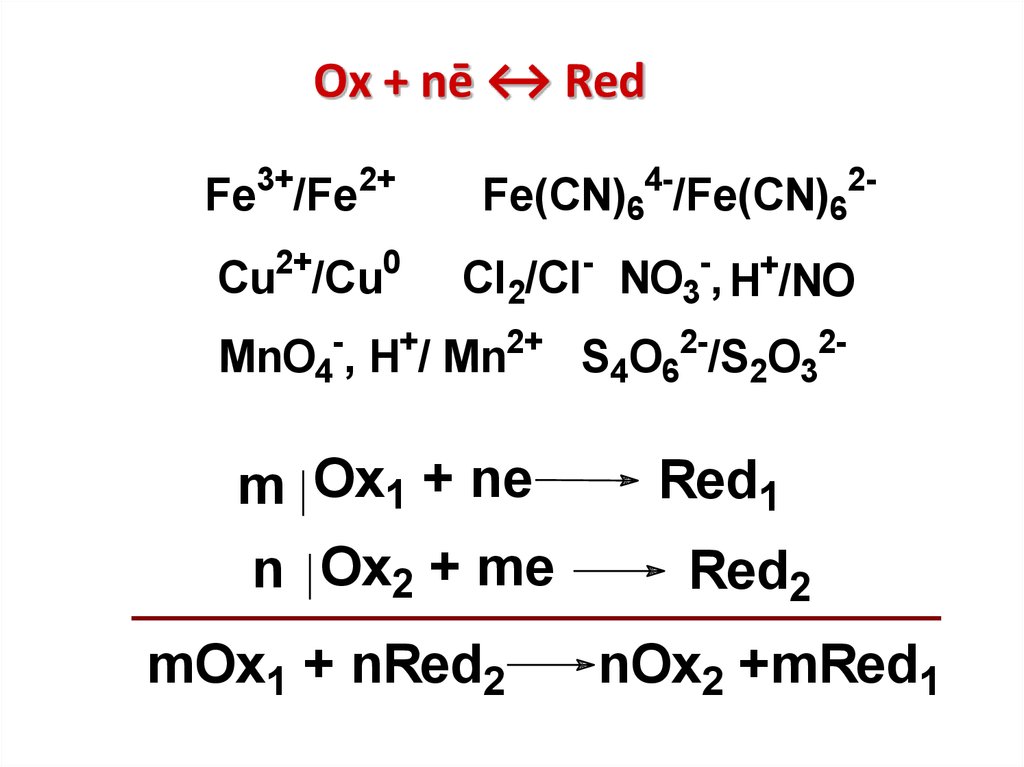
Ox + nē ↔ Red3+
Fe /Fe
2+
Cu2+/Cu0
42Fe(CN)6 /Fe(CN)6
Cl 2/Cl - NO3-, H+/NO
MnO4-, H+/ Mn2+ S4O62-/S2O32-
m Ox1 + ne
n Ox2 + me
mOx1 + nRed2
Red1
Red2
nOx2 +mRed1
4.
Мера окислительно-восстановительнойспособности редокс-пары –
окислительно-восстановительный
потенциал полуреакции Ox + nē ↔ Red
Измерить можно только разность
потенциалов двух редокс-пар
Zn2+/Zn0
CuSO4 + Zn0
Cu2+/Cu0
ZnSO4 + Cu0
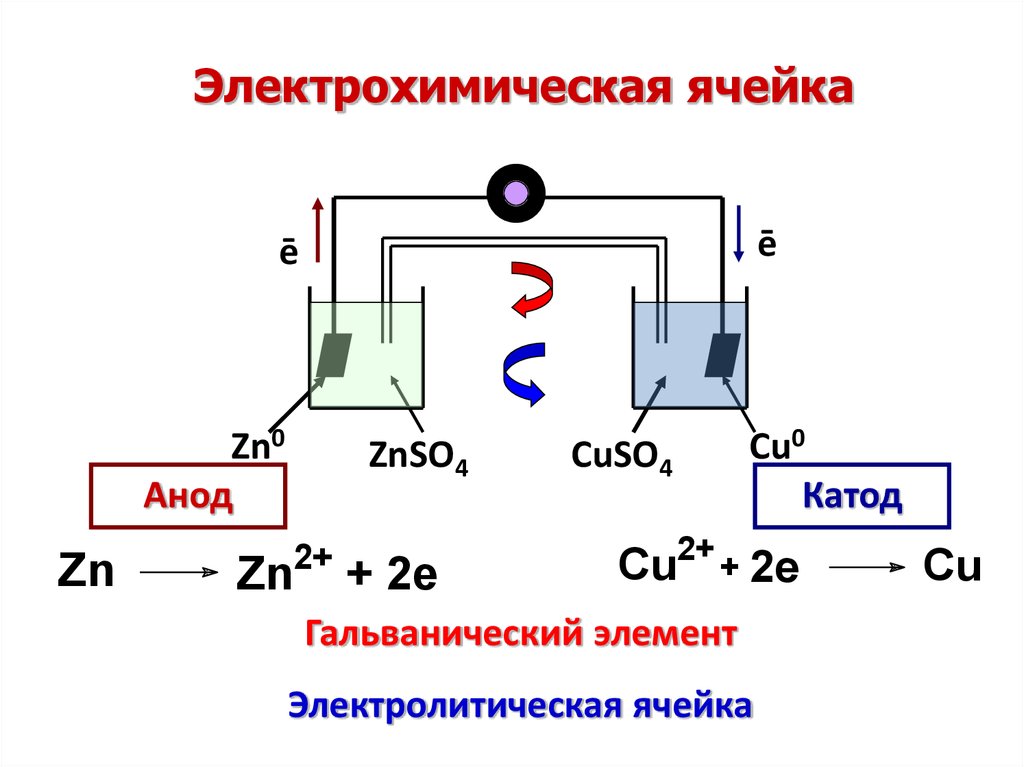
5.
Электрохимическая ячейкаē
ē
Zn0
Анод
Zn
ZnSO4
2+
Zn
+ 2e
CuSO4
Cu0
Катод
Cu2+ + 2e
Гальванический элемент
Электролитическая ячейка
Cu
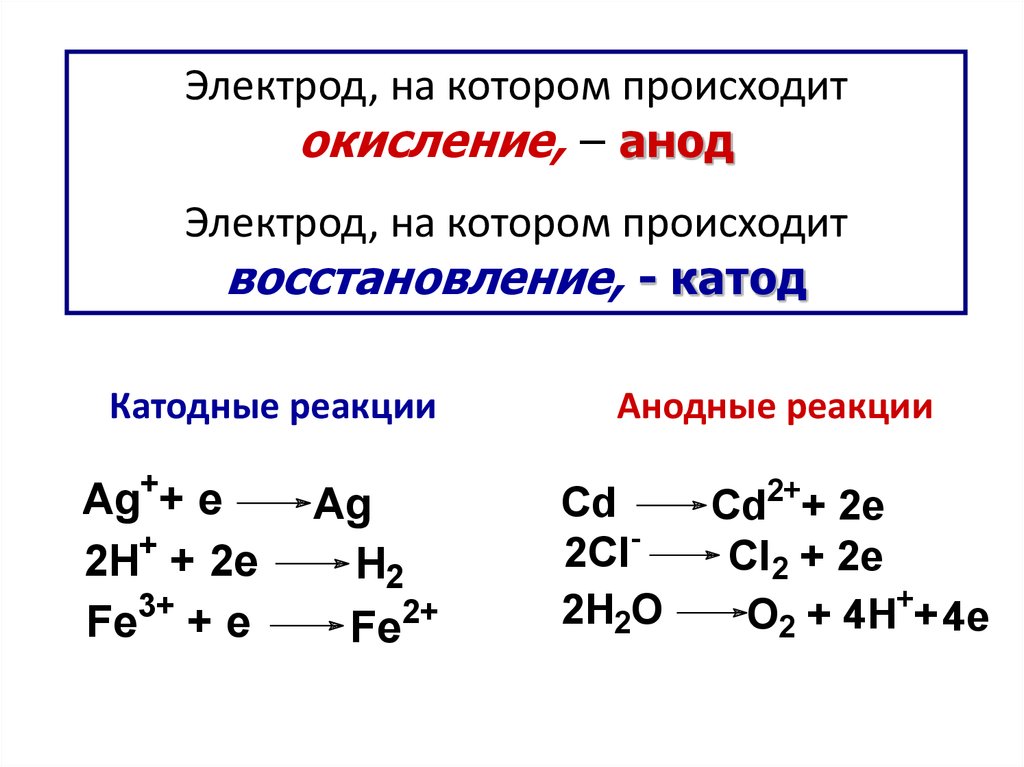
6.
Электрод, на котором происходитокисление, – анод
Электрод, на котором происходит
восстановление, - катод
Катодные реакции
+
Ag + e
+
2H + 2e
Fe3+ + e
Ag
H2
Fe2+
Анодные реакции
Cd
2Cl 2H2O
Cd2++ 2e
Cl 2 + 2e
O2 + 4H++ 4e
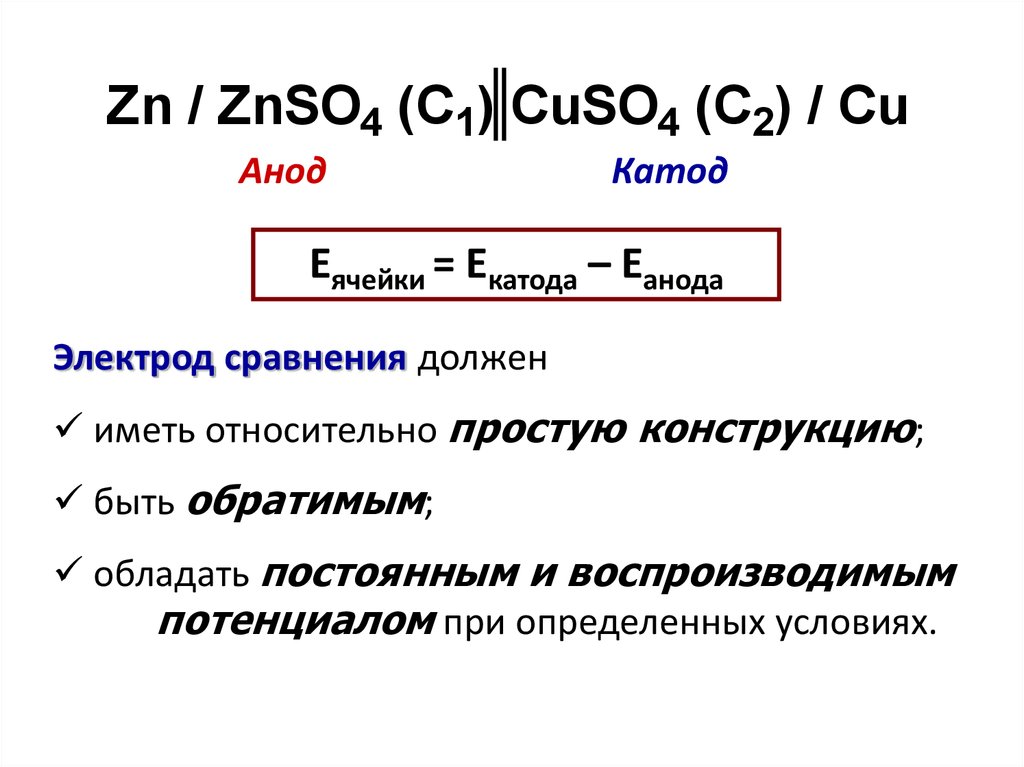
7.
Zn / ZnSO4 (C1) CuSO4 (C2) / CuАнод
Катод
Еячейки = Екатода – Еанода
Электрод сравнения должен
иметь относительно простую конструкцию;
быть обратимым;
обладать постоянным и воспроизводимым
потенциалом при определенных условиях.
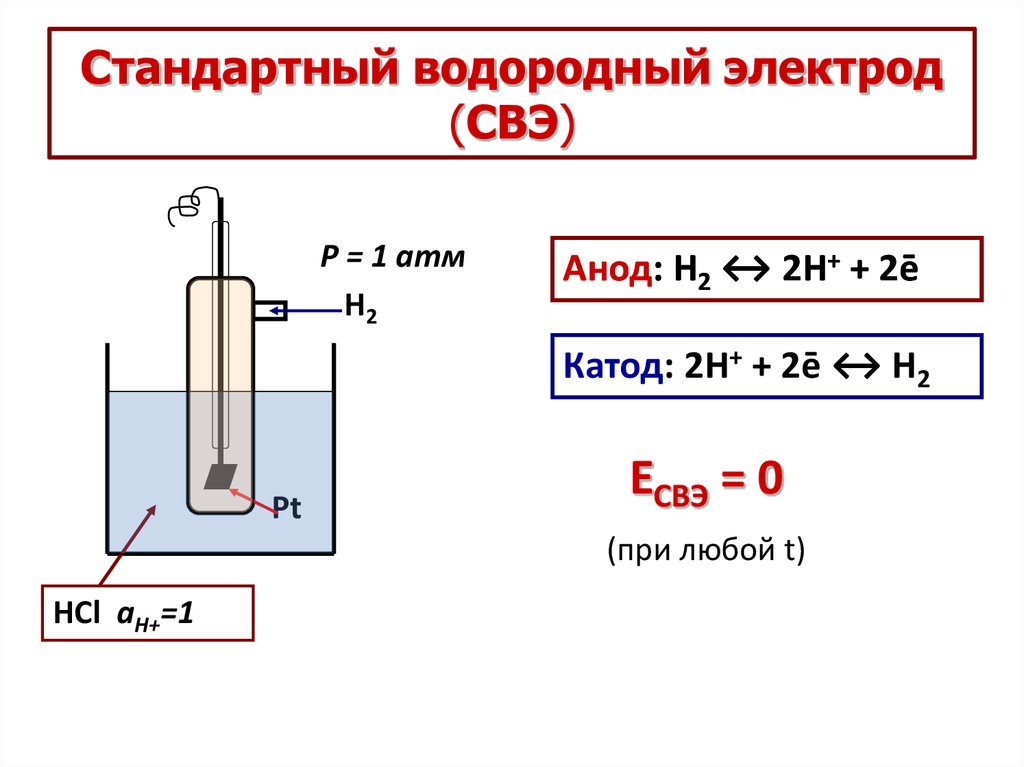
8. Стандартный водородный электрод (СВЭ)
P = 1 атмH2
Анод: H2 ↔ 2H+ + 2ē
Катод: 2H+ + 2ē ↔ H2
Pt
ЕСВЭ = 0
(при любой t)
HCl aH+=1
9.
Соглашение IUPAC (1953 г.)Все реакции записывают в форме
полуреакции восстановления.
За знак потенциала принимают
действительный знак получаемого
электрода относительно СВЭ.
Zn2++ 2e
2+
Cd + 2e
2+
Cu + 2e
3+
Fe + e
0
Zn
E = -0,76B
Cd0
0
Cu
2+
Fe
E = -0,40B
E = +0,33B
E = +0,77B
10.
«-» означает, что окислитель данной пары сильнее,чем Н+;
СВЭ - анод: H2 ↔ 2H+ + 2ē
«+» означает, что восстановитель данной пары
сильнее, чем Н2;
СВЭ - катод: 2H+ + 2ē ↔ H2
Знак Е указывает, будет ли процесс
восстановления протекать самопроизвольно
11. Уравнение Нернста
Ox + nē ↔ Red0
E = E + RT/nF ln aOx/aRed
R – молярная газовая постоянная, 8,314 Дж.моль-1.К-1; T –
абсолютная температура; n - число электронов; F – число
Фарадея, 9,65.104 Кл;
Е–
равновесный электродный потенциал;
E0 – стандартный электродный потенциал.
12.
При 250С0
E = E + 0,059/n lg aOx/aRed
При 200С – 0,058;
300С – 0,060
Стандартный электродный потенциал –
это равновесный потенциал полуреакции при
активностях всех участвующих в равновесии
частиц, равных 1.
Зависит только от температуры, давления и
природы растворителя.
I=0, γ=1, α=1
13.
I≠0, γ≠1, α≠1aOx = COx· γOx·αOx
aRed = CRed· γRed·αRed
Формальный электродный потенциал –
равновесный потенциал при общих концентрациях
окисленной и восстановленной форм, равных
1М, и известных концентрациях всех других
компонентов реакции
14. Факторы, влияющие на Е0’
рН средыOx + nē + mH+ ↔ Red + m/2 H2O
EOx/Red = E0Ox/Red + 0,059/n lg[H+]m +
+ 0,059/n lg[Ox]/[Red]
E0’Ox/Red = E0Ox/Red – 0,059/n · m pH
MnO4- + 8H++ 5e
EMnO4-/
Mn2+
=
E0MnO -/ 2++
4 Mn
Mn2++ 4H2O
0,059/5lg [MnO4-][H+]8/[Mn2+]
E0’MnO4- /Mn2+= E0MnO4- /Mn2+ - 0,059/5.8pH
15. Конкурирующие реакции образования малорастворимых соединений
Ox + A ↔ OxAOxA + nē ↔ Red + A
KSOxA= [Ox][A]
[Ox] = KSOxA/[A]
Напишите вывод формулы для расчета формального потенциала
системы в случае1) связывания окисленной формы - !сделали на
лекции и 2) восстановленной формы - самостоятельно
16. Конкурирующие реакции комплексообразования
Ox + mL ↔ OxLmOxLm + nē ↔ Red
βm = [OxLm]/[Ox][L]m
Напишите вывод формулы для расчета
формального потенциала системы в случае1)
связывания окисленной формы и 2)
восстановленной формы - самостоятельно
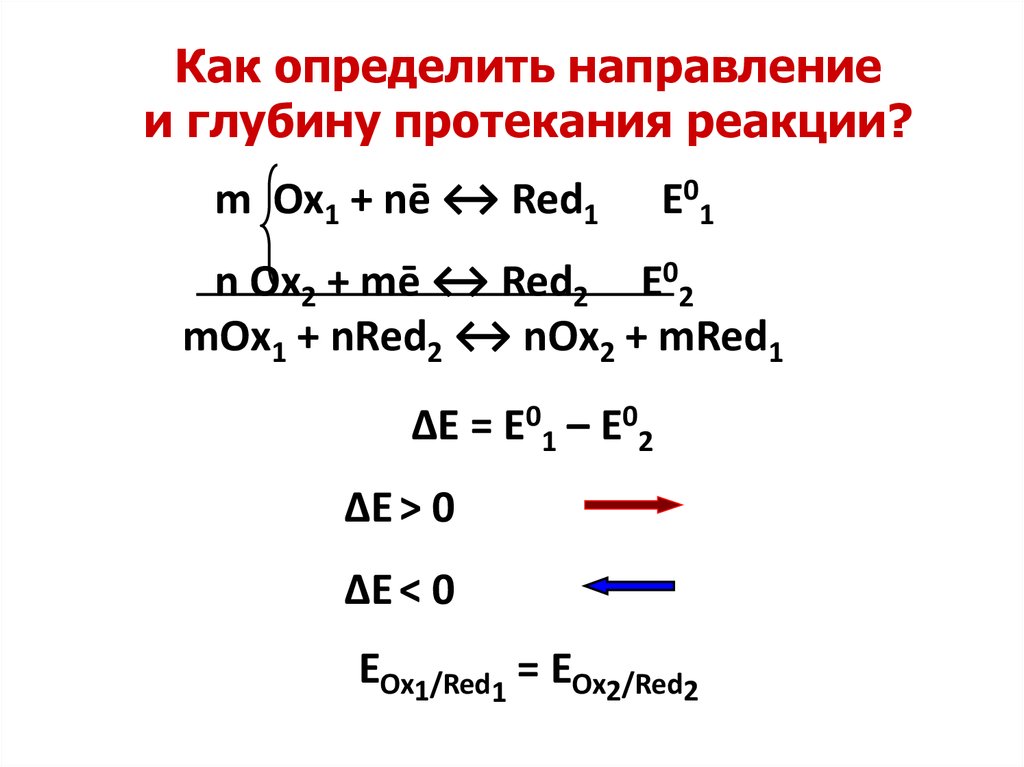
17. Как определить направление и глубину протекания реакции?
m Ox1 + nē ↔ Red1E01
n Ox2 + mē ↔ Red2 E02
mOx1 + nRed2 ↔ nOx2 + mRed1
ΔE = E01 – E02
ΔE > 0
ΔE < 0
EOx1/Red1 = EOx2/Red2
18.
EOx1/Red1= E0Ox1/Red1 + 0,059/nm lg aOx1m/aRed1mEOx2/Red2=
E0Ox1/Red1-
E0Ox2/Red2 + 0,059/nm
lg aOx2n/aRed2n
n
m
a
a
E0Ox2/Red2 = 0,059/nm lg Ox2 n Red1
aRed2 aOxm
1
lgKp = nm
Kравн > 1
0
(E 1
-
0
E 2)
/ 0,059
Kравн < 1
На направление и глубину протекания реакций влияют все факторы,
изменяющие Е0’Ox/Red
Обратите внимание! В формуле должны быть Формальные потенциалы, если есть конкурирующие
реакции.
19.
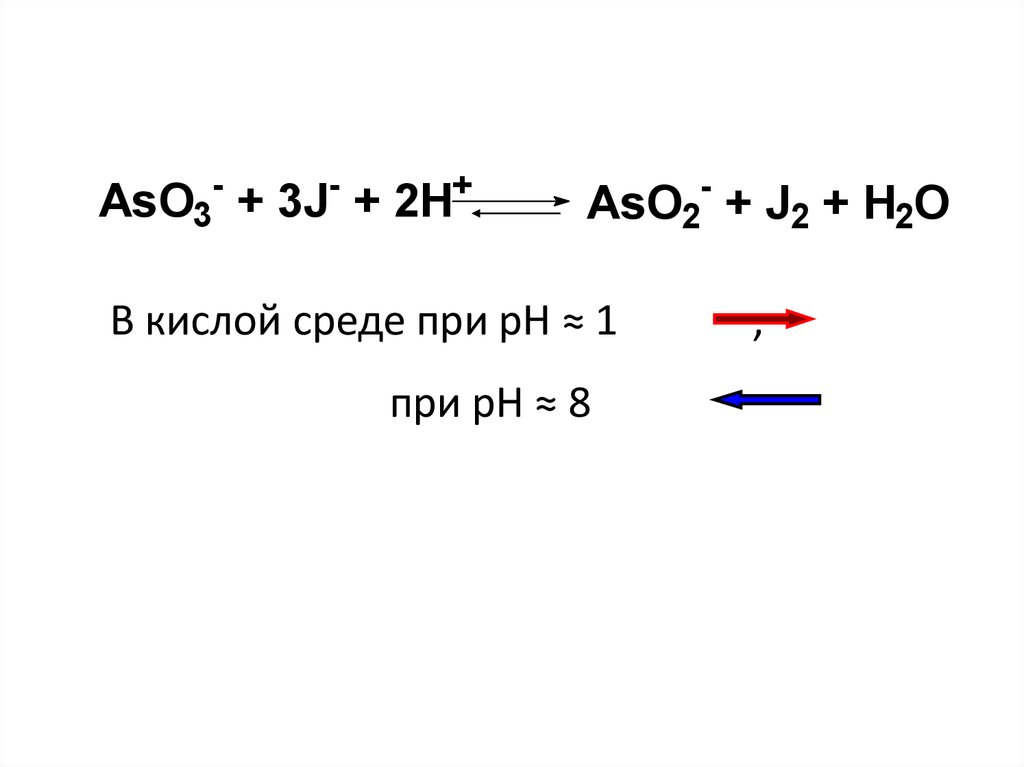
AsO3-
+
+ 3J + 2H
AsO2- + J2 + H2O
В кислой среде при рН ≈ 1
при рН ≈ 8
,
20. Применение окислительно-восстановительных реакций в анализе
Для переведения анализируемыхобъектов в растворимое состояние
3Ag2S + 8HNO3 = 6AgNO3 + 3S + 2NO + 4H2O
Для разделения элементов
2Cr(OH)4- + 3H2O2 + 2OH- = 2CrO42- + 8H2O
Отделение Zn, Al, Sn, Cr от катионов V, VI групп
Маскирование мешающих ионов
Co(II) + Fe(III) + 4SCN[Co(SCN)4]2Zn
Fe(II)
21.
Попробуем ответить1. Как и почему изменится формальный потенциал
системы Fe(III)/Fe(II): а) при введении фосфат-ионов;
б) при увеличении рН раствора?
EFe(III)/Fe(II) > EFe(H
2PO4)
2+
/Fe(II)
EFe(III)/Fe(II) > EFe(OH)3/Fe(II)
Во втором случае нет смысла рассчитывать формальный потенциал,
так как все железо свяжется в нерастворимый гидроксид, причем
железа в степени окисления +2 в системе не будет.














 Химия
Химия








