Похожие презентации:
Алканы в природе
1.
22.10.20182.
3.
Алканы в природеТвердые алканы
встречаются в природе в
виде залежей
горного воска – озокерита,
входят в состав
пчелиного воска
в восковых покрытиях листьев, цветов и
семян растений,
3
4.
Среди животных алканы встречаются в качестве ферромонову насекомых - муха цеце (C18H38, C39H80, C40H82).
Некоторые орхидеи, при помощи алканов – ферромонов,
привлекают опылителей.
Метан вырабатывается
в кишечном тракте крупного рогатого скота
некоторыми архебактериями.
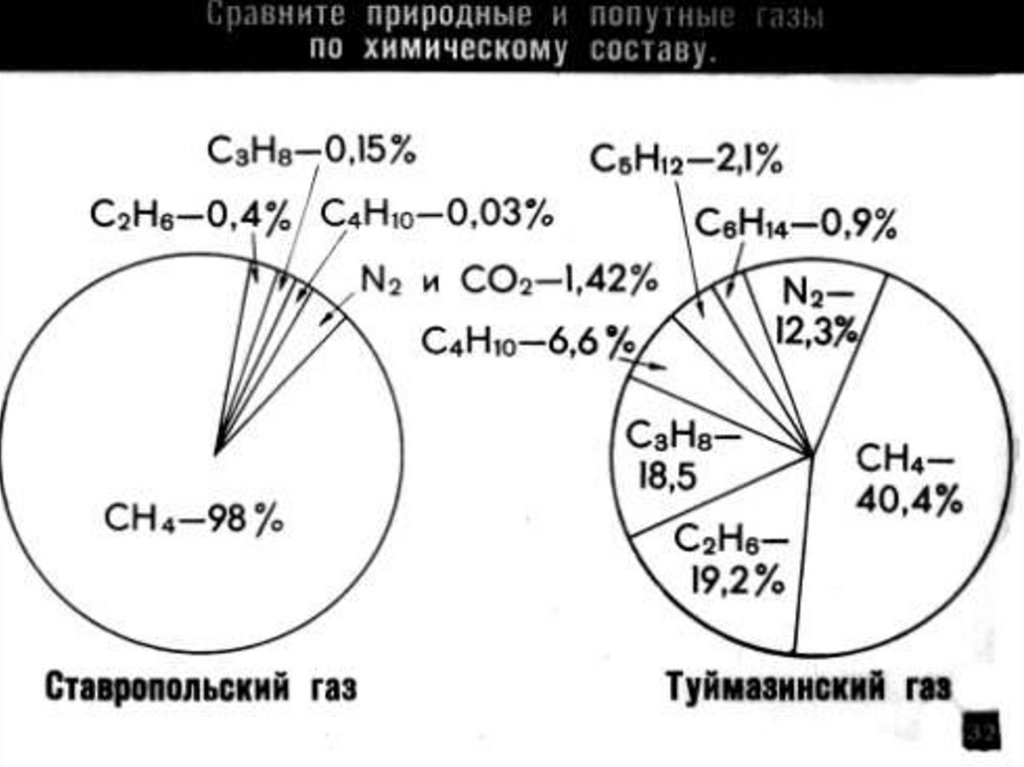
Содержится в биогазе.
5.
Метан образуется в природев результате разложения без
доступа воздуха остатков
растительных и животных
организмов.
Обнаружен в заболоченных
водоемах.
Накапливается в
каменноугольных
шахтах, содержится в
природном газе и в
попутных нефтяных
газах.
6.
67.
Метан и этан содержатся ватмосфере планет Солнечной
системы: на Юпитере,
Сатурне, Уране, Нептуне.
Метан найден в хвосте
кометы Хиякутаке и в
метеоритах.
8.
Топливо - алканы в составебензина, керосина, солярового
масла, мазута,
пропано-бутановой смеси.
Основа в изготовлении
косметики, медикаментов;
разные растворители
(жидкие УВ)
Применение
алканов
Сырье для нефтехимических
производств
Изготовление свечей,
пропитка бумаги и т. д.
(твердые УВ)
9. Применение алканов
1-3 – производствосажи
1 – картрижи
2 – резина
3 – типографическая
краска
4-7 – получение
органических веществ
4 – растворители
5 – хладогенты
6 – метанол
7 - ацетилен
10.
Алканы, парафины ,предельные , насыщенные УВ.
лат. parrum affinis
имеющий мало сродства, малоактивный.
алифатические (ациклические) УВ, в
которых атомы углерода связаны между
собой простыми (одинарными) связями в
неразветвленные или разветвленные цепи
с общей формулой
СnН2n + 2
11.
12.
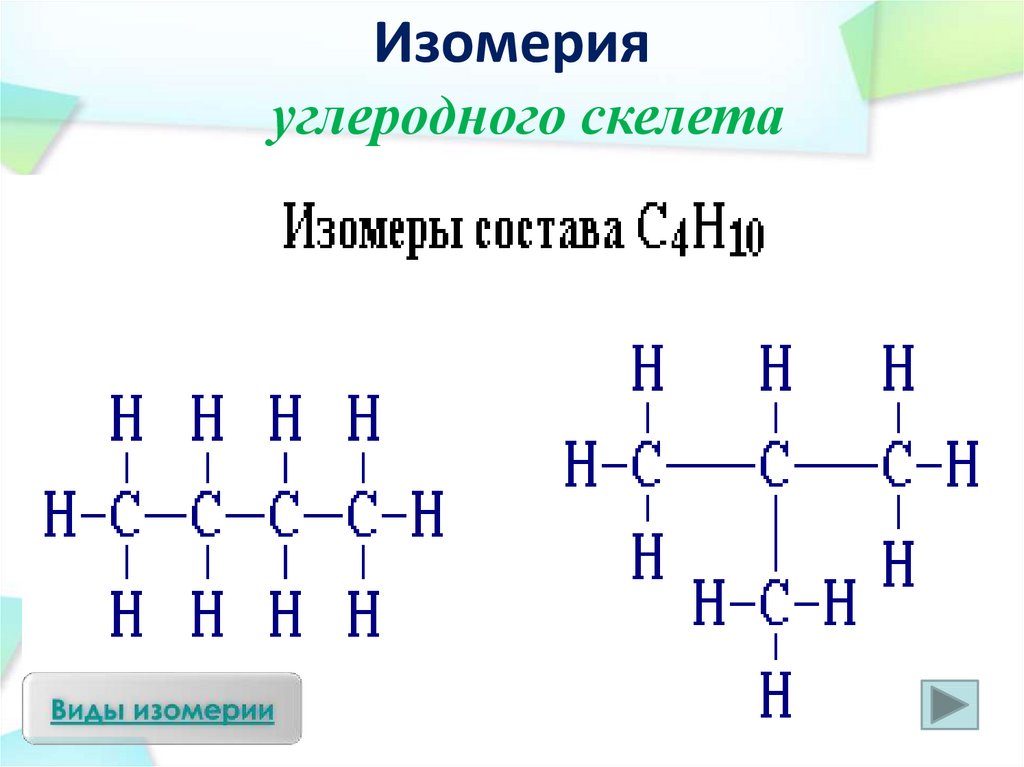
Изомерияуглеродного скелета
Шаростержневая модель
молекулы изобутана
Шаростержневая модель
молекулы бутана
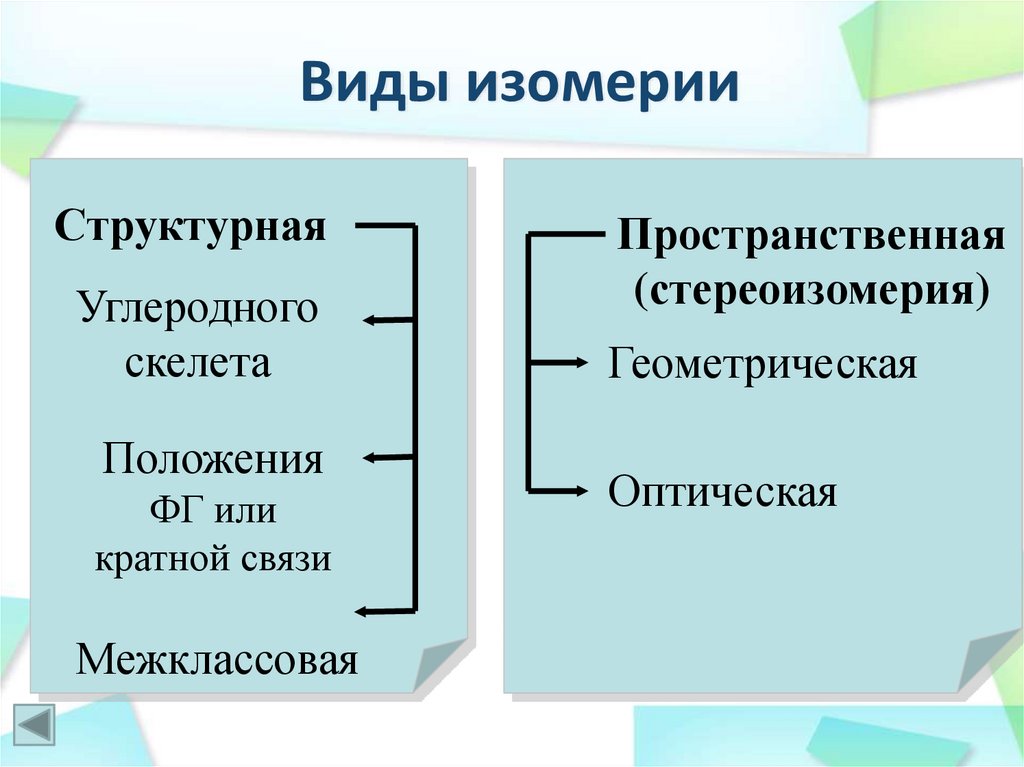
13. Виды изомерии
СтруктурнаяУглеродного
скелета
Положения
ФГ или
кратной связи
Межклассовая
Пространственная
(стереоизомерия)
Геометрическая
Оптическая
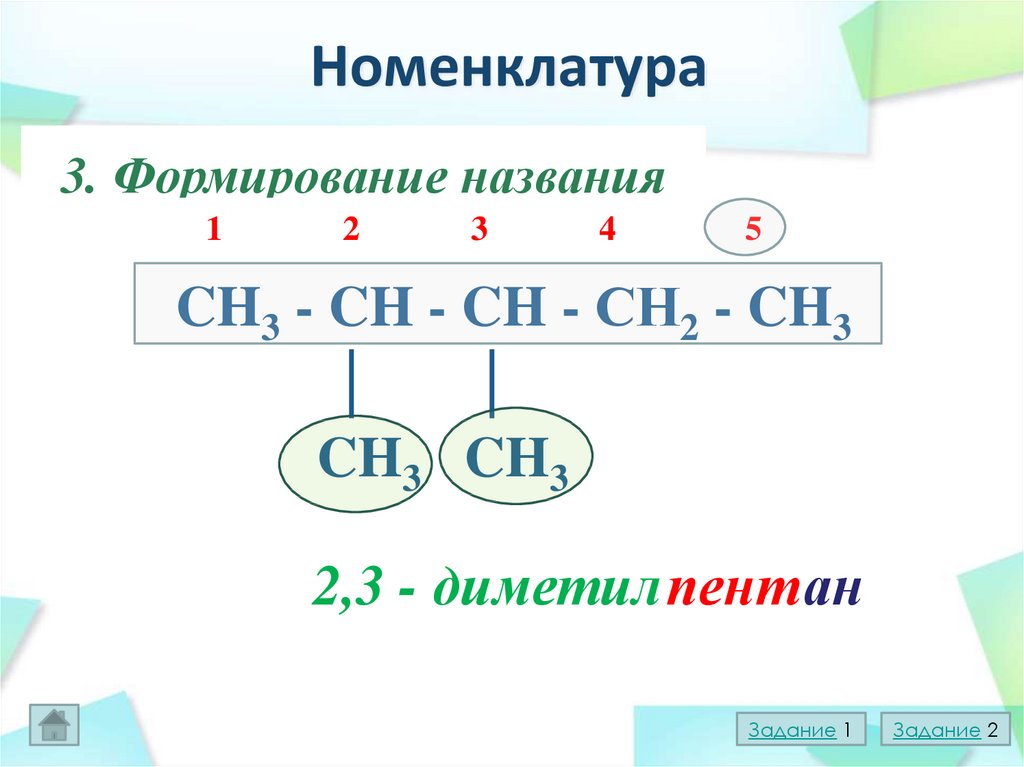
14. Номенклатура
1.Выборглавной
цепи
3.
Формирование
названия
2.Нумерация
главной
цепи
1
2
3
4
5
CH3 - CH - CH - СН2 - CH3
│
│
CH3 CH3
2,3 - диметил пент ан
Задание 1
Задание 2
15.
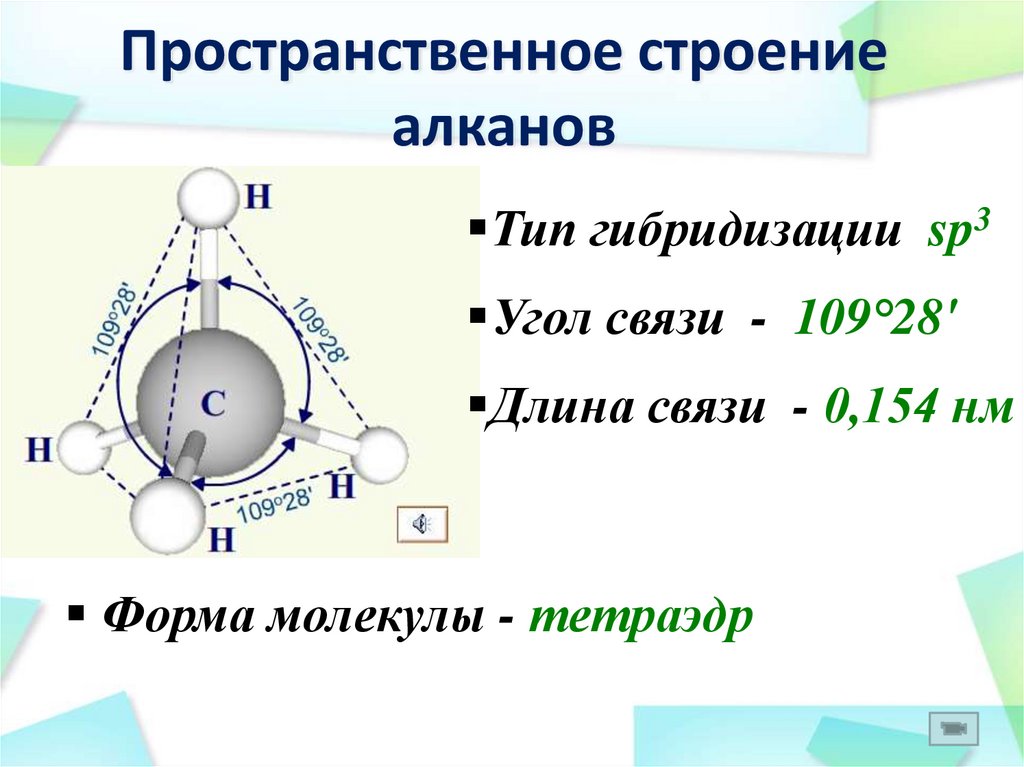
16. Пространственное строение алканов
Тип гибридизации sp3Угол связи - 109°28'
Длина связи - 0,154 нм
Форма молекулы - тетраэдр
17.
Схема образования химическихсвязей в молекуле этана
18.
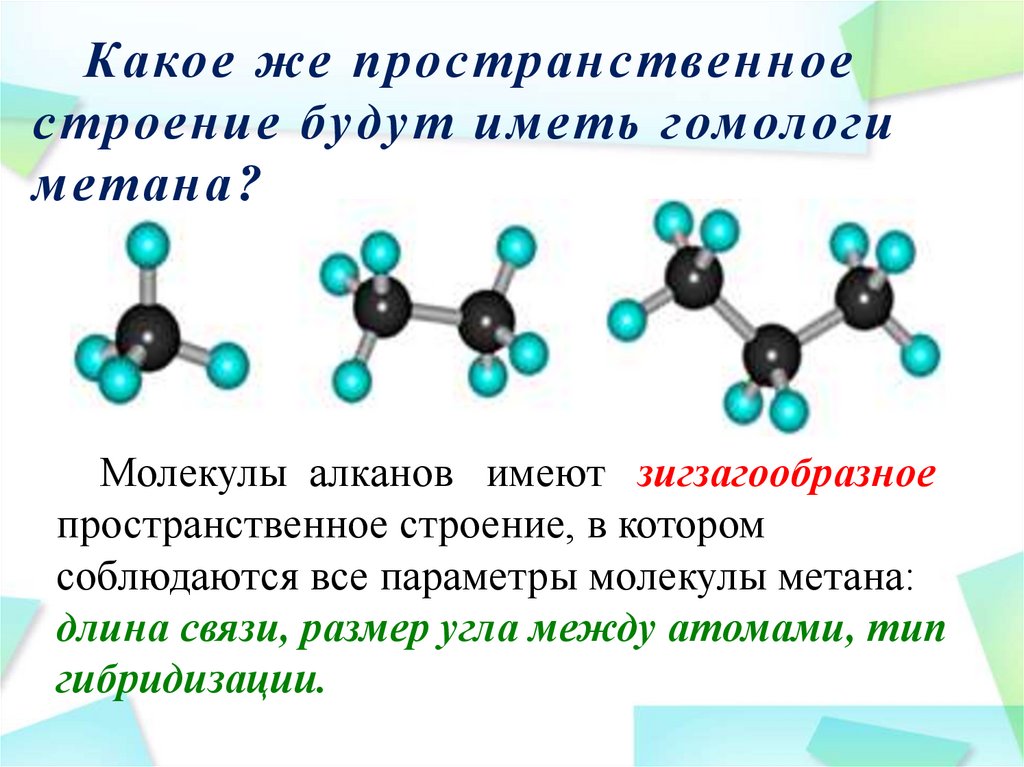
Какое же пространственноестроение будут иметь гомологи
метана?
Молекулы алканов имеют зигзагообразное
пространственное строение, в котором
соблюдаются все параметры молекулы метана:
длина связи, размер угла между атомами, тип
гибридизации.
19.
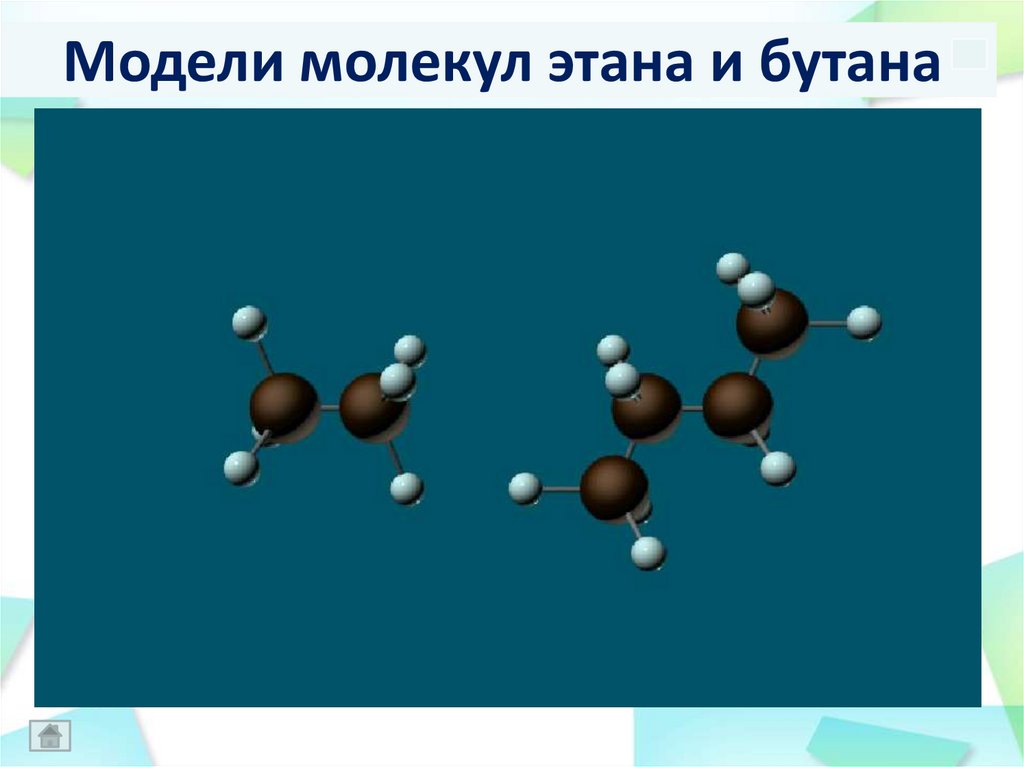
Модели молекул этана и бутана20.
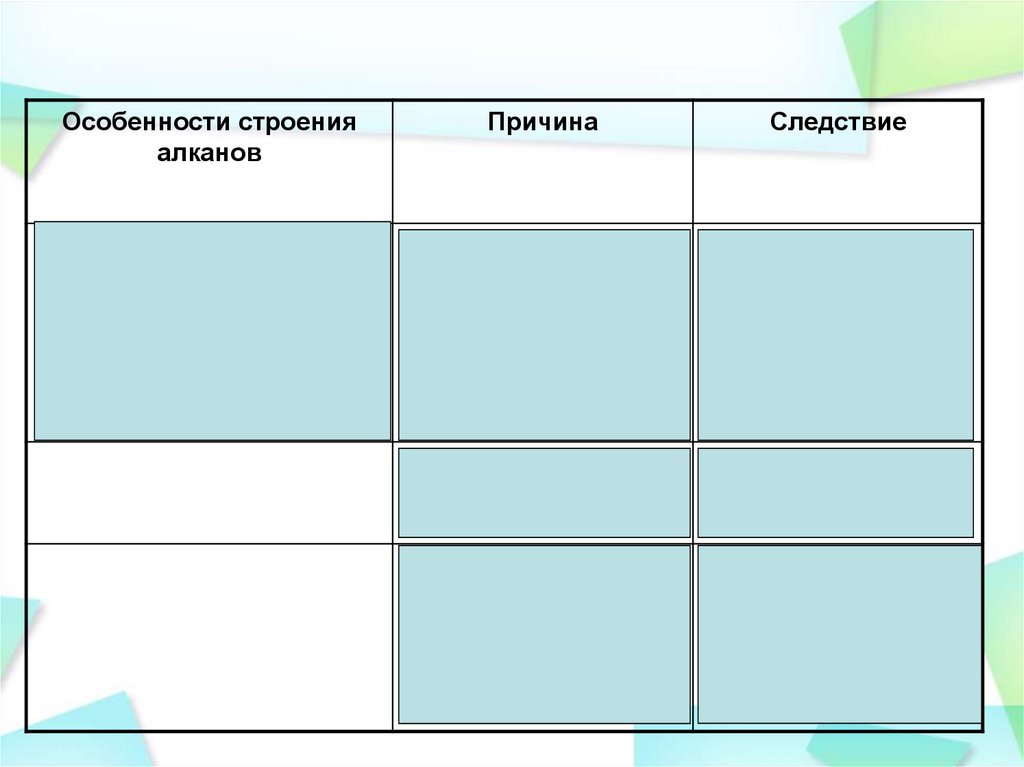
Особенности строенияалканов
Причина
Следствие
Образованы ковалентными
(σ)-связями между атомами
элементов с маленькой
разницей ЭО
Прочная связь
Возможен разрыв в
жестких условиях:
высокая температура,
облучение,
катализатор
Малополярная связь
Гомолитический
способ разрыва связи
Насыщенное
соединение
Возможность
вступления в реакции
замещения,
разложения,
изомеризации
21. Вывод:
• Алканы при обычных условиях инертны• Реакции возможны только в жестких
условиях
• Вступают в реакции замещения,
разложения, изомеризации, окисления.
• Механизм реакций преимущественно
радикальный
22.
Реакция замещенияРеакция
отщепления
(элиминирования)
Химические
свойства
Реакция окисления
Реакция
изомеризация
23.
Реакции замещения1. Галогенирование
C H4 + Cl2 hv→ CH3Cl + HCl
C H3Cl + Cl2 → CH2Cl2 + HCl
C H2Cl2 + Cl2 → CHCl3 + HCl
C HCl3 + Cl2 → CCl4 + HCl
Семенов Н.Н.
Низшие алканы (C1-C3) можно прохлорировать полностью.
Галогенирование под действием фтора и хлора может выйти
из под контроля и приобрести взрывной характер.
24.
1.Галогенирование начинается только поддействием инициатора радикальных реакций
(УФ-свет, радикальные реагенты, нагревание)
2.Реакционная способность в ряду галогенов
уменьшается в ряду:
F2 > Cl2 > Br2 > I2
3.Реакционная способность водорода у третичного
атома углерода выше, чем у вторичного, а вторичного
выше, чем у первичного.
CH3
CH3 C
CH3
>
CH3 CH CH3
>
CH3CH2
>
CH3
24
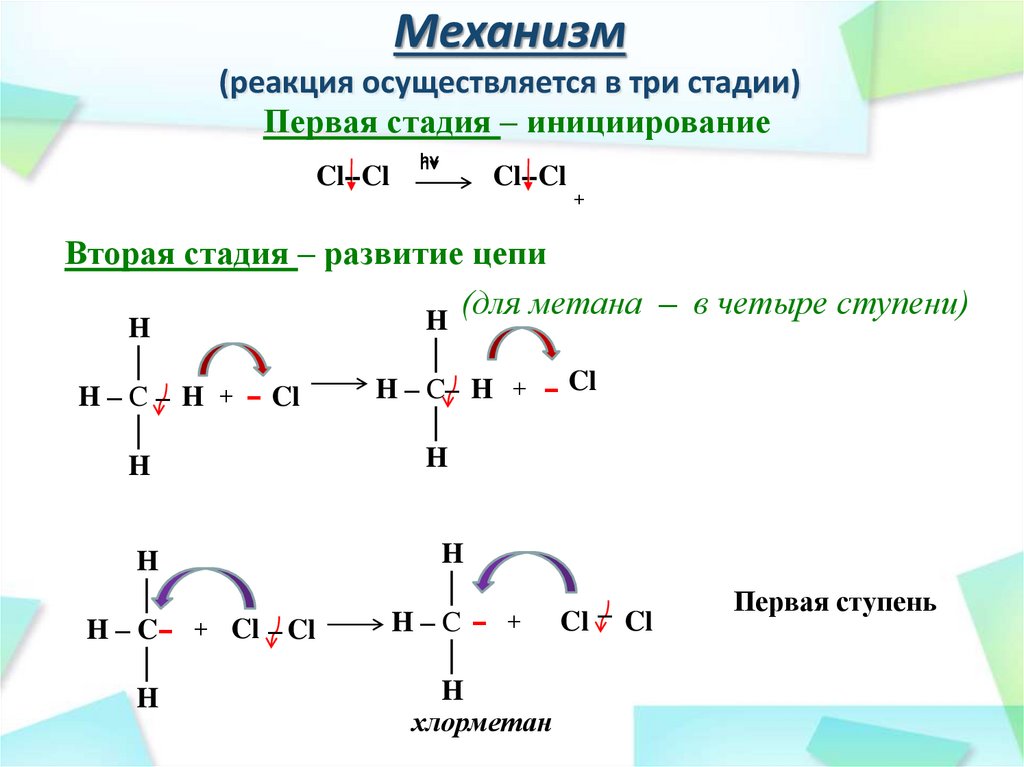
25. Механизм (реакция осуществляется в три стадии)
Первая стадия – инициированиеCl--Cl
hν
hν
Cl--Cl
+
Вторая стадия – развитие цепи
(для метана – в четыре ступени)
H
H
│
H – C – H + – Cl
│
H
H
│
H – C – + Cl – Cl
│
H
│
H – C– H + – Cl
│
H
H
│
H – C – + Cl – Cl
│
H
хлорметан
Первая ступень
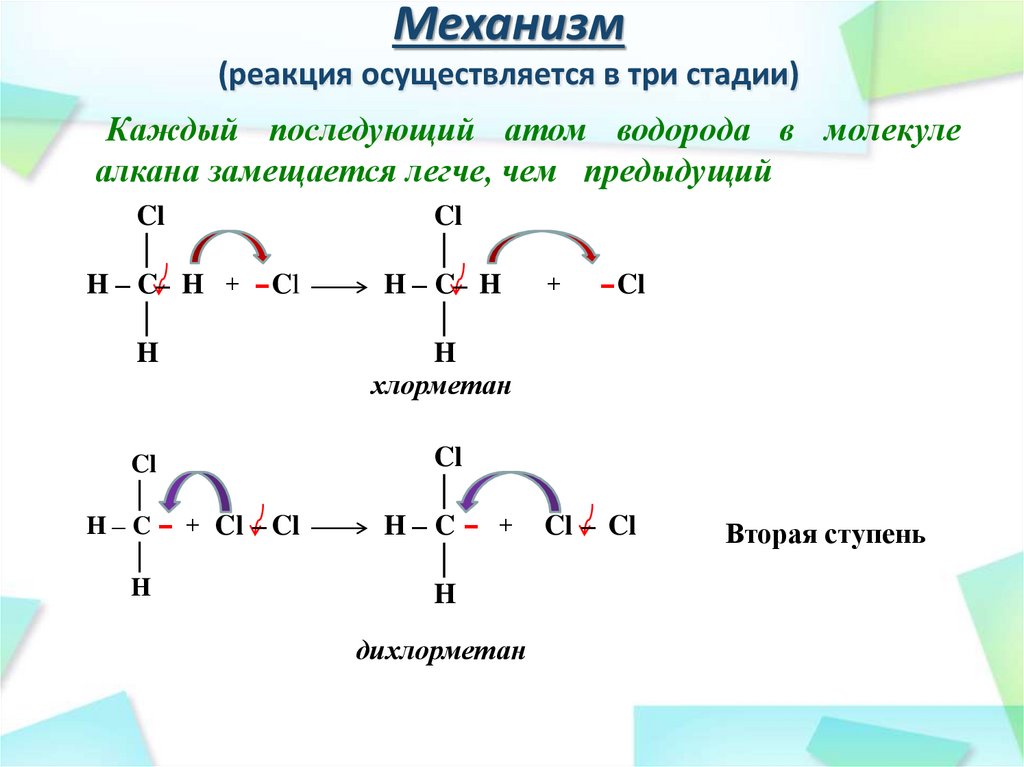
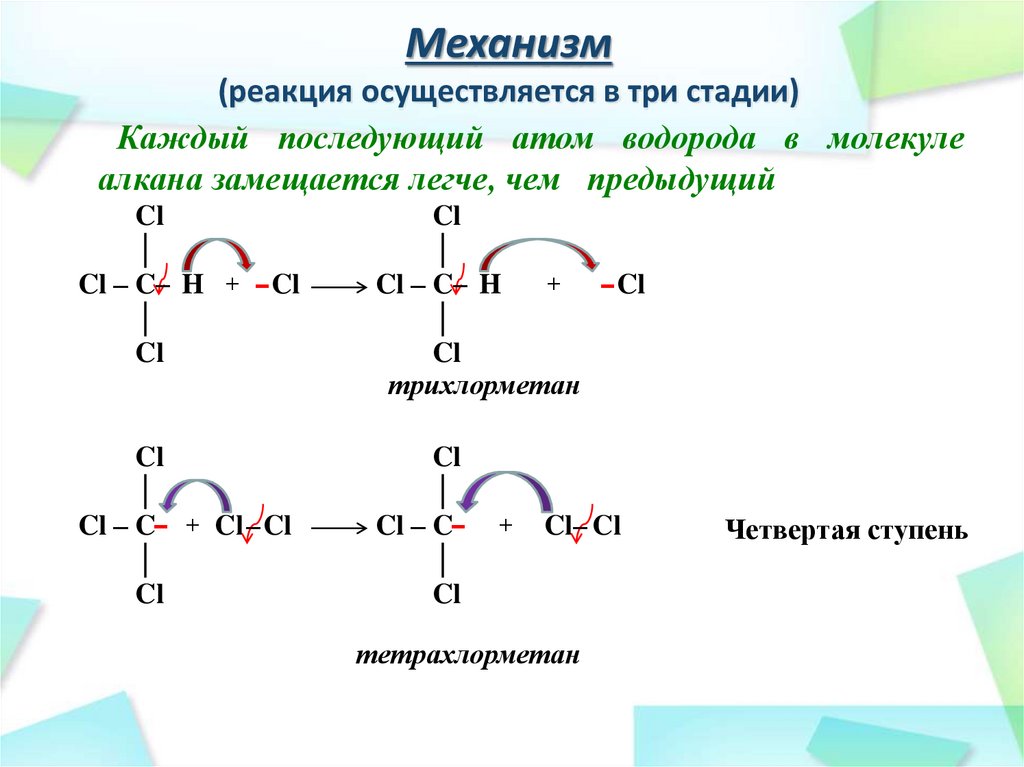
26. Механизм (реакция осуществляется в три стадии)
Каждый последующий атом водорода в молекулеалкана замещается легче, чем предыдущий
Cl
│
H – C– H + – Cl
│
H
Cl
│
H – C– H
│
H
хлорметан
Cl
│
H – C – + Cl – Cl
│
H
Cl
│
H–C – +
│
H
дихлорметан
+
– Cl
Cl – Cl
Вторая ступень
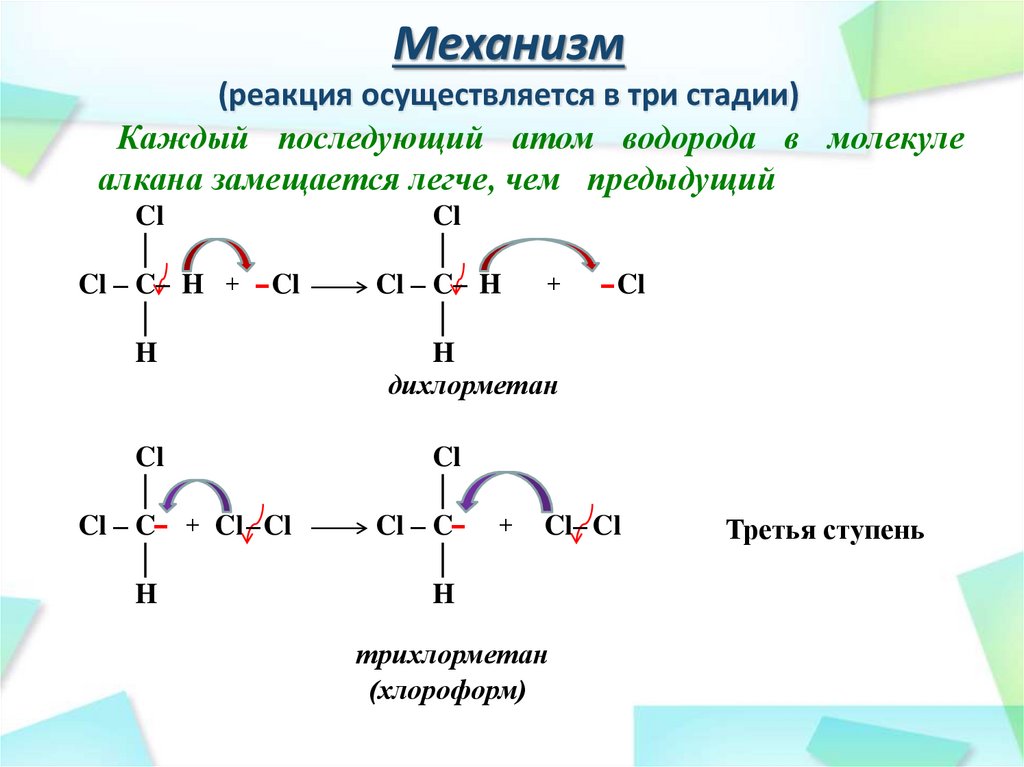
27. Механизм (реакция осуществляется в три стадии)
Каждый последующий атом водорода в молекулеалкана замещается легче, чем предыдущий
Cl
│
Cl – C– H + – Cl
│
H
Cl
│
+
Cl – C– H
│
H
дихлорметан
Cl
│
Cl – C– + Cl – Cl
│
H
Cl
│
Cl – C–
│
H
+
– Cl
Cl– Cl
трихлорметан
(хлороформ)
Третья ступень
28. Механизм (реакция осуществляется в три стадии)
Каждый последующий атом водорода в молекулеалкана замещается легче, чем предыдущий
Cl
│
Cl – C– H + – Cl
│
Cl
Cl
│
+
– Cl
Cl – C– H
│
Cl
трихлорметан
Cl
│
Cl – C– + Cl – Cl
│
Cl
Cl
│
Cl – C–
│
Cl
+
Cl– Cl
тетрахлорметан
Четвертая ступень
29. Механизм (реакция осуществляется в три стадии)
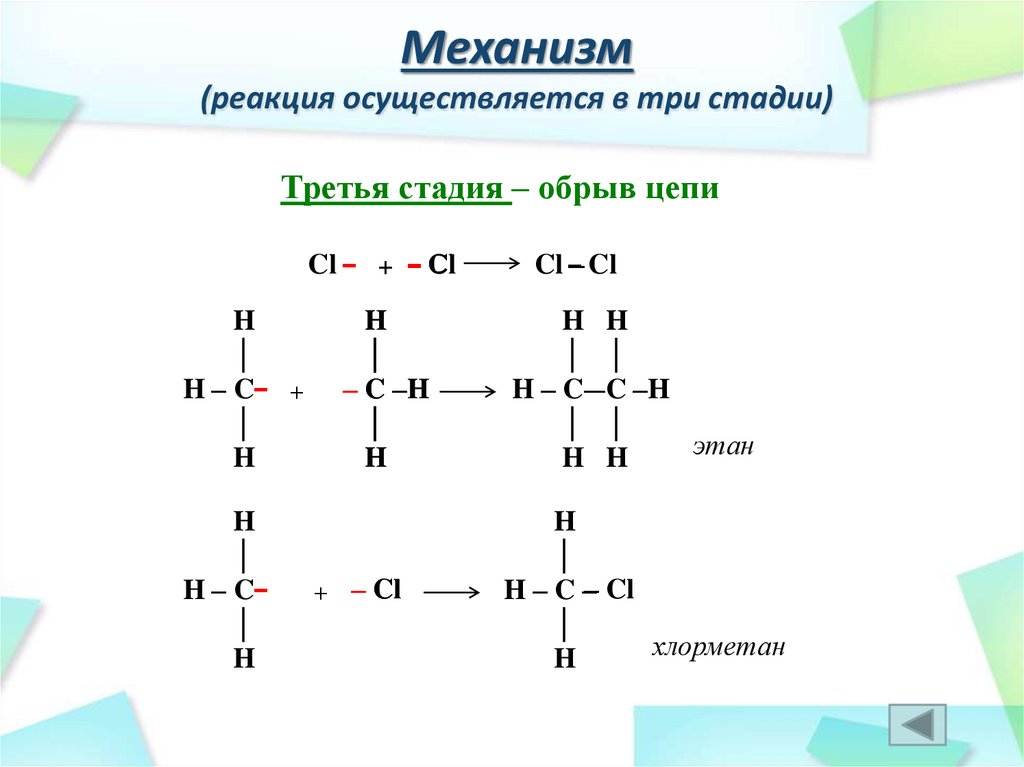
Третья стадия – обрыв цепиCl
Cl – + – Cl
H
│
H – C– +
│
H
H
│
H – C–
│
H
H
│
– C –H
│
H
+ – Cl
Cl –– Cl
H H
│ │
H – C –– C –H
│ │
этан
H H
H
│
H – C – Cl
│
хлорметан
H
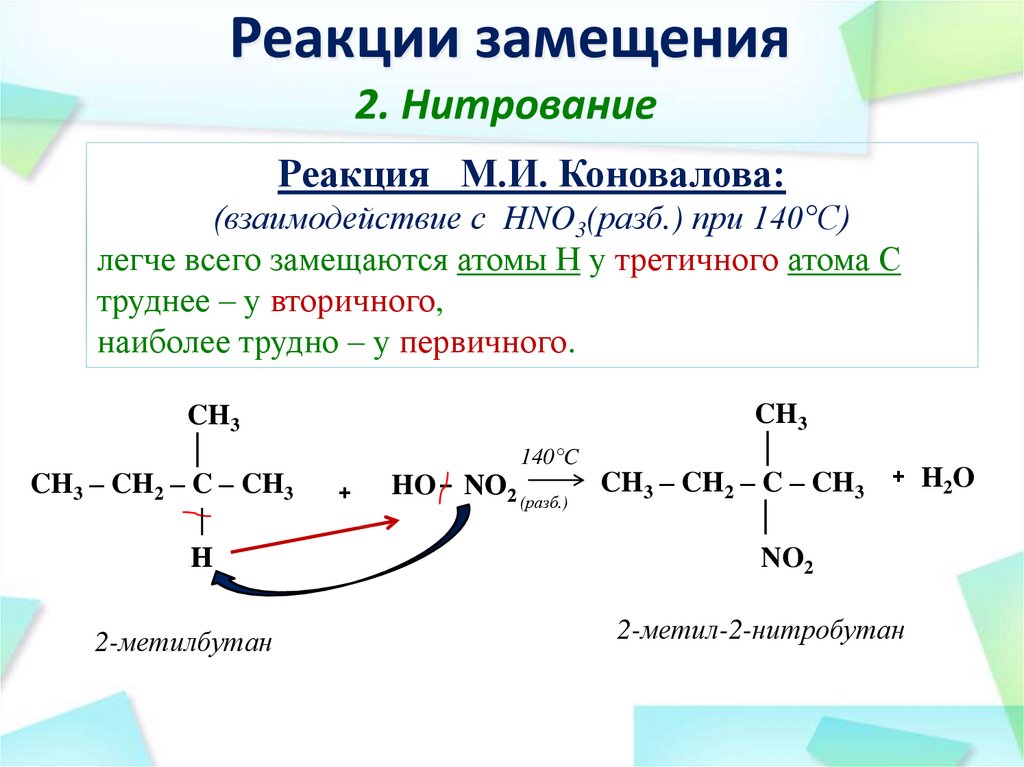
30. Реакции замещения
2. НитрованиеРеакция М.И. Коновалова:
(взаимодействие с HNO3(разб.) при 140°С)
легче всего замещаются атомы Н у третичного атома С
труднее – у вторичного,
наиболее трудно – у первичного.
CH3
│
CH3 – CH2 – C – CH3
│
H
2-метилбутан
140°C
+
HO – NO2 (разб.)
CH3
│
CH3 – CH2 – C – CH3
│
NO2
+
2-метил-2-нитробутан
H2 O
31.
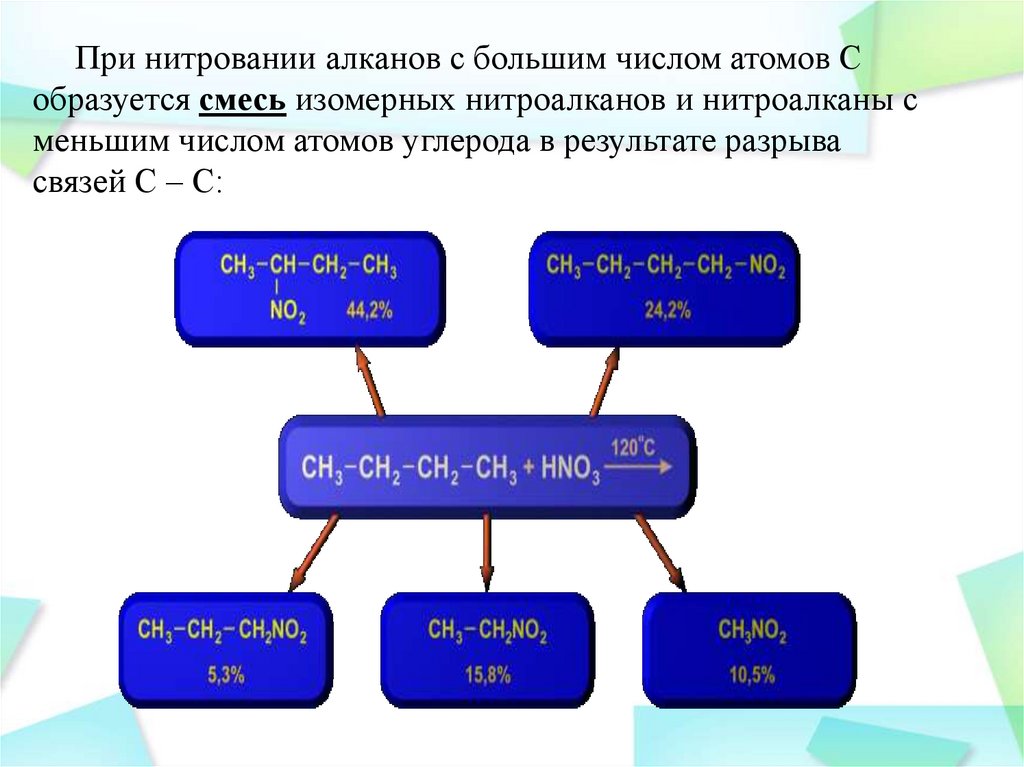
При нитровании алканов с большим числом атомов Собразуется смесь изомерных нитроалканов и нитроалканы с
меньшим числом атомов углерода в результате разрыва
связей С – С:
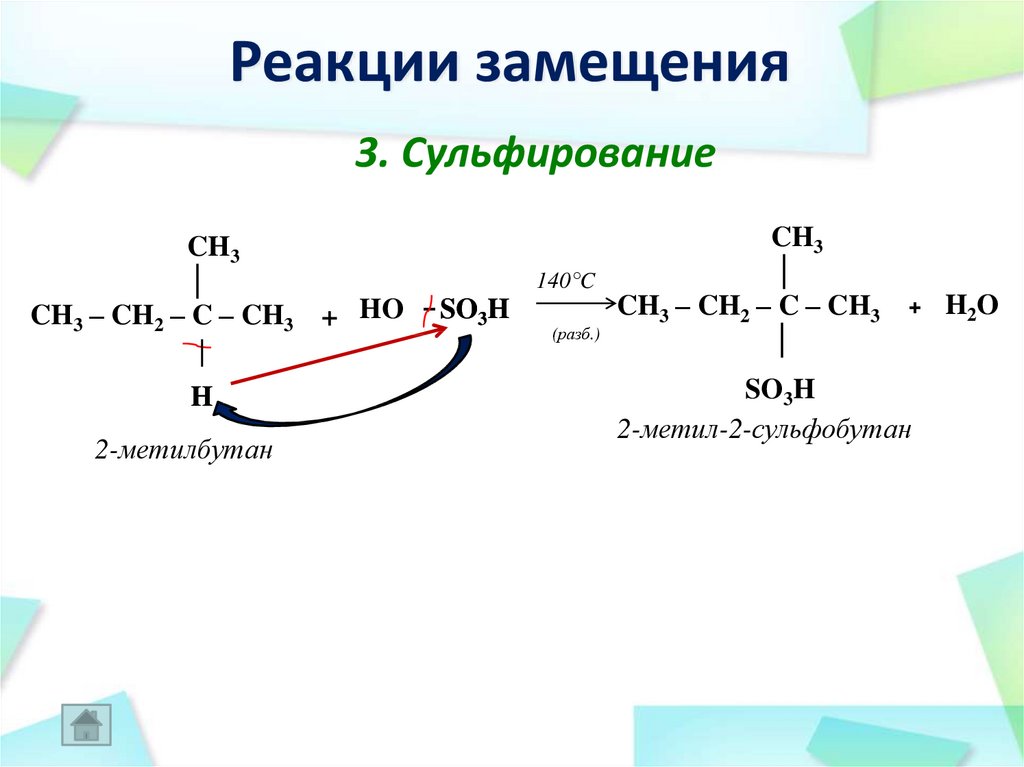
32. Реакции замещения
3. СульфированиеCH3
│
CH3 – CH2 – C – CH3 + HO
│
H
2-метилбутан
140°C
– SO3H
(разб.)
CH3
│
CH3 – CH2 – C – CH3
│
+
SO3H
2-метил-2-сульфобутан
H2O
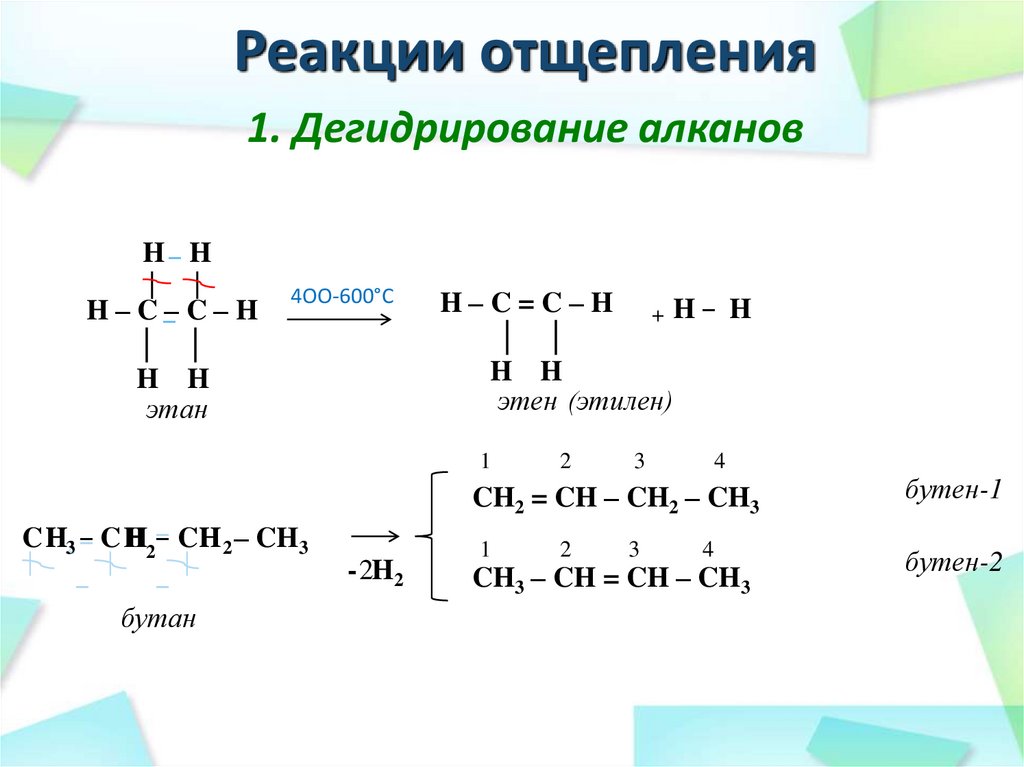
33. Реакции отщепления
1. Дегидрирование алкановH– H
│
│
H – C –– C – H
│ │
H H
этан
4OO-600°C
H–C=C–H +H– H
│ │
H H
этен (этилен)
1
2
3
4
CH2 = CH – CH2 – CH3
H – CH 2 – CH3
C H32 – C H
2
|
–
|
–
|
бутан
- 2H2
1
2
3
4
CH3 – CH = CH – CH3
бутен-1
бутен-2
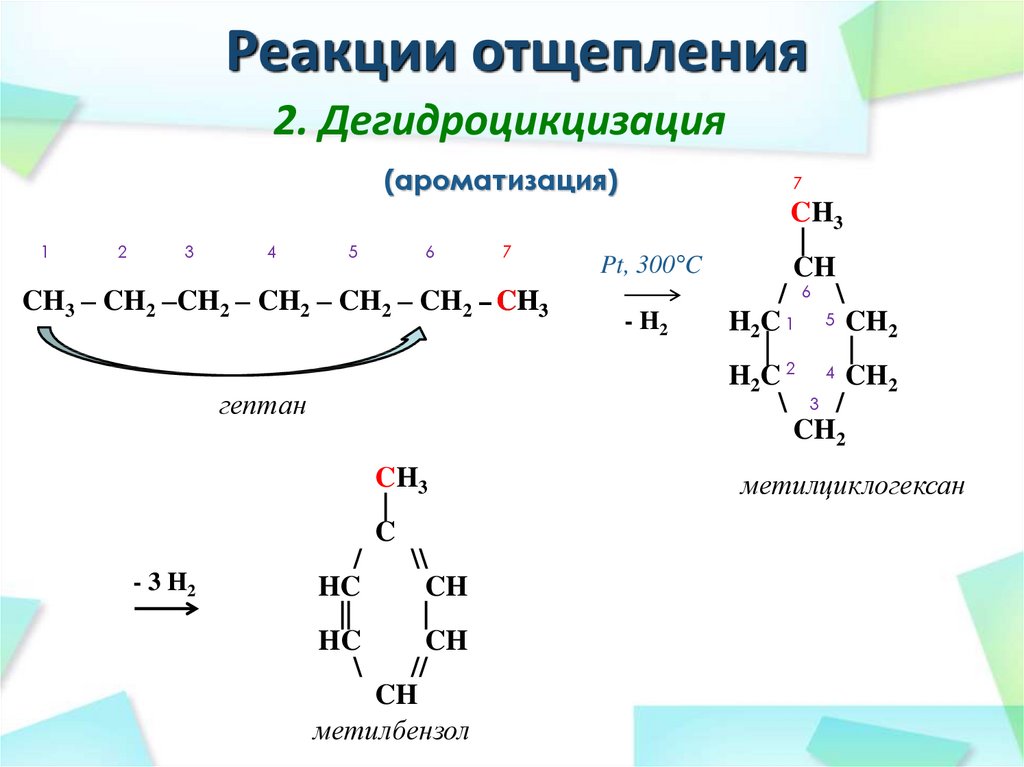
34. Реакции отщепления
2. Дегидроцикцизация(ароматизация)
1
2
3
4
5
6
7
CH3 – CH2 –CH2 – CH2 – CH2 – CH2 – CH3
гептан
- 3 H2
CH3
|
C
/
\\
HC
CH
||
|
HC
CH
\
//
CH
метилбензол
7
CH3
|
Pt, 300°C
CH
/ 6 \
- H2
H2C 1 5 CH2
│
|
2
4 CH
H2 C
2
\ 3 /
CH2
метилциклогексан
35.
3. Термическое разложениеПиролиз – термическое разложение
органических соединений без доступа воздуха
а) Полное разложение
2CH4
1000°C
CH ≡ CH + 3 Н2
этин (ацетилен)
метан
б) Неполный пиролиз
CH4
метан
1200°C
C +2 Н2
36.
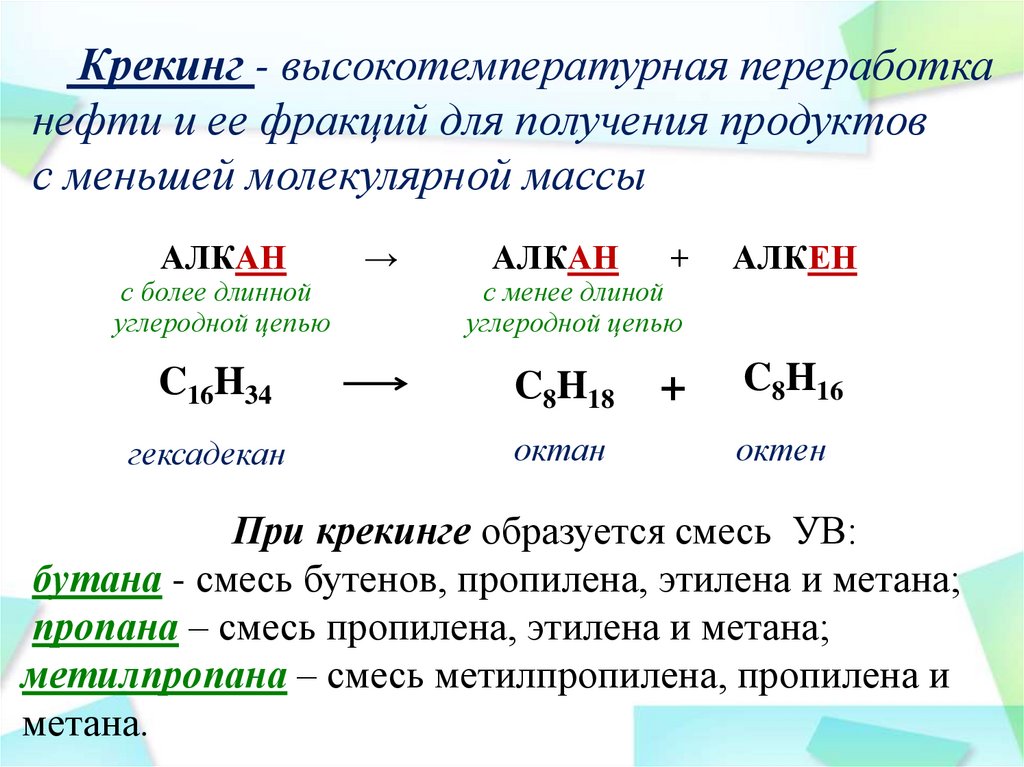
Крекинг - высокотемпературная переработканефти и ее фракций для получения продуктов
с меньшей молекулярной массы
АЛКАН
АЛКАН
+
АЛКЕН
C16H34
C8H18
+
C8H16
гексадекан
октан
с более длинной
углеродной цепью
→
с менее длиной
углеродной цепью
октен
При крекинге образуется смесь УВ:
бутана - смесь бутенов, пропилена, этилена и метана;
пропана – смесь пропилена, этилена и метана;
метилпропана – смесь метилпропилена, пропилена и
метана.
37.
Крекинг бутанаТемпература – 470—650°С;
Давление – 7 МПа
В.Г. Шухов (1891)
CH3CH3 + H2C CH2
H2C CH CH3 + CH4
H2C CH CH2 CH3 + H3C CH CH CH3 + H2
CH3CH2CH2CH3
H2C CH CH CH2 + 2H2
H3C CH3 + CH4 + C
2HC CH + 3H2
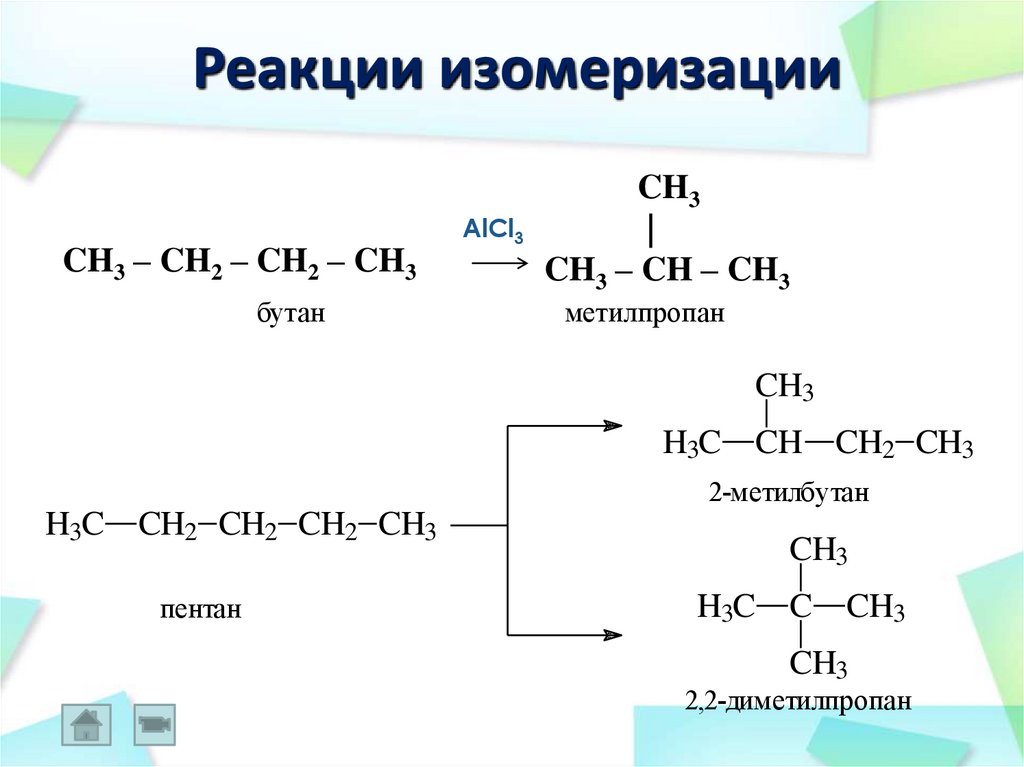
38. Реакции изомеризации
CH3 – CH2 – CH2 – CH3бутан
AlCl3
CH3
|
CH3 – CH – CH3
метилпропан
CH3
H3C
CH CH2 CH3
2-метилбутан
H3C CH2 CH2 CH2 CH3
пентан
CH3
H3C C
CH3
CH3
2,2-диметилпропан
39. Реакции окисления
1. ГорениеCH4 + 2О2
2 CH4 + 3 О2
CH4 + О2
CO2 + 2 Н2О
2 CO + 4 Н2О
CO + 2 Н2О
(при недостатке кислорода)
(при сильном недостатке
кислорода)
Горение
твердых УВ
Горение
жидких УВ
40.
При обычных условиях алканы устойчивы кдействию окислителей
При каталитическом окислении из алканов
получают кислородосодержащие органические
соединения
Сильные окислители (KMnO4, K2Cr2O7 и др.)
[O]
R CH2 CH2 R катализатор
R CH2OH
O
R C H
R COOH
Отношение к
окислителям
41.
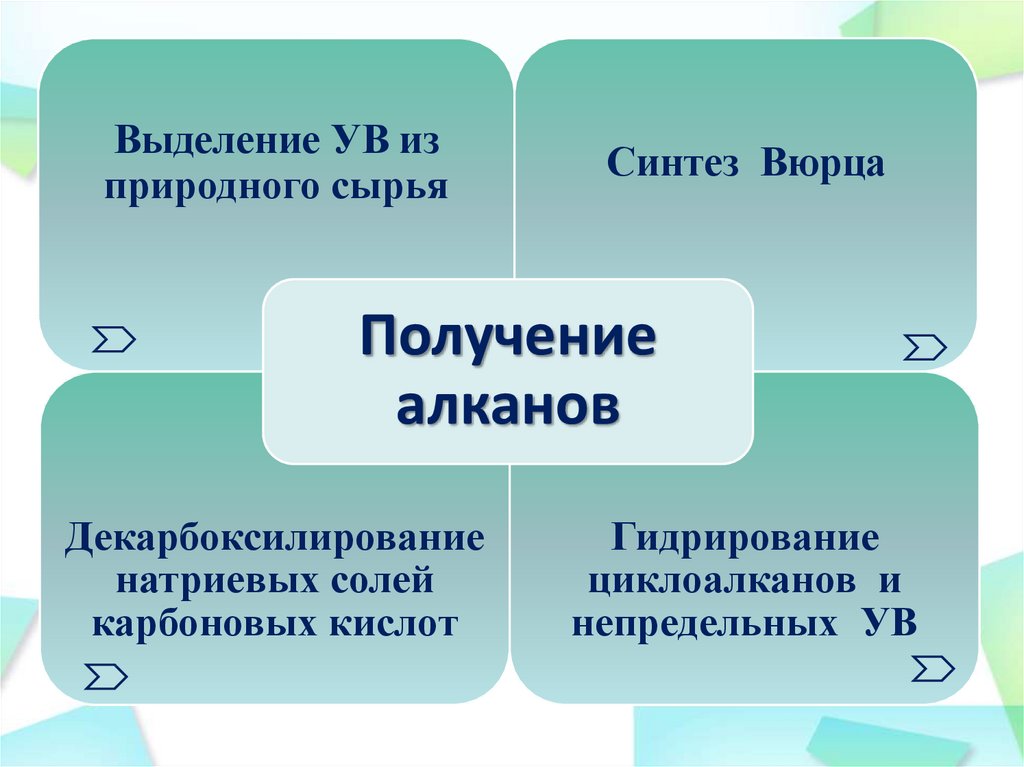
Выделение УВ изприродного сырья
Синтез Вюрца
Получение
алканов
Декарбоксилирование
натриевых солей
карбоновых кислот
Гидрирование
циклоалканов и
непредельных УВ
42. Выделение УВ из природного сырья
Основной способ получения алканов эторазделение различных фракций нефти.
Нефть – это смесь различных УВ:
30-50 % алканы (CnH2n+2)
25-75 % циклоалканы (CnH2n)
10-35 % арены (CnH2n-6)
ректификация
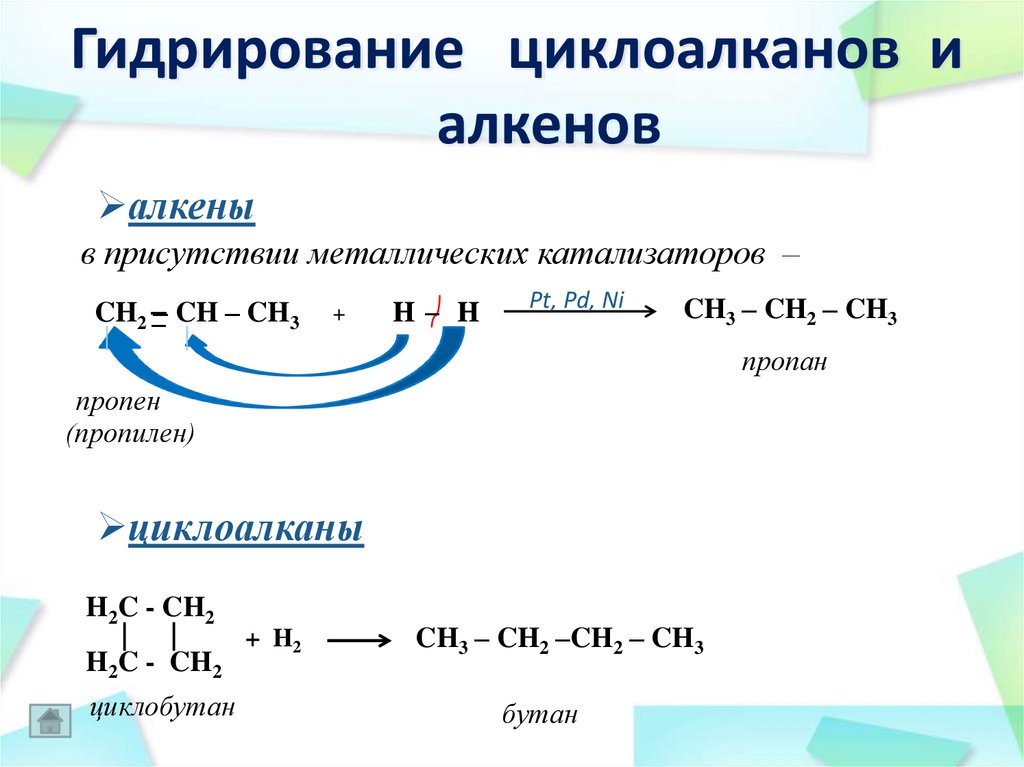
43. Гидрирование циклоалканов и алкенов
алкеныв присутствии металлических катализаторов –
CH2 –
–– CH – CH3
|
+
|
H– H
Pt, Pd, Ni
CH3 – CH2 – CH3
пропан
пропен
(пропилен)
циклоалканы
H2C - CH2
| |
+ H2
H2C - CH2
циклобутан
CH3 – CH2 –CH2 – CH3
бутан
44. Синтез Вюрца
(взаимодействие галогеналканов с активными металлами)Проводят с целью получения алканов с более длинной углеродной
цепью
R – Br
│
Na
+
R ––
– Br
R
│
Na
R
CH3 - Br + 2Na + Br - CH3
Na – Br
+
Na – Br
CH3 - CH3 + 2NaBr
Если в реакции участвуют разные галогеналканы, то образуется
смесь алканов:
3 R – Br
3CH3 – Br
+
+ 3 R′ – Br
+ 6 Na
3C2H5 –Br + 6Na
бромметан бромэтан
R –R
+ R – R′
+ R′ – R′
+ 6 Na– Br
CH3 – CH3 +CH3 – C2H5 + C2H5 – C2H5
этан
пропан
бутан
+
6Na –Br
45.
Декарбоксилированиенатриевых солей карбоновых кислот
(реакция Дюма )
при сплавлении солей карбоновых кислот со
щелочью:
R-COONa + NaOH → R-H + Na2CO3
CH3COONa + NaOH
CН4 + Na2CO3
ацетат натрия
метан
Получение
метана
46.
Получение метанаВ электрической дуге(1200 С0), горящей в атмосфере
водорода, образуется значительное количество метана:
C + 2H2 = CH4
Такая же реакция идет при нагревании углерода в
атмосфере водорода до 400—500 °С при повышенном
давлении в присутствии катализатора (Ni).
Синтез на основе водяного газа:
CO + 3H2 = CH4 + H2O
Гидролиз карбида алюминия:
Al4C3 + 12H2O = 4CH4 + 3Al(OH)3























 Химия
Химия








