Похожие презентации:
Растворы. Гетерогенные равновесия растворов с осадком
1. РАСТВОРЫ
2. Гетерогенные равновесия растворов с осадком
2+CaCO3(т.)
Ca +
2
CO3
[Ca 2 ][CO3 2 ]
К=
[CaCO3 ]
[Ca2+], [CO32 ] - равновесные концентрации ионов в растворе;
[CaCO3] - концентрация вещества в осадке (в твердой фазе), она постоянна.
К [CaCO3] = Ksp = [Ca ]
2+
2
[CO3 ]
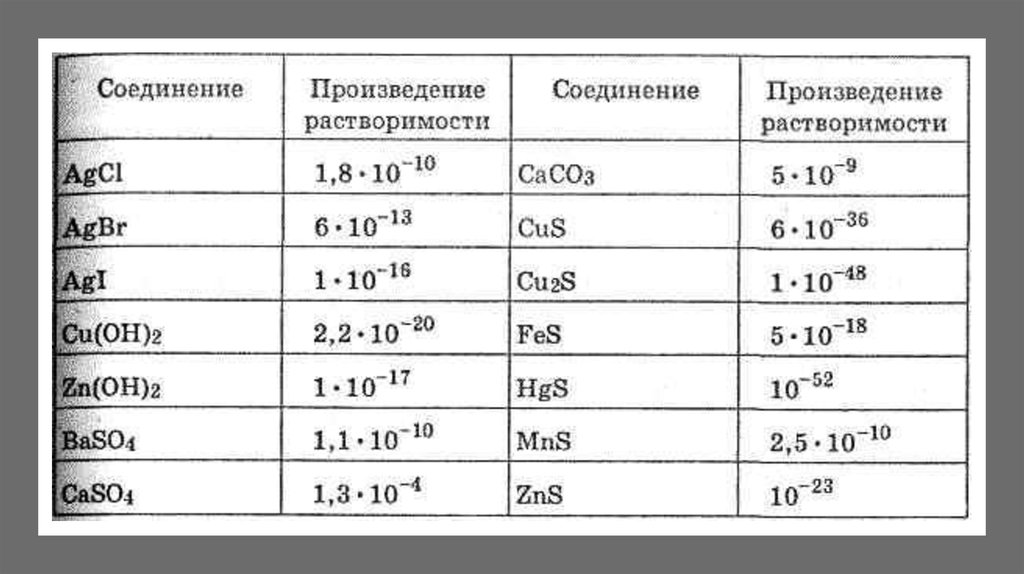
Произведение растворимости – это произведение концентраций ионов
малорастворимого вещества в его насыщенном растворе в степенях их
стехиометрических коэффициентов
.
3.
4.
Связь между произведением растворимости ирастворимостью осадка
y+
KxAy
xK
y+ x
x
+ yA
x y
Ksp = [K ] [A ]
Обозначим молярную растворимость вещества через “S” . Тогда раствор
будет содержать катионов [Ky+]=xS (моль/л), анионов - [Ax ]=yS (моль/л).
Ksp = [xS]x [yS]y
5.
6.
В присутствии одноименных ионовравновесие смещается в сторону образования
осадка (эффект одноименного иона).
Ag2S
AgNO3
2 Ag + + S2
Ag + + NO3
7.
В присутствии сильных электролитов, не содержащихобщих ионов, подвижность ионов в растворе
уменьшается и равновесие смещается в сторону
большего растворения осадка (солевой эффект).
При добавлении к малорастворимому электролиту посторонней
соли межионные силы взаимодействия возрастают и
коэффициенты активности ионов, составляющих молекулу
малорастворимого электролита, уменьшаются до значений меньше
единицы. Это вызывает увеличение растворимости электролита,
так как раствор становится ненасыщенным вследствие введения
посторонних ионов.
8.
9. Образование осадков - реакции обмена
10.
Условие образования осадка: произведение концентраций ионов врастворе должно быть больше, чем величина произведения
растворимости данного соединения. Например,
[Pb2+] [Cl ]2 > Ksp (PbCl2).
Условие растворения осадка: произведение концентраций ионов в
растворе (Pi) меньше, чем величина произведения растворимости
данного соединения ([Pb2+] [Cl ]2 < Ksp (PbCl2) ).
11.
12.
13.
14.
Задача. Выведите формулу зависимости произведениярастворимости Ksp от растворимости S для Ag2S.
Решение.
Ag2S
2 Ag + + S2
Согласно уравнению диссоциации соли,
[Ag +] = 2S (моль/л), [S2 ] = S (моль/л).
Ksp = (2S)2 (S) = 4S3,
K sp
3
s 4
или
15.
Задача. Вычислите растворимость AgCl в присутствии 0.01 Mраствора HCl.
Решение.
AgCl
s
Ag+ + Cl
(s+0.01 моль/л 0.01 моль/л)
s
KSp (AgCl) = [Ag+] [Cl ] = s 0.01 = 1,6 10 10, s = 1,6 10 моль/л
16.
Задача. Выпадет ли осадок PbCl2 при смешивании равныхобъемов 0.01M раствора Pb(NO3)2 и 0.02M раствора of HCl?
Решение.
Pb(NO3)2 + 2HCl PbCl2 + 2HNO3
Pb 2+ + 2Cl PbCl2
При смешивании равных объемов рстворов концентрации
реагирующих веществ уменьшаются в 2 раза. Концентрации ионов
в растворе составляют:
[Pb2+] = C(Pb(NO3)2) = 0.01 / 2 = 0.005 моль/л
[Cl ] = C(HCl) = 0.02 / 2 = 0.01 моль/л
Произведение концентраций ионов в растворе:
Pi = [Pb2+] [Cl ]2 = 0.005 (0.01)2 = 5 10
Из таблицы находим, что KSp(PbCl2) = 1.6 10 5.
Так как Pi < Ksp, то осадок PbCl2 не образуется.
17. ГИДРОЛИЗ СОЛЕЙ
обменная реакция ионов соли с молекулами воды,приводящей к образованию молекул и ионов новых
слабых электролитов.
18.
Основные правила написания реакций гидролиза:1. Гидролизу подвергаются анионы слабых кислот и
катионы слабых оснований, входящих в состав соли.
2. Гидролиз - процесс ступенчатый. На каждой ступени один
гидролизующийся ион реагирует с одной молекулой воды.
3. В обычных условиях гидролиз протекает только по
первой ступени. Гидролиз усиливается при нагревании и
разбавлении растворов солей.
4. Гидролиз - процесс, как правило, обратимый, его
равновесие можно смещать. Добавление одноименных ионов (Н +
или ОН ), выделяющихся в процессе гидролиза, смещает
равновесие в сторону уменьшения гидролиза. Добавление
противоположных ионов, связывающих выделяющиеся ионы Н + и
ОН в молекулы воды, смещает равновесие в сторону усиления
гидролиза.
19.
Типы реакций гидролиза.1. Соль образована ионами сильного основания и сильной
кислоты (например, NaCl, KNO3 и др.).
NaCl + H2O гидролиз не идет (NaOH - сильное
основание, HCl - сильная кислота).
Среда нейтральная, рН=7
20.
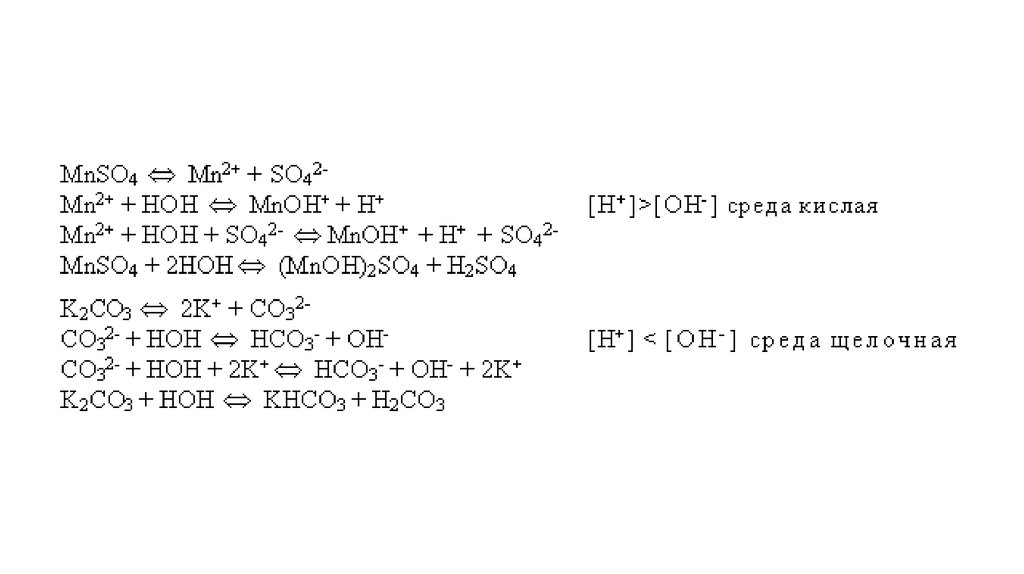
2. Соль образована ионами сильного основания и слабойкислоты (например, Na2CO3, KSCN и др.).
Na2CO3 + Н2О гидролиз по аниону (NaOH - сильное
основание, H2CO3 - cлабая кислота).
CO32 + HOH
HCO3 + OH (среда щелочная, рН>7).
Na2CO3+ HOH
NaHCO3 + NaOH (1 ступень гидролиза).
21.
Добавление к раствору щелочей (NaOH), содержащиходноименные ионы (OH ), вызывает ослабление гидролиза
(смещение равновесия влево по принципу Ле Шателье). Добавление
к раствору кислот усиливает гидролиз за счет реакции Н++OH
Н2О, в результате которой концентрация ионов OH в растворе
уменьшается, и равновесие гидролиза смещается вправо. Гидролиз
усиливается и начинает идти по второй ступени:
НCO3 + HOH
H2CO3 + OH
NaНCO3 + HOH
H2CO3 + NaOH (2 ступень гидролиза).
22.
3. Соль образована ионами слабого основания и сильнойкислоты (например, AlCl3, FeSO4 и др.).
AlCl3 + H2O гидролиз по катиону (Al(OH)3 - слабое
основание, НCl - cильная кислота).
Al3+ + HOH
AlOH2+ + H+
(среда кислая, рН<7)
AlCl3 + HOH
AlOHCl2 + HCl (1 ступень гидролиза).
23.
4. Соль образована ионами слабого основания и слабойкислоты:
а) соль растворима в воде (например, (NH4)2CO3, NH4NO2 и др.).
(NH4)2CO3 + H2O гидролиз идет сразу по катиону и аниону:
2NH4+ + CO32 + HOH
NH4OH + HCO3 + NH4+ (рН 7)
(NH4)2CO3 + HOH
NH4OH + NH4HCO3
б) соль нерастворима в воде (например, FeS, ZnSiO3 и др.).
FeS + H2O нерастворимые соли гидролизу не подвергаются.
в) соль разлагается водой (в таблице растворимости стоит прочерк,
например, Fe2S3, Al2(CO3)3 и др.). Гидролиз таких солей идет
необратимо и до конца: Fe2S3+6H2O 2Fe(OH)3 +3H2S
24.
Соль гидролизуется полностью и необратимо еслиона образована:
- легколетучей или труднорастворимой кислотой
(константа диссоциации не превышает 10-7)
- труднорастворимым основанием (константа диссоциации не
превышает 10-8)
Аl(СО3)3 + 6Н2О → 2Аl(ОН)3 + 3Н2СО3
Cr2S3 +6H2O → 2Cr(OH)3↓ + 3H2S↑
25.
Глубина гидролизаПоказателем глубины протекания гидролиза является
степень гидролиза. Глубина гидролиза зависит от
соотношений значений константы гидролиза и константы
диссоциации (чем больше разбавлен раствор, тем глубже
протекает гидролиз), а также от температуры, природы
ионов, образующих соль, и от растворимости соли в воде
(концентрации раствора)
26.
27.
28.
Смещение равновесия реакции гидролизаЕсли в раствор гидролизующейся соли ввести реактив,
связывающий образующиеся при гидролизе ионы Н + или ОН , то
в соответствии с принципом Ле Шателье равновесие смещается в
сторону усиления гидролиза; в результате гидролиз может
протекать полностью - до образования конечных продуктов.
Например, добавление к раствору карбоната натрия
небольшого количества сильной кислоты приведет к усилению
гидролиза за счет связывания образующихся в процессе гидролиза
ионов ОН :
Na2CO3 + H2O
NaHCO3 + NaOH
CO32 + HOH
HCO3 + OH
OH + H+ H2O
В результате становится возможной и вторая ступень
гидролиза карбоната натрия:
NaHCO3 + H2O
H2CO3 + NaOH
HCO3 + HOH
H2CO3 + OH .
Добавляя к системе избыток одного из образующихся при
реакции веществ (кислоты или щелочи), можно подавить гидролиз
(сместить равновесие гидролиза в обратную сторону). Так, в
случае карбоната натрия растворы щелочей ослабляют или даже
полностью прекращают гидролиз соли.
29.
Равновесие реакции гидролиза может смещаться в сторонуего усиления, если продуктом одной из ступеней гидролиза будет
малорастворимое соединение:
Bi(NO3)3 + HOH
BiOH(NO3)2 + HNO3
Bi3+ + HOH
BiOH2+ + H+
При разбавлении раствора равновесие реакции смещается
вправо за счет образования осадка нитрата оксовисмута:
BiOH(NO3)2 + HOH Bi(OH) 2NO3 + HNO3
BiONO3 + H2O
BiOH2+ + HOH + NO3 BiONO3 + H+
30.
Гидролиз соли можно усилить также нагреваяили разбавляя ее раствор.
Гидролиз усиливается при нагревании.
Гидролиз усиливается при разбавлении
31.
Взаимный гидролизИоны Н+ (или ОН ) можно связать в молекулы воды, вводя в
раствор не только щелочь (или кислоту), но и другую соль,
гидролиз которой приводит к накоплению в растворе ионов ОН
(или Н+); ионы Н+ и ОН будут нейтрализовать друг друга, что
вызовет взаимное усиление гидролиза обеих солей и в результате образование конечных продуктов гидролиза (взаимный гидролиз).
32.
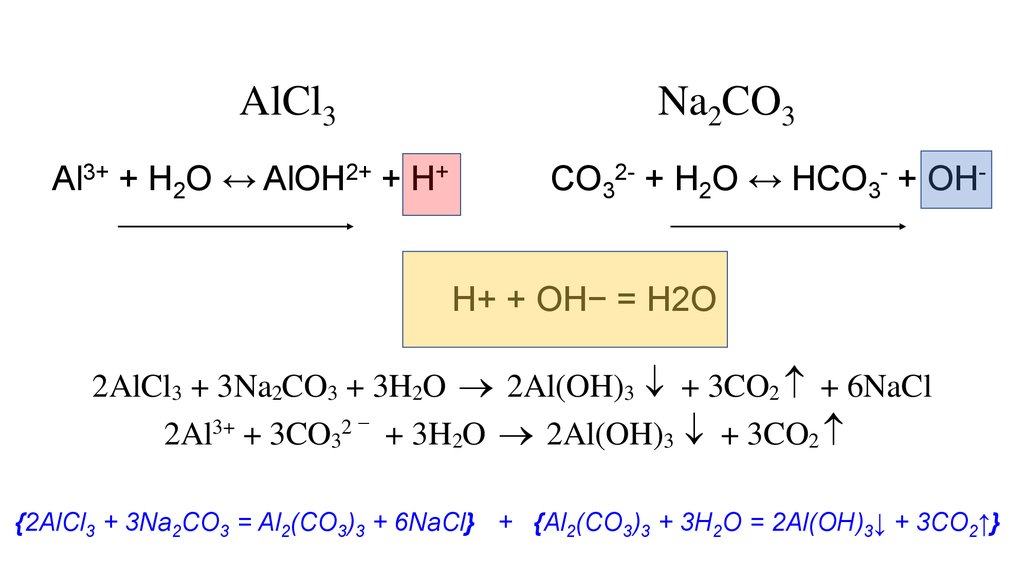
AlCl3Al3+ + H2O ↔ AlOH2+ + H+
Na2CO3
CO32- + H2O ↔ HCO3- + OH-
Н+ + ОН− = Н2О
2AlCl3 + 3Na2CO3 + 3H2O 2Al(OH)3 + 3CO2 + 6NaCl
3+
2
2Al + 3CO3 + 3H2O 2Al(OH)3 + 3CO2
{2AlCl3 + 3Na2CO3 = Al2(CO3)3 + 6NaCl} + {Al2(CO3)3 + 3H2O = 2Al(OH)3↓ + 3CO2↑}
33.
В реакциях взаимного гидролиза в осадоквыпадает наименее растворимый из возможных
продуктов гидролиза.
2CuSO4 + 2Na2CO3 + H2O (CuOH)2CO3 + CO2 + 2Na2SO4
2Cu2+ + 2CO32 + H2O (CuOH)2CO3 + CO2
34.
Практическое применениеЯвление гидролиза широко используется в химическом анализе для обнаружения ионов,
соли которых образуют при гидролизе нерастворимые соединения, для разделения ионов и
для усиления / ослабления кислотности / щелочности водных растворов.
Гидролиз широко используется в процессах получения из отходов древесины,
подсолнечной лузги, соломы, шелухи хлопка, кукурузной кочерыжки и другого непищевого
сырья различных продуктов (метилового/этилового спирта, белковых дрожжей, глюкозы, и
др.).
Гидролиз используется также для уменьшения жесткости воды при ее очистке
На реакциях гидролиза основаны процессы производства бумаги (гидролиз древесины),
мыла (омыливание жиров - щелочной гидролиз), осахаривание крахмала, и др.
Даже в организмах живых существ протекают процессы гидролиза (белков, полисахаридов и
других органических веществ)































 Химия
Химия








