Похожие презентации:
Лекция 6. Химическая кинетика
1. Лекция 6
Химическаякинетика
2.
Химическаякинетика - то раздел
химии, изучающий
скорость и механизм
химических реакций.
3.
План6.1 Понятие о скорости и механизме
химических реакций.
6.2 Влияние концентрации реагирующих
веществ на скорость химических реакций.
6.3 Влияние температуры на скорость
химических реакций.
6.4 Ферментативный катализ
4.
Большинство биохимическихреакций являются гомогенными
(протекающими в одной фазе).
Они могут быть как быстрыми
(реакции, лежащие в основе
передачи нервного импульса,
протекают практически
мгновенно), так и медленными
(время обновления белков на
половину составляет 70 дней).
5.
Средняя скорость гомогеннойреакции
(υ) равна изменению
концентрации вещества в единицу
времени:
υ=
[A] - [A]0
τ
6.
[A]0_ и [A] – исходная иконечная концентрация
вещества, моль/л
τ - время реакции, с., мин.,
(+) – вещество образуется,
(–) – вещество расходуется.
7.
Средняя скорость гетерогеннойреакции, протекающей на границе
раздела фаз, равна изменению
количества вещества в единицу времени
на единице площади поверхности
раздела фаз:
Полное
υ=
ν - ν0
Полное
обновление
костной
ткани
составляет от
4 до 7 лет.
8.
где ν0 и ν – количествовещества в начальный
и конечный момент
времени, моль
S – площадь
поверхности раздела
2
фаз, м
9.
Чтобы произошлахимическая реакция,
необходимо взаимодействие
между молекулами
реагирующих веществ.
Это взаимодействие
происходит в форме
столкновения молекул.
10.
11.
Во всем многообразиистолкновений
выделяют
элементарные стадии
процесса.
Элементарная стадия –
это столкновение
молекул реагирующих
веществ, приводящее к
образованию молекул
продуктов.
12.
Характеристикой элементарнойстадии является ее
молекулярность, т.е. число
участвующих в ней частиц.
Стадии могут быть:
•мономолекулярными I2 → 2I
Н2
•бимолекулярными
+ I2 → 2HI
•тримолекулярными
+ O → 2NO
2NO
13.
Механизмхимической реакции
– это число и
последовательность
элементарных
стадий процесса.
14.
Химические реакциипростые по
сложные по
механизму
механизму
представляет собой
протекают в
многократное
несколько
чередование одной
элементарных
элементарной
стадий
стадии
15.
6.2 Уравнения,описывающие влияние
концентрации реагирующих
веществ на скорость
химических реакций,
называются кинетическими
уравнениями.
16.
Кинетические уравнениясоставляют на основе закона
действующих масс (Гульдберг и
Вааге,1867): скорость
химических реакций прямо
пропорциональна произведению
концентраций реагирующих
веществ, возведенных в
некоторые показатели степени.
17.
Математическое выражениеЗДМ для реакции:
аА + bВ + cС → Р
x
y
z
υ = k [A] [B] [C]
где k – константа скорости,
являющаяся фундаментальной
кинетической характеристикой
реакций.
18.
k зависит от температуры иприроды веществ и не зависти
от их концентрации;
[A], [B], [C] – концентрации
реагирующих веществ, моль/л;
x, y и z – порядок реакции по
веществам.
Общий порядок реакции (n)
равен: n = x + y + z
19.
Порядок реакции определяетсятолько экспериментально. Он
является величиной
формальной и может
принимать любые значения:
положительные,
отрицательные, целые ,
дробные, а также 0.
20.
Только для простыхреакций порядок и
молекулярность
совпадают:
H2 + I2 → 2HI
υ = k [H2][I2]
21.
Кинетическое описаниепростых реакций.
Реакции нулевого порядка
(n=0)
Примеры: фотохимические,
каталитические и
ферментативные реакции (при
высокой концентрации
субстрата).
22.
Условное уравнение: А РКинетическое
уравнение:
Константа
скорости
= k A = k
0
[A]0 - [A]
k=
τ
23.
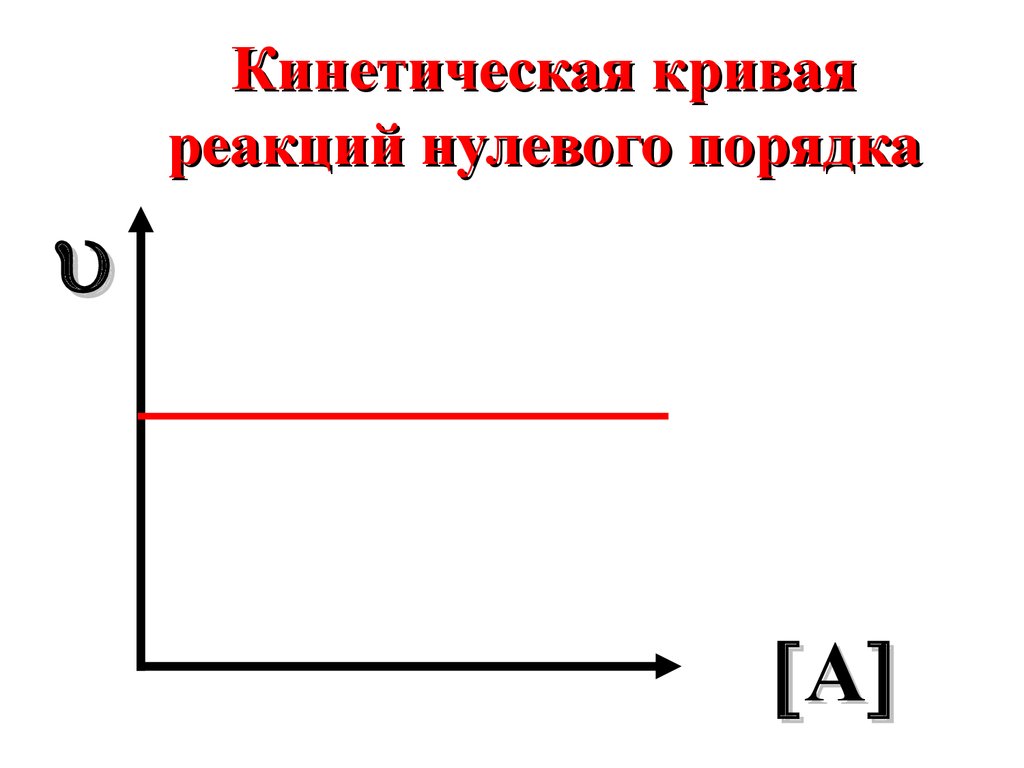
Кинетическая криваяреакций нулевого порядка
A
24.
Время полуреакции(τ ½) –
это время, необходимое для
уменьшения концентрации
исходного вещества в два раза.
[A]0
τ½=
2k
25.
Реакции первого порядка (n=1)Примеры: каталитические и
ферментативные реакции (при
низкой концентрации
субстрата), радиоактивный
распад, выведение
лекарственных препаратов из
организма человека.
26.
Условное уравнение: А РКинетическое
уравнение:
Константа
скорости
= k A
k=
1
[A]0
ℓn
[A]
27.
Кинетическая криваяреакции первого порядка
A
28.
Время полуреакции:ℓn 2
τ ½=
k
29.
Кинетика сложных реакций1) обратимые реакции
A
k1
k2
B
Кинетическое уравнение:
= k1[A] – k2[B]
30.
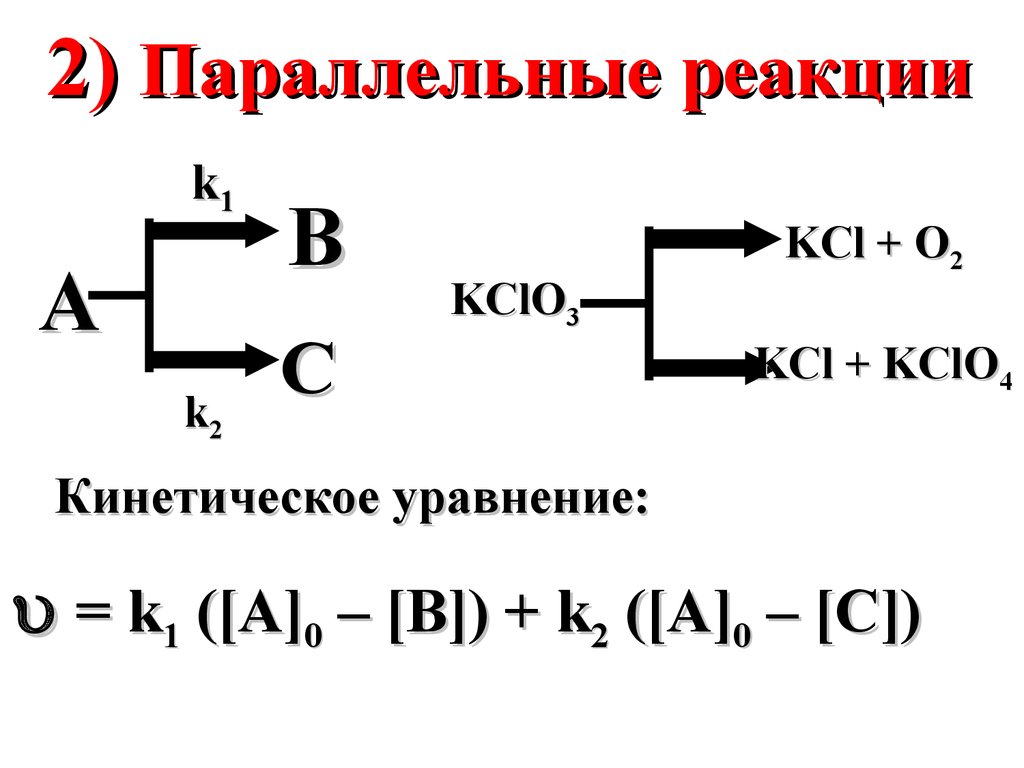
2) Параллельные реакцииk1
A
k2
B
C
KClO3
KCl + O2
KCl + KClO4
Кинетическое уравнение:
= k1 ([A]0 – [B]) + k2 ([A]0 – [C])
31.
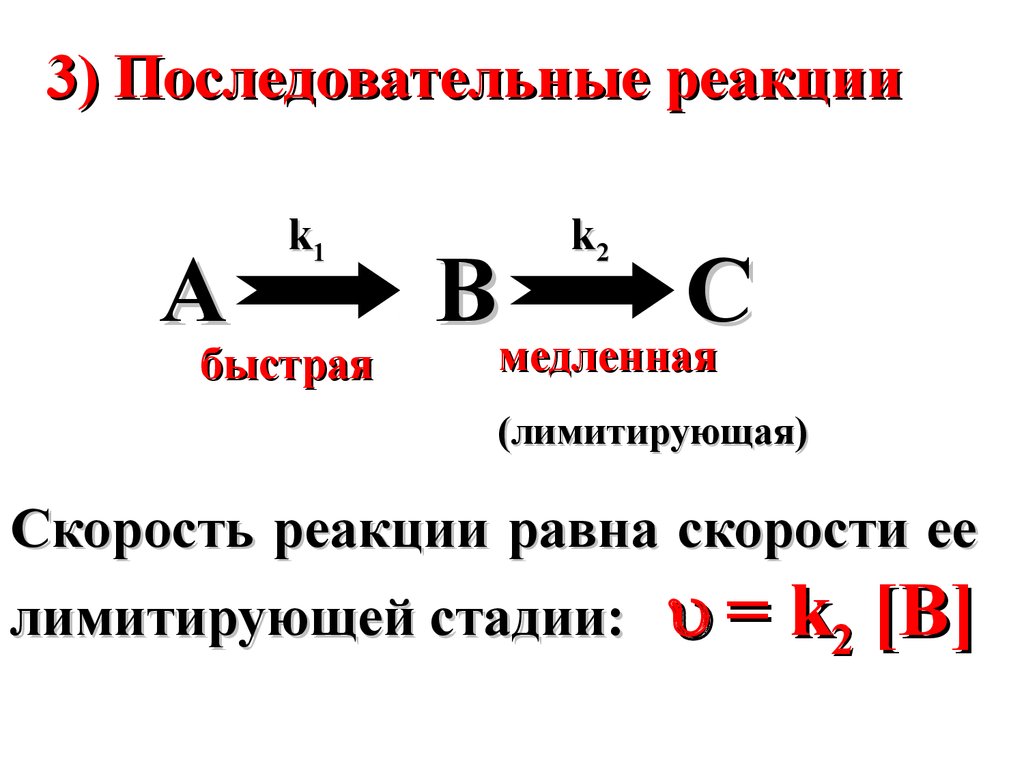
3) Последовательные реакцииA
k1
быстрая
k2
B
C
медленная
медленная
(лимитирующая)
Скорость реакции равна скорости ее
лимитирующей стадии:
= k2 [B]
32.
6.3 Влияние температурына скорость может быть
различным. Скорость
тримолекулярных
реакций с ростом
температуры уменьшается
T
33.
Радикальные реакцииВзрывной
режим
T
34.
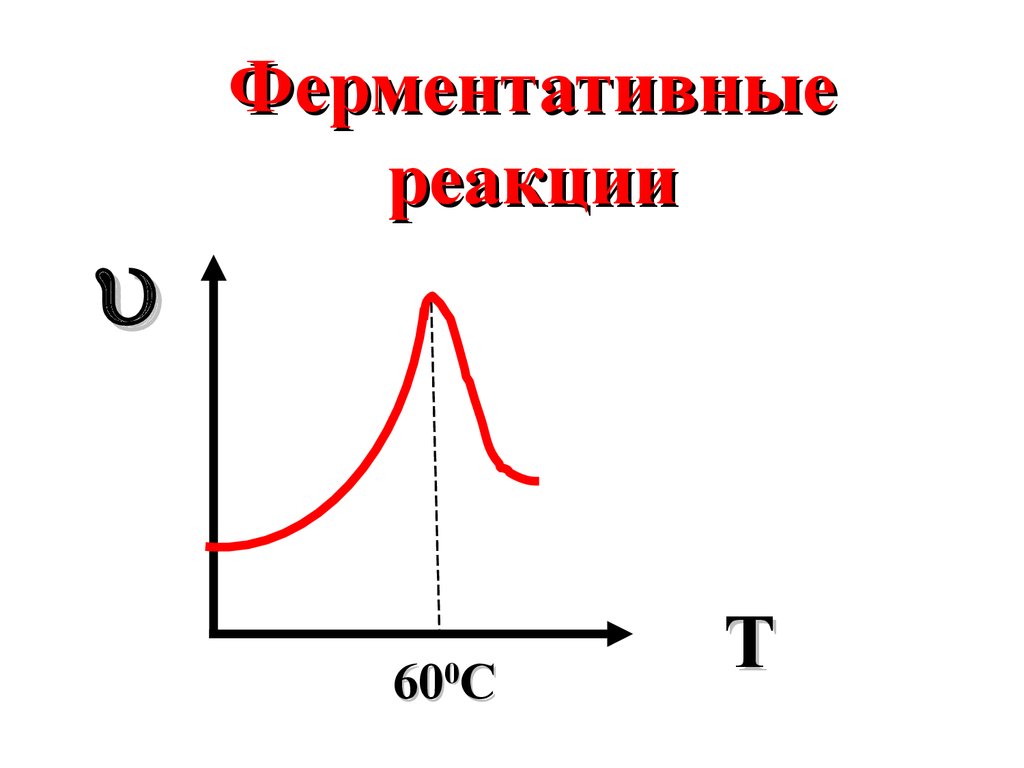
Ферментативныереакции
60 C
0
T
35.
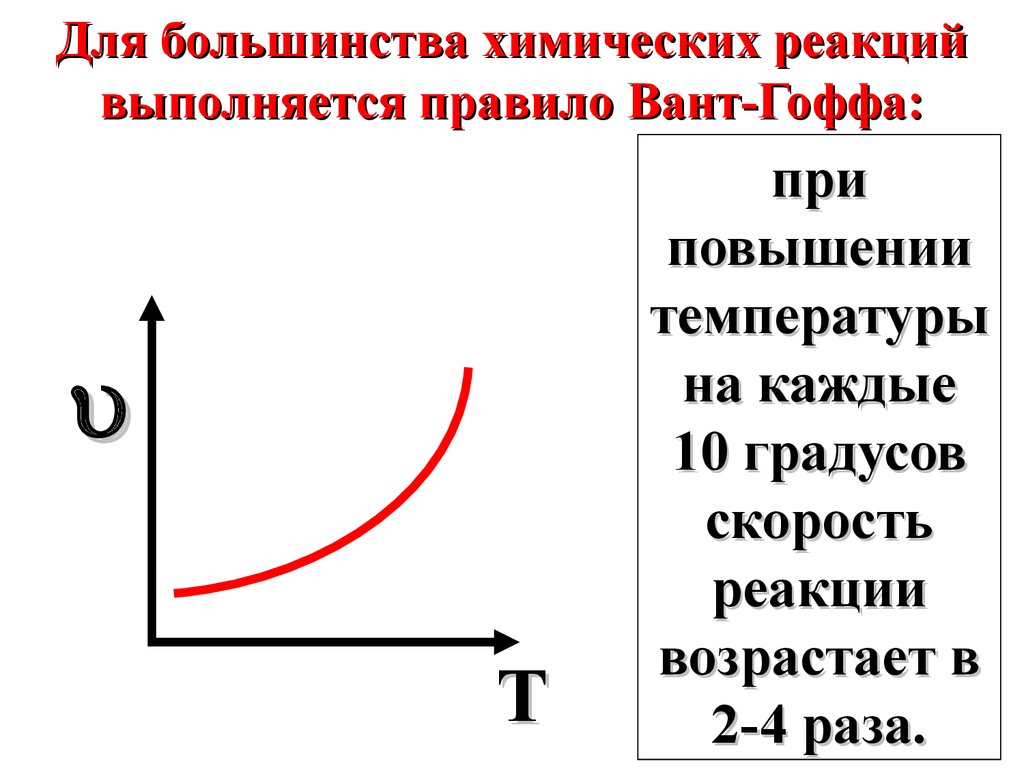
Для большинства химических реакцийвыполняется правило Вант-Гоффа:
T
при
повышении
температуры
на каждые
10 градусов
скорость
реакции
возрастает в
2-4 раза.
36.
T = T2
1
T2 – T 1
10
где Т1 и Т2 - начальная и конечная
температура,
температурный
коэффициент
реакции
2< <4
37.
Значительно точнее зависимостьскорости и температуры описывается
уравнением Аррениуса:
-Еак/RT
= 0e
-Еак/RT
k = k0 e
38.
где 0 и k0 - коэффициентыпропорциональности,
называемые
предэкспоненциальными
множителями,
Еак - энергия активации,
кДж/моль.
39.
С точки зрения теорииактивного комплекса,
энергия активации
(энергетический барьер
химической реакции) - это
энергия образования
активного комплекса из
реагирующих веществ.
40.
Активный комплекс- промежуточная частица,
в которой старые связи
еще не полностью
разорвались, а новые - не
полностью образовались.
41.
Схема химическойреакции :
А + В А...В
Р
А...В - активный
комплекс
42.
НI
Н2 + I 2
→ 2HI
Н
I
AK
43.
Энергия, кДж/мольЭнергетическая диаграмма
экзотермической реакции
A…B
A+B
Eaк
P
Координата реакции
44.
Энергия, кДж/мольЭнергетическая диаграмма
эндотермической реакции
A…B
Eaк
P
A+B
Координата реакции
45.
Энергия активации(Еак) зависит от
природы
реагирующих веществ
и не зависит от
температуры.
46.
С повышением температурыв реакционной смеси
возрастает доля активных
молекул, способных
преодолеть энергетический
барьер химической реакции,
что приводит к увеличению
ее скорости.
47.
6.4 Катализаторы– это вещества, изменяющие
скорость химической реакции,
но не изменяющиеся в ходе
процесса ни качественно, ни
количественно. Они не входят в
состав продуктов реакции.
48.
С точки зрения теорииактивного комплекса
механизм действия
катализаторов в том, что
они изменяют высоту
энергетического барьера
химической реакции.
49.
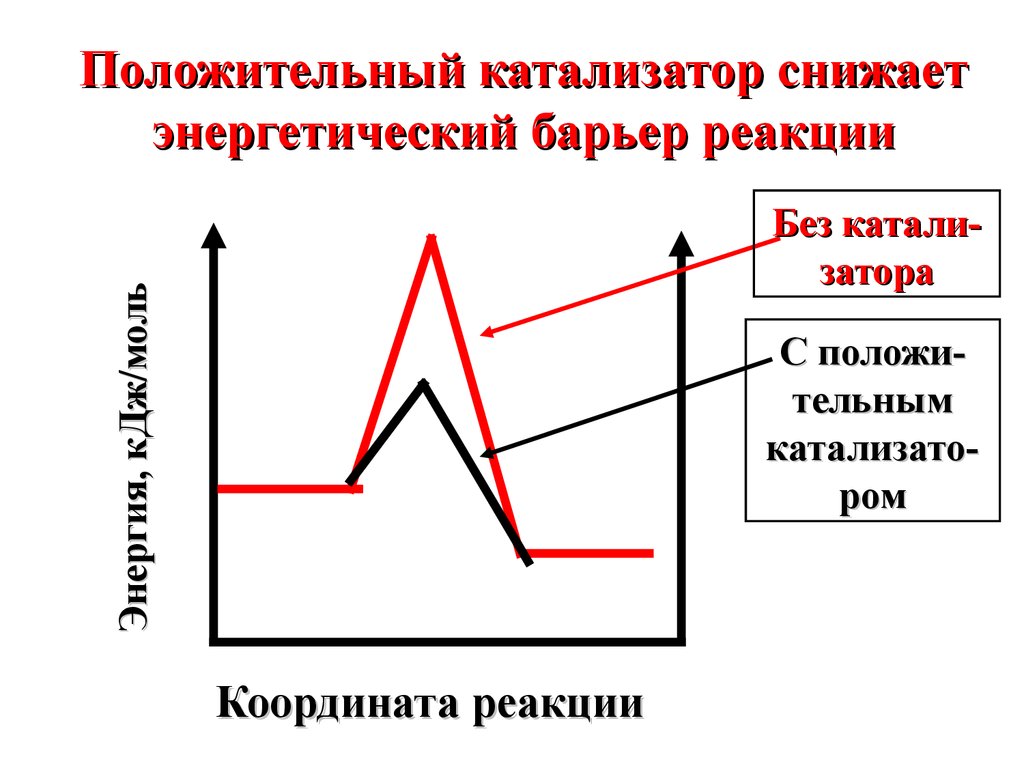
Положительный катализатор снижаетэнергетический барьер реакции
Энергия, кДж/моль
Без катализатора
С положительным
катализатором
Координата реакции
50.
Под воздействием положительного катализатора вреакционной смеси возрастает
доля активных молекул при
данной температуре.
Скорость
реакции увеличивается.
51.
Отрицательный катализаторповышает энергетический барьер
реакции
С отрицаЭнергия, кДж/моль
тельным катализатором
Без катализатора
Координата реакции
52.
Под воздействиемотрицательного катализатора в
реакционной смеси снижается
доля активных молекул при
данной температуре. Скорость
реакции уменьшается.
53.
Практически всебиохимические реакции
являются
ферментативными. Ферменты (биокатализаторы) – это
вещества белковой природы,
активированные катионами
металлов.
54.
Ферменты отличаются отобычных катализаторов:
а) более высокой
каталитической
активностью;
б) высокой
специфичностью, т.е.
избирательностью действия.
55.
Механизм односубстратнойферментативной реакции можно
представить схемой:
KM
k2
P+
Лимитирующая
стадия
56.
Е–
фермент,
S –
субстрат,
ЕS –
ферментсубстратный
комплекс,
Р –
продукт
57.
Характеристикой первойстадии ферментативной
реакции является КМ –
константа Михаэлиса.
КМ является величиной,
обратной константе
равновесия.
58.
KMKM = 10‾ –10‾ моль/л
Чем меньше КМ, тем
устойчивее комплекс .
5
3
59.
Кинетическое уравнениеферментативной реакции:
= k2 [ES],
(1)
где k2 – константа скорости,
называемая числом
оборотов или молекулярной
активностью фермента.
60.
k2 равна числу молекулсубстрата, превращающихся
в продукт под воздействием
одной молекулы фермента
0
за 1 минуту при 25 С
1×10 < k2 < 6×10 мин‾
4
6
1
61.
Из-за невозможностиэкспериментального
определения [ES], уравнение
(1) преобразовали, выразив
[ES] через легко
измеряемые параметры
реакции.
62.
Кинетическое уравнениеферментативных реакций (уравнение
Михаэлиса-Ментен) 1913
= k2
E общ S
K M + S
63.
Произведение k2× E общ являетсявеличиной постоянной, которую
обозначают υmax (максимальная
скорость)
=
max S
K M + S
64.
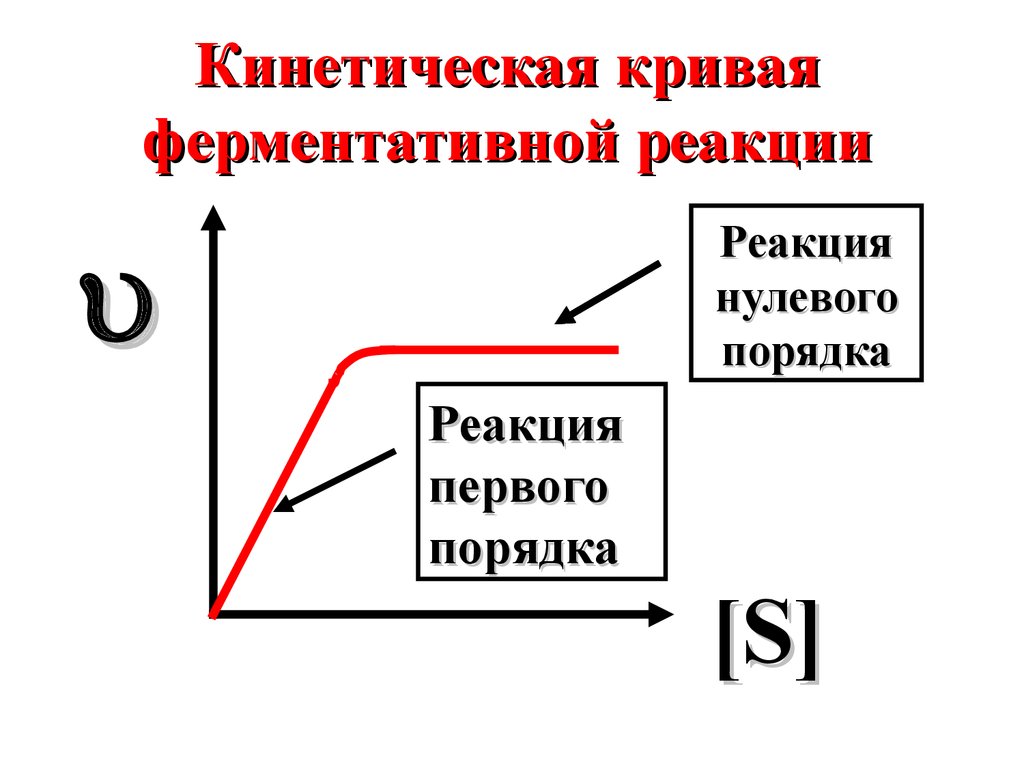
1)При низкой концентрациисубстрата
KM >> S ,
поэтому
max
S
=
KM
Кинетическое уравнение
реакции 1-го порядка
65.
2) При высокойконцентрации субстрата
Км << [S], поэтому
= max
Кинетическое уравнение реакции 0го порядка
66.
Кинетическая криваяферментативной реакции
Реакция
нулевого
порядка
Реакция
первого
порядка
[ S]
67.
На активностьферментов
оказывают влияние:
а) температура,
б) кислотность среды,
в) наличие ингибиторов
68.
Влияние кислотности растворовна активность ферментов
k2
рНопт
pH
69.
Ингибиторы ферментов –это вещества,
занимающие часть
активных центров
молекул фермента, в
результате чего скорость
ферментативной реакции
уменьшается.
70.
В роли ингибиторов выступаюткатионы тяжелых металлов,
органические кислоты и другие
соединения.
71.
Благодаримза
внимание !!!






























































 Химия
Химия








