Похожие презентации:
Обмен белков (часть 1)
1. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
Лекция по теме:Обмен белков – 1
Краснодар
2016
2. Азотистый баланс – соотношение поступившего в организм азота (в виде азота аминокислот) и выведенного азота (в виде конечных
продуктов обмена –мочевины и солей аммония)
Равновесие
Положительный
Отрицательный
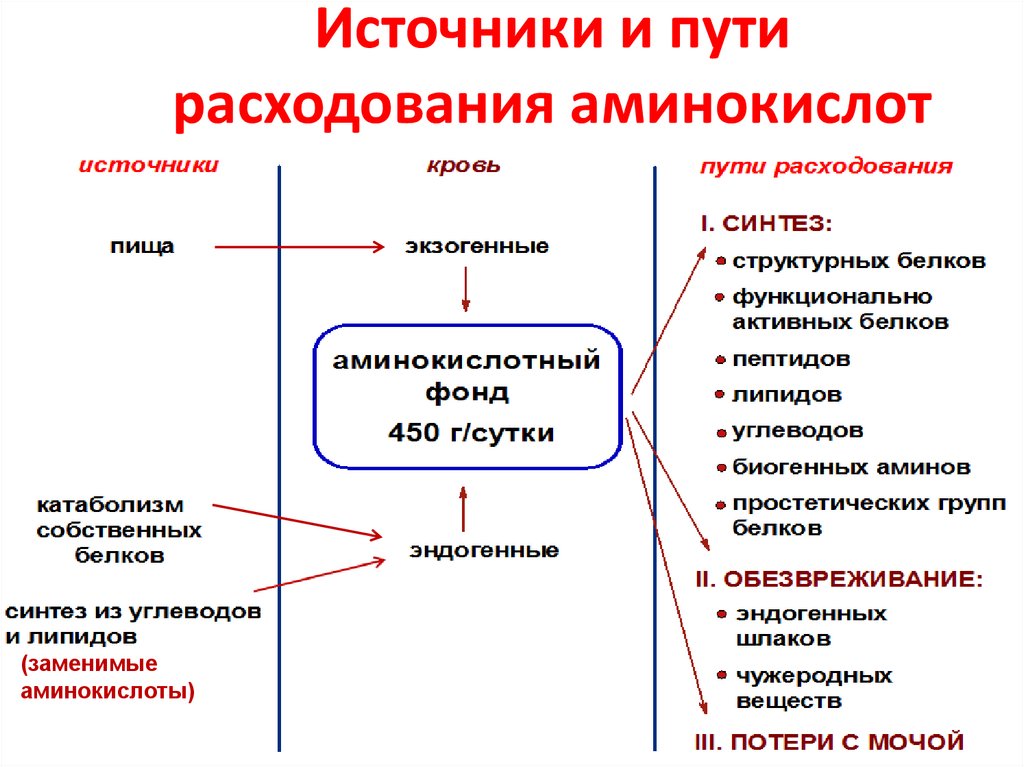
3. Источники и пути расходования аминокислот
(заменимыеаминокислоты)
4. Потребность в пищевых белках
• 23,2 г/сут – коэффициент Рубнера –«коэффициент изнашивания» (азотистый
баланс отрицательный).
• 30-45 г/сут – «физиологический минимум
белка». Это минимальное количество белка,
позволяющее поддерживать азотистое
равновесие.
• Физиологическая норма – 1-1,2 г белка
на кг массы тела
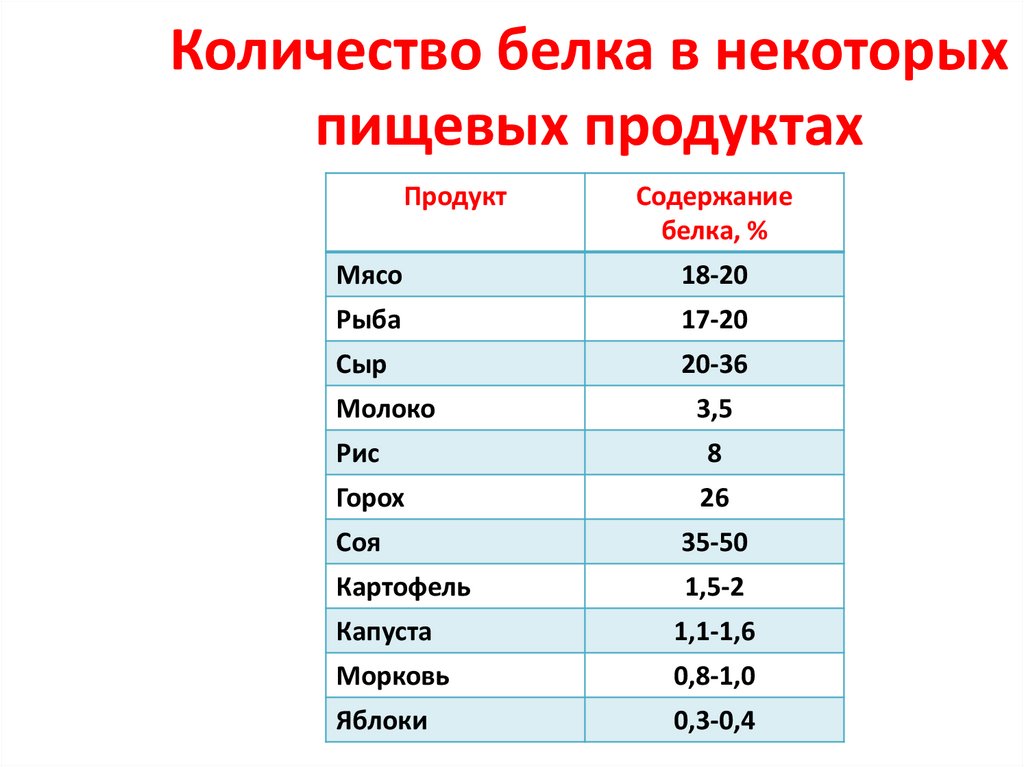
5. Количество белка в некоторых пищевых продуктах
ПродуктСодержание
белка, %
Мясо
18-20
Рыба
17-20
Сыр
20-36
Молоко
3,5
Рис
8
Горох
26
Соя
35-50
Картофель
1,5-2
Капуста
1,1-1,6
Морковь
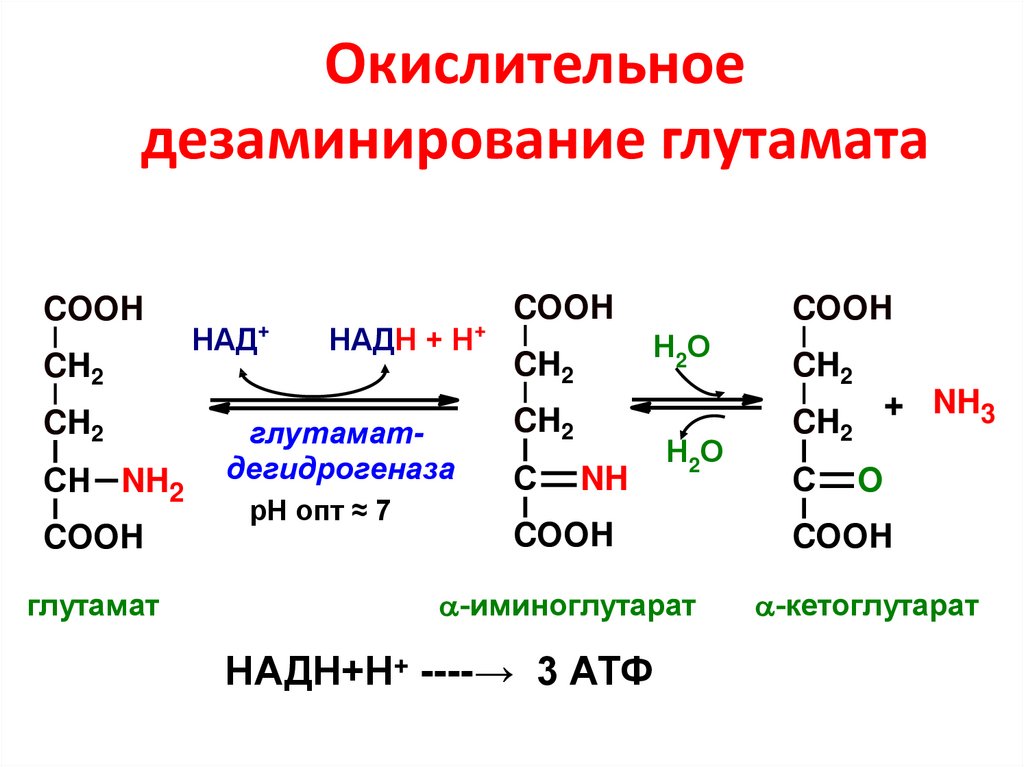
0,8-1,0
Яблоки
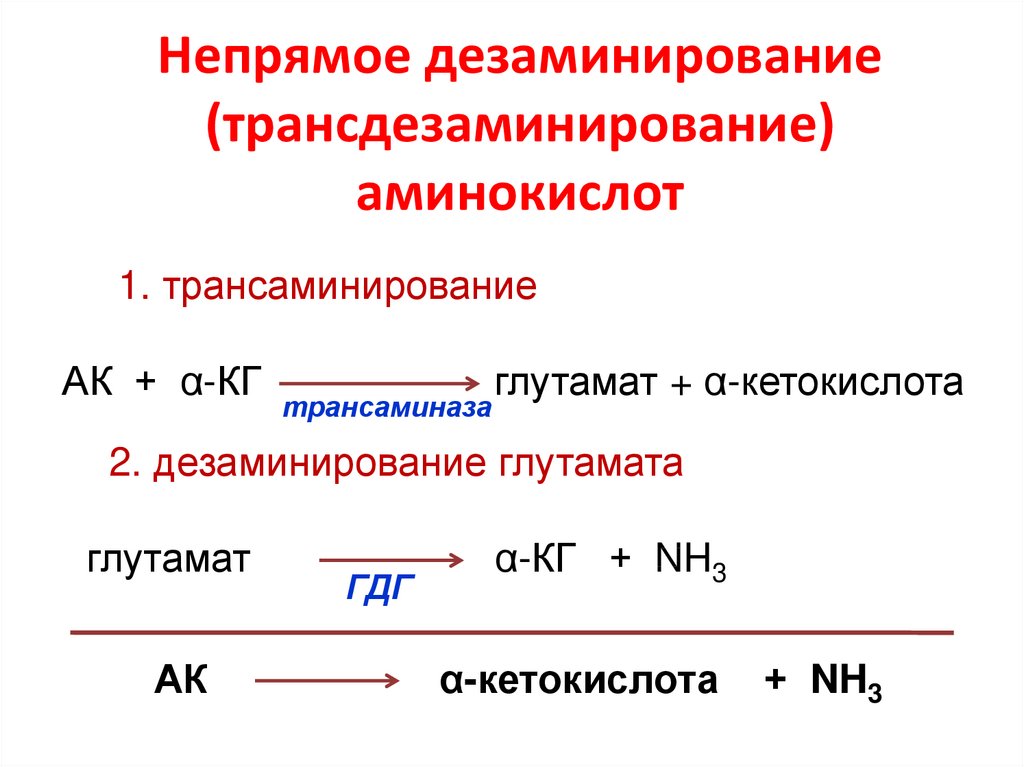
0,3-0,4
6. Критерии полноценности пищевого белка
• Белок должен содержать все заменимыеаминокислоты в соотношениях, близких к их
соотношениям в человеческом организме
• Белок должен перевариваться ферментами
ЖКТ
• Белок не должен содержать веществ,
мешающих перевариванию и усваиванию
7.
Ферменты,переваривающие белки
(гидролизующие пептидные
связи), называются
протеиназы (пептидазы,
протеазы, протеолитические
ферменты)
8. Катепсины –
лизосомальныепротеолитические ферменты
(протеиназы), обеспечивающие
распад тканевых (собственных)
белков, рН оптимум их лежит в
кислой среде
9. Действие протеиназ (протеолиз)
10. Протеиназы ЖКТ
Эндопептидазы ЭкзопептидазыПепсин;
Реннин;
Гастриксин;
Трипсин;
Химотрипсин;
Эластаза.
• Карбоксипептидазы
А и В;
• Аминопептидазы;
• Дипептидазы;
• Трипептидазы.
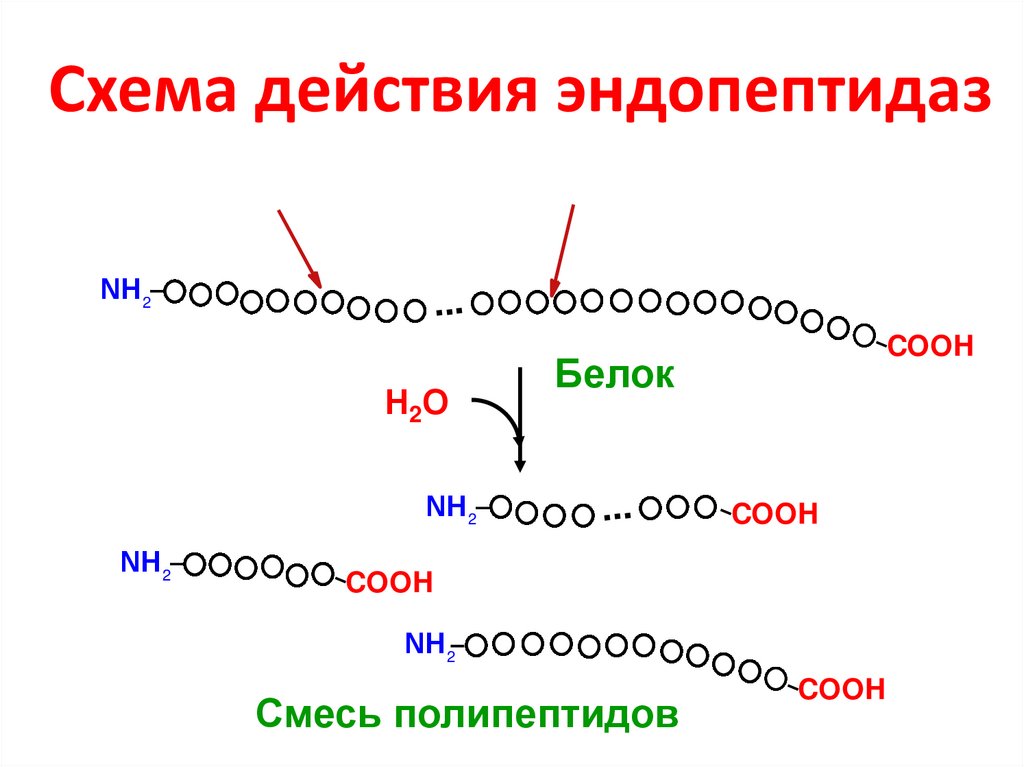
11. Схема действия эндопептидаз
NН 2...
Н2О
NН 2
NН 2
COOH
Белок
...
COOH
COOH
NН 2
Смесь полипептидов
COOH
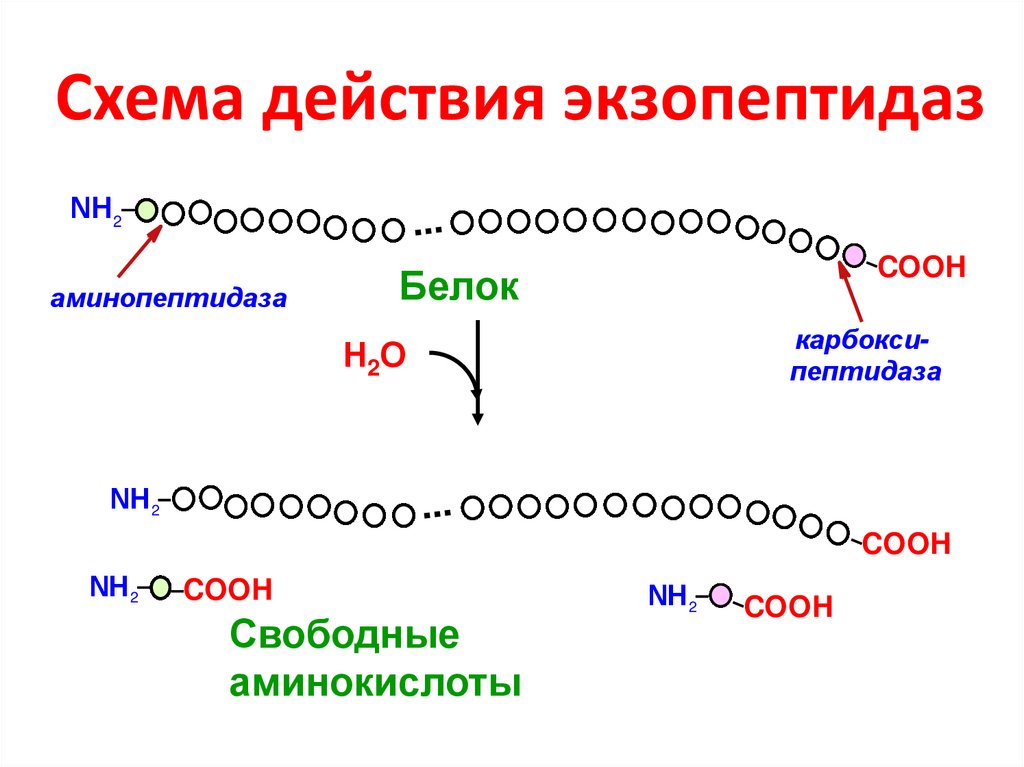
12. Схема действия экзопептидаз
NН 2...
аминопептидаза
COOH
Белок
карбоксипептидаза
Н2О
NН 2
...
COOH
NН 2
COOH
Свободные
аминокислоты
NН 2
COOH
13. Пищеварительные соки
Пищеварительный сокКол-во, рН
л
Химический состав,
%
Вода Орг.в-ва Неорг.
(белки)
в-ва
Желудочный 2-2,5
сок
1,5-2,5 99
0,5
0,5
Панкреатический сок
0,6-0,8
7,5-8,2 98,4
1,2
0,6
Кишечный
сок
2-3
8,5
0,5-1,0
0,3
98,7
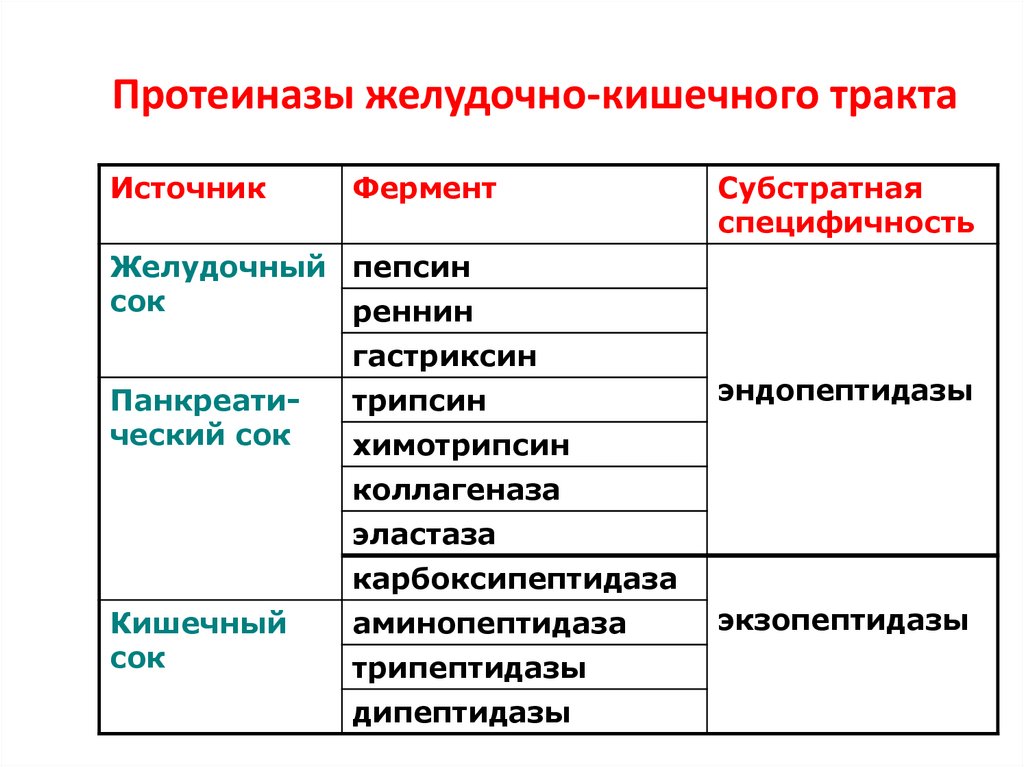
14. Протеиназы желудочно-кишечного тракта
ИсточникФермент
Субстратная
специфичность
Желудочный пепсин
сок
реннин
гастриксин
Панкреатический сок
трипсин
эндопептидазы
химотрипсин
коллагеназа
эластаза
карбоксипептидаза
Кишечный
сок
аминопептидаза
трипептидазы
дипептидазы
экзопептидазы
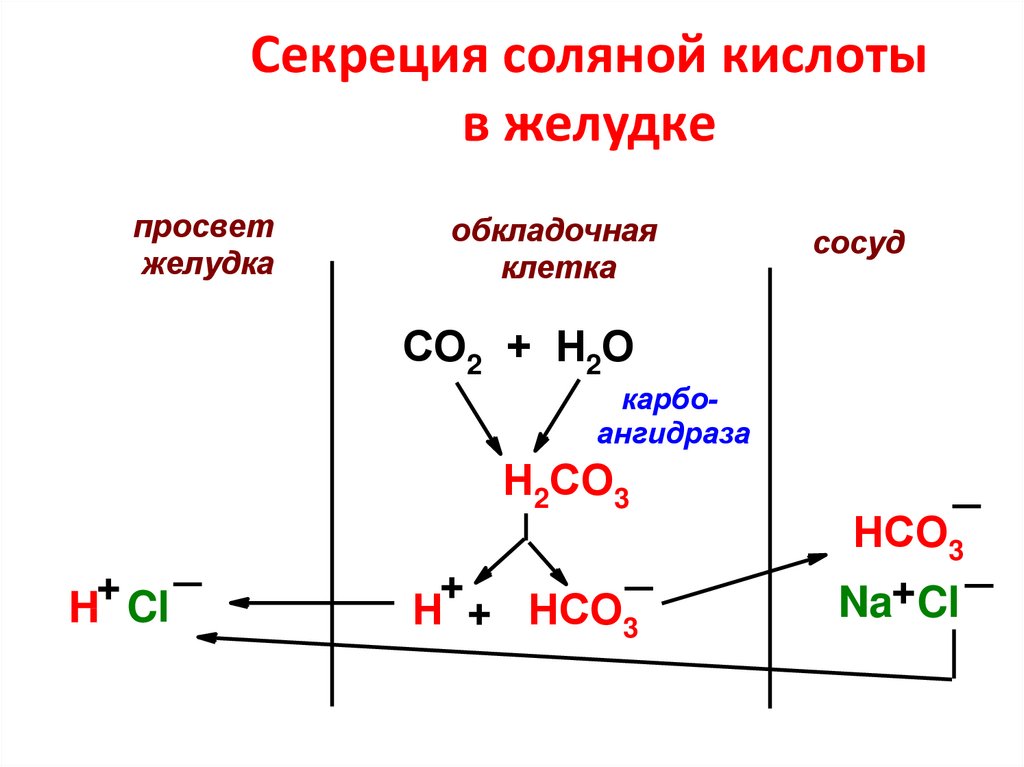
15. Секреция соляной кислоты в желудке
просветжелудка
обкладочная
клетка
сосуд
СО2 + Н2О
карбоангидраза
Н2СО3
+
H Cl
+
Н + НСО3
НСО3
Na+Cl
16. Функции соляной кислоты
1.2.
3.
4.
5.
активация пепсиногена
создание рН-оптимума для пепсина (1,5-2,5)
бактерицидное действие
денатурирует белки
регулирует работу привратника и стимулирует
выработку секретина в кишечнике
6. активирует всасывание железа
7. обеспечивает всасывание витамина В12 (участвует
с синтезе белкового фактора Кастла –
антианемического)
17. Виды кислотности желудочного сока
• Общая кислотность (НСl + прочиекислые вещества – кислые соли,
органические кислоты) 40-60 ммоль/л
• Соляная кислота:
– Свободная 20-40 ммоль/л
– Связанная (с ионогенными группами белков) –
СООН + -NH3Сl 10-12 ммоль/л
18. Компоненты желудочного сока в норме и при патологии
СостояниерН
кислотность (ТЕ)
общая
Норма
1,5-2,5 40-60
Гиперацидный гастрит
≈ 1,0
Гипоацидный гастрит
Ахилия
связанная НСl
10-12
пепсин
свободная HCl
20-40
+
> 60
> 40
±
> 2,5
< 40
< 20
±
7,0
0
-
-
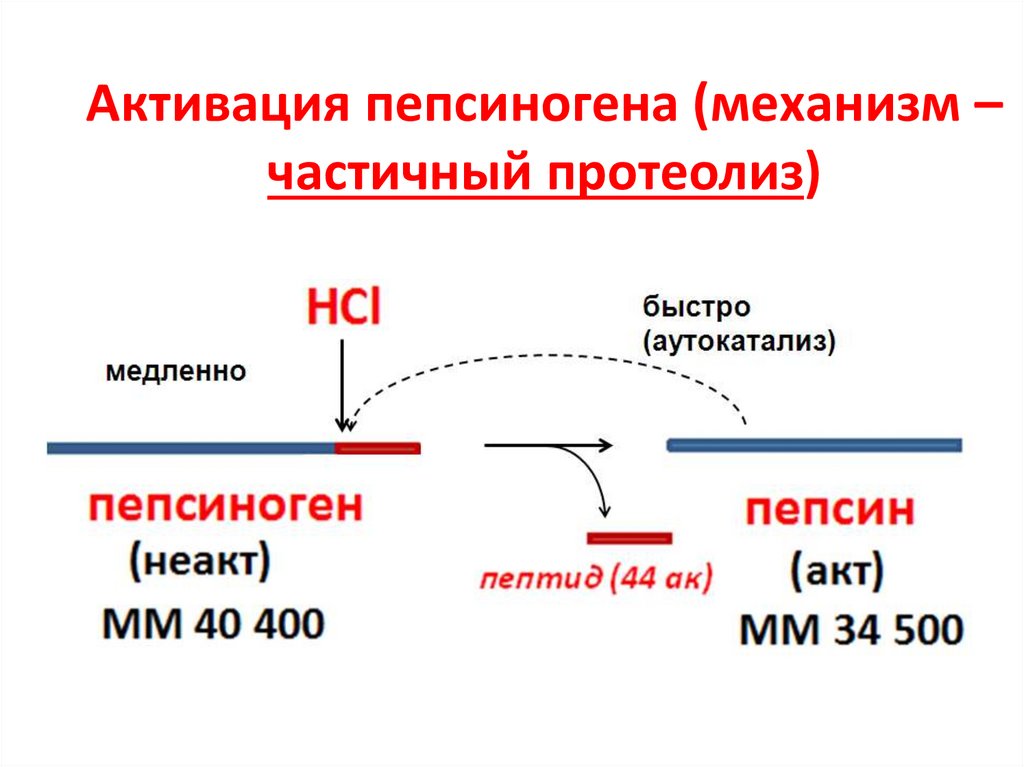
19. Активация пепсиногена (механизм – частичный протеолиз)
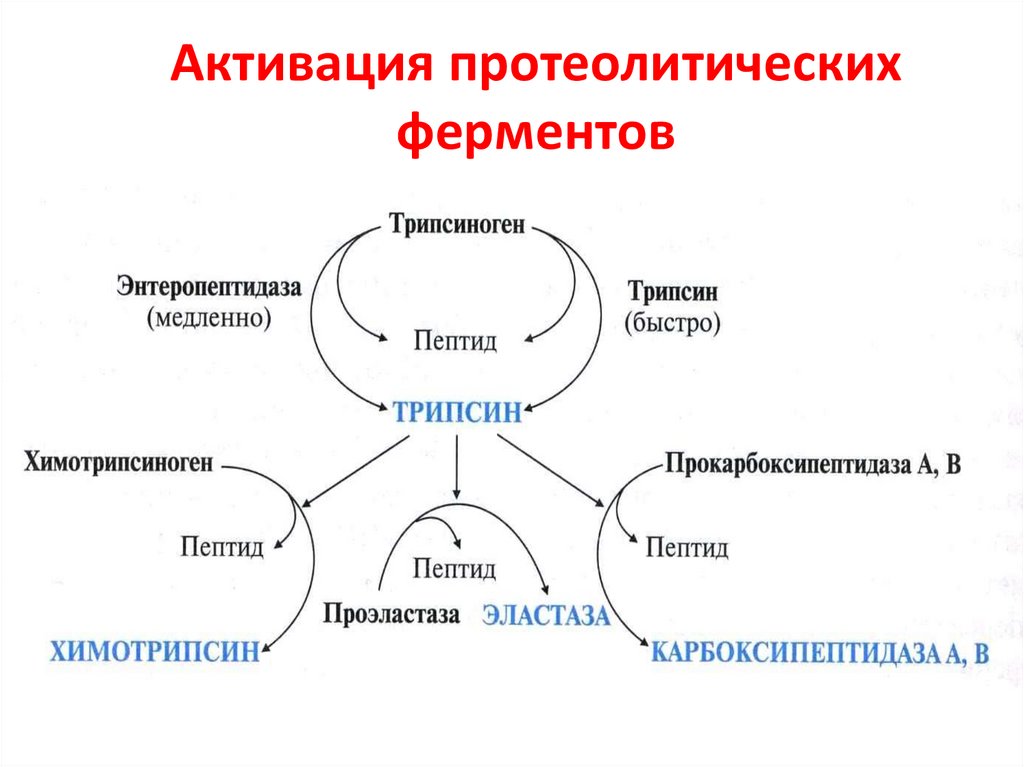
20. Активация трипсиногена
ЭнтеропептидазаТрипсиноген
неактивный
Трипсин
активный
21. Активация протеолитических ферментов
22. Биологический смысл синтеза проферментов –
защита тканейпищеварительных желёз
от самопереваривания
(аутолиза)
23. Переваривание белков
24.
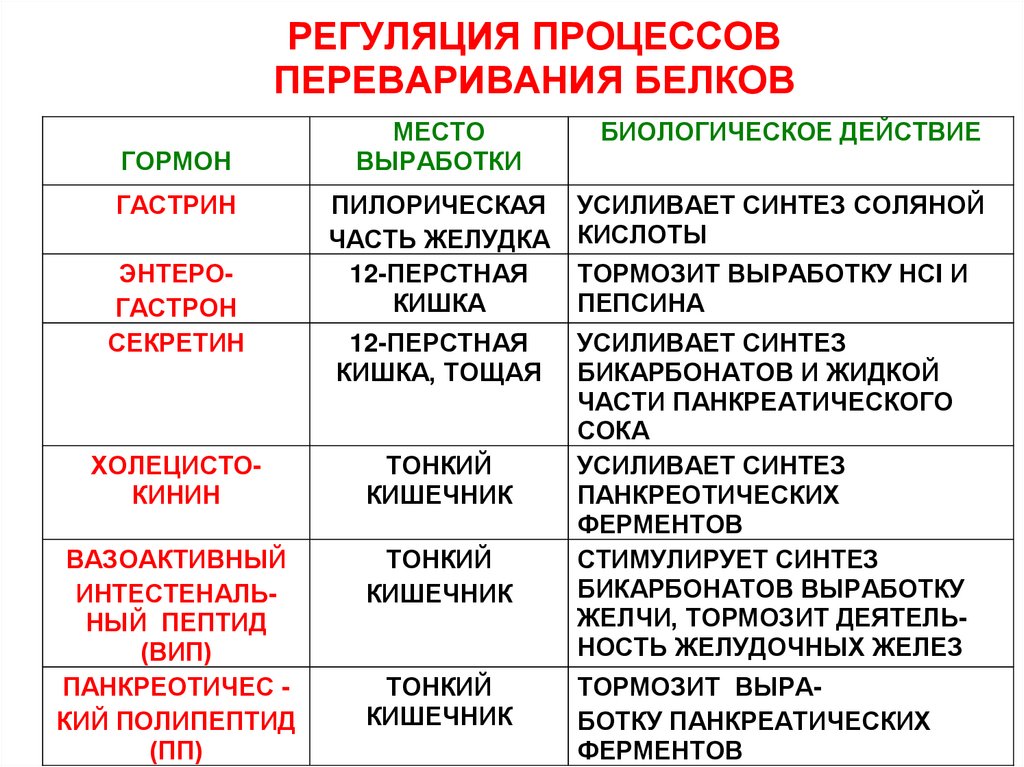
РЕГУЛЯЦИЯ ПРОЦЕССОВПЕРЕВАРИВАНИЯ БЕЛКОВ
ГОРМОН
ГАСТРИН
ЭНТЕРОГАСТРОН
СЕКРЕТИН
МЕСТО
ВЫРАБОТКИ
ПИЛОРИЧЕСКАЯ
ЧАСТЬ ЖЕЛУДКА
12-ПЕРСТНАЯ
КИШКА
12-ПЕРСТНАЯ
КИШКА, ТОЩАЯ
ХОЛЕЦИСТОКИНИН
ТОНКИЙ
КИШЕЧНИК
ВАЗОАКТИВНЫЙ
ИНТЕСТЕНАЛЬНЫЙ ПЕПТИД
(ВИП)
ПАНКРЕОТИЧЕС КИЙ ПОЛИПЕПТИД
(ПП)
ТОНКИЙ
КИШЕЧНИК
ТОНКИЙ
КИШЕЧНИК
БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
УСИЛИВАЕТ СИНТЕЗ СОЛЯНОЙ
КИСЛОТЫ
ТОРМОЗИТ ВЫРАБОТКУ НСI И
ПЕПСИНА
УСИЛИВАЕТ СИНТЕЗ
БИКАРБОНАТОВ И ЖИДКОЙ
ЧАСТИ ПАНКРЕАТИЧЕСКОГО
СОКА
УСИЛИВАЕТ СИНТЕЗ
ПАНКРЕОТИЧЕСКИХ
ФЕРМЕНТОВ
СТИМУЛИРУЕТ СИНТЕЗ
БИКАРБОНАТОВ ВЫРАБОТКУ
ЖЕЛЧИ, ТОРМОЗИТ ДЕЯТЕЛЬНОСТЬ ЖЕЛУДОЧНЫХ ЖЕЛЕЗ
ТОРМОЗИТ ВЫРАБОТКУ ПАНКРЕАТИЧЕСКИХ
ФЕРМЕНТОВ
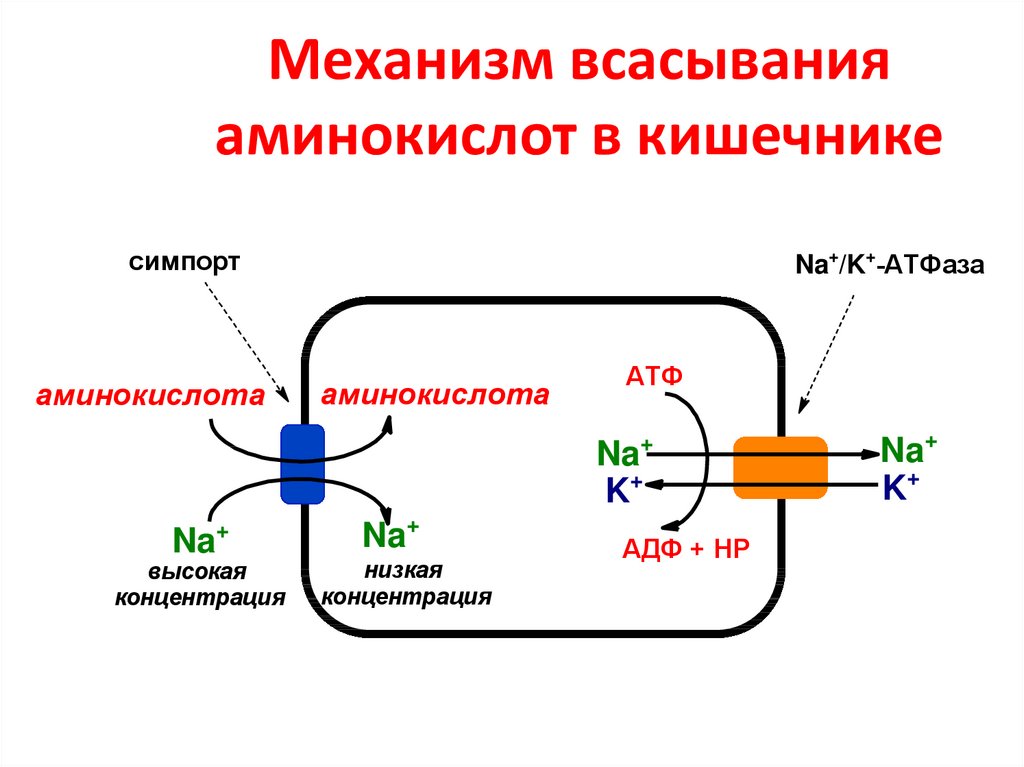
25. Механизм всасывания аминокислот в кишечнике
симпортаминокислота
Na+/K+-АТФаза
аминокислота
АТФ
Na+
K+
Na
+
высокая
концентрация
Na+
низкая
концентрация
АДФ + НР
Na+
K+
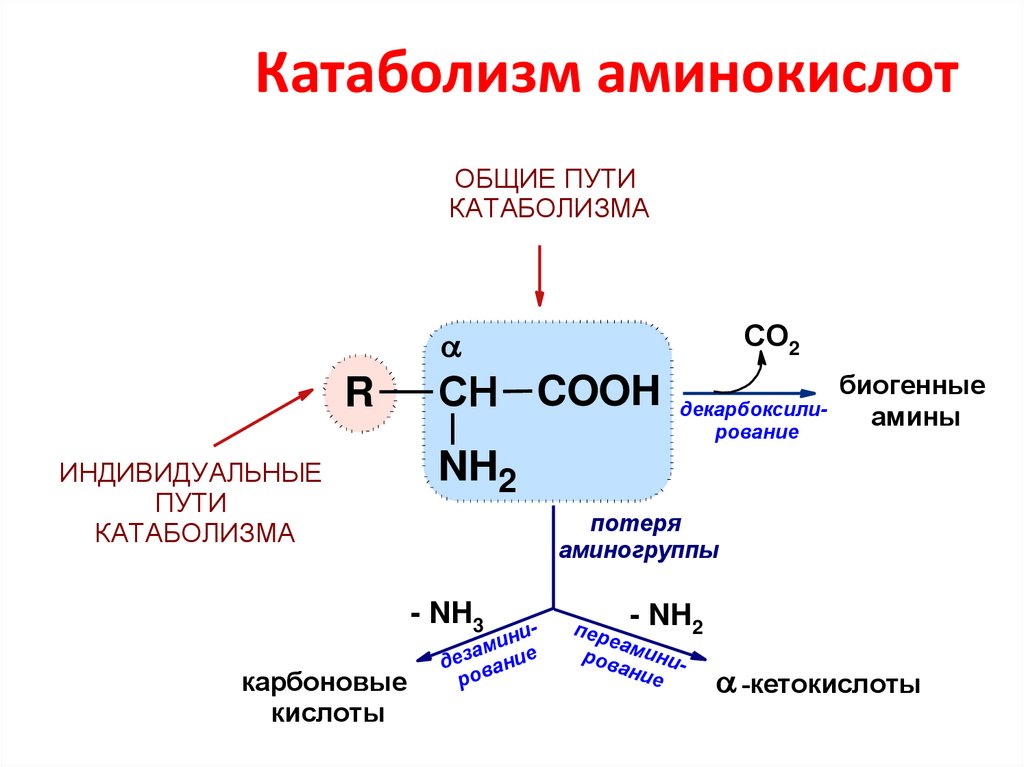
26. Катаболизм аминокислот
ОБЩИЕ ПУТИКАТАБОЛИЗМА
СО2
R
ИНДИВИДУАЛЬНЫЕ
ПУТИ
КАТАБОЛИЗМА
СН COOH
NH2
потеря
аминогруппы
- NH3
карбоновые
кислоты
декарбоксилирование
биогенные
амины
нии
м
а
дез вание
ро
- NH2
п ер
еа
ров миниани
е
-кетокислоты
27. Реакции декарбоксилирования
СО2R СН COO H
NH2
аминоксилота
декарбоксилаза
R СН2 NH2
ПФ (vit B6)
биогенный амин
Декарбоксилирование – отщепление
карбоксильной группы в виде молекулы
углекислого газа
28. Биологическая роль реакций декарбоксилирования –
образование биогенных аминов,которые могут быть:
1. Гормонами
2. Нейромедиаторами
3. Входить в состав более сложных
структур
29. Декарбоксилирование глутаминовой кислоты
COOHСН2
СН2
СН NH2
COOH
глу
СО 2
декарбоксилаза
ПФ (vit B6)
COOH
СН2
СН2
СН2 NH2
-аминомасляная к-та
(ГАМК)
ГАМК – тормозной нейромедиатор центральной
нервной системы
30. Декарбоксилирование аспарагиновой кислоты
аспартатβ-аланин
β-аланин – структурный компонент пантотеновой
кислоты (вит В3) и дипептидов мышечной ткани –
карнозина и анзерина
31. Декарбоксилирование гистидина
CO 2СН 2 СН
N
NH
гистидин
1.
2.
3.
4.
5.
NH2
COO H
Декарбоксилаза
гистидина
ПФ (vit B6)
СН 2 СН 2
N
NH
гистамин
Гистамин:
Расширяет сосуды (вызывает гиперемию, гипертермию),
Обеспечивает приток крови (и соотв.лейкоцитов к месту
воспаления, травмы, укуса и т.д.), т.е. участвует в
воспалительных реакциях,
Является медиатором боли,
Усиливает секрецию соляной кислоты в желудке,
Вызывает аллергические реакции
NH2
32. Декарбоксилирование триптофана
СН2 СН COOHNH2
NH
триптофан
1/2 О2
СО2
СН2 СН2
декарбоксилаза
NH2
NH
трипамин
ПФ (vit B6)
гидроксилаза
СО2
HO
СН2 СН COOH
NH
NH2
5-гидрокситриптофан
декарбоксилаза
ПФ (vit B6)
HO
СН2 СН2
NH
NH2
серотонин
Триптамин – внутриклеточный регулятор, нейромедиатор.
Серотонин – нейромедиатор, суживает сосуды, обеспечивает
поддержание температуры, участвует в процессах памяти,
обучения и т.д.
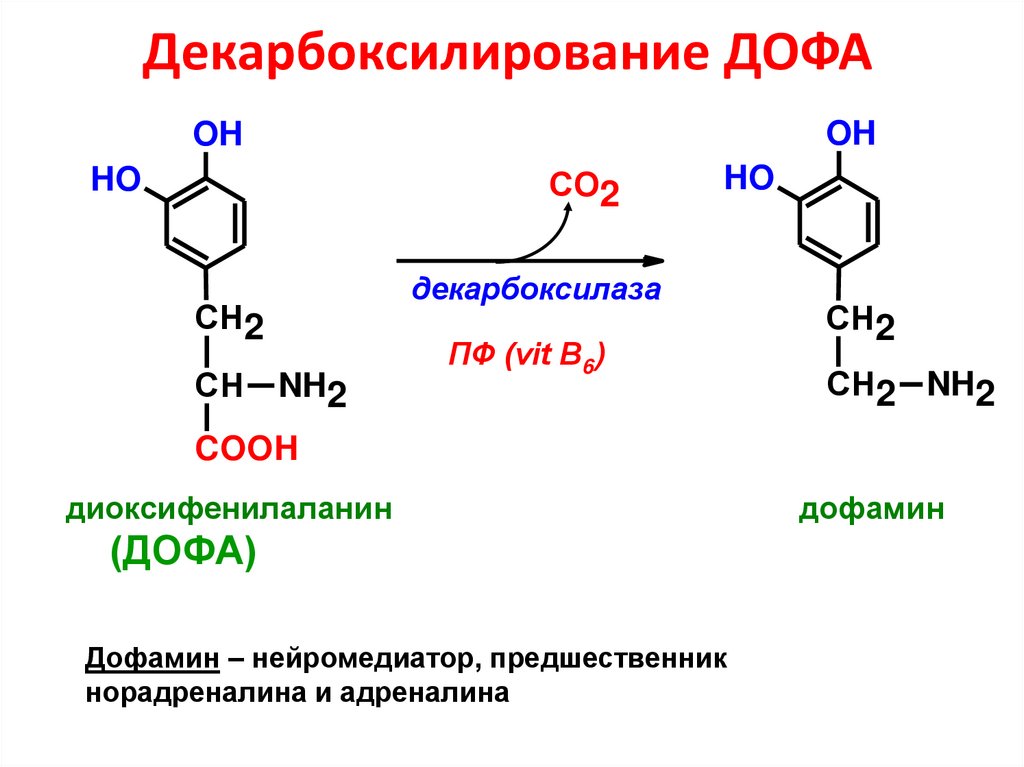
33. Декарбоксилирование ДОФА
OHOH
СО2
HO
декарбоксилаза
СН2
СН
HO
NH2
ПФ (vit B6)
СН2
СН2 NH2
COOH
диоксифенилаланин
(ДОФА)
Дофамин – нейромедиатор, предшественник
норадреналина и адреналина
дофамин
34.
Декарбоксилирование цистеинаТиоэтиламин –
входит в состав
КоА;
Таурин:
- структурный
компонент парных
желчных кислот,
участвует в
переваривании и
всасывании
липидов;
- обладает
антиоксидантным
действием.
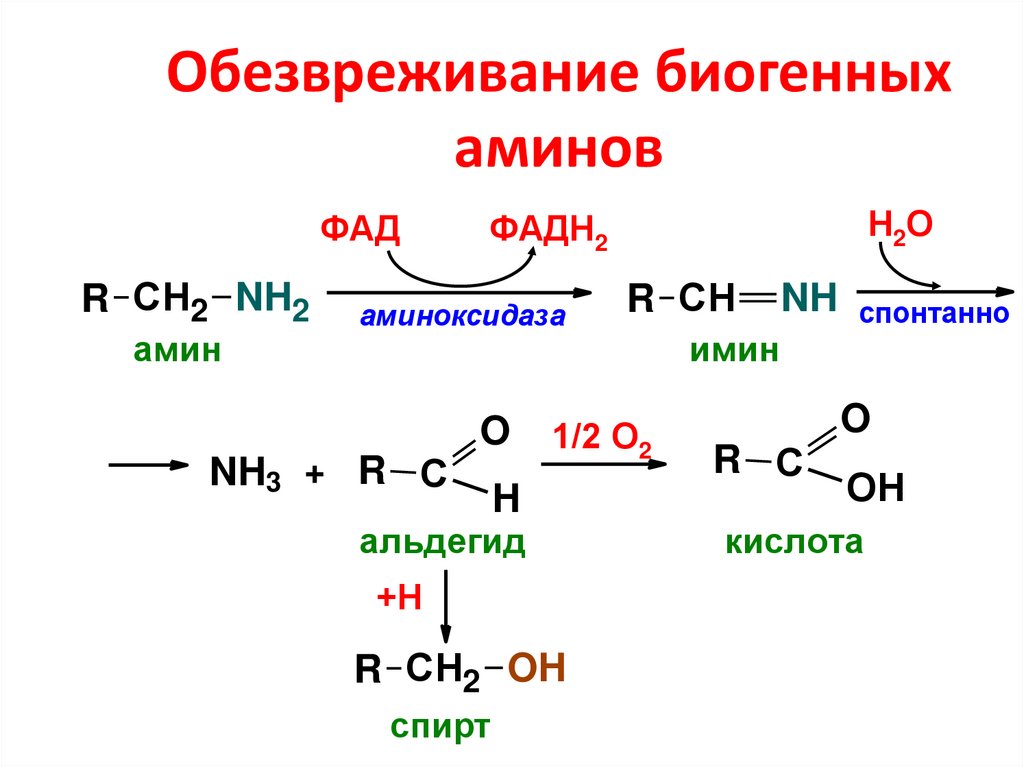
35. Обезвреживание биогенных аминов
ФАДR СН2 NH2
амин
аминоксидаза
NH3 + R С
Н2О
ФАДН2
O
1/2 О2
H
альдегид
+Н
R СН2 OH
спирт
R СН
NH
имин
спонтанно
O
R С
ОН
кислота
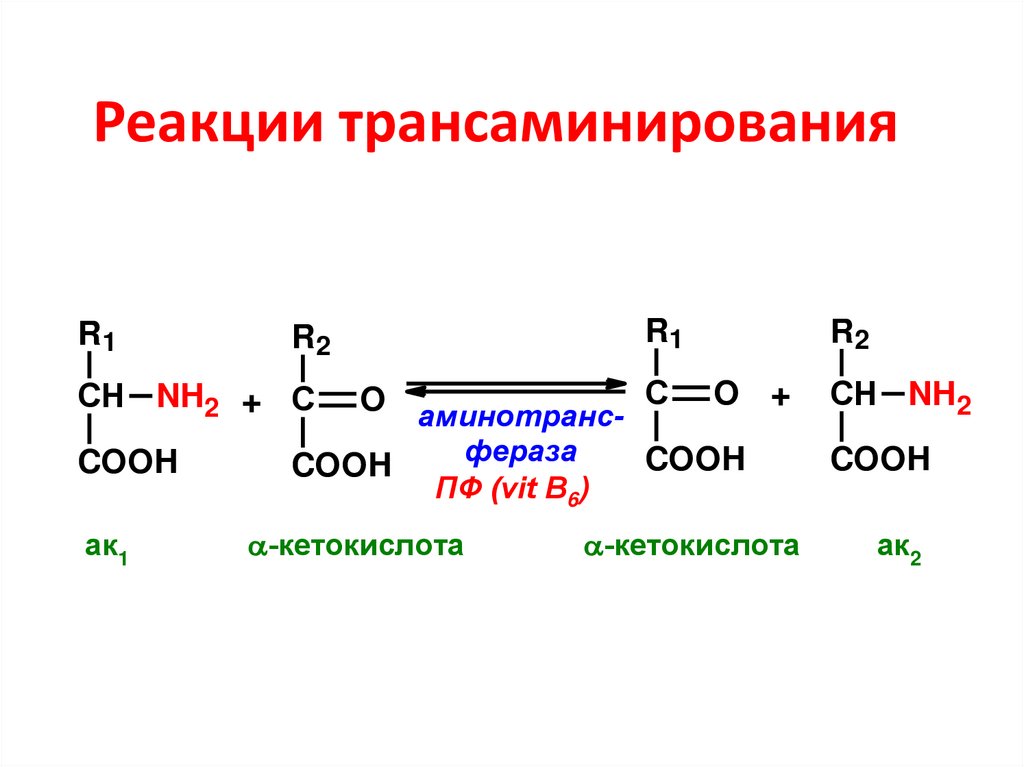
36. Реакции трансаминирования
R1R1
R2
O аминотранс- С O +
фераза
COOH
COOH
R2
СН NH2 + С
СН NH2
COOH
COOH
ак1
ПФ (vit B6)
-кетокислота
-кетокислота
ак2
37. Вещества, участвующие в трансаминировании:
• Аминокислоты – практически все, крометреонина, лизина и пролина, но особенно
активны глу, асп, ала;
• Кетокислоты – только три – ПВК, ЩУК и α-КГ
• ПФ – активная форма витамина В6
Ферменты – трансаминазы, или
аминотрансферазы, специфичны к
донорно-акцепторной паре
38. Роль пиридоксальфосфата в трансаминировании – является промежуточным переносчиком аминогруппы (первичным акцептором)
39. Биологическая роль трансаминирования
• Путь синтеза заменимых аминокислот• Путь перераспределения азота без
образования токсичного аммиака
• Путь пополнения энергетического
материала (образование субстратов
окислительного декарбоксилирования
ПВК и ЦТК)
40. Реакции трансаминирования
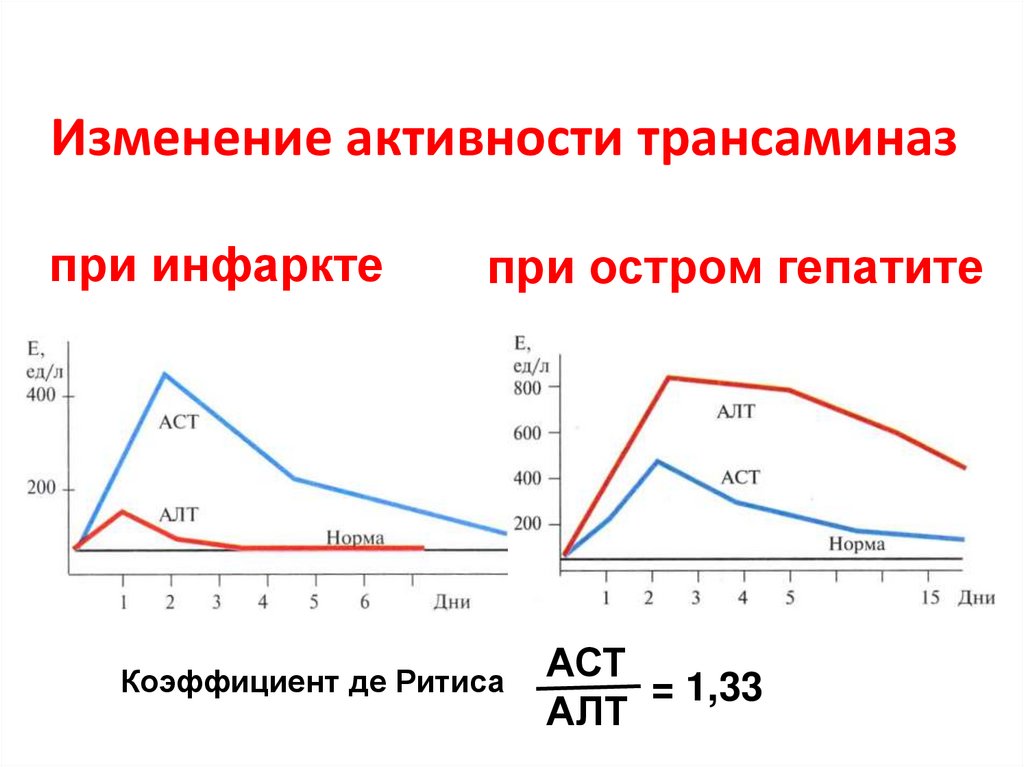
41. Изменение активности трансаминаз
при инфарктепри остром гепатите
Коэффициент де Ритиса
АСТ
= 1,33
АЛТ
42. Типы реакций дезаминирования
Дезаминирование – отщеплениеаминогруппы в виде молекулы аммиака
Восстановительное
Гидролитическое
Внутримолекулярное
Окислительное
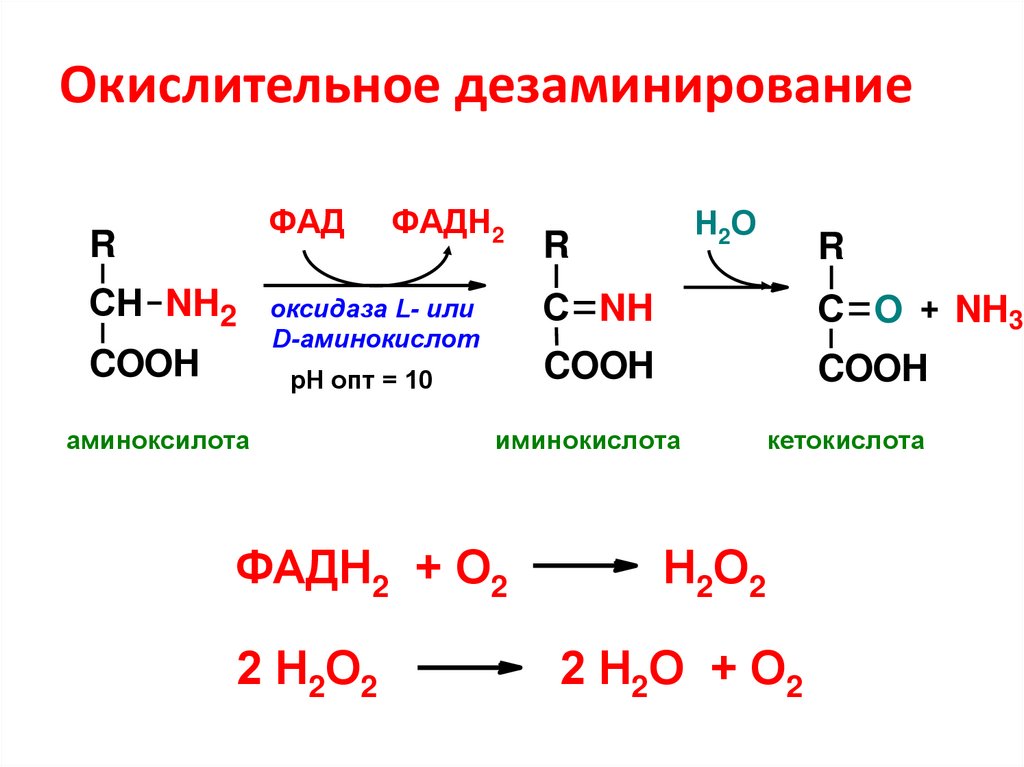
43. Окислительное дезаминирование
ФАДR
СН NH2
COOH
ФАДН2
оксидаза L- или
D-аминокислот
рН опт = 10
аминоксилота
R
R
С NH
С O + NH3
COOH
COOH
иминокислота
ФАДН2 + О2
2 Н2О2
Н2О
кетокислота
Н2О2
2 Н2О + О2
44. Окислительное дезаминирование глутамата
COOHCH2
CH2
СН NH2
COOH
глутамат
+
НАД
НАДН + Н
глутаматдегидрогеназа
рН опт ≈ 7
+
COOH
COOH
Н2О
CH2
CH2
С
NH
Н2О
COOH
-иминоглутарат
НАДН+Н+ ----→ 3 АТФ
CH2
+ NH3
CH2
С
O
COOH
-кетоглутарат
45. Отличия и роль процесса дезаминирования глутамата
• Глутаматдегидрогеназа активна прифизиологических значениях рН;
• Глутаматдегидрогеназа обладает обратимостью
действия (обратный процесс –
восстановительное аминирование – путь
обезвреживания аммиака);
• Глутаматдегидрогеназа в качестве кофермента
содержит НАД (а не ФАД);
• Восстановленный НАД – источник 3 молекул
АТФ в дыхательной цепи.
46. Непрямое дезаминирование (трансдезаминирование) аминокислот
1. трансаминированиеАК + α-КГ
трансаминаза
глутамат + α-кетокислота
2. дезаминирование глутамата
глутамат
АК
ГДГ
α-КГ + NH3
α-кетокислота
+ NH3





























 Биология
Биология








