Похожие презентации:
Антибиотикотерапия в реанимации и интенсивной терапии
1. АО «Медицинский Университет Астаны»
ТЕМА: Антибиотикотерапия в реанимации иинтенсивной терапии
Выполнила: Сейткасым Шолпан 6/110 гр ВБ
Проверил: Сыздыкбаев М.К
2.
Антибактериальная терапия пациентов, находящихся в отделенияхреанимации и интенсивной терапии (ОРИТ), представляет сложную
проблему.
Это связано с тем, что от адекватности выбора антибиотиков при
инфекциях в ОРИТ нередко зависит жизнь пациента. Убедительно
показано, что неверный выбор антибактериального препарата ухудшает
исход болезни и является наиболее значимым
независимым фактором риска летального исхода у этих пациентов [1].
Однако у пациентов в ОРИТ адекватность выбора антибиотиков
определяется не только
in vitro чувствительностью к ним микроорганизма,
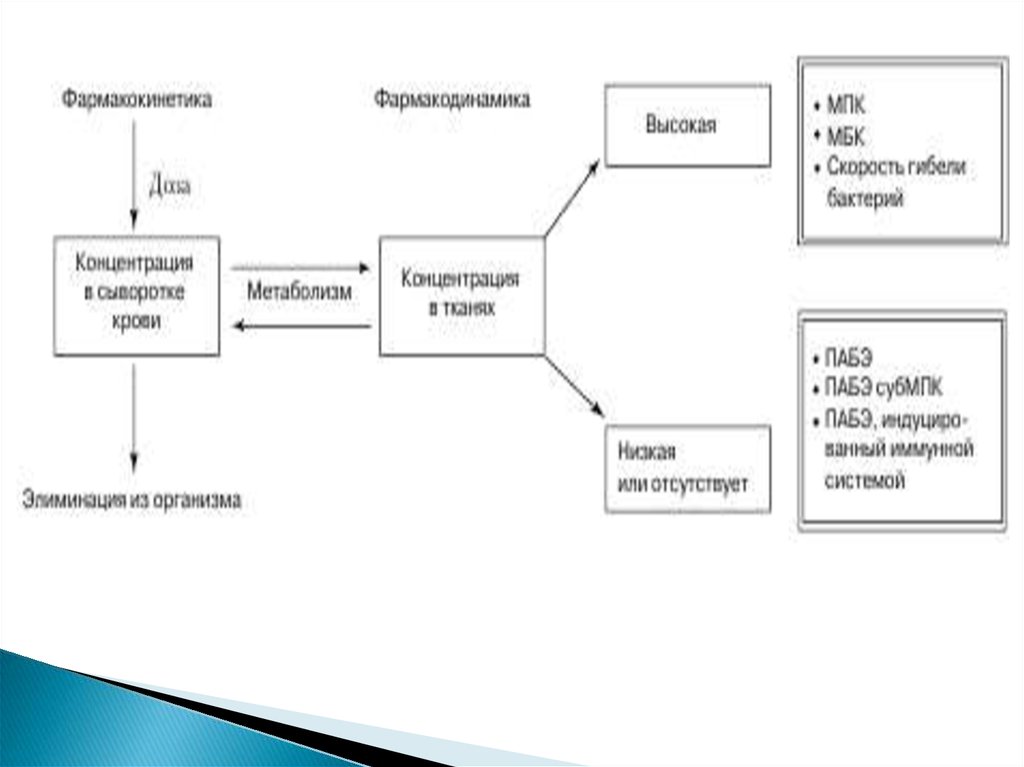
вызвавшего инфекцию, но и во многом зависит от соотношения
фармакокинетических (ФК) и фармакодинамических (ФД) параметров
(рис. 1).
Фармакокинетика антимикробных препаратов,
как и любых других лекарственных средств, складывается из таких
процессов, как абсорбция, метаболизм, распределение в биологических
жидкостях и тканях, выведение из организма. ФД параметры
отражают зависимость между концентрацией антибиотика в плазме или
тканях и его антимикробным эффектом.
Активность антибиотика определяется такими показателями, как
минимальная подавляющая концентрация (МПК), минимальная
бактерицидная
3.
концентрация (МБК), а также скорость бактерицидного эффекта.Антибиотики, достигающие высокой концентрации в тканях и
сыворотке крови, обычно дают высокую эффективность. Однако даже
при относительно
невысокой концентрации некоторые классы антимикробных
препаратов проявляют антимикробное действие, обеспечивающее
достаточную эффективность. Это, в частности, связано с такими
феноменами, как постантибиотический эффект (ПАБЭ),
ПАБЭ субингибирующей концентрации препарата, а также ПАБЭ,
потенциированный (индуцированный) иммунной системой.
Согласно современным представлениям, все антибиотики можно
разделить на две основные группы:
1) концентрационноозависимые;
2) времязависимые [2].
К первой группе, например, относятся аминогликозиды и
фторхинолоны.
Вторая группа включаетпочти все β лактамные антибиотики,
активность которых лишь до определенного уровня
зависитотконцентрации, достигаемой в сыворотке крови.
Эффективность препаратов второй группы
определяется главным образом временем, в течение
которого концентрация антибиотика превышает его МПК для
определенного возбудителя. В то же
4.
время для препаратов первой группы бактерицидный эффектпрямопропорционален их концентрации, что нехарактерно для
времязависимых антибиотиков.
В последние годы широко проводятся исследования, в которых на
моделях инфекции in vitro и in vivo изучаются различные режимы
дозирования
антибиотиков.
Их цель – установить, какие соотношения ФК и ФД показателей могут
оказаться полезными для прогнозирования антимикробной активности
различных классов препаратов.
В экспериментах на in vitro моделях инфекции установлено, что
соотношение время больше (выше) МПК (время > МПК) является
основным параметром, определяющим эффективность времязависимых
антибиотиков, таких, как β лактамы, гликопептиды и эритромицин.
В то же время такие ФК/ФД соотношения, как Сmax/МПК, площадь под
фармакокинетической кривой/МПК (ПФК/МПК), представляют наиболее
важные параметры, позволяющие определить эффективность
концентрационноозависимых препаратов, к которым, в частности,
относятся хинупристин/дальфопристин, новые препараты из
группы кетолидов, полусинтетические макролиды,(кларитромицин,
азитромицин).
5.
Более того, в нескольких клиническихисследованиях продемонстрировано, что
ФК/ФД параметры являются важными
прогностическими показателями
(предикторами) исхода болезни – достижения
эрадикации возбудителя или клинического
выздоровления [2].
Не менее важно, что ФК/ФД параметры
позволяют прогнозировать селекцию
резистентности
бактерий и находить пути к ее
предотвращению.
Последнее, в свою очередь, является одним из
6.
основных факторов, требующих внимания кпациентам, находящихся в ОРИТ.
В настоящее время нет идеального препарата
для лечения тяжелых инфекций у пациентов,
находящихся в ОРИТ. Среди антибиотиков, которые
могут быть использованы в качестве первой линии
антимикробной терапии у этой категории
пациентов, предпочтение следует отдавать β
лактамам:
карбапенемам, цефалоспоринам III и IV поколений,
комбинациям уреидопенициллинов с
ингибиторами β лактамаз. Для достижения
максимальной
эффективности и/или расширения спектра действия
их можно сочетать с аминогликозидами,
гликопептидами или фторхинолонами.
7.
Концентрационноозависимые препаратыДля выбора препаратов, обладающих максимальной
эффективностью, важно учитывать их ФК/ФД профили.
Одним из первых исследований, продемонстрировавших
влияние ФК/ФД параметров антибиотиков на их клиническую
эффективность, стала опубликованная в 1987 г. оценка связи
между значением
отношения Сmax/ МПК и частотой клинической эффективности
терапии у 236 пациентов (с инфекцией,
вызванной грамотрицательными микроорганизмами),
лечившихся различными аминогликозидами
(гентамицином, тобрамицином, амикацином) [3].
Согласно полученным результатам, наибольшие
возможности для получения удовлетворительного
клинического ответа на терапию создаются при достижении
соотношения Сmax/ МПК более 8 для любого из
перечисленных аминогликозидов. Поэтому
для достижения максимального соотношения
Cmax/МПК аминогликозиды лучше назначать один
раз в сутки.
8.
9.
В другом клиническом исследованииоценивалась зависимость между ПФК24/МПК
(ПФКИ –
площадь под фармакокинетической кривой
ингибирования) ципрофлоксацина и частотой
эрадикации
возбудителя у 74 пациентов с инфекциями
дыхательных путей в ОРИТ. Наиболее высокая
частота
эрадикации возбудителя наблюдалась в том
случае, если при лечении ципрофлоксацином
удавалось достичь значения ПФК24/ МПК
более 125. В противном случае вероятность
микробиологического
выздоровления составляла не более 30% [4].
10.
Времязависимые препаратыВ отношении времязависимых препаратов, к которым относятся
β掀лактамы, остается нерешенным
вопрос о том, какой режим дозирования позволяет
достичь максимальной эффективности: введение
равных доз через короткие интервалы или постоянная инфузия.
В целом это зависитотособенностей выбранного для лечения
препарата.
Так, например, в нашем предыдущем исследовании наиболее
эффективным режимом терапии цефтазидимом 8 пациентов с
инфекцией в ОРИТ, позволявшим достичь максимально высоких
значений время > МПК, явилось введение в начале лечения
нагрузочной дозы (1 г) с последующей длительной
внутривенной инфузией 3 г препарата (общая суточная доза–
4г) и длительной внутривенной инфузией 4 г препарата в
последующие дни. Такой
способ введения обеспечиваетсохраняющиеся на
протяжении всего курса терапии оптимальную концентрацию
цефтазидима в сыворотке крови и высокое значение ПФК
данного антибиотика.
11.
Так, например, соотношение ПФК24/ МПКцефтазидима для P. aeruginosa в 11й день
терапии, когда используется нагрузочная доза,
составляет
112,8 мг/(л Ч ч). В то же время значение этого
параметра снижается на 22й и 33й дни терапии,
в связи с чем при лечении инфекций, вызванных
этим возбудителем, целесообразно назначать
цефтазидим в комбинации с аминогликозидом.
По нашим данным, лучшим аминогликозидом
для этой цели является амикацин. Цефтазидим
также можно сочетать с фторхинолонами –
ципрофлоксацином и левофлоксацином.
12.
КарбапенемыКак правило, карбапенемы, к которым относятся имипенем и
меропенем, описываются как времяя
зависимые препараты. Однако при сравнении
параметров, определяющих бактерицидную активность в
отношении P. aeruginosa, обнаруживается
выраженная зависимость эффекта от концентрации
[5]. Для карбапенемов, как и для тикарциллина, характерно
усиление антимикробной активности по мере увеличения
концентрации препарата in vitro.
Оба препарата из группы карбапенемов обладают
достаточно высоким ПАБЭ в отношении некоторых
наиболее распространенных грамотрицательных
возбудителей инфекций в ОРИТ: Escherichia coli,
Pseudomonas aeruginosa, Staphylococcus aureus [6–10].
В целом как для имипенема, так и для меропенема важным
ФК/ФД соотношением, позволяющим
оценить антимикробную активность по меньшей
мере на животных моделях, является процент времени от
длительности интервала дозирования, в
течение которого концентрация препарата превышает его МПК
для конкретного возбудителя
13.
Так, в экспериментах на модели инфекции мягкихтканей у мышей максимальная бактерицидная
активность имипенема достигалась в том случае,
если время выше МПК составляло не менее 30–40%
от длительности интервала дозирования [11].
ФК характеристики обоих карбапенемов обычно
описываются как очень сходные. Как видно из
данных табл. 1, период полувыведения и мипенема
и меропенема составляет около 1 ч. Оба препарата
имеют достаточно большой объем распределения и
очень сходную долю почечной экскреции.
Тем не менее недавно были опубликованы
результаты как минимум 3 сравнительных
исследований на здоровых добровольцах, в
которых
14.
15.
16.
продемонстрированы некоторые преимуществаимипенема по сравнению с меропенемом [12–
14]. Например, при использовании имипенема
достигалась более высокая концентрация
препарата в сыворотке крови. Более того,
значение ПФК имипенема составило 94–96 мг/(л
Ч ч), тогда как ПФК меропенема оказалась
равной 70–77 мг/(л Ч ч). Для меропенема
оказались более высокими плазменный и
почечный клиренсы (табл. 1).
Так, в одном из этих исследований, в котором
участвовали 12 здоровых добровольцев, у
имипенема выявлены более высокие, чем у
меропенема,
показатели ПФК: 96,1±14,4 мг/(л Ч ч) против
70,5±10,3 мг/(л Ч ч) [13].
17.
В связи с выявленными различиями ФК/ФДпрофилей имипенема и меропенема нами
проведено сравнительное клиническое
исследование различий ФК параметров обоих
карбапенемов. В его
ходе оценивалась концентрация, развивавшаяся
в
сыворотке крови и моче после однократного
введения в виде 200минутной внутривенной
инфузии 1 г каждого антибиотика.
В исследование были включены 19
госпитализированных в ОРИТ пациентов старше
18 лет.
Первая группа (n=9) получала имипенем,
вторая (n=10) – меропенем. Все пациенты были
сгруппированы по полу, возрасту и характеру
18.
19.
патологии и оценены по шкалам SAPS II и SOFA.По возрасту, массе тела, уровням в крови креатинина и
общего белка, оценкам по шкалам SAPS II
и SOFA больные обеих групп существенно не отличались.
Образцы мочи и венозной крови собирали в течение
первых 8 ч после введения антибиотика. Сразу после
получения пробы крови ее центрифугировали, сыворотку
замораживали в жидком азоте и
хранили при температуре минус 80°С до проведения
исследования.
Концентрацию антибиотиков в сыворотке крови
и моче исследовали трехкратно микробиологическим
методом путем разведения в агаре. Для определения
активности имипенема использовали агар
BHI (Difco) и штамм Bacillus subtilis ATCC 6633,
меропенема – Nutrient Agar (Difco) и штамм
Escherichia coli NHIJ
20.
ФК параметры рассчитывали с использованиемкомпьютерной программы Syphar 4.0 (SIMED).
Для статистического анализа применяли метод
наименьшей квадратической регрессии и открытую
двухстороннюю математическую модель.
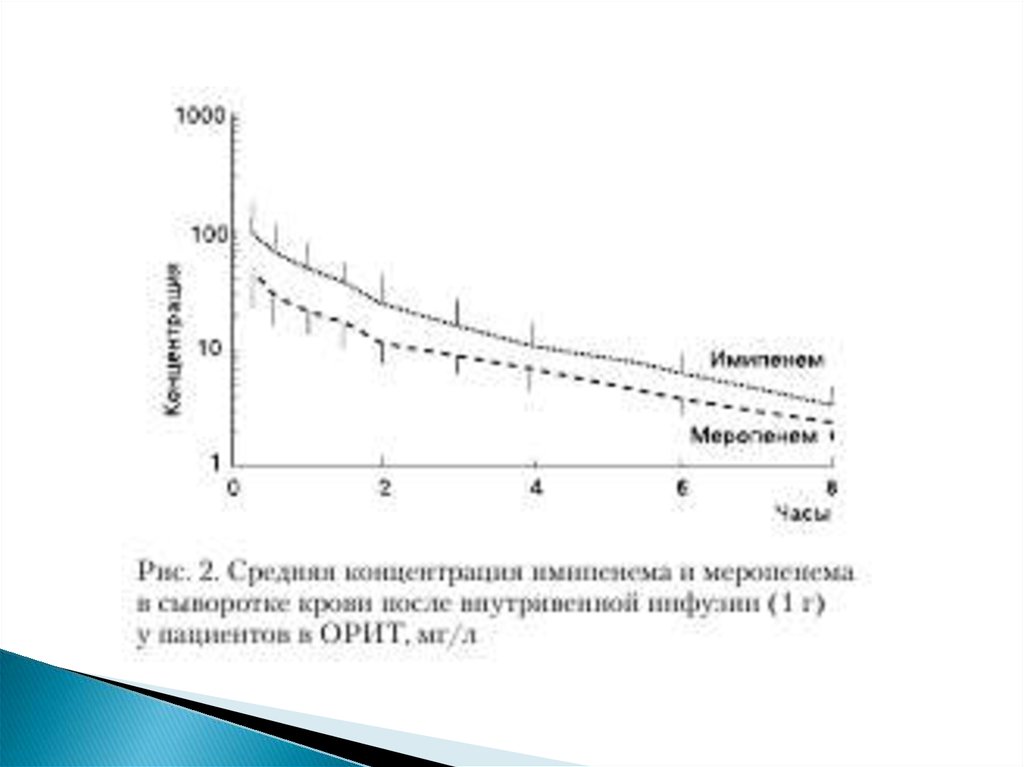
По полученным данным, средняя концентрация
имипенема, развивавшаяся в сыворотке крови после
внутривенной инфузии 1 г препарата, значительно
превышала таковую у меропенема (рис. 2).
Выявлены статистически значимые различия
между основными ФК параметрами обоих антибиотиков,
такими, как максимальная концентрация препарата в
сыворотке крови (Сmax) и ПФК. При этом
имипенем, как видно из данных табл. 2, имел более
высокий, чем у меропенема, ФК/ФД профиль: Сmax
составила 95,8±50,5 для имипенема и 46,6±14,7 – для
меропенема (p<0,01), ПФК0→∞ – 226,4±85,3 и
99,5±23,9 мг/(лЧч) для имипенема и меропенема соо
ответственно (p<0,01). Периоды полувыведения
(Т1/2) обоих антибиотиков оказались сходными
21.
В другом исследовании, проведенном M.Palazzo
и соавт. (служба реанимации и интенсивной
терапии, госпиталь «Чэринг Кросс», Лондон,
Великобритания; неопубликованные
данные), оценивалась
концентрация меропенема, развивавшаяся в
сыворотке крови после внутривенного
введения у
22.
23.
24.
пациентов, госпитализированных в ОРИТ.Использовались 2 различных режима терапии:
1) болюсное введение препарата в дозе1г3раза
в сутки (n = 6);
2) введение нагрузочной дозы (1 г) с
последующей постоянной инфузией 3 г
препарата в течение
24ч(n = 8).
Необходимо отметить, что сывороточная
концентрация меропенема, достигавшаяся у
пациентов в обеих группах, оказались
значительно ниже, чем у
имипенема, зарегистрированная в описанном
исследовании. При этом ФК преимущества
имипенема наблюдались при его сравнении как
с первым,
так и со вторым режимом введения меропенема.
25.
Одно из наиболее вероятных объясненийразличий ФК профилей карбапенемов в
сыворотке крови
– неодинаковая степень их проникновения в
ткани и жидкости организма. Однако,
согласно результатам нескольких
исследований, имипенем и меропенем
обладаюточень сходной степенью
проникновения в ткани [15]. Другими
возможными причинами различий ФК
профилей карбапенемов могут быть разные
величины таких показателей, как общий и
почечный
26.
клиренсы препаратов, объем распределения и,вероятно, особенности тканевого метаболизма
каждого.
Важные различия в характеристиках имипенема и
меропенема могут быть выявлены при сравнении
концентраций, развивающихся в сыворотке крови
при внутривенном введении каждого препарата, с
теоретическими МПК90 для различных
возбудителей, являющихся наиболее частыми
причинами инфекций у пациентов в ОРИТ.
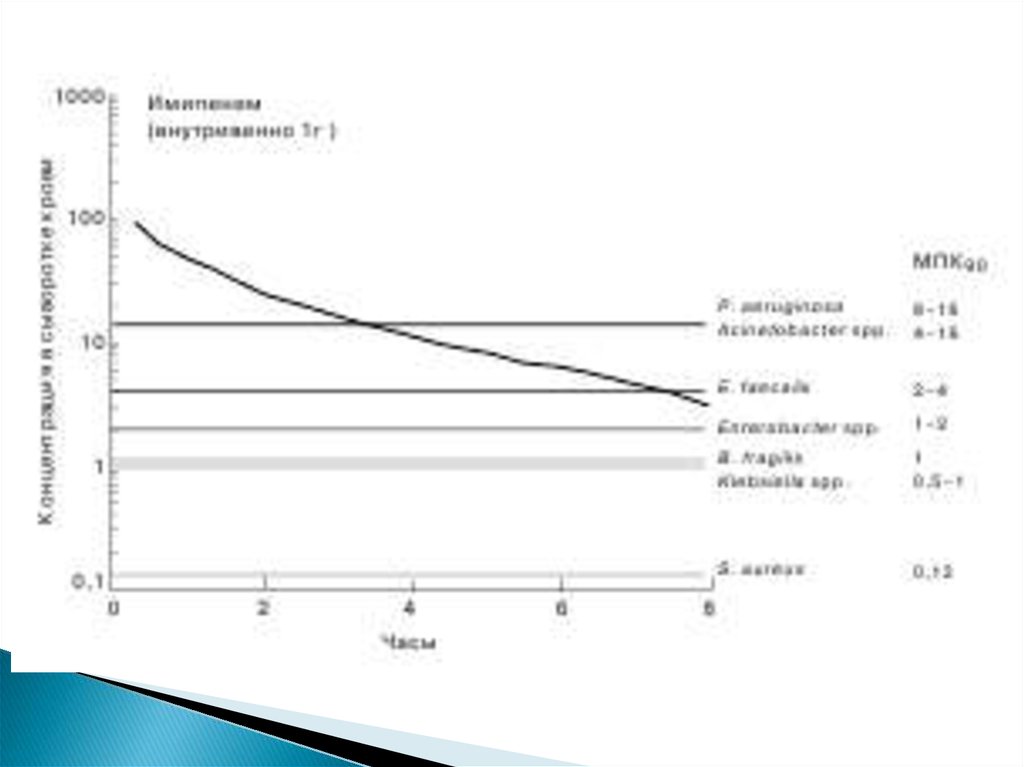
Так, по данным нашего исследования, при
внутривенном введении 1 г
имипенема в сыворотке крови достигается
концентрация, превышающая
8 мг/л и являющаяся бактерицидной в отношении
большинства возбудителей, имеющих МПК90 ниже
этого
значения (рис. 3)
27.
К таким патогенам относятсяS. aureus, Klebsiella spp., Bacteroides fragilis,
Enterobacter spp., Enterococcus faecalis, некоторые
штаммы Acinetoo bacter spp. и P. aeruginosa.
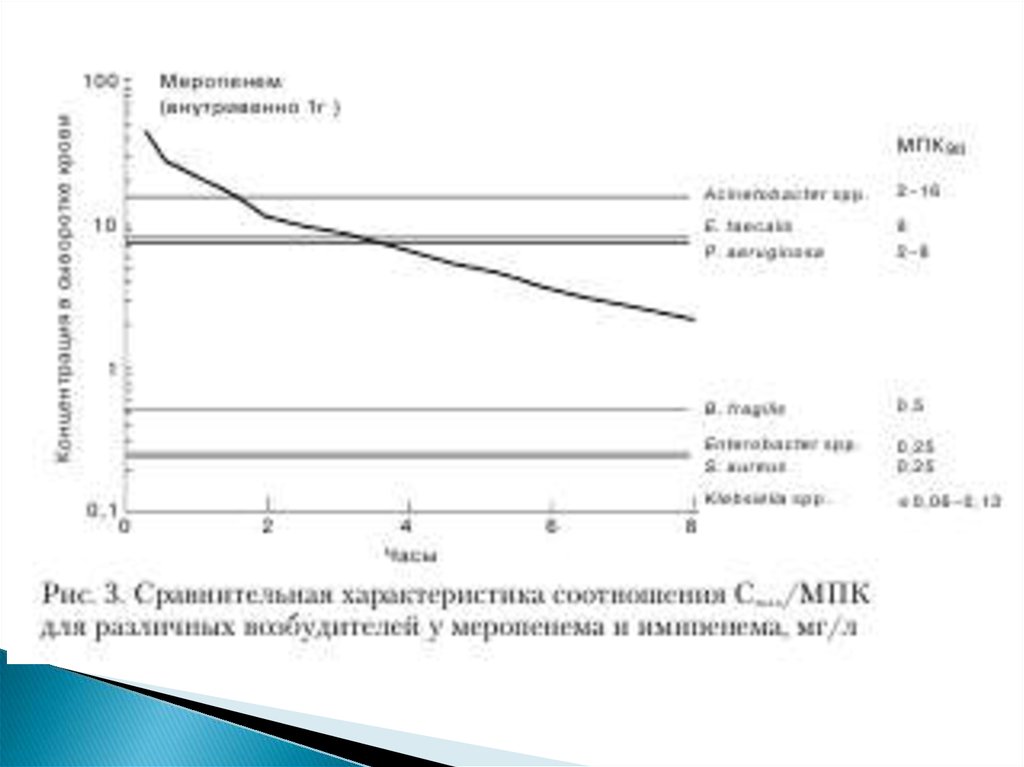
В противоположность имипенему сывороточная
концентрация, развивающаяся при использовании
меропенема, эффективна только в
отношении возбудителей, имеющих
МПК данного препарата не более 4 мг/л (рис. 3).
Этим объясняется более низкая активность
меропенема в отношении большинства штаммов P.
Aerugii nosa, E. faecalis и Acinetobacter spp.
Для того чтобы судить о преимуществах какого
либо карбапенема, необходимо сравнить их
клиническую эффективность
28.
Так, например, суммарные результатынескольких рандомизированных открытых
сравнительных клинических исследований
эффективности имипенема и меропенема,
использовавшихся в
качестве эмпирической терапии пациентов с
тяжелы ми инфекциями (n = 561),
продемонстрировали сходную частоту
эрадикации возбудителя, составившую
67–94% для меропенема и 60–88% – для
имипенема.
Не выявлено и существенных различий в частоте
удовлетворительных клинических ответов на
терапию, составившей 76–88 и 68–85% для
меропенема и имипенема соответственно [16–
18]
29.
Исходя из современных представлений офармакокинетике и фармакодинамике
антибиотиков,
можно сделать следующие выводы, касающиеся
применения отдельных препаратов у пациентов
с
инфекцией в ОРИТ:
1) для достижения максимального значения
Сmax/ МПК аминогликозиды должны
назначаться1 раз в сутки;
2) для поддержания стабильной сывороточной
концентрации β쯐лактамных антибиотиков,
превышающих МПК для отдельных
возбудителей, их
30.
следует вводить через короткие интервалывремени или постоянно внутривенно;
3) на основании приведенных ФК
характеристик карбапенемов наиболее
эффективные значения
время > МПК (≥50%) достигаются при
использовании имипенема в дозе1г 3раза в
сутки в отношении возбудителей, имеющих
МПК ≤8мг/л,меропенема в отношении
возбудителей, имеющих МПК
≤4 мг/л; только при лечении тяжелых
инфекций,
вызванных P. aeruginosa и Acinetobacter spp.
наиболее предпочтительными могут оказаться
сокращение интервала дозирования и
увеличение дозы вводимого препарата до 1 г
каждые 6 ч;
31.
4) особенности ФК/ФД профилей позволяютобъяснить сходную клиническую
эффективность
обоих карбапенемов, несмотря на различия
между
ними в in vitro активности в отношении
грамполоо
жительных и грамотрицательных бактерий.



























 Медицина
Медицина








