Похожие презентации:
Дослідження процесів біотрансформаціі ксенобіотиків та єндогенних токсинів
1.
2.
1.Ксенобіотики2.Метаболізм ксенобіотиків ( 2 фази )
3.Вітаміни, на які діють ксенобіотики
4.Рекакції знешкодження токсичних речовин
5.Мікросомальне окислення
6.Цитохром 450
3.
Ксенобіо́тики — чужорідні для біосфери хімічні речовини, щоприродно не синтезуються, не можуть асимілюватись
організмами внаслідок чого не беруть участі
у кругообігуречовин у природі, а тому накопичуються у
зовнішньому середовищі (наприклад пластмаси). У вужчому
значенні так називають речовини, що зазвичай присутні у
природі у набагато менших кількостях, і, як правило, прямо
або побічно породжені господарською діяльністю людини.
4.
Чужорідні сполуки, потрапляючи в організм різними шляхами,підлягають ряду хімічних і біохімічних перетворень і
виділяються у вигляді метаболітів.
Біотрансформація являє собою біохімічний процес, в ході
якого речовини зазнають змін під дією різних ферментів
організму. Це явище називають також метаболізмом або
детоксикацією. Його біологічний сенс - перетворення хімічної
речовини в форму, зручну для виведення з організму.
Метаболізм, або обмін речовин, в загальному випадку являє
собою сукупність процесів перетворення певних речовин
всередині клітин з моменту їх надходження до утворення
кінцевих продуктів. У процесі метаболізму утворюються
метаболіти - продукти проміжного і кінцевого обміну речовин.
5.
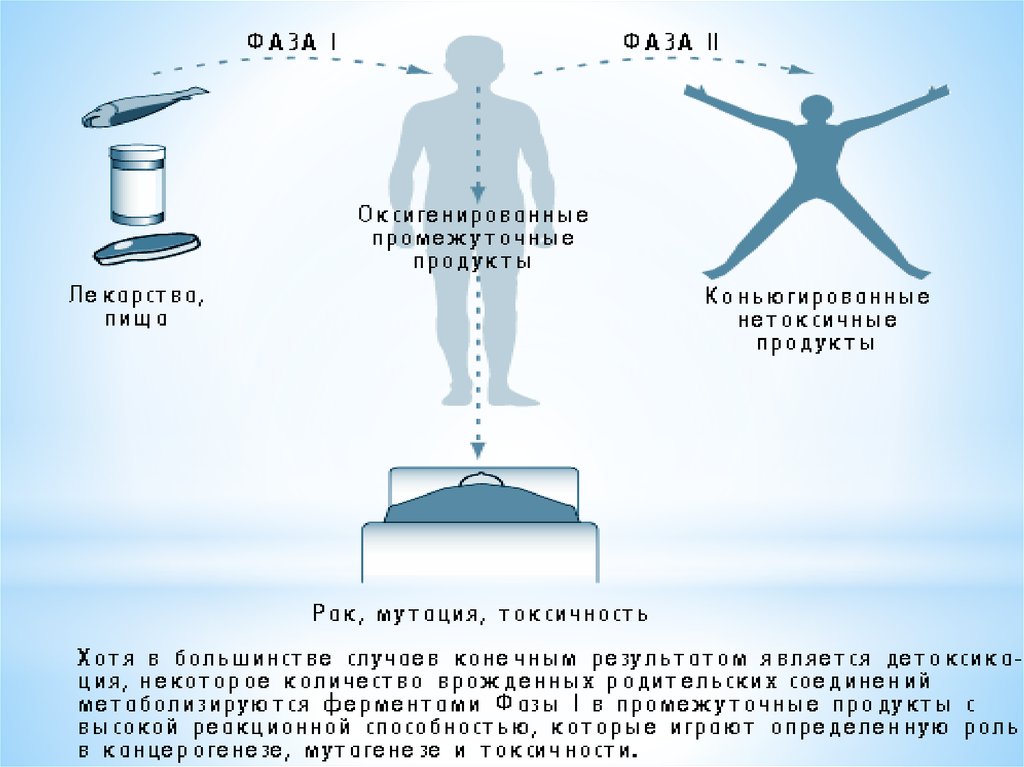
Метаболізм ксенобіотиків проходить у дві фази:I фаза II фаза
ксенобіотик → проміжний продукт → кон'югат.
В ході першої фази - окислювально-відновного або гідролітичного
перетворення - молекула речовини збагачується полярними
функціональними групами (гідроксильними, аміно-, нітрогрупами
і т.д.), що робить її реакційно здатною і краще розчинною у воді.
У другій фазі проходять синтетичні процеси кон'югації проміжних
продуктів метаболізму з ендогенними молекулами, в результаті
чого утворюються полярні сполуки, які і виводяться з організму.
Наслідком метаболізму ксенобіотика можуть стати:
- Ослаблення токсичності;
- Посилення токсичності;
- Зміна характеру токсичної дії;
- Ініціація токсичного процесу.
6.
7.
8.
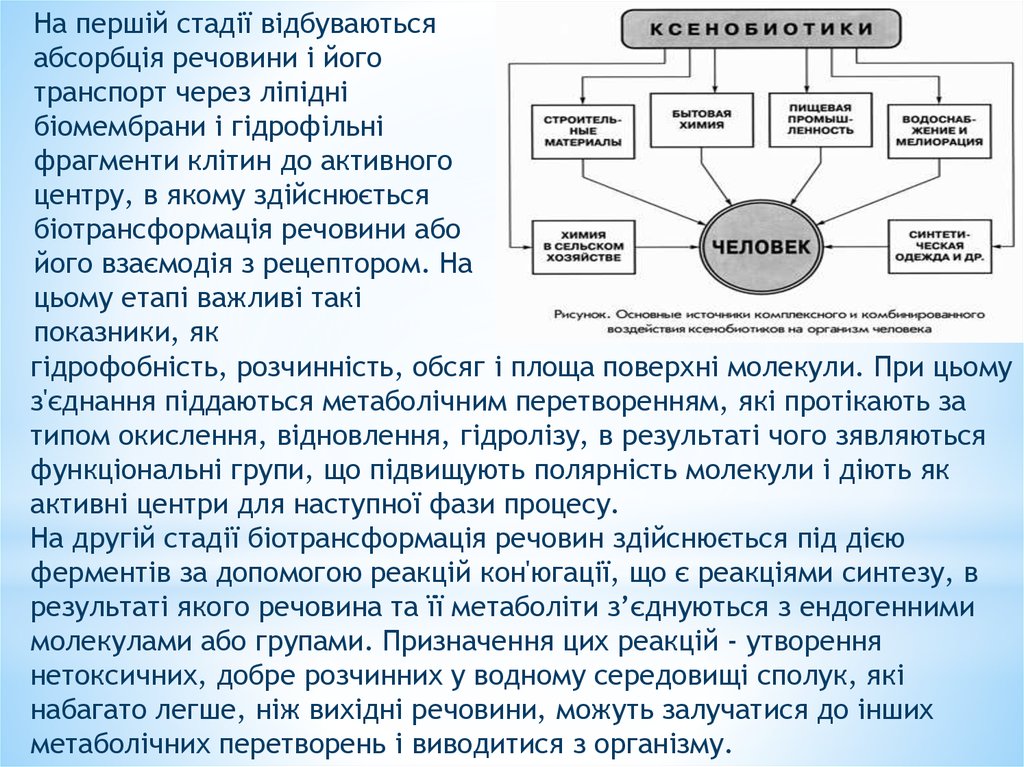
На першій стадії відбуваютьсяабсорбція речовини і його
транспорт через ліпідні
біомембрани і гідрофільні
фрагменти клітин до активного
центру, в якому здійснюється
біотрансформація речовини або
його взаємодія з рецептором. На
цьому етапі важливі такі
показники, як
гідрофобність, розчинність, обсяг і площа поверхні молекули. При цьому
з'єднання піддаються метаболічним перетворенням, які протікають за
типом окислення, відновлення, гідролізу, в результаті чого зявляються
функціональні групи, що підвищують полярність молекули і діють як
активні центри для наступної фази процесу.
На другій стадії біотрансформація речовин здійснюється під дією
ферментів за допомогою реакцій кон'югації, що є реакціями синтезу, в
результаті якого речовина та її метаболіти з’єднуються з ендогенними
молекулами або групами. Призначення цих реакцій - утворення
нетоксичних, добре розчинних у водному середовищі сполук, які
набагато легше, ніж вихідні речовини, можуть залучатися до інших
метаболічних перетворень і виводитися з організму.
9.
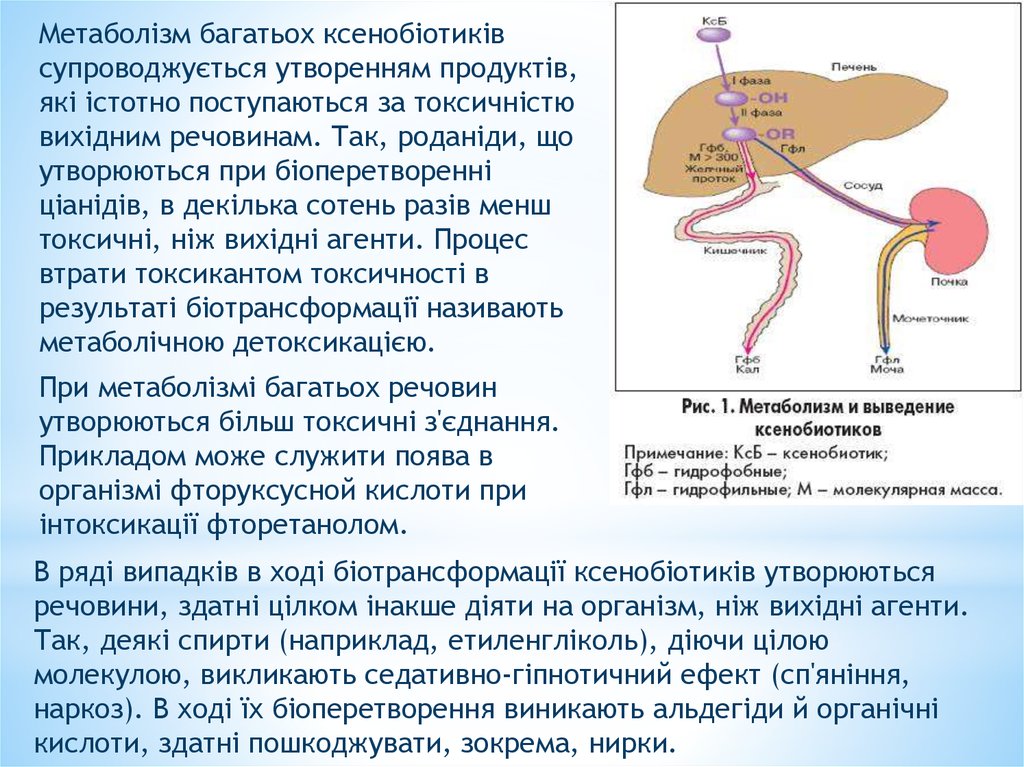
Метаболізм багатьох ксенобіотиківсупроводжується утворенням продуктів,
які істотно поступаються за токсичністю
вихідним речовинам. Так, роданіди, що
утворюються при біоперетворенні
ціанідів, в декілька сотень разів менш
токсичні, ніж вихідні агенти. Процес
втрати токсикантом токсичності в
результаті біотрансформації називають
метаболічною детоксикацією.
При метаболізмі багатьох речовин
утворюються більш токсичні з'єднання.
Прикладом може служити поява в
організмі фторуксусной кислоти при
інтоксикації фторетанолом.
В ряді випадків в ході біотрансформації ксенобіотиків утворюються
речовини, здатні цілком інакше діяти на організм, ніж вихідні агенти.
Так, деякі спирти (наприклад, етиленгліколь), діючи цілою
молекулою, викликають седативно-гіпнотичний ефект (сп'яніння,
наркоз). В ході їх біоперетворення виникають альдегіди й органічні
кислоти, здатні пошкоджувати, зокрема, нирки.
10.
11.
Реакції знешкодження токсичних та інактивації біологічно активнихречовин перебігають, головним чином, у печінці. Продукти реакцій
виділяються у жовч і виводяться через кишечник або в кров і
виводяться з сечею. Як правило, відносно малі молекули виділяються
у сечу, а більші (типу білірубіну) – у жовч. Процес знешкодження
токсичних речовин поділяють на дві фази. У першій фазі біологічної
трансформації ксенобіотики піддаються реакціям окиснення,
відновлення, гідролізу й іншим, в результаті чого у молекулах
з'являються полярні функціональні групи (-ОН, -СООН, -SН, -С=О, NН2). У другій фазі до функціональної групи ксенобіотика
приєднуються глюкуронова чи сірчана кислоти, амінокислоти,
метильна чи ацетильна групи, трипептид глутатіон. Це так звані
реакції кон'югації, вони каталізуються специфічними ферментами.
Утворені кон'югати добре розчинні у воді і легко виводяться з
організму. Для більшості токсичних сполук процес знешкодження
включає реакції обох фаз, але у деяких випадках тільки одну фазу –
першу чи другу (табл. 10).
12.
13.
Реакції першої фази трансформації сторонніх речовинкаталізують в основному ферменти ендоплазматичного
ретикулуму печінки (ферменти мікросомального окиснення і
відновлення) (рис. 32). Мікросомальна окиснювальна система,
яка включає цитохром Р450 і флавіновий фермент НАДФНцитохром Р-450-редуктазу, каталізує реакцію гідроксилювання
субстратів за рівнянням:
В ендоплазматичному ретикулумі печінки містяться флавінові
ферменти, які відновлюють сторонні речовини – нітро- і
азосполуки до аміносполук. Донором воднів служить НАДФН
Другу фазу трансформації сторонніх і ендогенних біологічно
активних речовин складають реакції кон'югації.
14.
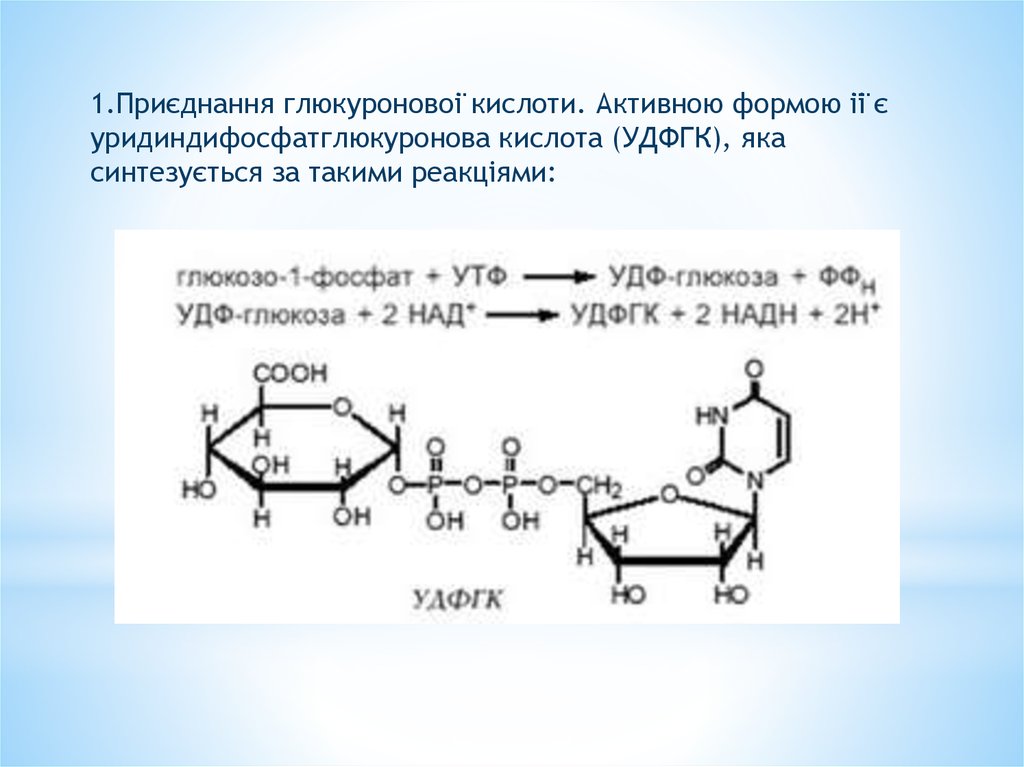
1.Приєднання глюкуронової кислоти. Активною формою її єуридиндифосфатглюкуронова кислота (УДФГК), яка
синтезується за такими реакціями:
15.
Ферменти УДФ-глюкуронілтрансферази, що знаходяться умікросомальній фракції, каталізують перенесення
глюкуронової кислоти на різні функціональні групи органічних
сполук з утворенням глюкуронідів. Такі кон'югати утворюють:
1) ендогенні субстрати: білірубін, стероїдні гормони,
тироксин; 2) продукти гниття білків у кишечнику: фенол,
крезол, індол і скатол (після їх окиснення до індоксилу і
скатоксилу); 3) сторонні сполуки
При спадковій відсутності чи зниженій активності
глюкуронілтрансферази має місце печінкова спадкова
жовтяниця (синдром Кріглера-Найяра). У печінці, крові, шкірі
накопичується некон'югований білірубін.
16.
2. Утворення складних ефірів сірчаної кислоти. Активноюформою сірчаної кислоти в організмі є 3'-фосфоаденозин-5'фосфосульфат (ФАФС). Цитозольні ферменти
сульфотрансферази каталізують перенос сульфату від ФАФС
до фенолів, спиртів та амінів. У людини сульфатній кон'югації
піддаються стероїдні гормони і продукти їх метаболізму,
продукти гниття білка в кишечнику (фенол, крезол, індоксил і
скатоксил), сторонні речовини. Більшість таких речовин
можуть утворювати кон'югати однаковою мірою з
глюкуроновою і сірчаною кислотами. Схема реакції сульфатної
кон'югації:
ROH+ФАФС
R–OSO3H+ФАФ
17.
3. Метилювання. Донором метильної групи служить Sаденозилметіонін. Йогобудова і участь у реакціях метилювання при біосинтезі
різних біологічно активних речовин розглянуті у розд. 8.6.
Декілька видів метилтрансфераз каталізують перенесення
метильної групи від S-аденозилметіоніну на такі
ксенобіотики, як аміни, фенол і тіолові сполуки, а також
на неорганічні сполуки сірки, селену, ртуті, арсену.
Шляхом метилювання інактивуються катехоламіни, амід
нікотинової кислоти (вітамін РР).
18.
4. Ацетилювання. Цим шляхом знешкоджуються сторонніароматичні аміни, ароматичні амінокислоти, сульфаніламідні
препарати. Реакція полягає у перенесенні ацетильної групи від
ацетил-КоА:
R–NH2+CH3–CO–SKoA R–NH–CO–CH3+KoASH Виявлено, що
для одних осіб характерна висока швидкість ацетилювання, а
для інших - низька
19.
5. Кон'югація з гліцином. Цей шлях знешкодження ароматичних ігетероциклічних карбонових кислот здійснюється у 2 стадії.
Спочатку утворюється коензим А – похідне сторонньої карбонової
кислоти, наприклад бензойної:
На другій стадії відбувається пептидна кон'югація з амінокислотою
гліцином:
Кон'югат бензойної кислоти і гліцину називається гіпуровою
кислотою і у невеликій кількості утворюється в організмі людини із
бензойної кислоти, яка є продуктом перетворення фенілаланіну
ферментами мікрофлори товстої кишки.
Для оцінки знешкоджувальної функції печінки застосовують пробу
на синтез гіпурової кислоти (пробу Квіка-Пителя). Вона полягає у
пероральному прийомі бензоату натрію і визначенні в сечі кількості
гіпурової кислоти.
20.
6. Глутатіонова кон'югація. Сторонні речовини, різні заструктурою, знешкоджуються шляхом кон'югації з трипептидом
глутатіоном. Цей процес включає ряд етапів. Спочатку
глутатіон-трансферази каталізують взаємодію субстрату (RХ) з
відновленим глутатіоном:
Від глутатіонового кон'югата відокремлюються послідовно
глутамінова кислота і гліцин. Утворені кон'югати ксенобіотиків з
цистеїном можуть виводитись з сечею або в реакції
ацетилювання перетворюватись у меркаптурові кислоти, які
також виводяться із сечею:
21.
ОКИСНЕННЯ МІКРОСОМАЛЬНЕ — напрямок оксигеназних реакцій, функцією якихє знешкодження ксенобіотиків та різних ендогенних сполук, у т.ч. токсичних.
22.
Знешкодження ксенобіотиків та інших токсичних речовин відбуваєтьсяу дві фази. До першої належать окисно-відновні, гідролітичні та інші
реакції (гідроксилювання, дезалкілування, сульфоокиснення, окиснювального дезамінування та ін.), внаслідок чого у складі ксенобіотиків
та ендогенних субстратів утворюються функціональні групи -ОН, СООН, -SH, -NH2. Це сприяє збільшенню полярності молекул,
які окиснюються. Спочатку деякі з них стають більш гідрофільними
і виводяться з сечею. Більш гідрофобні сполуки з мол. м.,
яка перевищує 300 кД, можуть затримуватися у тканинах, з’єднуючись
з білками чи утворюючи комплекси з ліпідами клітинних мембран.
Вони частіше виводяться через кишечник, в який потрапляють
із жовчю.
23.
Назва цього різновиду біологічного окиснення походить від поняття«мікросоми», яка є фрагментом мембран ендоплазматичного
ретикулуму клітин. Оксигеназними називають реакції, за яких
відбувається безпосереднє приєднання до субстрату атомів кисню
за участю ферментів оксигеназ. Ці реакції класифікують залежно
від кількості атомів кисню, які приєднуються до субстратів,
на монооксигеназні та діоксигеназні. Монооксигенази каталізують
включення в субстрат (R), який окиснюється, лише одного атома
кисню, який виступає як пластична речовина. Другий атом
включається у молекулу води, а ферменти, які каталізують такі
реакції, називають мікросомальними оксигеназами змішаної функції
R-Н + ½O2 → ROH
Монооксигеназні системи сприяють утворенню реакційноздатного
молекулярного кисню, переводячи його у синглетну форму,
яка може реагувати з органічними речовинами. Загальна
монооксигеназна реакція виглядає таким чином:
НАДФ·Н+Н+ + R-H + O2 → НАДФ+ + R-ОН + Н2О
24.
Друга фаза О.м. забезпечує знешкодження ксенобіотиківта ендогенних субстратів за участю ферментів кон’югації. До перетворених залишків молекул ксенобіотиків і субстратів приєднуються
окремі ендогенні метаболіти (глюкуронова і сірчана кислоти, гліцин,
глутатіон та ін.), утворюючи парні сполуки — кон’югати,
які виводяться з організму. Це — реакції синтезу, а мікросомальні
ферменти, які беруть у них участь, належать до класу трансфераз
і мають широку субстратну специфічність
25.
Ферментні системи, локалізовані в мікросомальній фракції і здатнівикористовувати молекулярний кисень для окиснення специфічних
органічних сполук, поділяють на дві групи: діоксигенази і
монооксигенази. Діоксигенази до субстрату приєднують два атоми
кисню.
S + O2 ® SO2
Монооксигенази калізують реакції, в яких у молекулу органічного
субстрату включається тільки один з двох атомів кисню, а другий
використовується для утворення води: джерелом атомів водню для
утворення води служить НАДФН2, рідше НАДН2.
26.
До реакцій, які каталізуються мікросомальними ферментами,відносяться реакції гідроксилювання, тобто включення
гідроксильних груп у склад молекул субстрату. Тому монооксигенази
називають ще гідроксигеназами. Активний кисень використовується
для цілого ряду процесів. Він необхідний для гідроксилювання
стероїдів і перетворення їх в біологічно активні речовини, в тому
числі, для синтезу гормонів кори наднирників, статевих гормонів.
Мікросомальне окиснення відіграє важливу роль у реакціях
детоксикації цілого ряду токсичних речовин, лікарських препаратів
та продуктів їх перетворення шляхом гідроксилювання. Речовини при
цьому стають краще розчинними в воді, менш токсичними.
Необхідно ще раз підкреслити, що роль мікросомального окиснення
полягає в гідроксилюванні субстрату, а не в окиснювальному
фосфорилуванні.
27.
Субстрати, що окиснюються, на першій стадії взаємодіють ізокисненою формою цитохрому Р-450 (Fe3+) з утворенням ЕСК (SHFe3+). Під час другої стадії ЕСК відновлюється електроном (SH-Fe2+),
який надходить з НАДФН залежного ланцюга за допомогою НАДФНцитохрому Р-450-редуктази. Третя стадія характеризується
взаємодією відновленого ЕСК з киснем. Приєднання кисню
відбувається з великою швидкістю. Під час четвертої стадії
потрійний комплекс ензим-субстрат-кисень відновлюється іншим
електроном, який надходить із НАДФН-специфічного ланцюга
перенесення електронів, що має в своєму складі НАДФН цитохром
b5-редуктазу.
28.
П’ята стадія характеризується утворенням пероксикомплексу.Згодом за участі двох протонів відбувається гетеролітичний
розрив зв’язку О-О з вивільненням води та утворенням комплексу
RH(Fe-O)3+, в якому міститься електрондефіцитний оксеноїдний
атом кисню. Оксеноїдний комплекс вважають найважливішим
окисником у циклі цитохрому Р-450. Його взаємодія з молекулою
субстрату спричинює вивільнення атома водню й утворення
радикалу субстрату та координованого з залізом гідроксильного
радикалу (стадія 7). У подальшому відбувається їх рекомбінація,
при цьому гідроксильна група включається в молекулу субстрату,
після чого окиснений субстрат відділяється від ензиму (стадія 8)
29.
Необхідним компонентом гідроксилюючого комплексу ємікросомальні ліпіди (головний компонент – фосфатидилхолін),
які беруть участь як в організації монооксигеназної системи, так
і в регуляції її функцій. У результаті цих реакцій забезпечується
швидке виведення їх із організму, а більша частина речовин
перетворюється на неактивні сполуки. Але є такі речовини, які в
процесі біотрансформації стають активнішими порівняно із
вихідними: циклофосфан, аміназин, естрогени, дауноміцин,
тетрахлорид вуглецю тощо.
На метаболічні перетворення субстратів у системі
мікросомального окиснення впливає велика кількість
різноманітних чинників – спосіб харчування, стан кишкової
флори, умови зовнішнього середовища (температура, пора року,
висота над рівнем моря), а також стать і вік.
30.
Цитохроми Р450 — надродина монооксигеназ (офіційне скорочення CYP),велика і різноманітна група ферментів, які каталізують реакції окислення
органічних речовин.
31.
Субстратами монооксигеназ виступають проміжні метаболіти, такіяк ліпіди і стероїдні гормони, а також ксенобіотики, такі як
фармацевтичні препарати та інших токсичних хімічних речовин.
CYP є основними ферментами, що беруть участь у метаболізмі
ліків. Монооксигеназні реакції складають близько 75% від
загальної кількості різних метаболічних реакцій.
Найбільш поширеною реакцією, що каталізується
цитохромом P450 є реакцією мікросомального
окислення — включення одного атома кисню в
склад аліфатичногоорганічного субстрату (RH), інший же
атом кисню відновлюється до води:
32.
Цитохроми Р450 (CYP) належать до білків, що містятькофактором гем і, отже, є гемопротеїнами. Загалом, ці
ферменти є кінцевими ділянками в ланцюгах переносу
електронів, що широкому сенсі класифікуються яко P450вмісні системи. Термін P450 походить
від спектрофотометричного піку при довжині хвилі максимуму
поглинання ферменту (450 нм), коли він знаходиться у
відновленому стані і в комплексі з чадним газом (СО).
Монооксигенази виявлені у всіх форм життя — тварин, рослин,
грибів, найпростіших, бактерій, архей, і навіть у вірусів.
Однак, цей фермент не було знайдено в E.coli. Відомо більше
18 000 різних CYP.
33.
Більшість CYP потрібен допоміжний білок, для перенесення одного абокількох електронів для відновлення йона Заліза (а в кінцевому
підсумку молекулярний кисень). На підставі характеру білків
перенесення електронів, CYP можна розділити на кілька груп:
• Мікросомальні P450 системи, в яких електрони передаються
від НАДФН через цитохром P450 редуктазу. Цитохром b5 (cyb5)
також може сприяти зниження потужності до цієї системи після
його відновлення цитохром b5 редуктазою (CYB5R).
• Мітохондріальні P450 системи задіюють адренодоксинредуктазу і
адренодоксин для перенесення електронів від НАДФН в P450.
• Бактеріальні Р450 системи використовують в
ферредоксинредуктазу і ферредоксин в перенесенні електронів на
P450.
• CYB5R/cyb5/P450 системи, в яких обидва електрона, необхідні CYP
переходять від цитохрому b5.
• FMN/Fd/P450 системи вперше знайдені у виду Rhodococcus в
якому ФМН-залежна редуктаза спаяна з CYP.
• Власне P450 системи не вимагають зовнішнього відновну систему.
Відомі з них включають CYP5 (тромбоксан-синтазу), CYP8
(простациклін-синтазу) і CYP74A





























 Медицина
Медицина