Похожие презентации:
Основные положения теории резонанса
1. Основные положения теории резонанса
C OC O
C O
O H
O H
O H
C O
+ O H
1. Если молекула может быть представлена несколькими
«граничными» структурами, то ни одна из них не отражает
реальную молекулу. Считают, что возникает резонанс и
молекула является гибридом этих структур.
2. Чем устойчивее граничная структура, тем больше её
вклад в гибрид. Близкие по устойчивости структуры
(содержащие примерно одинаковое количество энергии)
вызывают наибольший резонанс.
3. Резонансный гибрид стабильнее, чем любая из
граничных структур. Такое увеличение устойчивости
называют энергией резонанса. Чем ближе по устойчивости
резонирующие структуры, тем больше энергия резонанса.
2. Ароматичность. Арены Определение и классификация
Арены, не смотря на свою «ненасыщенность», в отличиеот алифатических непредельных соединений более
стабильны, устойчивы к окислителям,
восстановителям, не полимеризуются, и вместо
реакций присоединения склонны больше к реакциям
ионного замещения (электрофильного и
нуклеофильного замещения).
Ароматические соединения в основном делят на
карбоциклические (бензол, нафталин, антрацен,
фенантрен) и гетероциклические (пяти-,
шестичленные с одним, двумя и более
гетероатомами (в основном кислород, азот и сера)
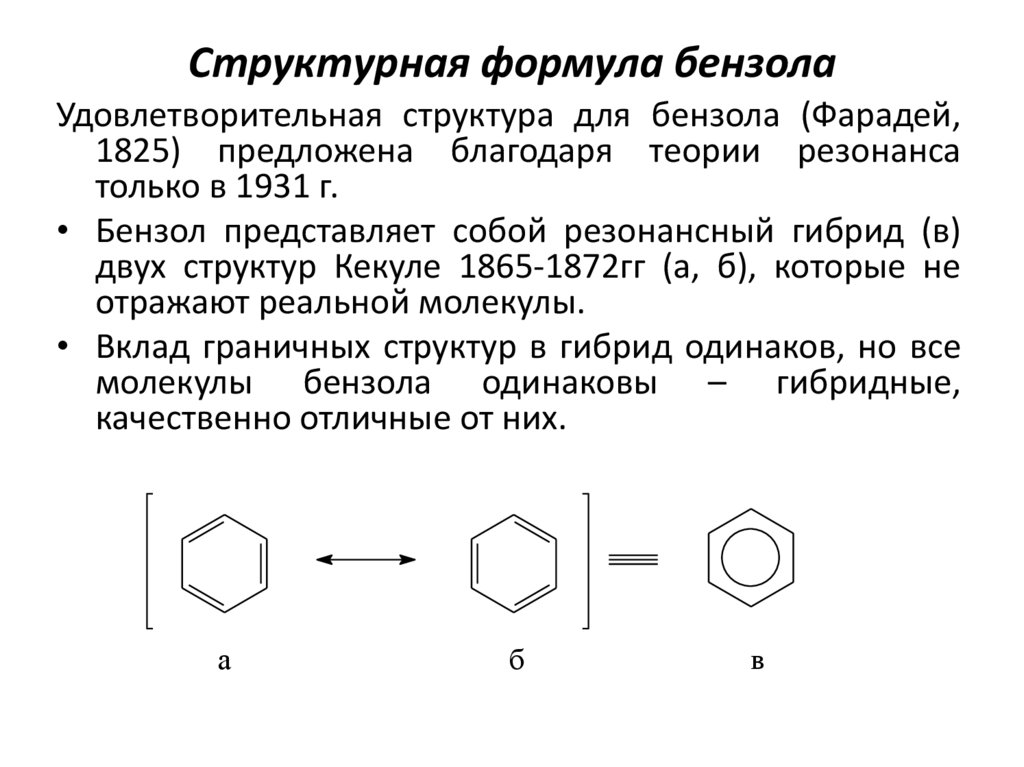
3. Структурная формула бензола
Удовлетворительная структура для бензола (Фарадей,1825) предложена благодаря теории резонанса
только в 1931 г.
• Бензол представляет собой резонансный гибрид (в)
двух структур Кекуле 1865-1872гг (а, б), которые не
отражают реальной молекулы.
• Вклад граничных структур в гибрид одинаков, но все
молекулы бензола одинаковы – гибридные,
качественно отличные от них.
а
б
в
4. Структурная формула бензола (2)
• Все С – С – связи бензола одинаковы («гибридные») иназываются полуторными или бензольными.
• p-Связь непредельных соединений окисляется,
восстанавливается, полимеризуется, вступает в
реакции присоединения.
• Полуторные связи устойчивы к окислителям,
восстановителям, им не характерны реакции
присоединения, полимеризации, но придают бензолу
способность вступать в реакции замещения.
• Однако полуторная и p-связь родственные, поэтому
при определенных условиях бензол реагирует как
ненасыщенный углеводород.
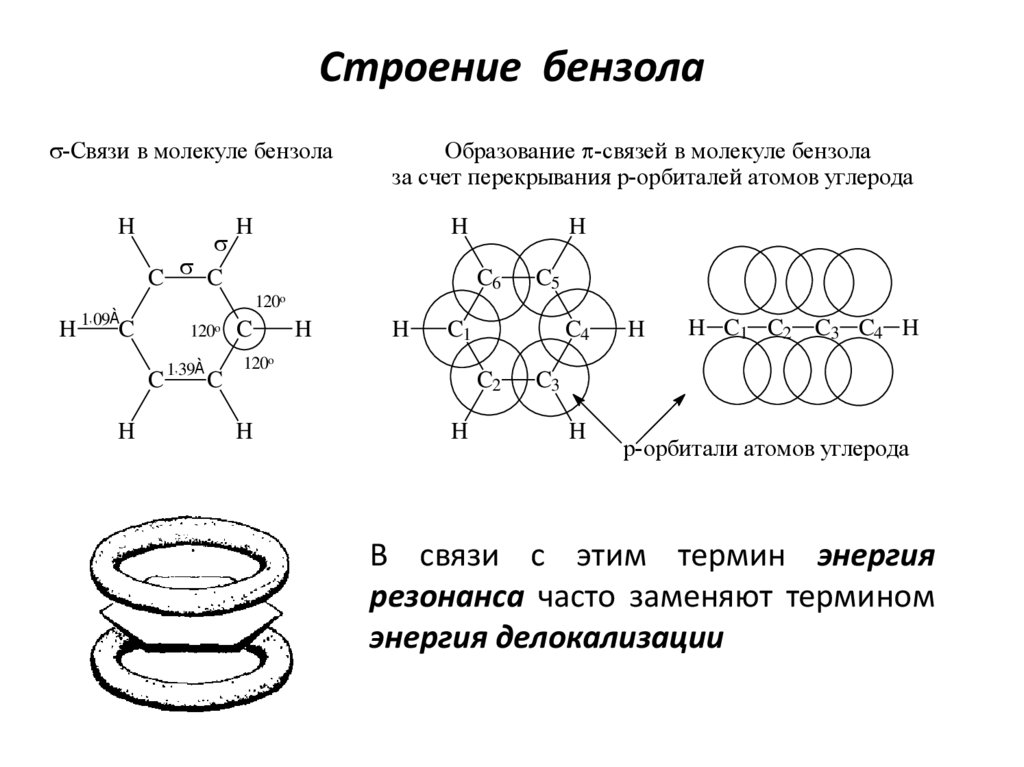
5. Строение бензола
s-Связи в молекуле бензолаH
s
C s C
À
120o
C
H
H
H
H
C6
C5
120o
H 1 09 C
,
Образование p-связей в молекуле бензола
за счет перекрывания p-орбиталей атомов углерода
1, 39À
C
C
H
H
C1
120o
H
C4
C2
H
H
H C1 C2 C3 C4 H
C3
H
p-орбитали атомов углерода
В связи с этим термин энергия
резонанса часто заменяют термином
энергия делокализации
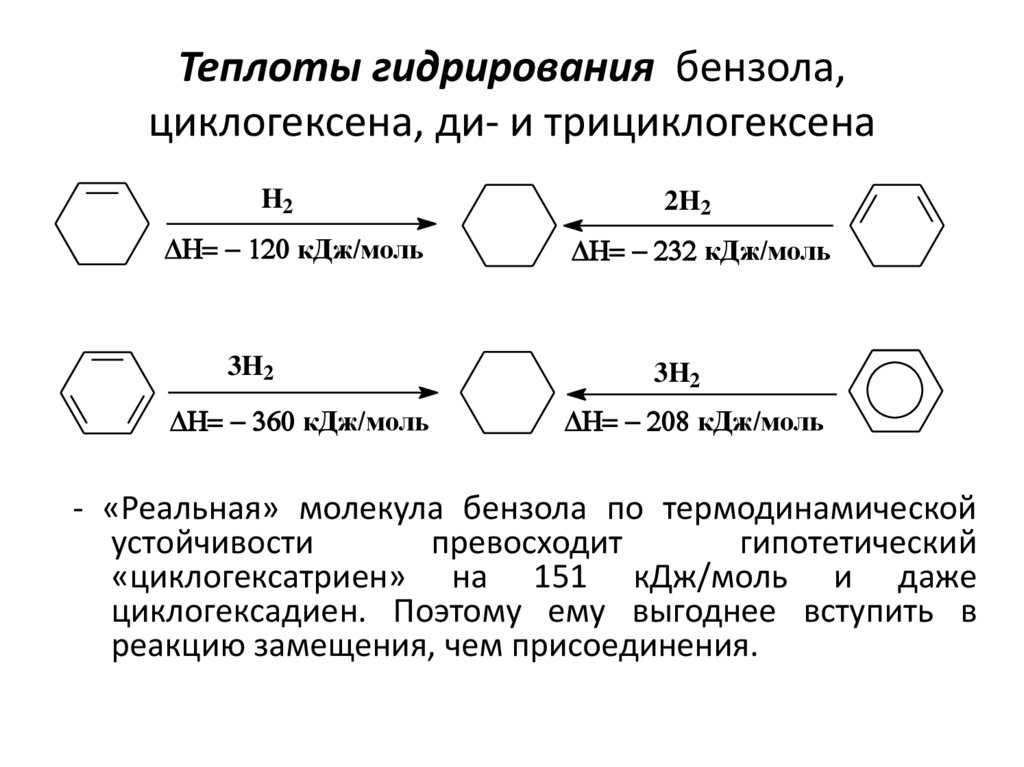
6. Теплоты гидрирования бензола, циклогексена, ди- и трициклогексена
H2кДж/моль
3H2
кДж/моль
2H2
кДж/моль
3H2
кДж/моль
- «Реальная» молекула бензола по термодинамической
устойчивости
превосходит
гипотетический
«циклогексатриен» на 151 кДж/моль и даже
циклогексадиен. Поэтому ему выгоднее вступить в
реакцию замещения, чем присоединения.
7. Цикло-октатетраен
H2кДж/моль
4H2
кДж/моль
• - не является ареном, нет резонанса, поэтому
теплота его гидрирования примерно в 4 раза больше,
чем теплота гидрирования циклооктена.
• Структурные
формулы
ароматических
соединений часто пишут с использованием кратных
связей, поэтому необходимо уметь отличать их от
алифатических.
• Для отнесения малознакомых соединений к
ароматическим
или
алифатическим
по
«классическим» структурным формулам, необходимо
знать признаки ароматичности.
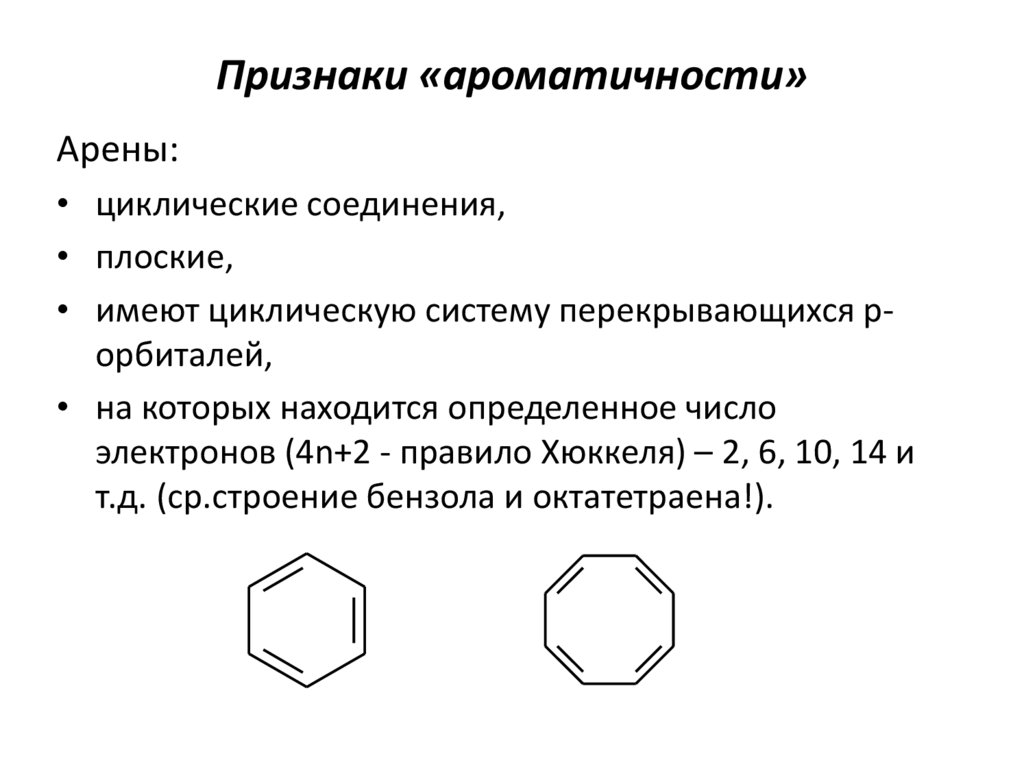
8. Признаки «ароматичности»
Арены:• циклические соединения,
• плоские,
• имеют циклическую систему перекрывающихся pорбиталей,
• на которых находится определенное число
электронов (4n+2 - правило Хюккеля) – 2, 6, 10, 14 и
т.д. (ср.строение бензола и октатетраена!).
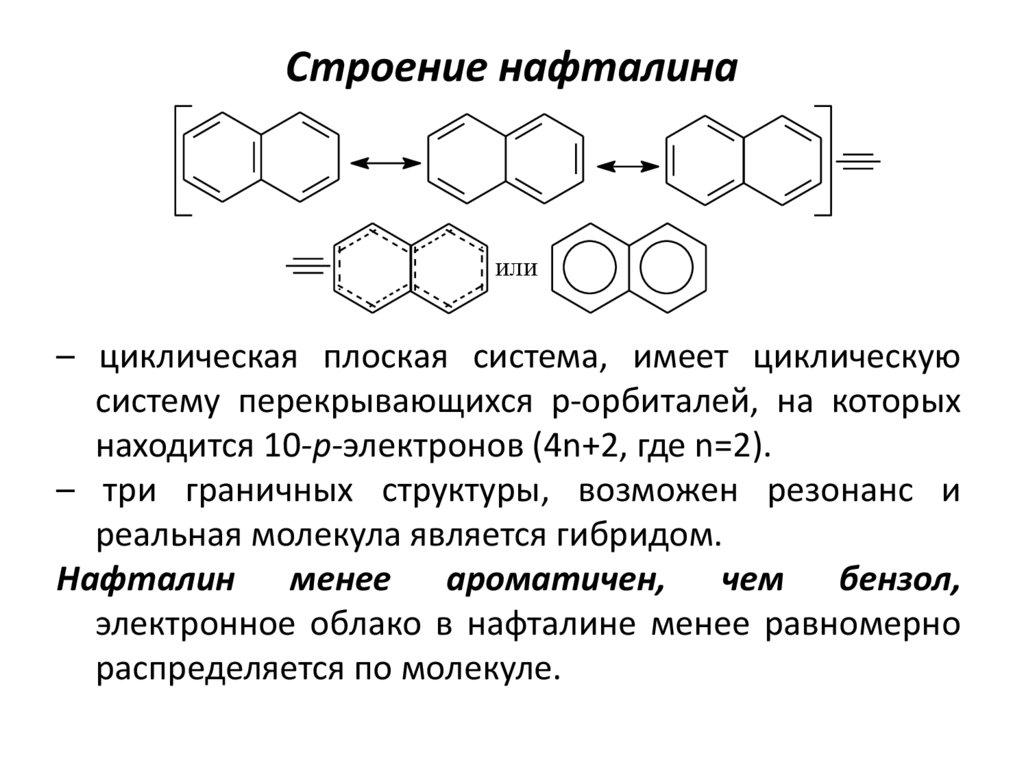
9. Строение нафталина
или– циклическая плоская система, имеет циклическую
систему перекрывающихся p-орбиталей, на которых
находится 10-р-электронов (4n+2, где n=2).
– три граничных структуры, возможен резонанс и
реальная молекула является гибридом.
Нафталин менее ароматичен, чем бензол,
электронное облако в нафталине менее равномерно
распределяется по молекуле.
10. Взаимодействие заместителей с электронным облаком бензола
• Атомы и группы атомов, связанные с аренами,активно влияют на их электронное облако.
• Используются эффекты:
индукционный,
сопряжение
(мезомерный)
и
сверхсопряжение,
• Заместители поляризуют электронное облако
и меняют свойства арена.
• Действие
эффектов
может
быть
согласованным и несогласованным.
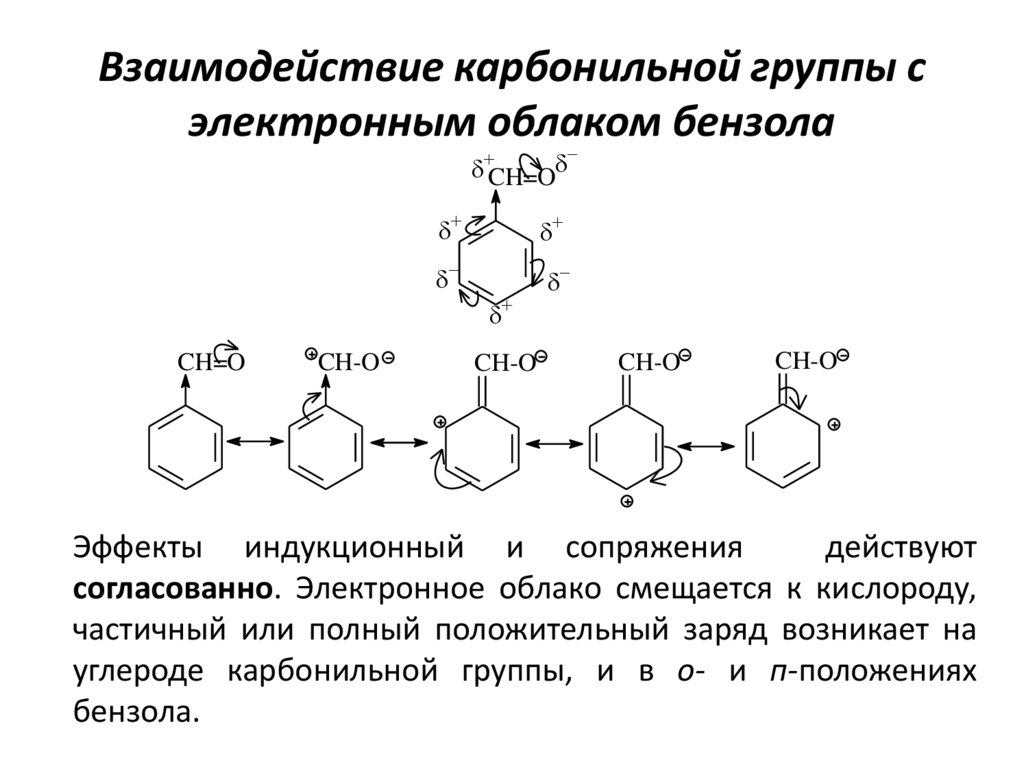
11. Взаимодействие карбонильной группы с электронным облаком бензола
CH=OCH=O
CH-O
CH-O
CH-O
CH-O
Эффекты индукционный и сопряжения
действуют
согласованно. Электронное облако смещается к кислороду,
частичный или полный положительный заряд возникает на
углероде карбонильной группы, и в о- и п-положениях
бензола.
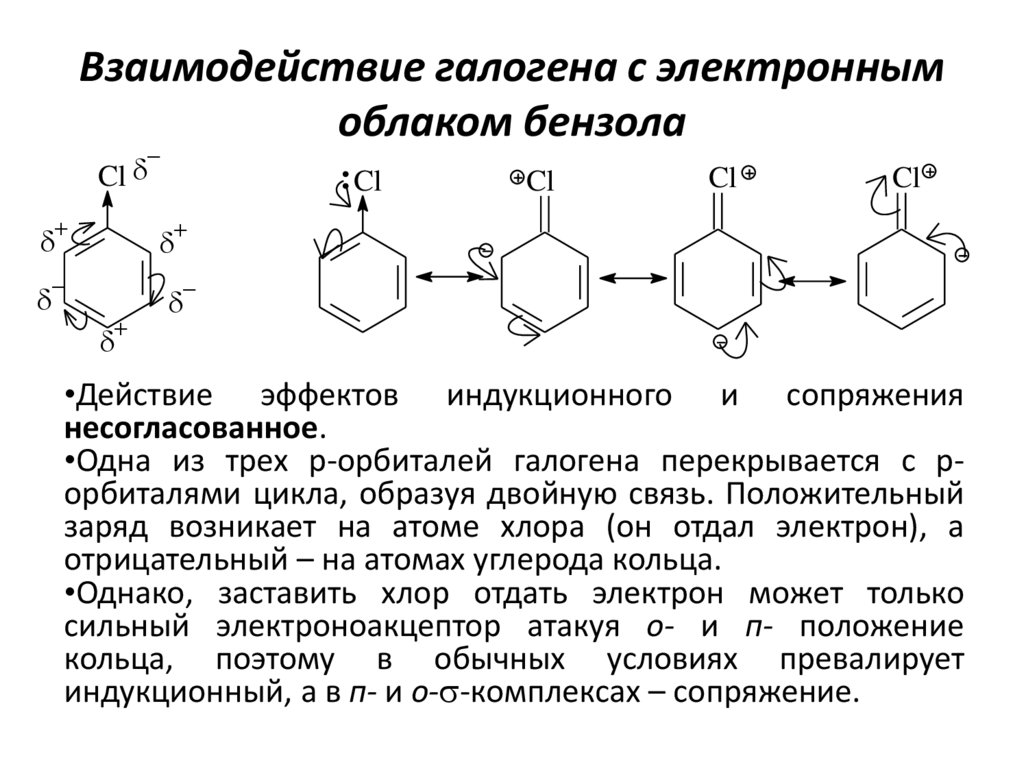
12. Взаимодействие галогена с электронным облаком бензола
ClCl
Cl
Cl
Cl
•Действие эффектов индукционного и сопряжения
несогласованное.
•Одна из трех р-орбиталей галогена перекрывается с рорбиталями цикла, образуя двойную связь. Положительный
заряд возникает на атоме хлора (он отдал электрон), а
отрицательный – на атомах углерода кольца.
•Однако, заставить хлор отдать электрон может только
сильный электроноакцептор атакуя о- и п- положение
кольца, поэтому в обычных условиях превалирует
индукционный, а в п- и о-s-комплексах – сопряжение.
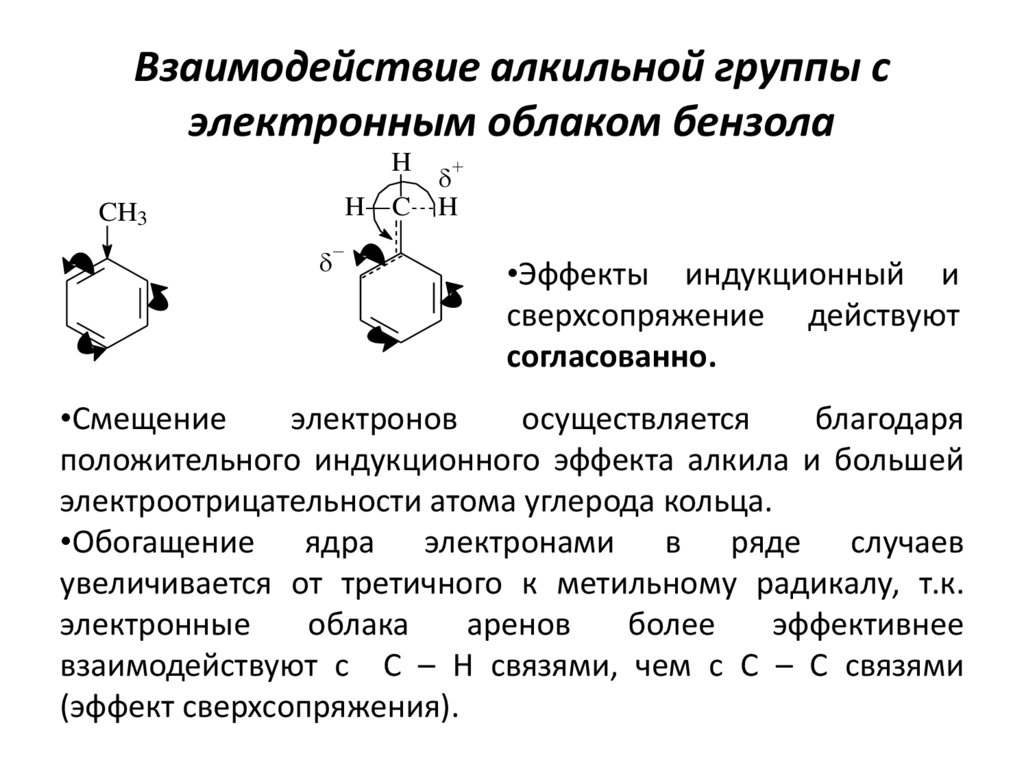
13. Взаимодействие алкильной группы с электронным облаком бензола
HH
CH3
C
H
•Эффекты индукционный и
сверхсопряжение действуют
согласованно.
•Смещение
электронов
осуществляется
благодаря
положительного индукционного эффекта алкила и большей
электроотрицательности атома углерода кольца.
•Обогащение ядра электронами в ряде случаев
увеличивается от третичного к метильному радикалу, т.к.
электронные
облака
аренов
более
эффективнее
взаимодействуют с С – Н связями, чем с С – С связями
(эффект сверхсопряжения).
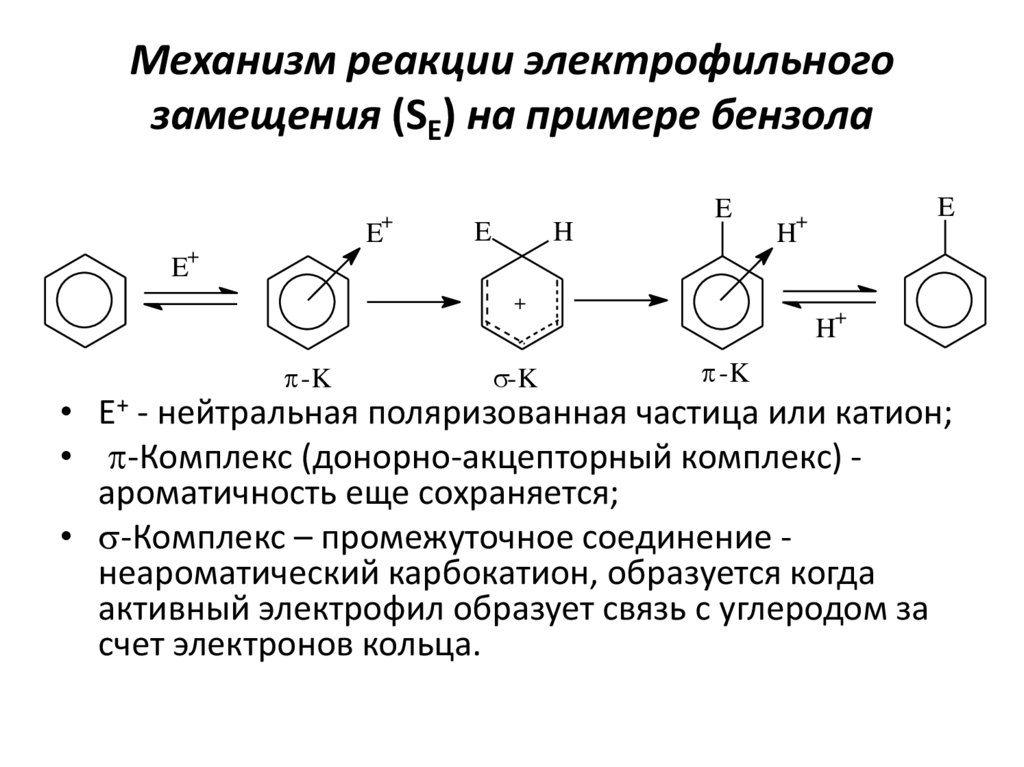
14. Механизм реакции электрофильного замещения (SE) на примере бензола
+E
E
H
E
E
+
H
E+
+
+
H
p-K
s-K
p-K
• Е+ - нейтральная поляризованная частица или катион;
• p-Комплекс (донорно-акцепторный комплекс) ароматичность еще сохраняется;
• s-Комплекс – промежуточное соединение неароматический карбокатион, образуется когда
активный электрофил образует связь с углеродом за
счет электронов кольца.
15. Распределение электронов в s-комплексе
E+H
E
H
E
H
+
+
E
H
E
+
+
•В s-комплексе 4 p-электрона делокализованы по 5
атомам углерода за счет эффекта сопряжения:
•Катион может присоединить анион, как в реакциях АЕ по
двойным С=С связям, но отщепление протона приводить к
значительно более устойчивому замещенному бензолу,
чем ц.гексадиен.
•Направление и скорость реакции, в большинстве
случаях, определяется стабильностью s-комплекса,
которую можно определить числом и устойчивостью
граничных структур.
16. Направление и относительная реакционная способность замещенных бензолов
-определяются уже имеющимися заместителями.Заместители первого рода:
•направляют электрофил в орто- и пара-положения;
•за
исключением
галогенов,
являются
электронодонорами, обогащают ядро электронами и
облегчают электрофильное замещение (по сравнению с
бензолом);
•на атоме, непосредственно связанном с ароматическим
ядром, имеют частичный или полный отрицательный
заряд или/и электронные пары.
К ним относятся радикалы, гидроксил и его
производные (-OH, -O-,-OR,-OCOR), аминогруппа и её
производные (-NH2, -NHR, -NR2, -NHCOR), галогены и др.
17. Заместители второго рода
• направляют электрофильный реагент в метаположение;• являются электроноакцепторами, уменьшают
электронную плотность в ядре и сильно
затрудняют электрофильное замещение (по
сравнению с бензолом и галогенбензолом);
• на атоме, непосредственно связанном с
ароматическим кольцом, имеют частичный
или полный положительный заряд.
• К ним относятся нитрогруппа, трихлорметил,
карбонильная, сульфо-, карбокси- группы и их
производные и другие
18. Скорость реакции SE
- определяется устойчивостью s-комплекса, котораязависит от равномерности распределения электронного
облака по частице:
E
A
+
E
E
H
<
+
H
<
D
+
H
Стабильность s-комплексов увеличивается (A-акцептор; D-донор)
- электронодонорные заместители (I рода за
исключением галогенов) стабилизируют s-комплекс за
счет распределения положительного заряда по частице и
повышают реакционную способность бензольного
кольца в реакциях SE, они обогощают электронами все
положения ядра, но о- и п- положения в наибольшей
степени
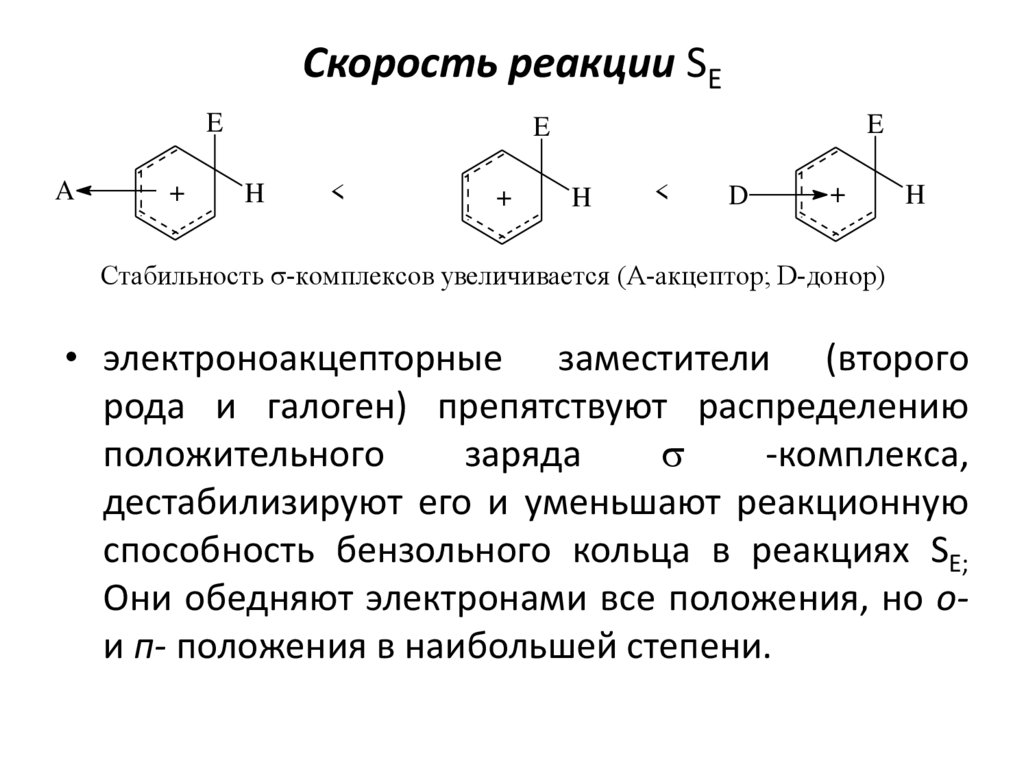
19. Скорость реакции SE
EA
+
E
E
H
<
+
H
<
D
+
H
Стабильность s-комплексов увеличивается (A-акцептор; D-донор)
• электроноакцепторные заместители (второго
рода и галоген) препятствуют распределению
положительного
заряда
s
-комплекса,
дестабилизируют его и уменьшают реакционную
способность бензольного кольца в реакциях SE;
Они обедняют электронами все положения, но ои п- положения в наибольшей степени.
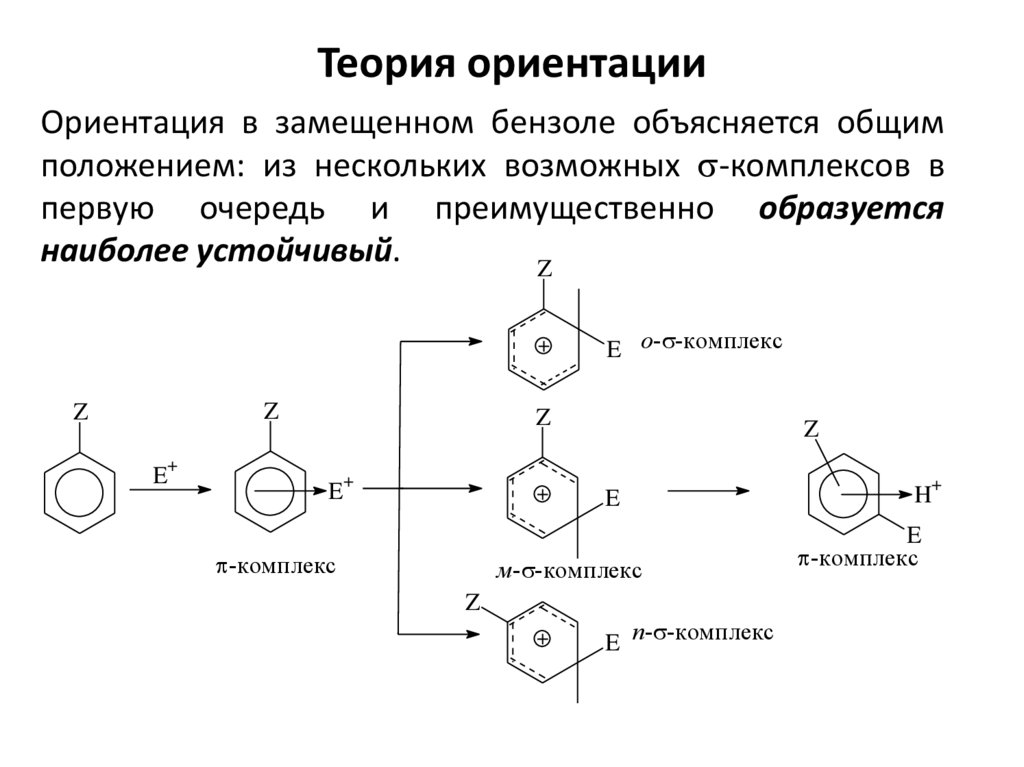
20. Теория ориентации
Ориентация в замещенном бензоле объясняется общимположением: из нескольких возможных s-комплексов в
первую очередь и преимущественно образуется
наиболее устойчивый.
Z
E o-s-комплекс
Z
Z
Z
+
E
+
E
Z
E
p-комплекс
м-s-комплекс
Z
E п-s-комплекс
+
H
E
p-комплекс
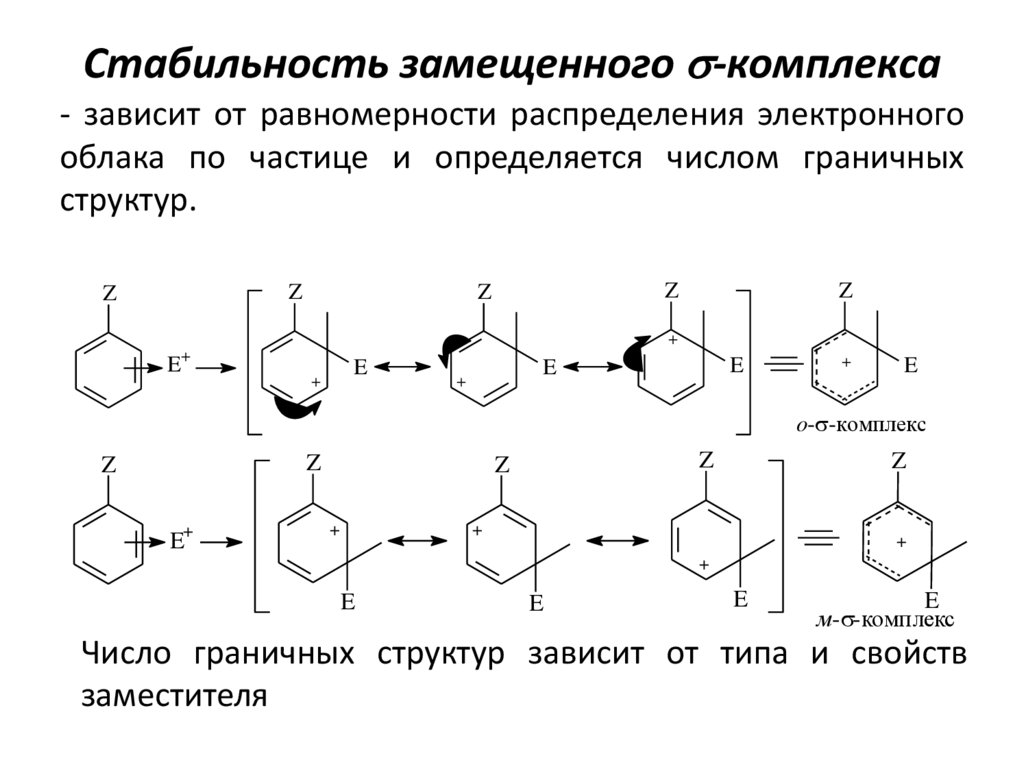
21. Стабильность замещенного s-комплекса
- зависит от равномерности распределения электронногооблака по частице и определяется числом граничных
структур.
Z
Z
Z
Z
Z
+
+
E
E
+
E
E
+
+
E
o-s-комплекс
Z
Z
E+
Z
Z
+
Z
+
+
+
E
E
E
E
м-s-комплекс
Число граничных структур зависит от типа и свойств
заместителя
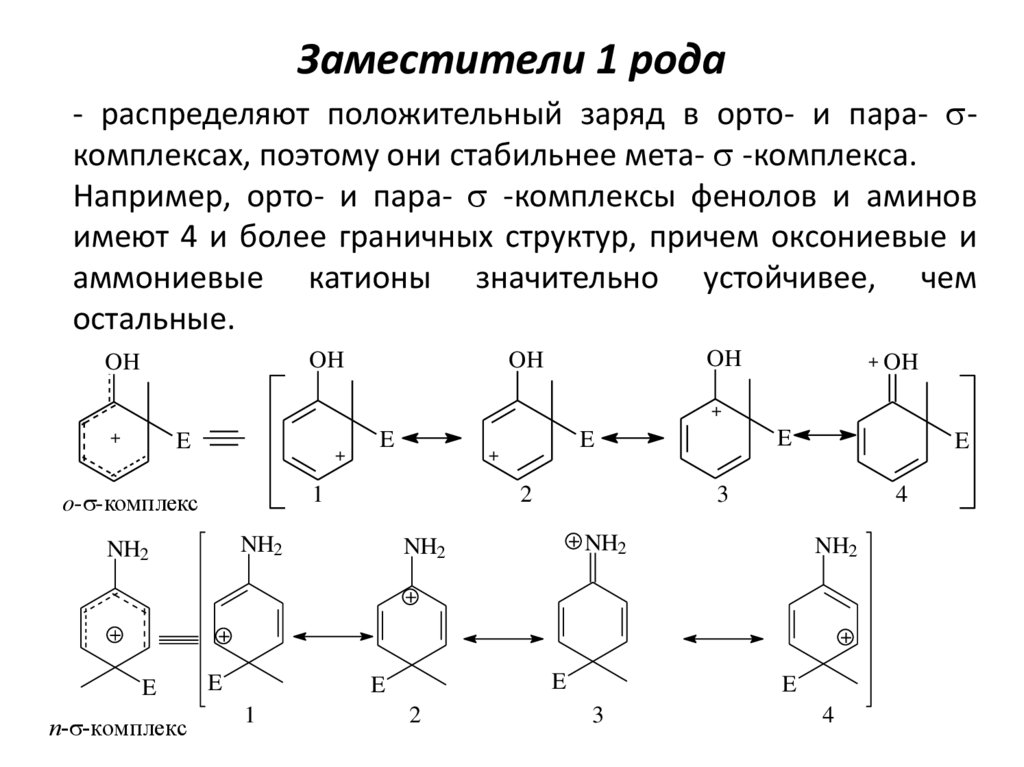
22. Заместители 1 рода
- распределяют положительный заряд в орто- и пара- sкомплексах, поэтому они стабильнее мета- s -комплекса.Например, орто- и пара- s -комплексы фенолов и аминов
имеют 4 и более граничных структур, причем оксониевые и
аммониевые катионы значительно устойчивее, чем
остальные.
OH
OH
OH
OH
+ OH
+
+
E
+
п-s-комплекс
2
NH2
NH2
E
1
4
NH2
E
2
E
3
NH2
E
E
E
+
1
o-s-комплекс
E
E
NH2
E
3
4
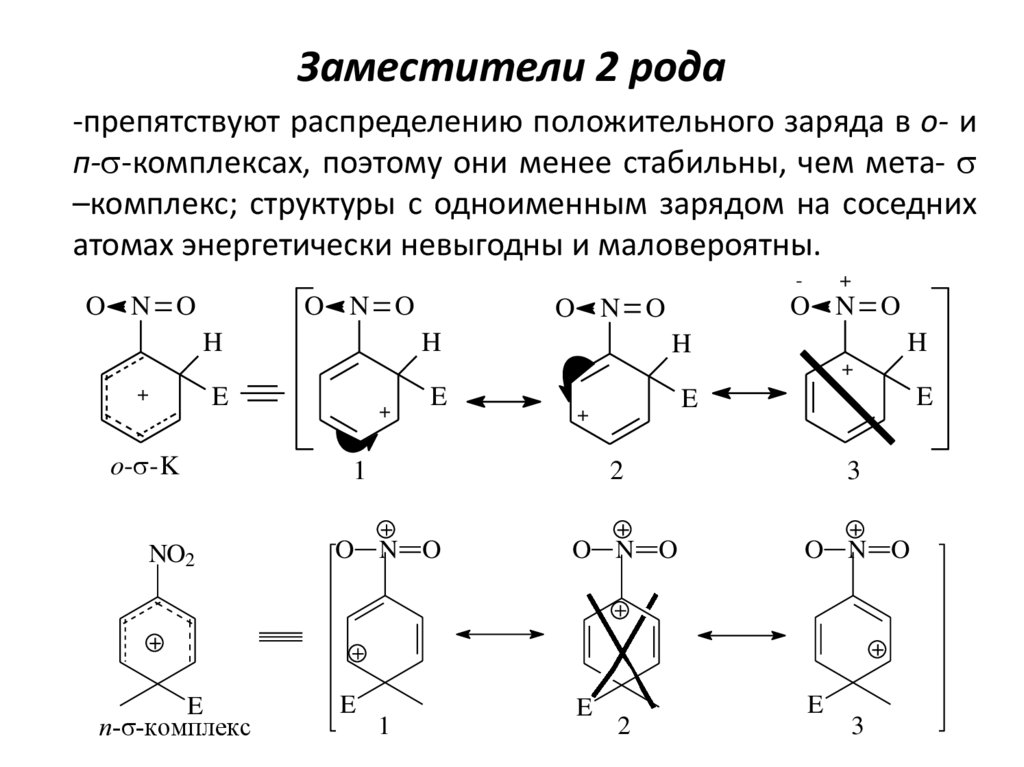
23. Заместители 2 рода
-препятствуют распределению положительного заряда в о- ип-s-комплексах, поэтому они менее стабильны, чем мета- s
–комплекс; структуры с одноименным зарядом на соседних
атомах энергетически невыгодны и маловероятны.
-
O N O
O N O
H
O N O
O N O
H
+
H
H
+
+
E
o-s-K
NO2
E
п-s-комплекс
+
E
1
E
E
+
2
3
O N O
O N O
O N O
E
E
E
1
2
3









 Химия
Химия








