Похожие презентации:
Ароматические соединения (арены)
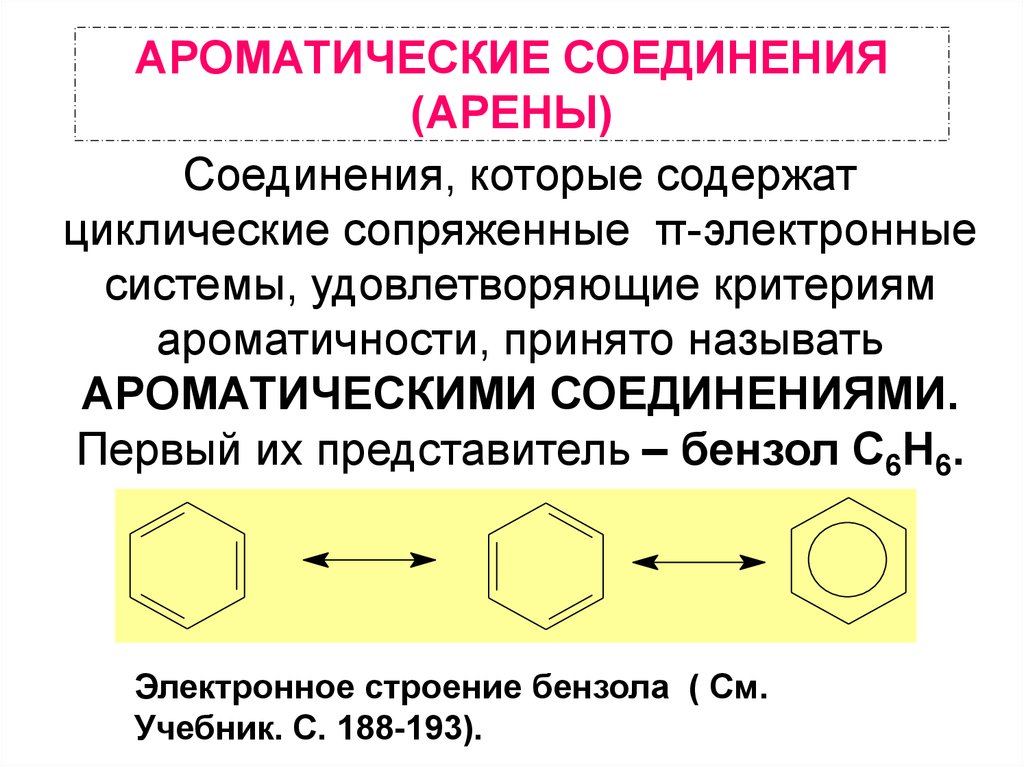
1. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ (АРЕНЫ)
Соединения, которые содержатциклические сопряженные π-электронные
системы, удовлетворяющие критериям
ароматичности, принято называть
АРОМАТИЧЕСКИМИ СОЕДИНЕНИЯМИ.
Первый их представитель – бензол С6Н6.
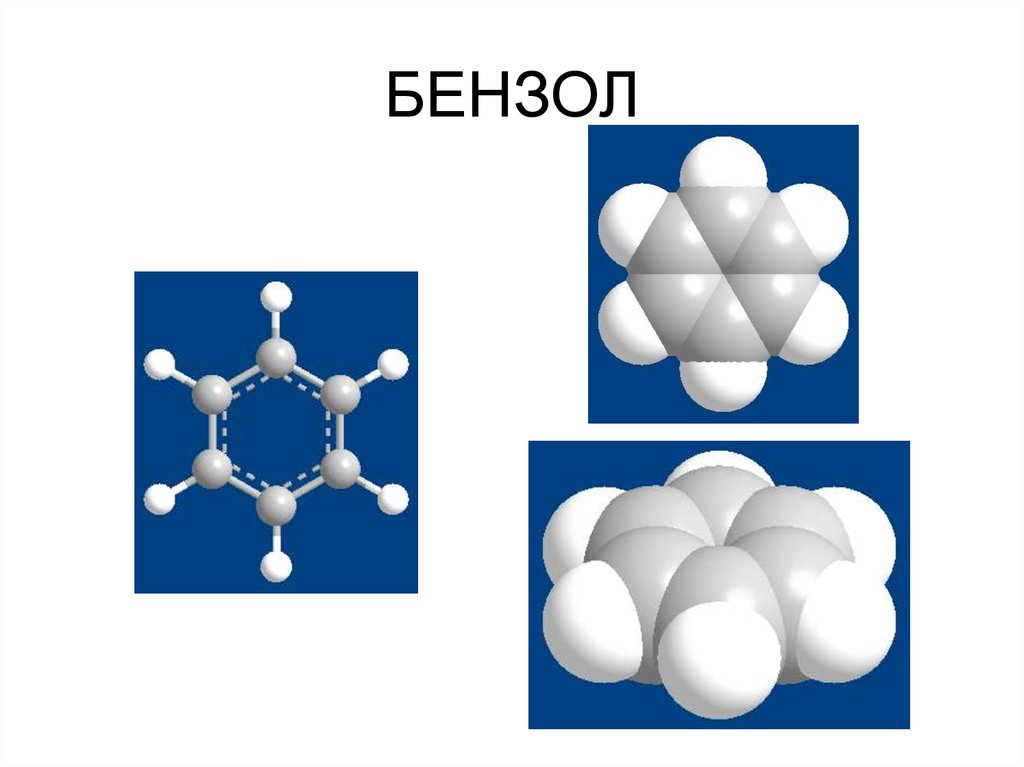
Электронное строение бензола ( См.
Учебник. С. 188-193).
2. БЕНЗОЛ
3.
Hsp2 H
sp2 C C sp2
H C
C H
2
2
sp
sp C C
2
sp
H
H
4. Ароматичность как особое химическое качество характерно не только для бензола. Существуют соединения, не относящиеся к ряду бензола, но об
Ароматичность как особое химическое качествохарактерно не только для бензола. Существуют
соединения, не относящиеся к ряду бензола, но
обладающие ароматическими свойствами.
Э.Хюккель (1930 г.) сформулировал правило
ароматичности:
• Плоские моноциклические соединения,
содержащие замкнутую сопряженную
систему (4n+2) π-электронов , где n =
0,1,2,3...(т.е. соединения содержащие
2, 6, 10, 14… π-электронов в цикле),
являются ароматическими.
5.
• Соединения, содержащие 4n π-электроновв такой сопряженной системе , являются
антиароматическими.
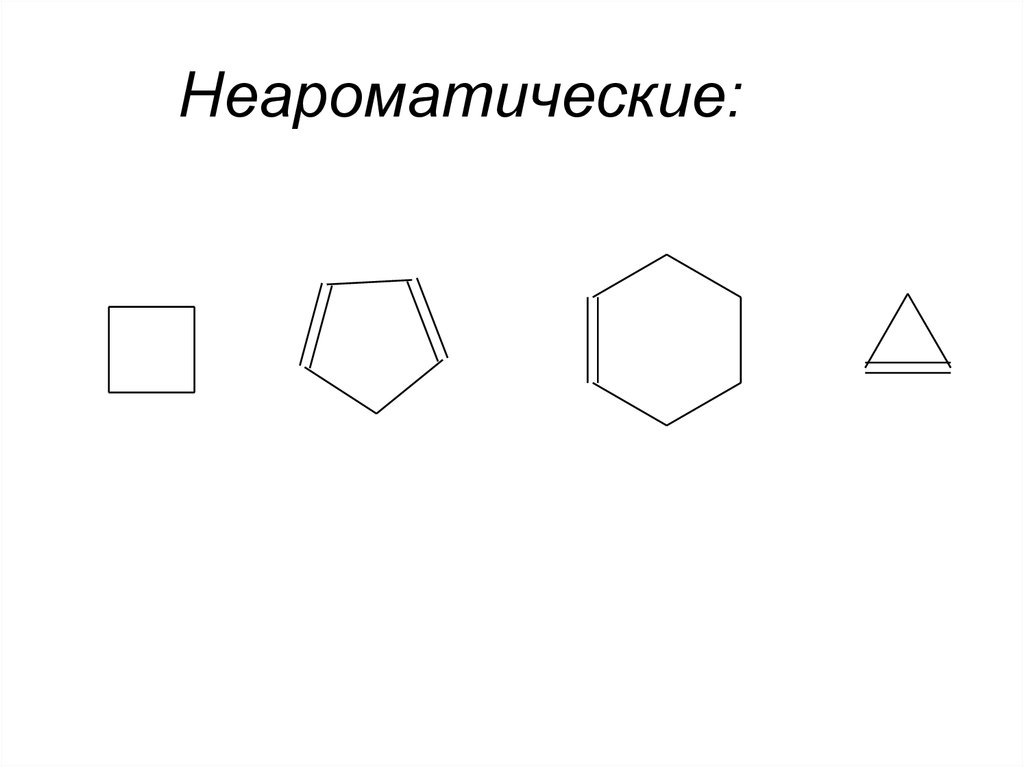
• Соединения, в которых отсутствует система
сопряженных двойных связей, называют
неароматической.
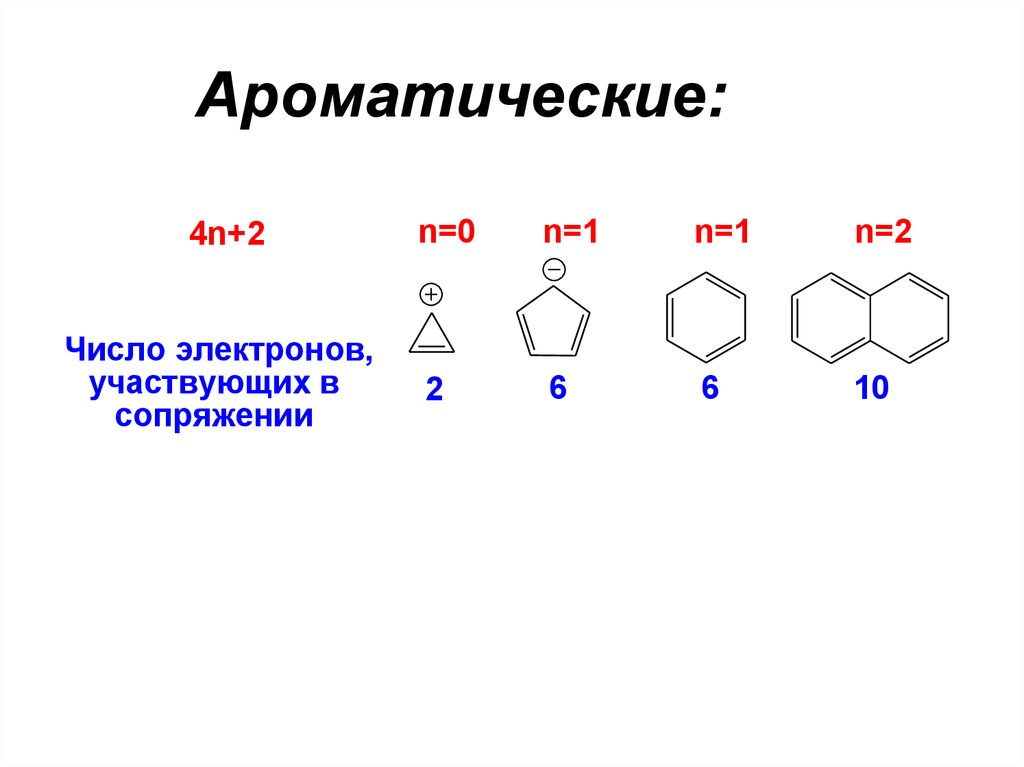
6. Ароматические:
4n+2Число электронов,
участвующих в
сопряжении
n=0
n=1
n=1
n=2
2
6
6
10
7. Антиароматические:
Число электронов,участвующих в
сопряжении
4
4
8
8. Неароматические:
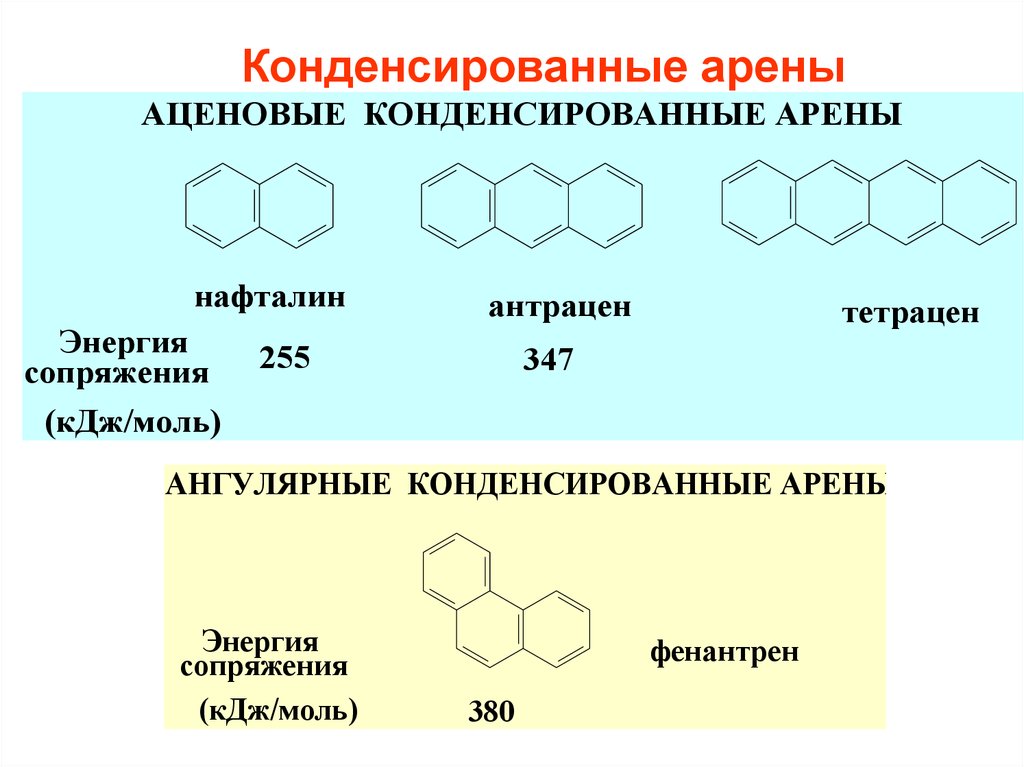
9. Конденсированные арены
АЦЕНОВЫЕ КОНДЕНСИРОВАННЫЕ АРЕНЫнафталин
Энергия
сопряжения
(кДж/моль)
антрацен
255
тетрацен
347
АНГУЛЯРНЫЕ КОНДЕНСИРОВАННЫЕ АРЕНЫ
Энергия
сопряжения
(кДж/моль)
фенантрен
380
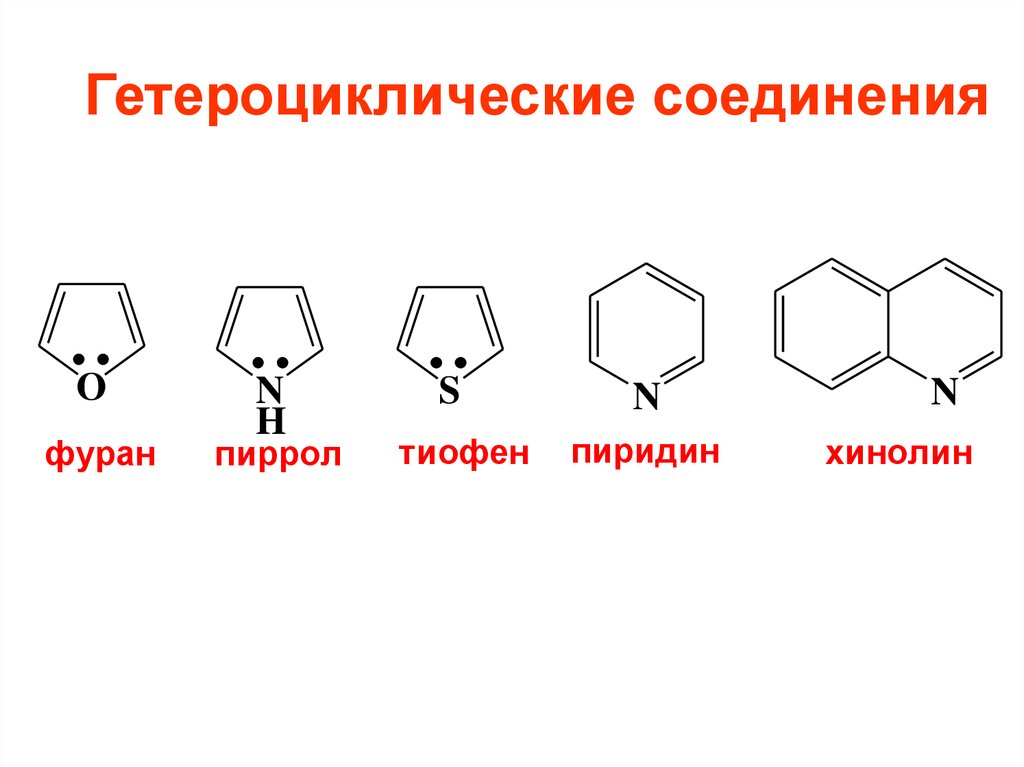
10. Гетероциклические соединения
Oфуран
N
H
пиррол
S
тиофен
N
пиридин
N
хинолин
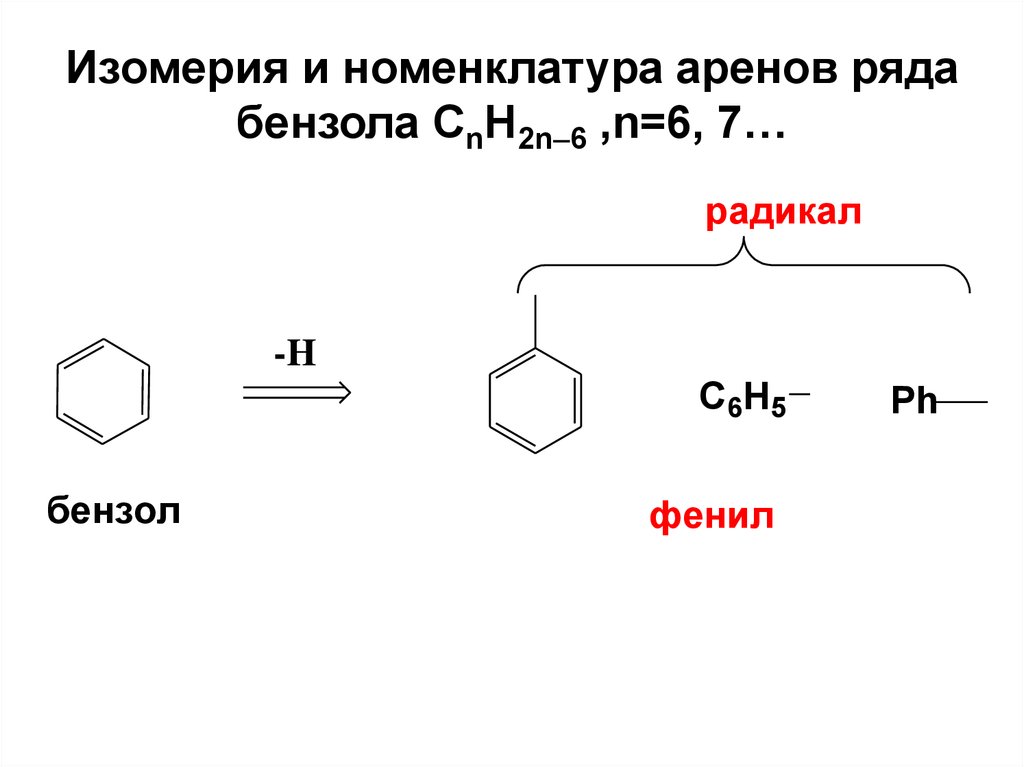
11. Изомерия и номенклатура аренов ряда бензола СnH2n6 ,n=6, 7…
Изомерия и номенклатура аренов рядабензола СnH2n 6 ,n=6, 7…
радикал
-H
C6H5
бензол
фенил
Ph
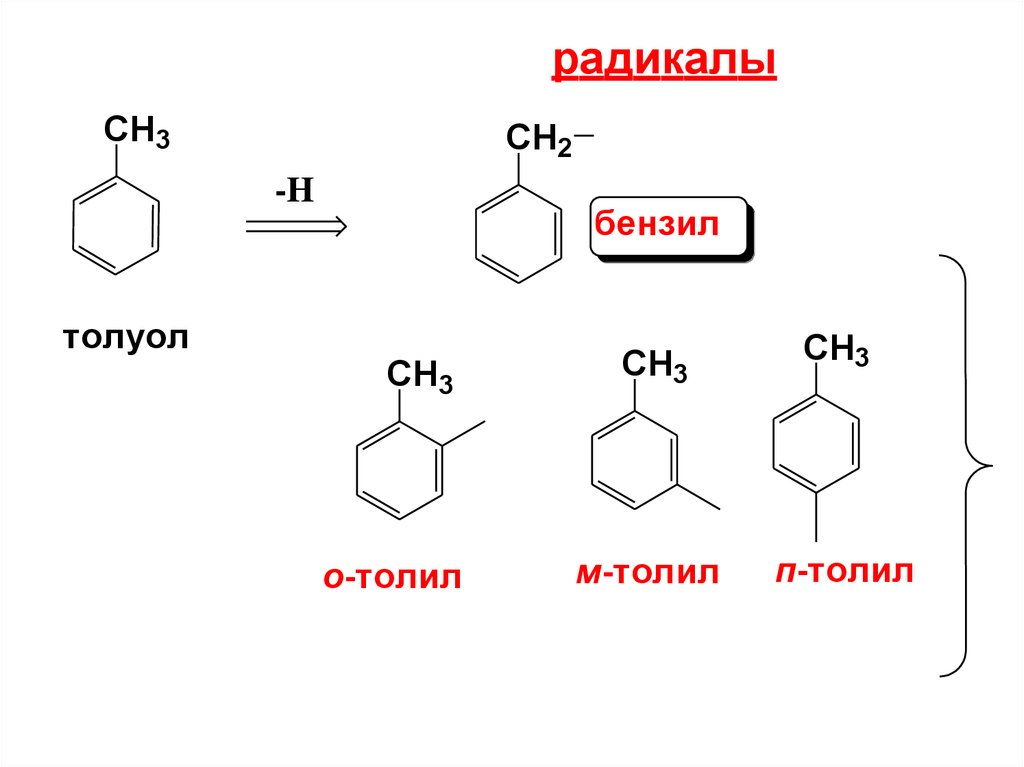
12.
радикалыCH3
CH2
-H
бензил
толуол
CH3
о-толил
CH3
CH3
м-толил
п-толил
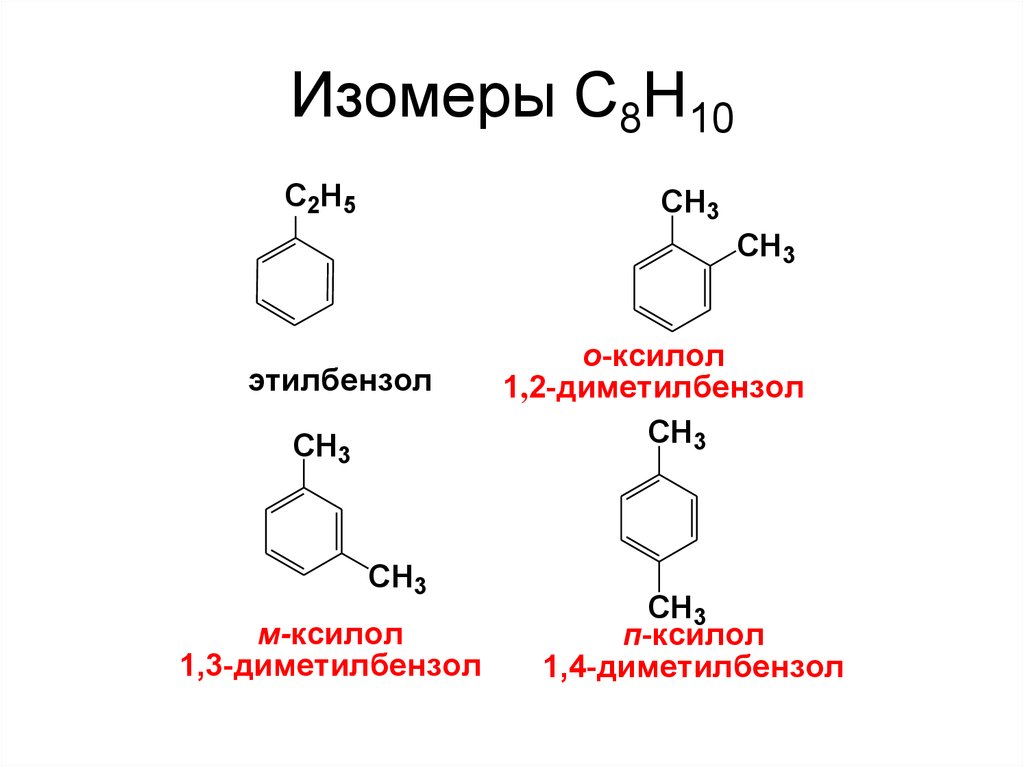
13. Изомеры С8Н10
C2H5CH3
СH3
этилбензол
CH3
CH3
м-ксилол
1,3-диметилбензол
о-ксилол
1,2-диметилбензол
CH3
CH3
п-ксилол
1,4-диметилбензол
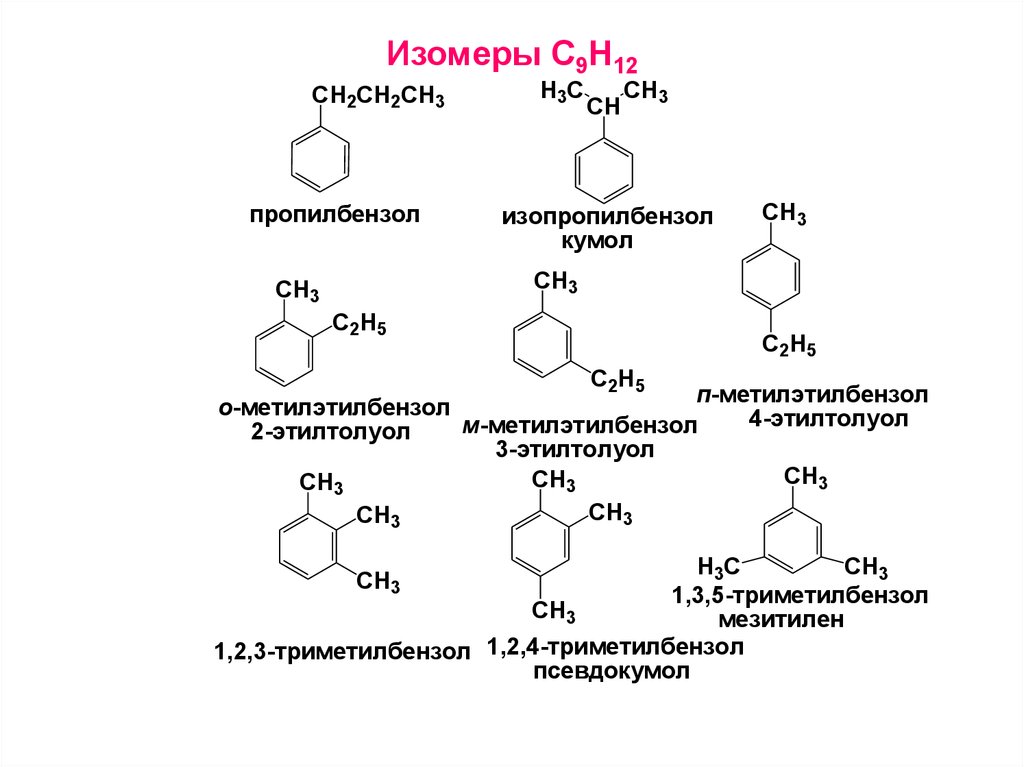
14. Изомеры С9Н12
CH2СH2CH3пропилбензол
H3C
CH
CH3
изопропилбензол
кумол
CH3
CH3
CH3
С2H5
C2H5
C2H5
п-метилэтилбензол
о-метилэтилбензол
4-этилтолуол
м-метилэтилбензол
2-этилтолуол
3-этилтолуол
CH3
CH3
CH3
CH3
CH3
H3C
CH3
1,3,5-триметилбензол
CH3
мезитилен
1,2,3-триметилбензол 1,2,4-триметилбензол
псевдокумол
CH3
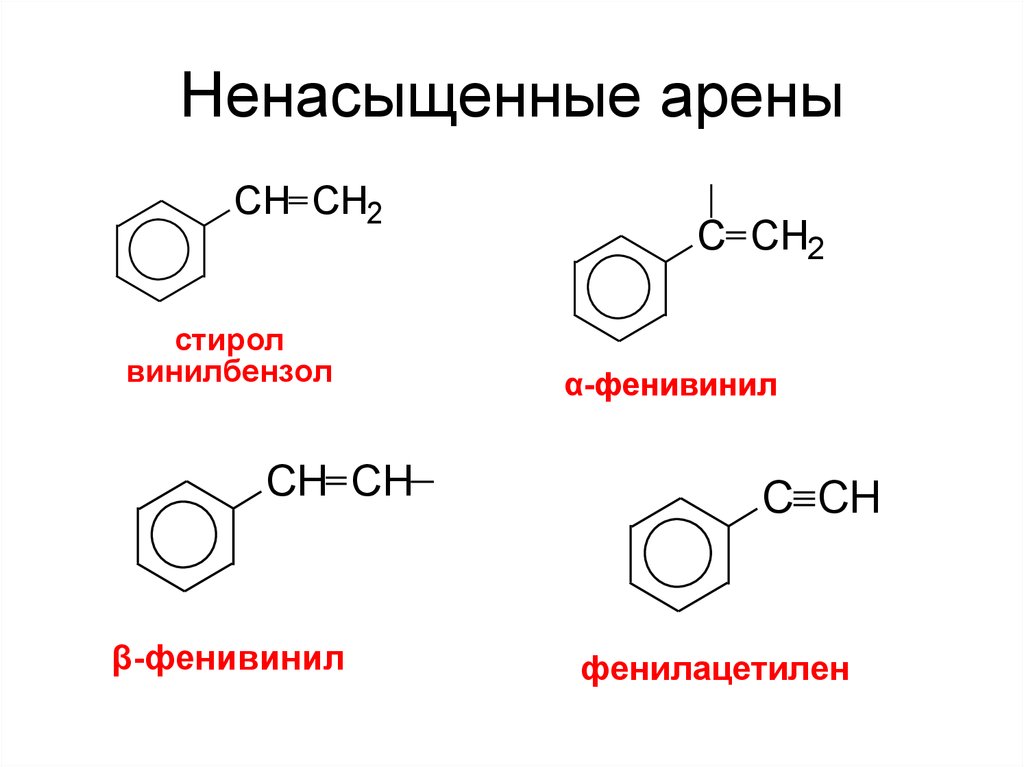
15. Ненасыщенные арены
CH CH2стирол
винилбензол
CH CH
β-фенивинил
C CH2
α-фенивинил
С CH
фенилацетилен
16. СПОСОБЫ ПОЛУЧЕНИЯ
• Ряд промышленных способов основан напереработке угля и нефти.
• Из 1 т угля в процессе коксования получают:
Продукт
Количество(кг)
Каменноугольной смолы
55
бензола
0,9
нафталина
2,3
толуола
0,2
ксилолов
0,045
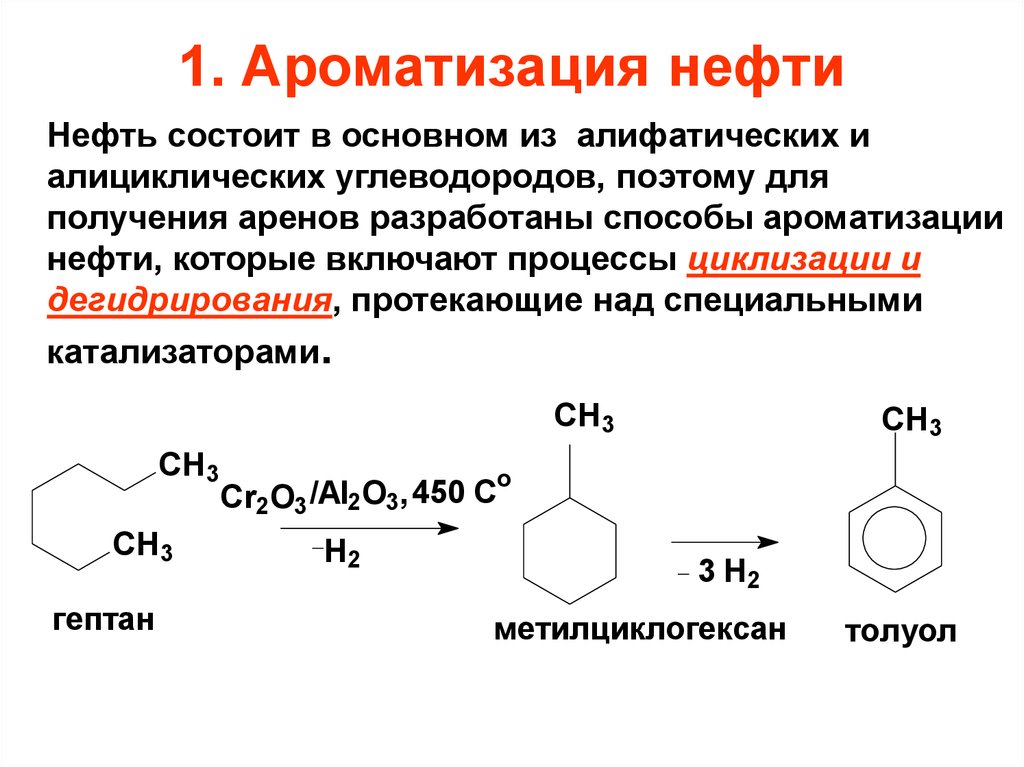
17. 1. Ароматизация нефти
Нефть состоит в основном из алифатических иалициклических углеводородов, поэтому для
получения аренов разработаны способы ароматизации
нефти, которые включают процессы циклизации и
дегидрирования, протекающие над специальными
катализаторами.
СН3
CH3
o
450
C
/Al
O
,
Cr2O3 2 3
CH3
H2
гептан
CH3
3 H2
метилциклогексан
толуол
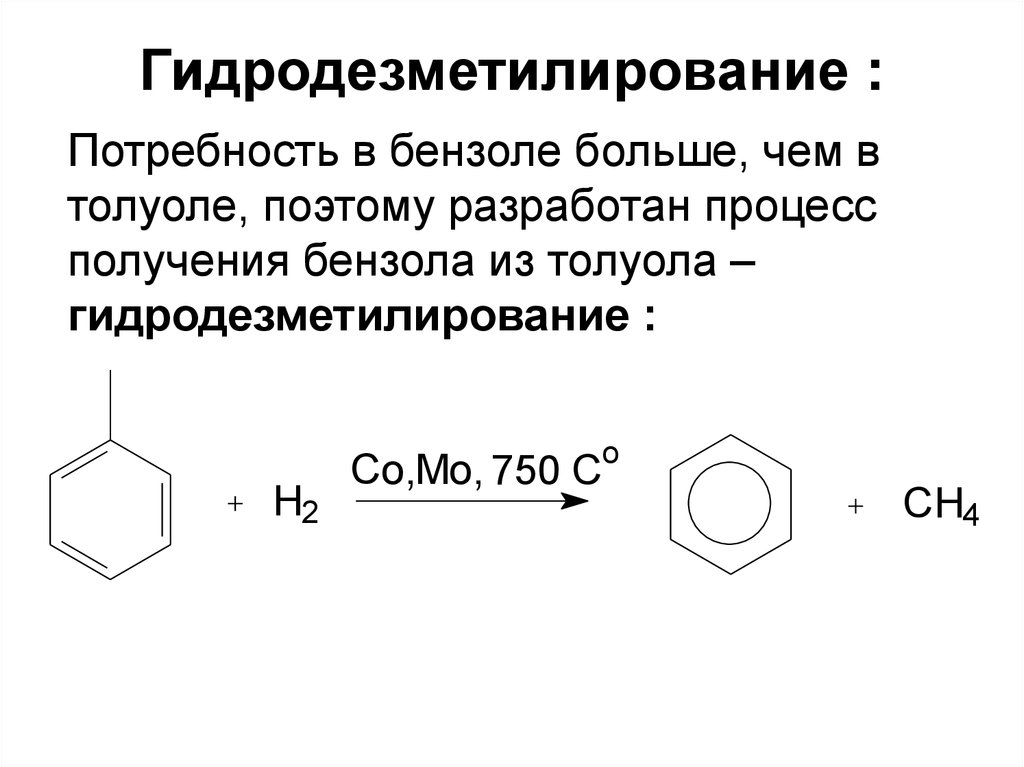
18. Гидродезметилирование :
Потребность в бензоле больше, чем втолуоле, поэтому разработан процесс
получения бензола из толуола –
гидродезметилирование :
o
H2
Co,Mo, 750 C
CH4
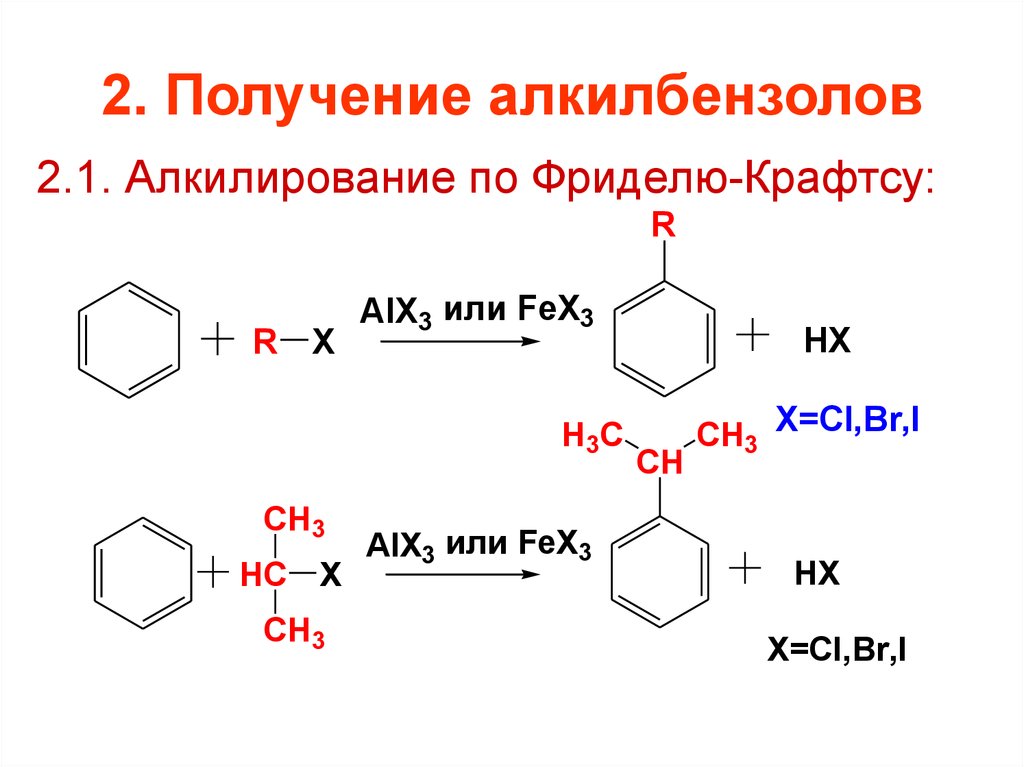
19. 2. Получение алкилбензолов
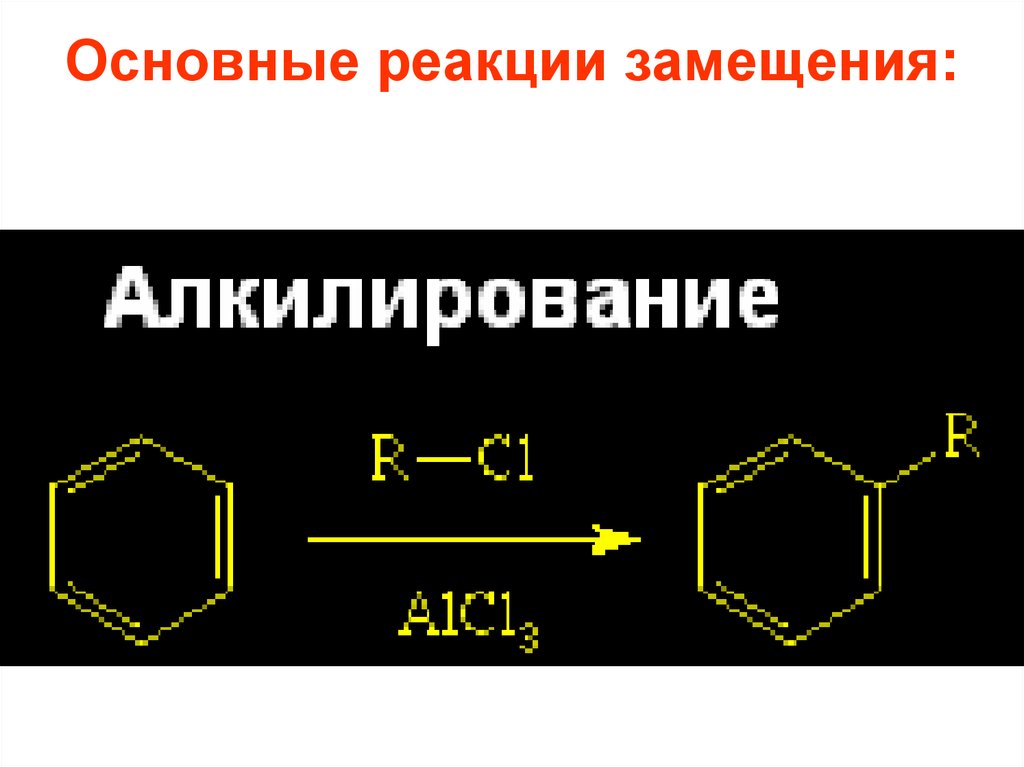
2.1. Алкилирование по Фриделю-Крафтсу:R
R X
AlX3 или FeX3
H3C
CH3
HC X
CH3
AlX3 или FeX3
HX
CH
CH3 X=Cl,Br,I
HX
X=Cl,Br,I
20.
2 C6H63 C6H6
CH2Cl2
CHCl3
AlCl3
AlCl3
o
80 C
C6H5
CH2 C6H5 2HCl
(C6H5)3CH
3HCl
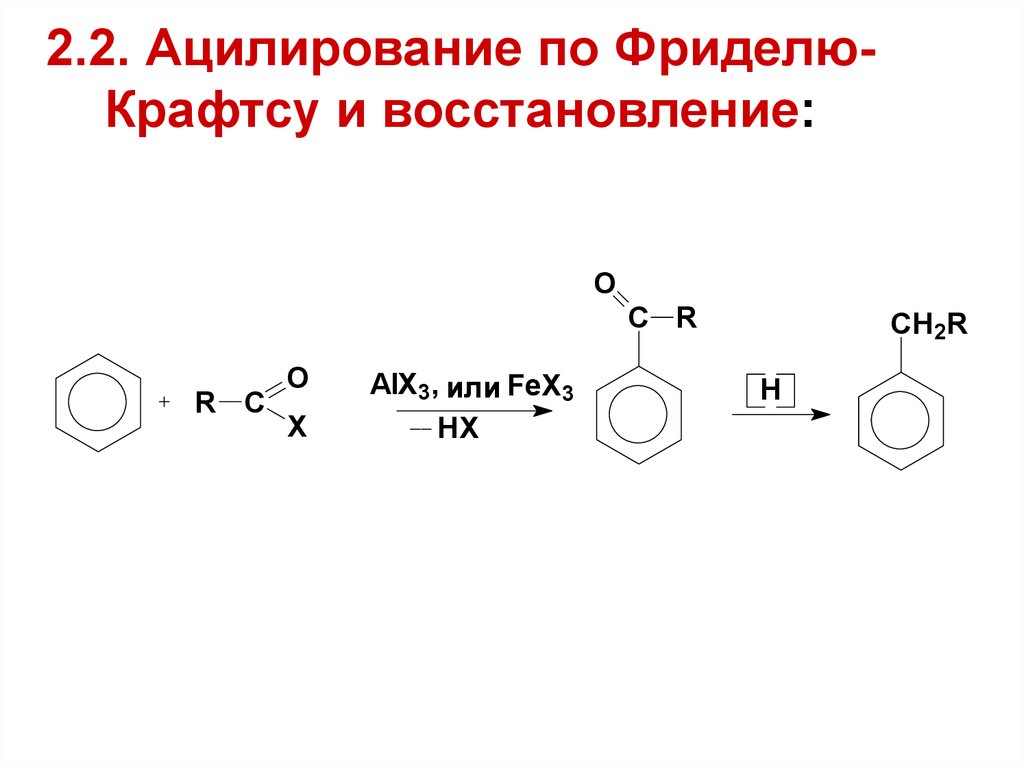
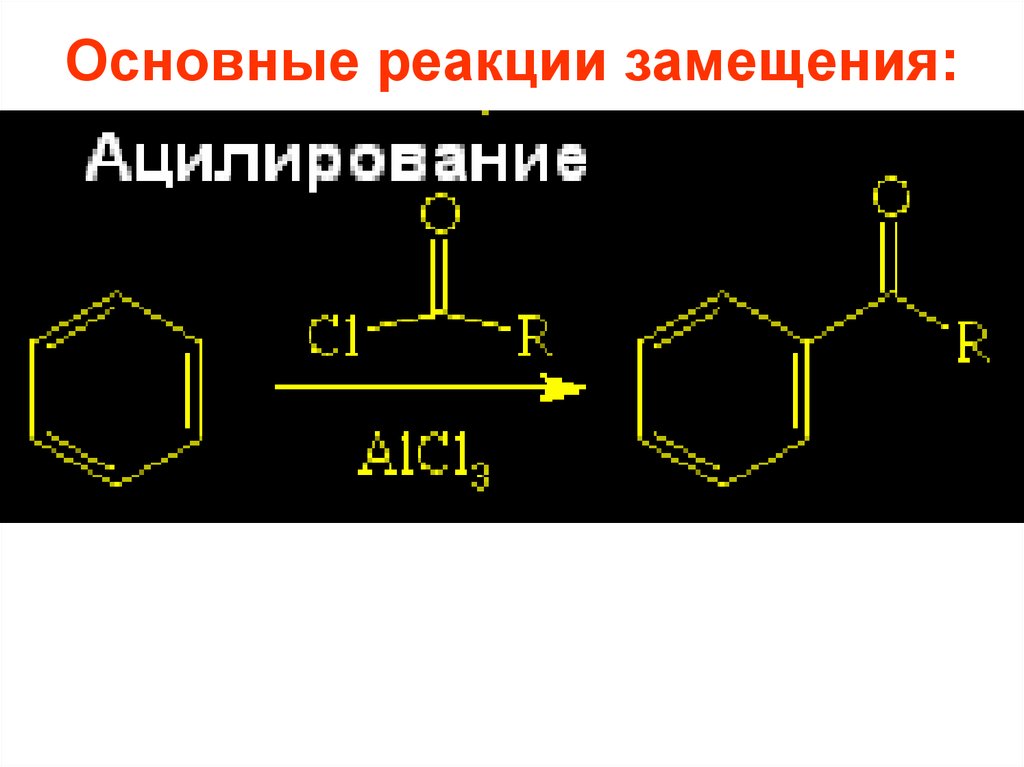
21. 2.2. Ацилирование по Фриделю-Крафтсу и восстановление:
2.2. Ацилирование по ФриделюКрафтсу и восстановление:O
C R
R C
O
X
AlX3, или FeX3
HX
CH2R
H
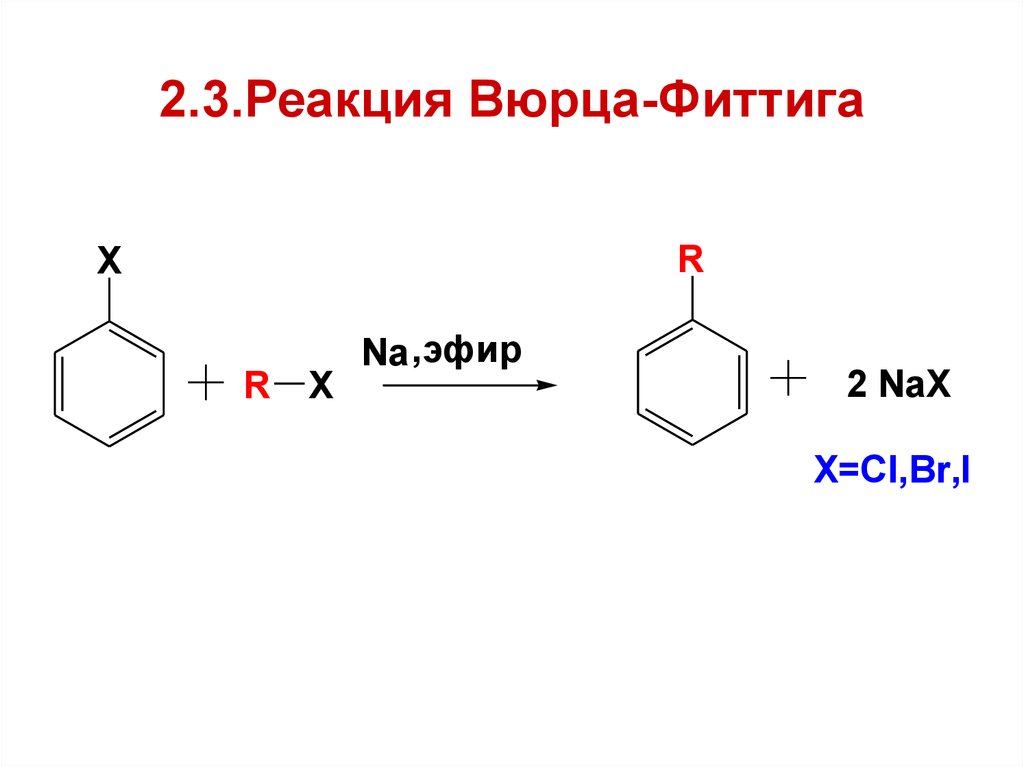
22. 2.3.Реакция Вюрца-Фиттига
RX
R
X
Na ,эфир
2 NaX
X=Cl,Br,I
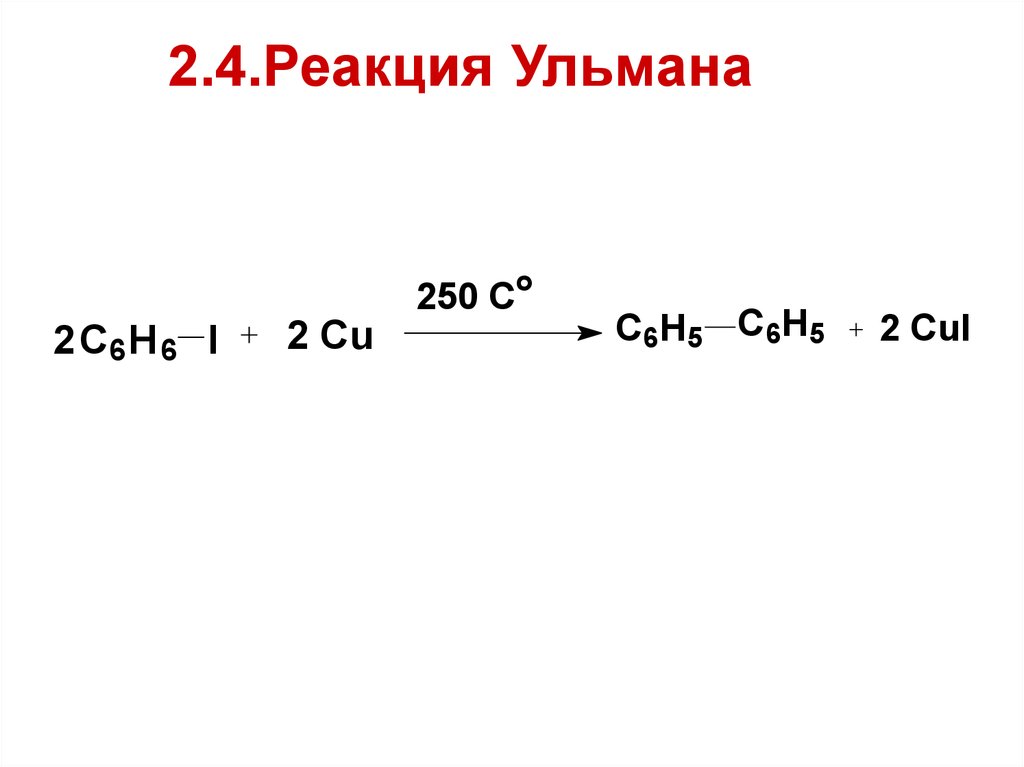
23. 2.4.Реакция Ульмана
2 C6 H 6 I2 Cu
250 Co
C6H5 C6H5
2 CuI
24. ХИМИЧЕСКИЕ СВОЙСТВА
Для аренов характерны:• Реакции электрофильного
замещения (SЕ).
• Реакции бензола с нарушением
ароматической системы.
• Реакции боковых цепей в
алкилбензолах.
25.
• Несмотря на высокую степень ненасыщенностиаренов, для них не характерны реакции
присоединения, свойственные алкенам и
алкинам.
• Ненасыщенный характер бензола не
выявляется с помощью обесцвечивания
бромной воды или реакцией Вагнера.
Наличие высокой энергии сопряжения
ароматической системы кольца
обуславливает его устойчивость, поэтому
арены вступают предпочтительно в реакции
с сохранением ароматичности, т. е. реакции
замещения.
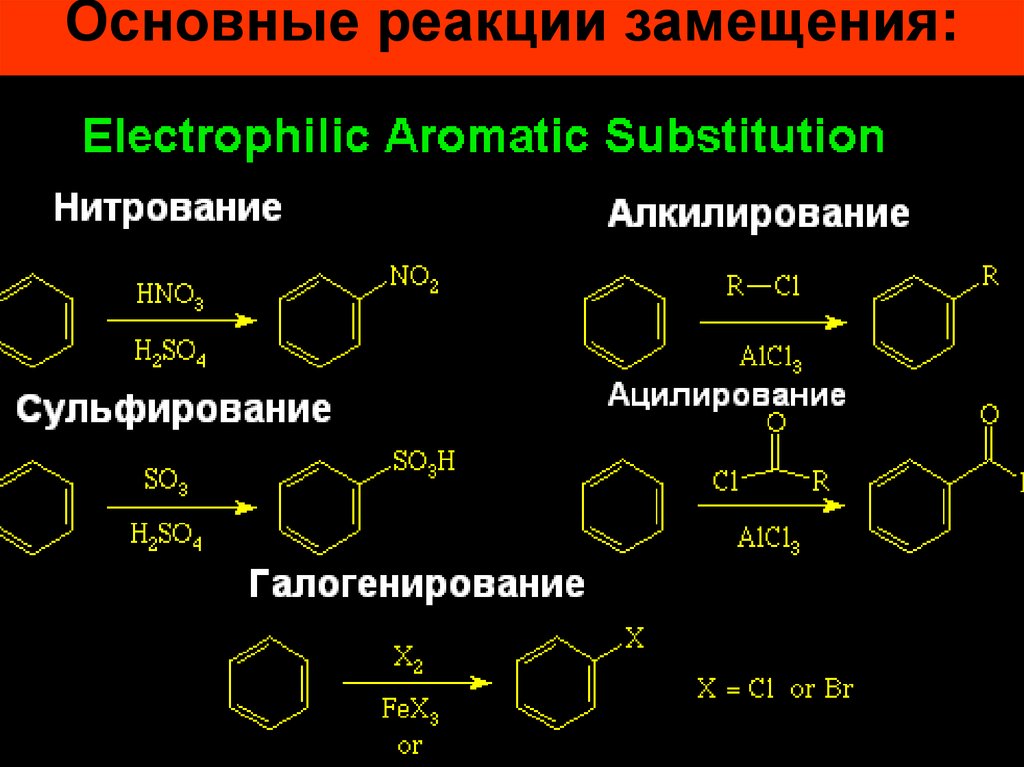
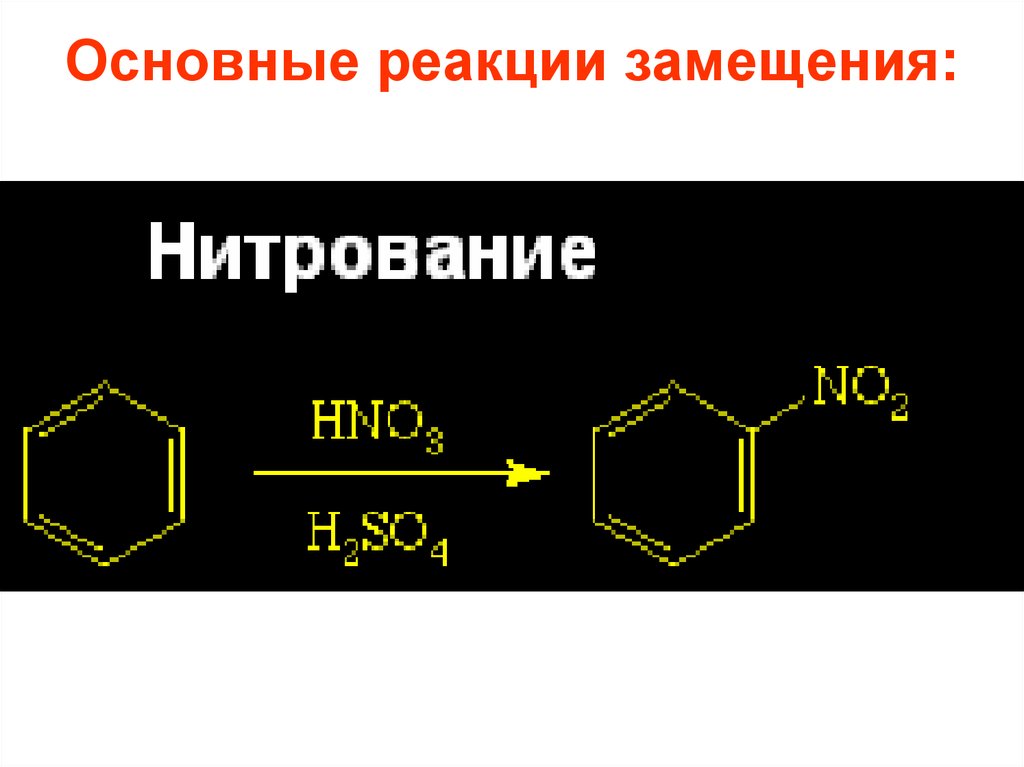
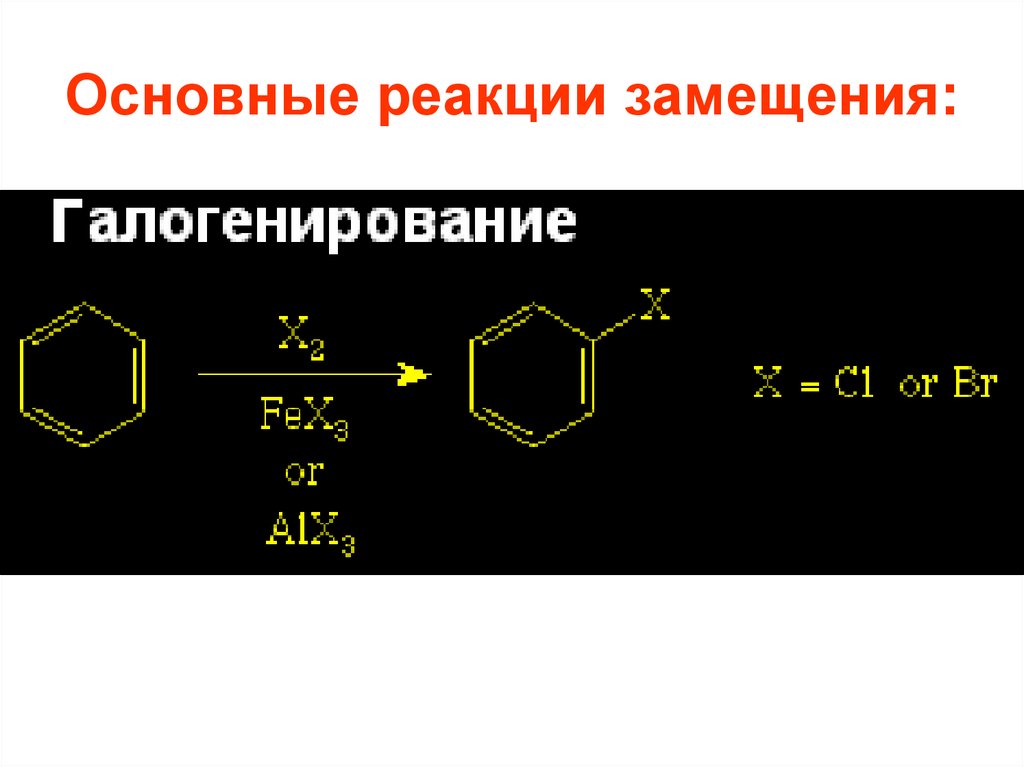
26. Основные реакции замещения:
27.
• Реакции галогенирования, нитрования исульфирования осуществляются почти
со всеми ароматическими соединениями,
• алкилирования и ацилирования – только
с соединениями, не содержащими
электроноакцепторных заместителей в
кольце.
28. Основные реакции замещения:
29. Основные реакции замещения:
30. Основные реакции замещения:
31. Основные реакции замещения:
32. Основные реакции замещения:
33. МЕХАНИЗМ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SЕ).
( См. Учебник. С. 195-199).Стадии реакции:
1. Активация реагента
2. Стадия электрофильной атаки:
а) образование π-аддукта;
б) образование σ-аддукта.
3. Стадия отщепления протона.
34. МЕХАНИЗМ (SЕ).
быстроE
активная
π-аддукт
субстрат форма
электрофила
E
медленно
1/3
E
H
E
быстро
1/3
1/3
δ-аддукт
H
продукт
реакции
35. ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И НАПРАВЛЕНИЕ SE ( См. Учебник. С. 199-206).
Заместители в бензольном кольце нарушаютравномерность распределения π-электронного
облака и оказывают влияние на его
реакционную способность.
Если бензольное кольцо содержит заместитель
Х, то положения, остающиеся свободными,
неравноценны. В общем случае замещение Н в
монозамещенных бензолах может протекать в
трёх направлениях:
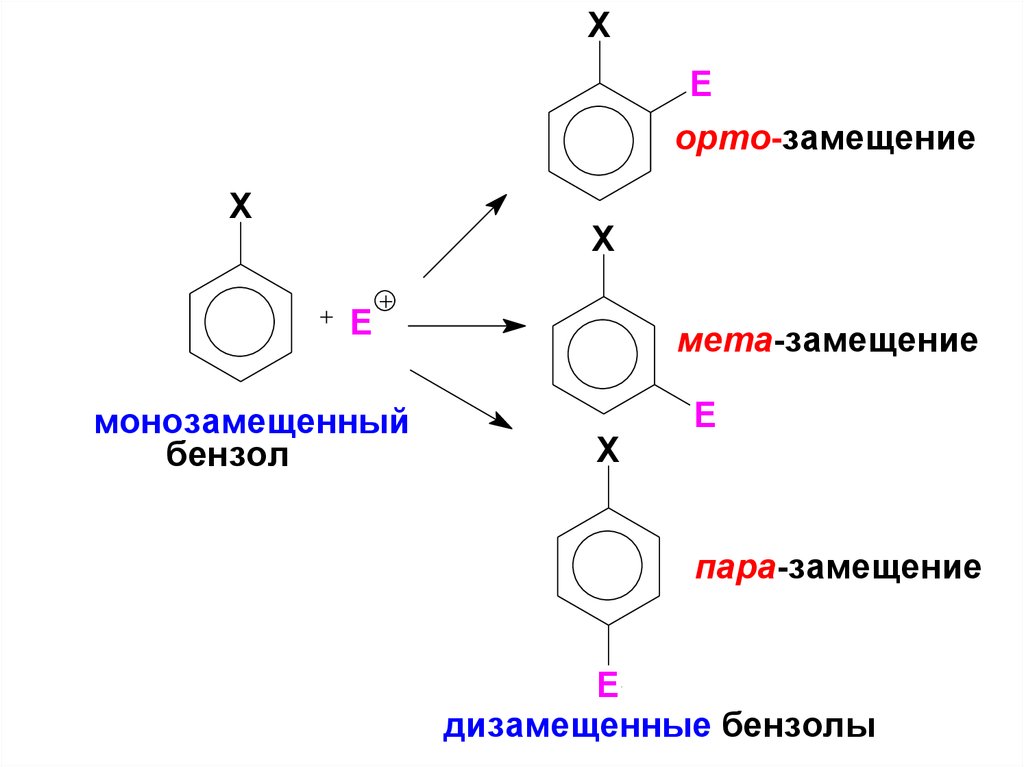
36.
XE
орто-замещение
X
X
E
монозамещенный
бензол
мета-замещение
X
E
пара-замещение
E
дизамещенные бензолы
37.
• При рассмотрении таких реакций надорешать два важных вопроса:
• Какие изомеры преимущественно
образуются в результате замещения, т.е.
каково ориентирующее влияние Х?
• В каком случае выше скорость реакции: в
бензоле С6Н6 или в замещенном бензоле
С6Н5Х, то есть какова относительная
реакционная способность?
38. Правила ориентации в монозамещенных аренах
• По влиянию на ориентацию в SEреакциях все заместители делятся,
на орто-, пара- и мета-ориентанты,
при этом заместители в бензольном
кольце по отношению к реакциям SE
в бензоле могут выступать как
активирующие и дезактивирующие.
39.
• Ориентирующее влияние заместителейобусловлено их электронными
эффектами (статический фактор) и
стабильностью промежуточно
образующихся аренониевых ионов σаддуктов (динамический фактор).
40.
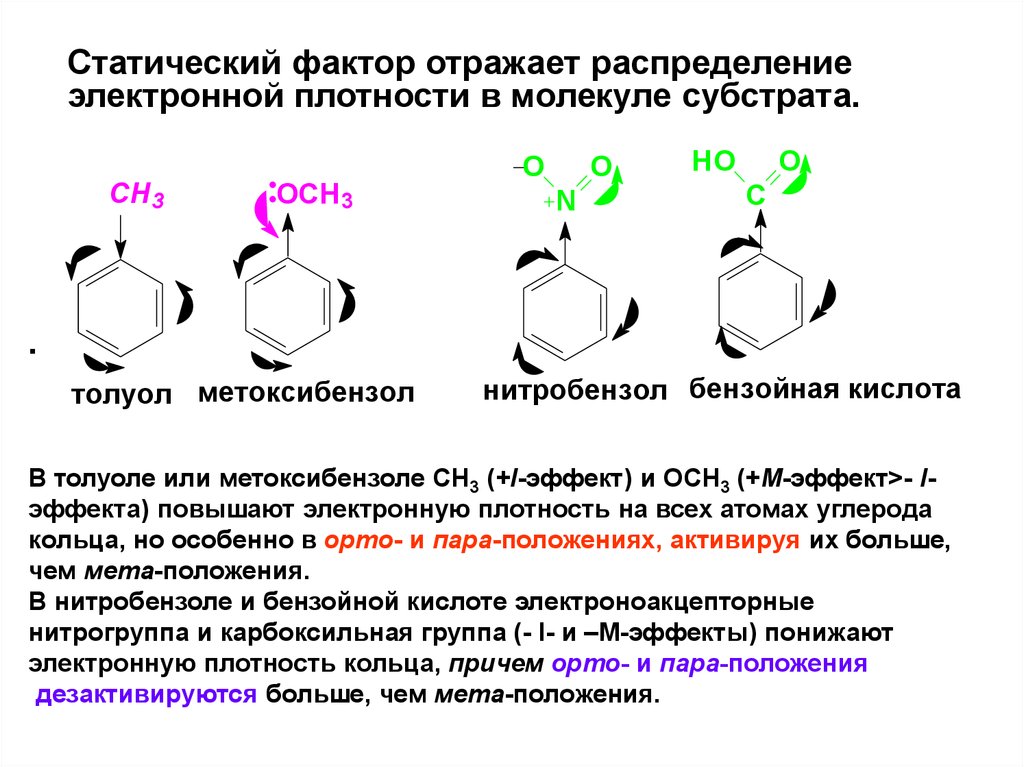
Статический фактор отражает распределениеэлектронной плотности в молекуле субстрата.
CH3
OCH3
O
O
N
HO
O
C
.
толуол метоксибензол
нитробензол бензойная кислота
В толуоле или метоксибензоле СН3 (+I-эффект) и ОСН3 (+М-эффект>- Iэффекта) повышают электронную плотность на всех атомах углерода
кольца, но особенно в орто- и пара-положениях, активируя их больше,
чем мета-положения.
В нитробензоле и бензойной кислоте электроноакцепторные
нитрогруппа и карбоксильная группа (- I- и –М-эффекты) понижают
электронную плотность кольца, причем орто- и пара-положения
дезактивируются больше, чем мета-положения.
41.
Динамический фактор, то естьстабилизирующее или дестабилизирующее
влияние заместителя на образующиеся в ходе
реакции аренониевые ионы, имеет важнейшее
значение. Заместители оказывают различное
влияние на энергию активации трех возможных
переходных состояний. Дезактивирующие
заместители дестабилизируют σ-аддукт и
увеличивают энергию активации стадии,
приводящей к его образованию. Группы,
активирующие бензольное кольцо,
стабилизируют σ-аддукт и снижают его
энергию и энергию активации образования σаддукта
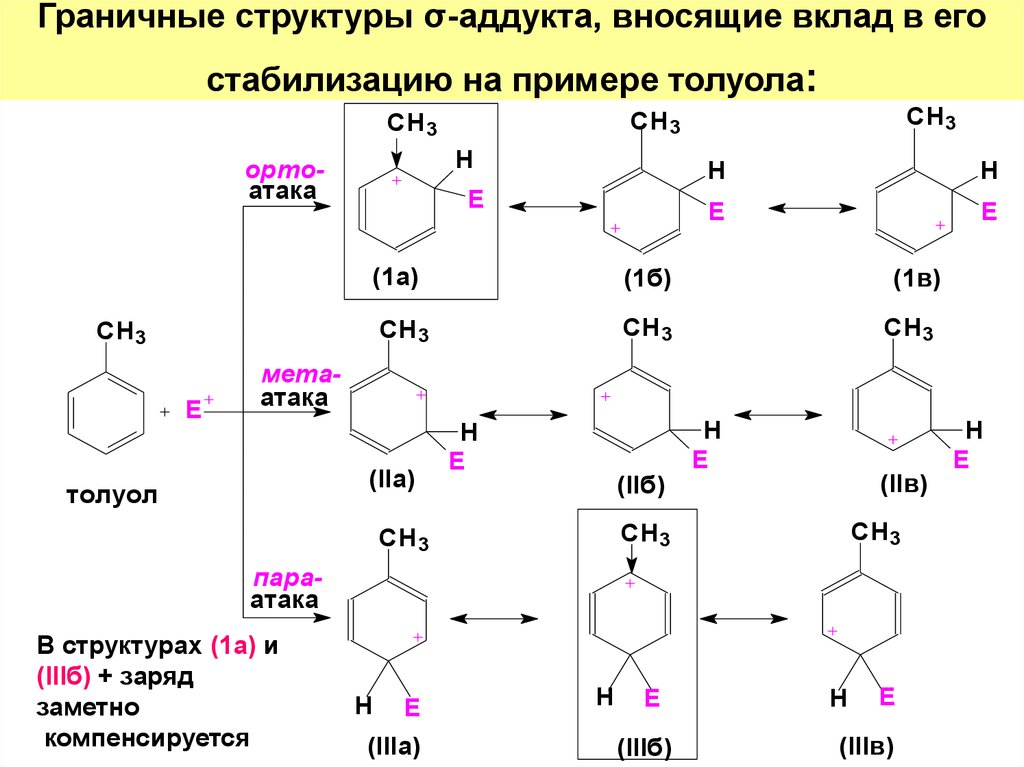
42. Граничные структуры σ-аддукта, вносящие вклад в его стабилизацию на примере толуола:
Hортоатака
E
(1а)
(1б)
СH 3
СH3
CH3
E
CH3
CH 3
СH3
H
H
E
E
(1в)
СH3
метаатака
(IIa)
толуол
H
E
(IIб)
H
E
(IIв)
CH3
СH3
CH 3
параатака
В структурах (1а) и
(IIIб) + заряд
заметно
компенсируется
H
E
(IIIa)
H
E
(IIIб)
H
E
(IIIв)
H
E
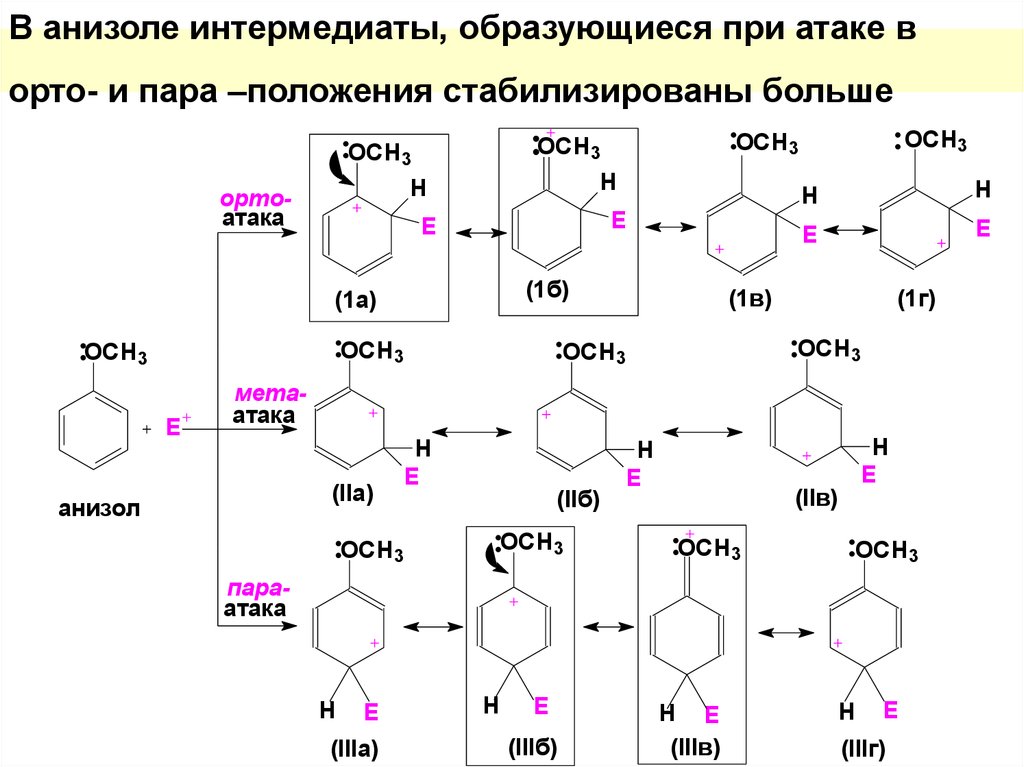
43. В анизоле интермедиаты, образующиеся при атаке в орто- и пара –положения стабилизированы больше
HH
ортоатака
E
E
(1б)
(1а)
OСH3
OCH3
E
OCH3
OCH3
OСH3
OСH3
H
H
E
E
(1в)
(1г)
OСH3
OСH3
метаатака
(IIa)
анизол
H
E
(IIб)
OСH3
OCH3
H
E
H
E
(IIв)
OСH3
OCH3
параатака
H
E
(IIIa)
H
E
(IIIб)
H E
(IIIв)
H
E
(IIIг)
44. Электроноакцепторные заместители дестабилизируют все три возможных σ-аддукта,но σ-аддукт, возникающий при атаке в мета положение, дестаби
Электроноакцепторные заместители дестабилизируютвсе три возможных σ-аддукта,но σ-аддукт, возникающий
при атаке в мета положение, дестабилизирован меньше.
O
O
O
H
ортоатака
E
(1а)
O
O
N
E
O
O
N
метаатака
нитробензол
(IIa)
O
O
H
E
H
O
N
H
H
E
E
(1б)
O
N
(IIб)
O
N
параатака
O
N
N
O
O
O
(1в)
O
N
H
E
(IIв)
O
O
N
N
E
(IIIa)
H
E
(IIIб)
O
H
E
(IIIв)
H
E
45.
• По влиянию статических идинамических факторов на
реакционную способность и
ориентацию в реакциях
электрофильного замещения
заместители можно разделить на
следующие типы:
46.
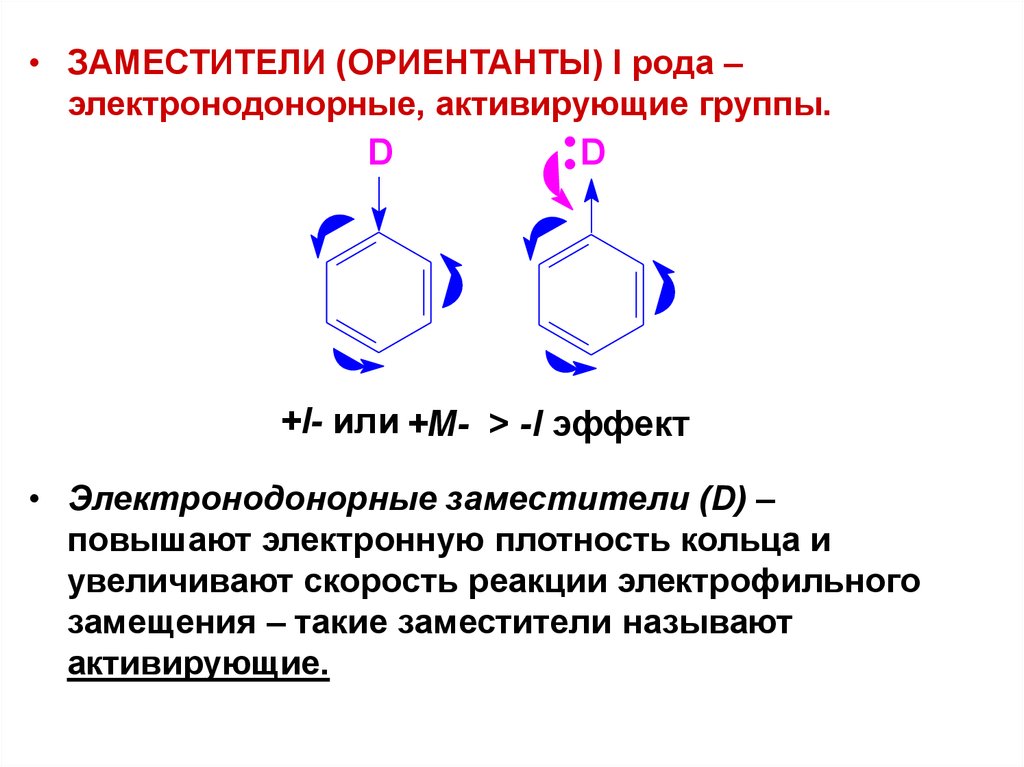
• ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) I рода –электронодонорные, активирующие группы.
D
D
+I- или +М- > -I эффект
• Электронодонорные заместители (D) –
повышают электронную плотность кольца и
увеличивают скорость реакции электрофильного
замещения – такие заместители называют
активирующие.
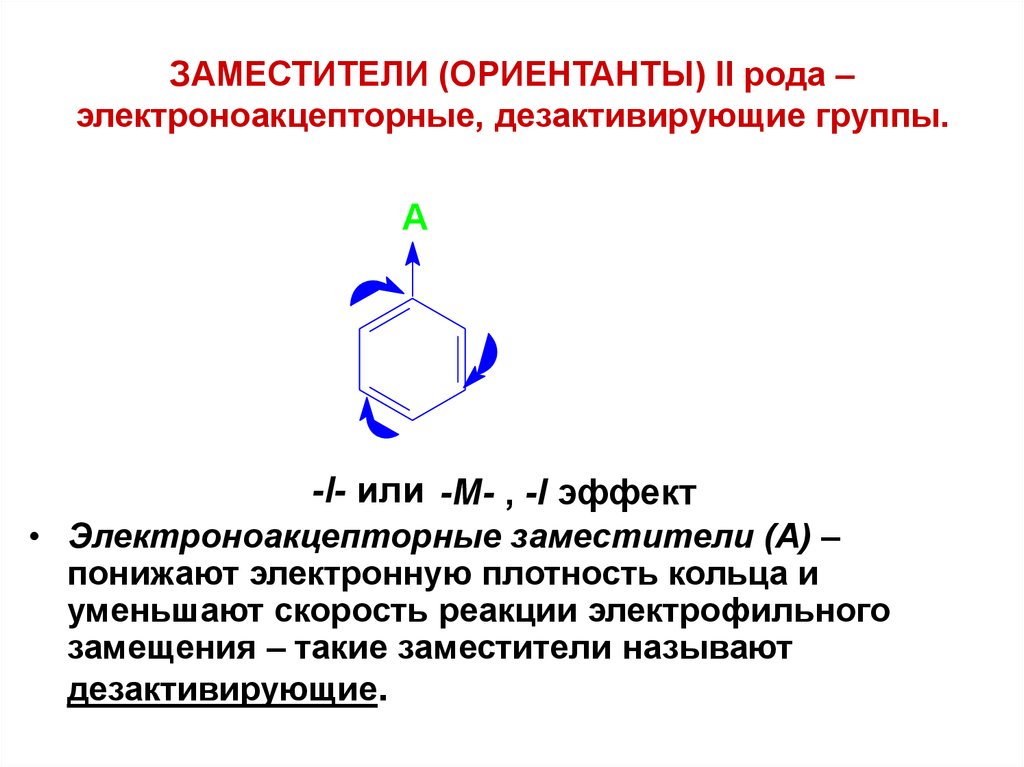
47. ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) II рода – электроноакцепторные, дезактивирующие группы.
A-I- или -М- , -I эффект
• Электроноакцепторные заместители (А) –
понижают электронную плотность кольца и
уменьшают скорость реакции электрофильного
замещения – такие заместители называют
дезактивирующие.
48.
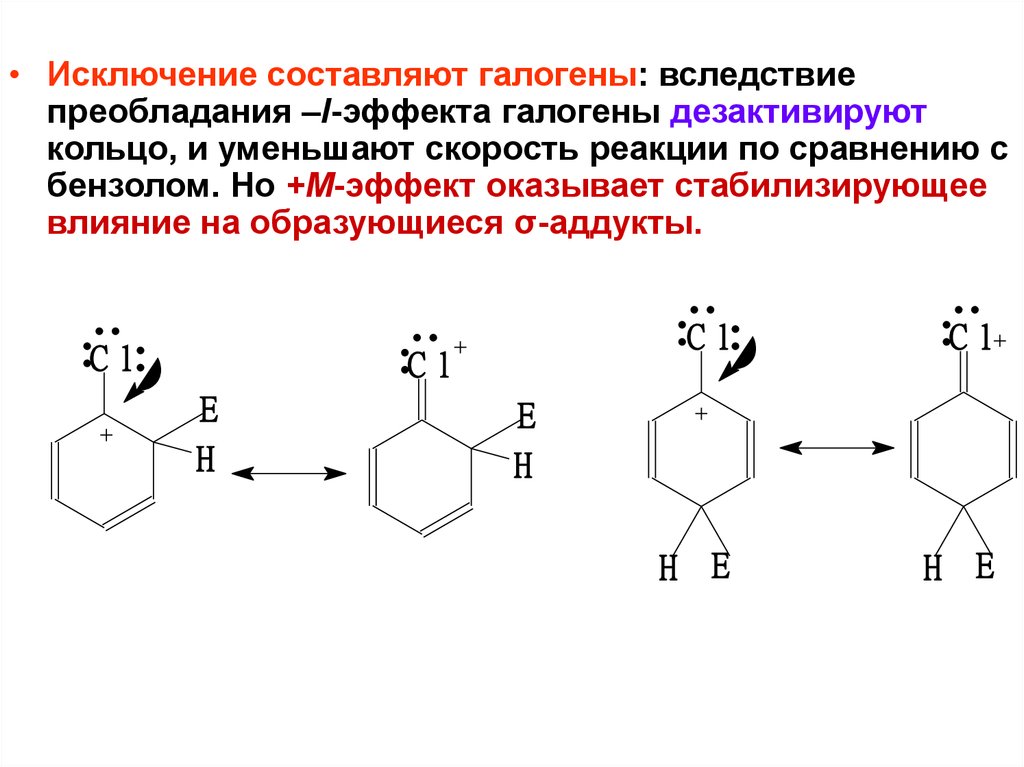
• Исключение составляют галогены: вследствиепреобладания –I-эффекта галогены дезактивируют
кольцо, и уменьшают скорость реакции по сравнению с
бензолом. Но +М-эффект оказывает стабилизирующее
влияние на образующиеся σ-аддукты.
Cl
Cl
Cl
E
H
Cl
E
H
H
E
H
E
49. ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ В БЕНЗОЛЬНОМ ЯДРЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ И ОРИЕНТАЦИЮ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
ЗаместителиТип
эффекта
Влияние на
реакц.
способность
Заместители I рода:
-NH2, -NHR,-NR2,-OH
-O-
+M>>-I
+M,+I
+++
+++
-NHCOR,-OR
+M>-I
++
-CH3 и другие
алкильные группы
-С6Н5,-СH=CH2
+I
-F,-Cl,-Br,-I
+M>-I
-I>+M
+
+
-
Преобладающее
ориентирующее
действие
орто- и
пара-
50.
ЗаместителиТип
эффекта
Влияние на
реакц.
способность
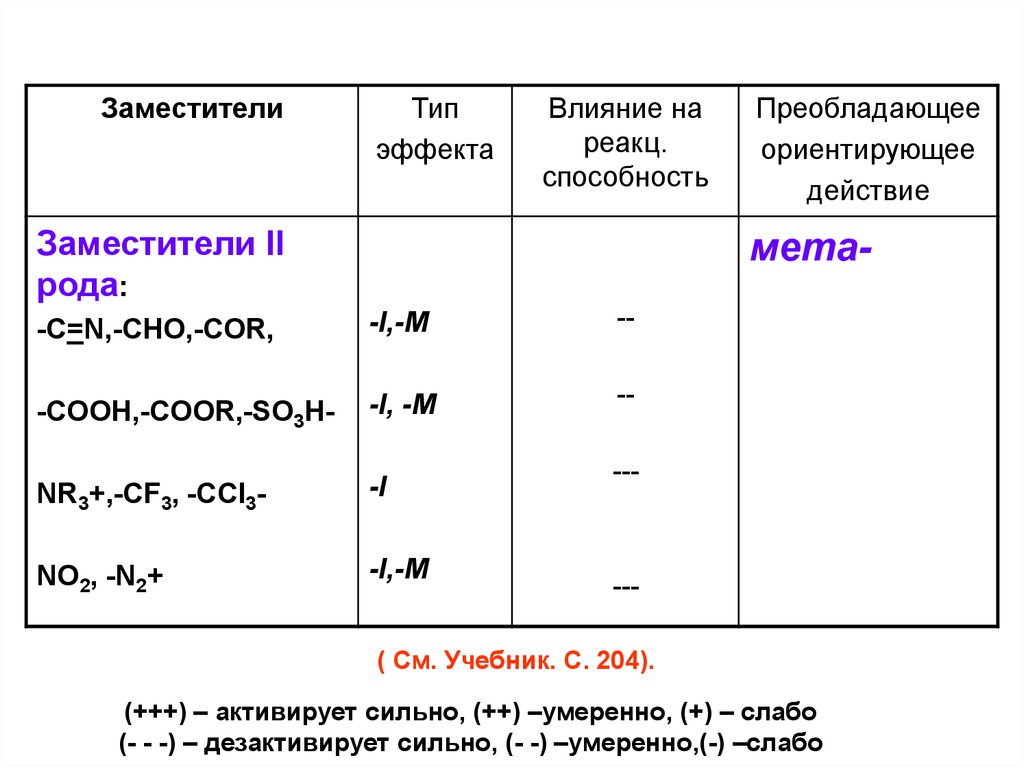
Заместители II
рода:
Преобладающее
ориентирующее
действие
мета-
-C=N,-CHO,-COR,
-I,-M
--
-COOH,-COOR,-SO3H-
-I, -M
--
NR3+,-CF3, -CCl3-
-I
NO2, -N2+
-I,-M
---
---
( См. Учебник. С. 204).
(+++) – активирует сильно, (++) –умеренно, (+) – слабо
(- - -) – дезактивирует сильно, (- -) –умеренно,(-) –слабо
51.
• Правила ориентации позволяютпредсказать преимущественное
направление реакции и преобладание
того или иного изомера в продуктах
реакции. В большинстве случаев
содержаться все три. Когда присутствует
заместитель 1 рода, чаще образуется
большее количество пара-изомера из-за
стерического фактора.
52. Правила ориентации в дизамещенных аренах
• В дизамещенных производных бензолаориентирующее влияние заместителей будет
согласованным, если заместители направляют
электрофильный реагент в одни и те же положения
кольца. Примеры согласованной ориентации:
OH
CH3
COOH
NHCOCH3
CN
SO3H
NO2
SO3H
OH
OH
HBr
Br2
NO2
NO2
Br
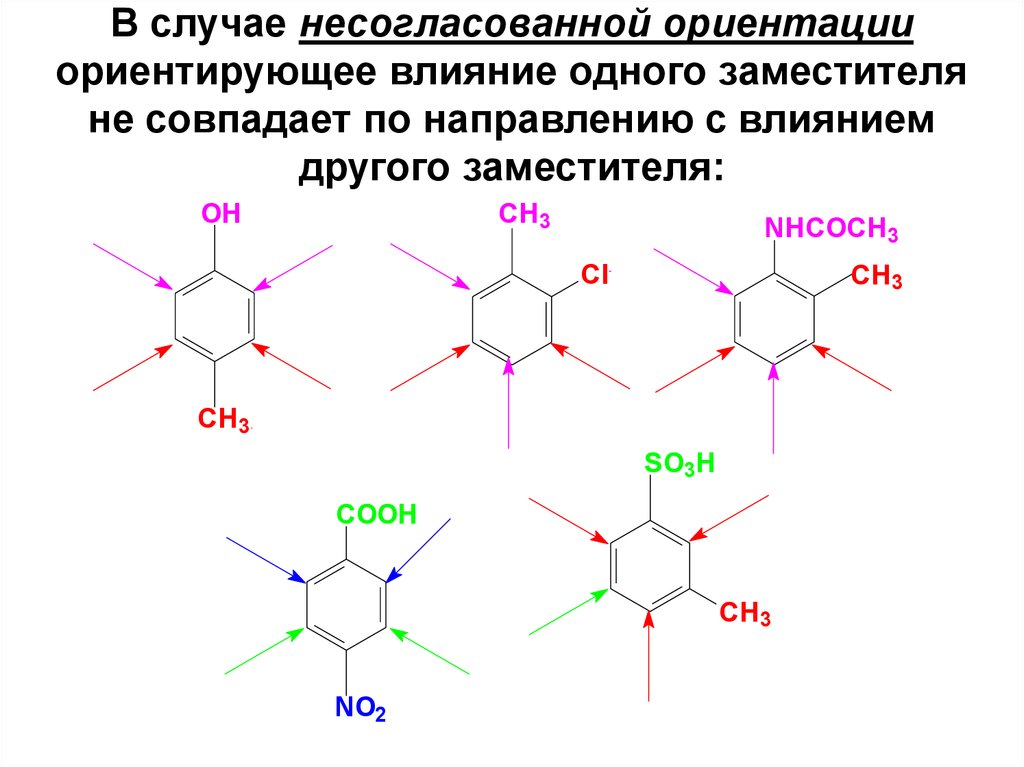
53. В случае несогласованной ориентации ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя
В случае несогласованной ориентацииориентирующее влияние одного заместителя
не совпадает по направлению с влиянием
другого заместителя:
OH
CH3
NHCOCH3
Cl
CH3
CH3
SO3H
COOH
CH3
NO2
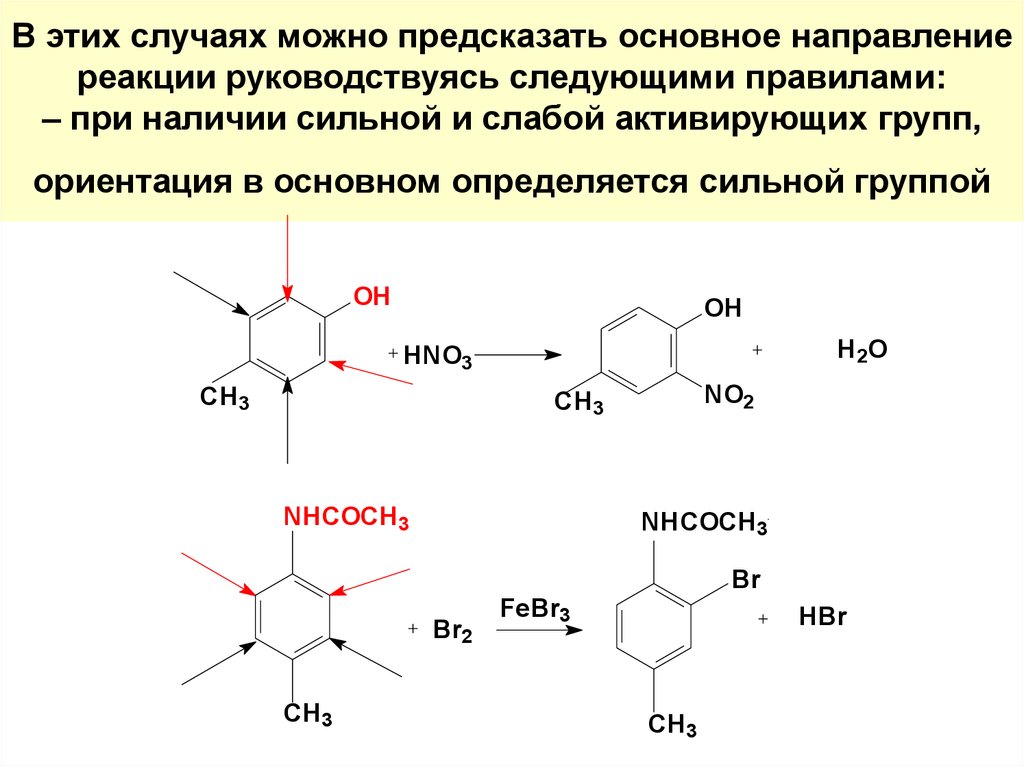
54. В этих случаях можно предсказать основное направление реакции руководствуясь следующими правилами: – при наличии сильной и слабой активи
В этих случаях можно предсказать основное направлениереакции руководствуясь следующими правилами:
– при наличии сильной и слабой активирующих групп,
ориентация в основном определяется сильной группой
OH
OH
H2O
HNO3
CH3
NO2
CH3
NHCOCH3
NHCOCH3
Br
Br2
CH3
FeBr3
HBr
CH3
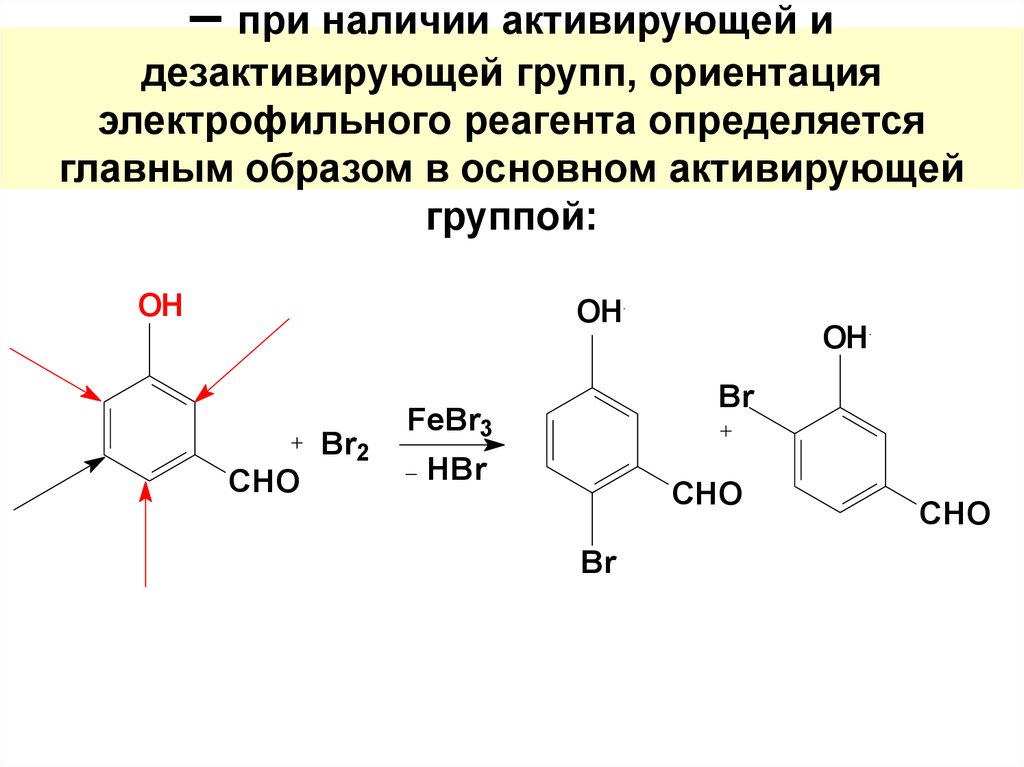
55. – при наличии активирующей и дезактивирующей групп, ориентация электрофильного реагента определяется главным образом в основном активир
– при наличии активирующей идезактивирующей групп, ориентация
электрофильного реагента определяется
главным образом в основном активирующей
группой:
OH
OH
Br2
CHO
OH
Br
FeBr3
HBr
CHO
Br
CHO
56.
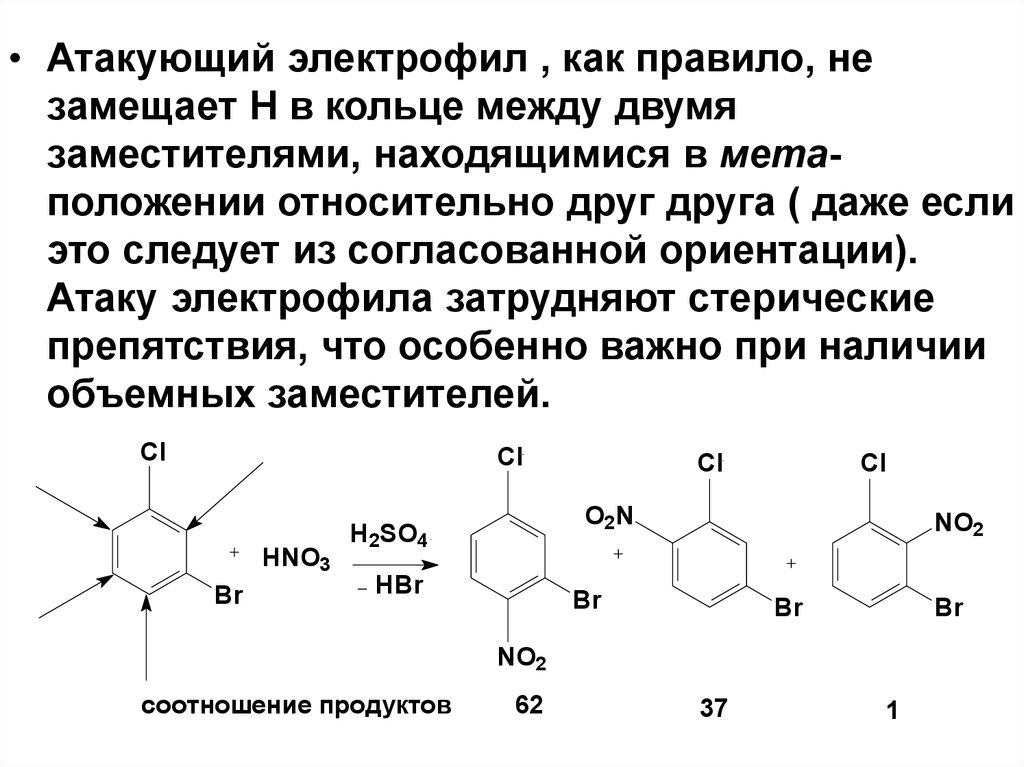
• Атакующий электрофил , как правило, незамещает Н в кольце между двумя
заместителями, находящимися в метаположении относительно друг друга ( даже если
это следует из согласованной ориентации).
Атаку электрофила затрудняют стерические
препятствия, что особенно важно при наличии
объемных заместителей.
Cl
Cl
HNO3
Br
Cl
Cl
O2N
H2SO4
HBr
NO2
Br
Br
Br
NO2
соотношение продуктов
62
37
1
57. Важнейшие реакции SE
– 1.1. Галогенирование.Бензол реагирует с Cl2 и Br2 в присутствии Kt
: безводных галогенидов Аl (AlCl3 , AlBr3) Fe
(FeCl3 , FeBr3), Sn (SnCl4) и Ti(TiCl4).
Другие галoгенирующие агенты: Cl-Cl<
AgClO4; хлорноватистая и бромноватистая
кислоты в кислой среде HOBr, HClO.
Прямое фторирование можно осуществить F2
(разбавленным азотом) при -70оС.
В реакциях I2 реагирует только с активными
аренами – анилин, фенол в щелочной среде.
Для иодирования других aренов используют
I-Cl или I2/AgClO4.
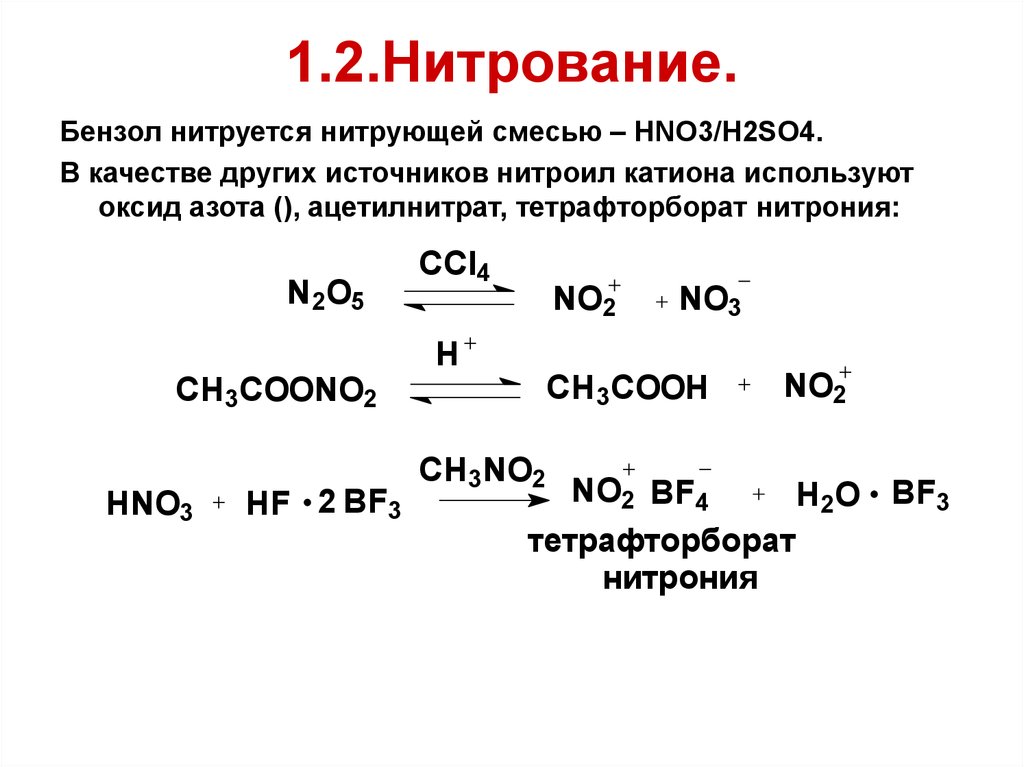
58. 1.2.Нитрование.
Бензол нитруется нитрующей смесью – HNO3/H2SO4.В качестве других источников нитроил катиона используют
оксид азота (), ацетилнитрат, тетрафторборат нитрония:
N2O5
CCl4
NO2
NO3
H
CH3COOH
CH3COONO2
HNO3
HF 2 BF3
CH3NO2
NO2
NO2 BF4
H2O BF3
тетрафторборат
нитрония
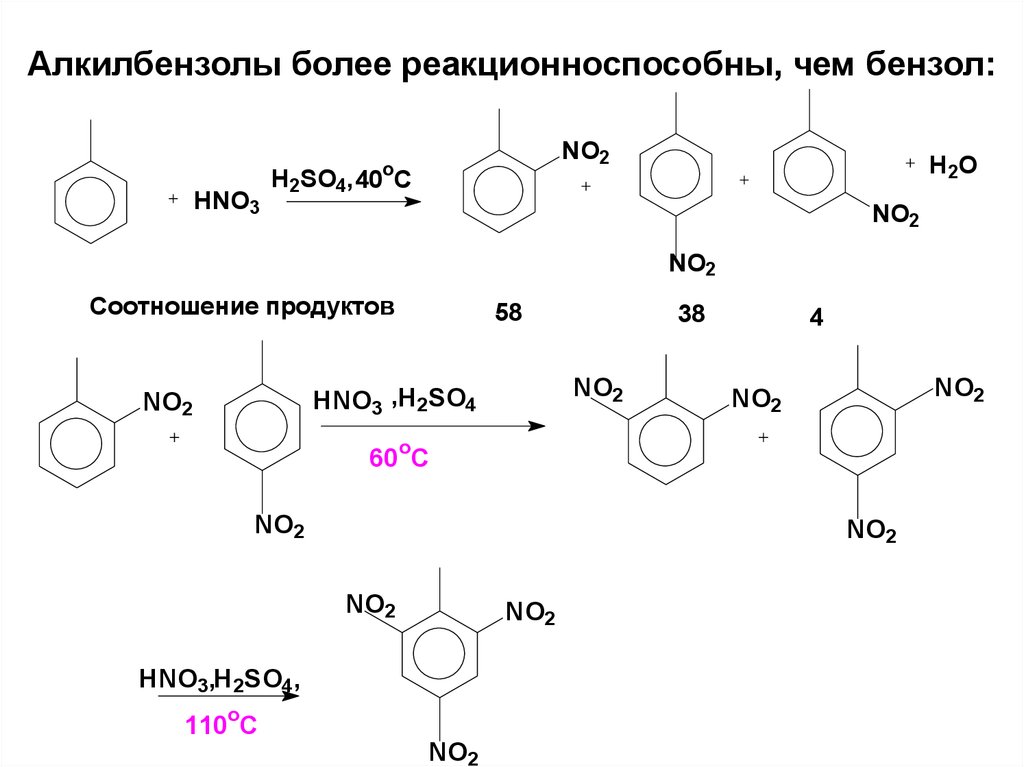
59. Алкилбензолы более реакционноспособны, чем бензол:
NO2o
HNO3
H2O
H2SO4,40 C
NO2
NO2
Соотношение продуктов
58
NO2
HNO3 ,H2SO4
NO2
38
4
NO2
NO2
o
60 C
NO2
NO2
NO2
NO2
HNO3,H2SO4,
110oC
NO2
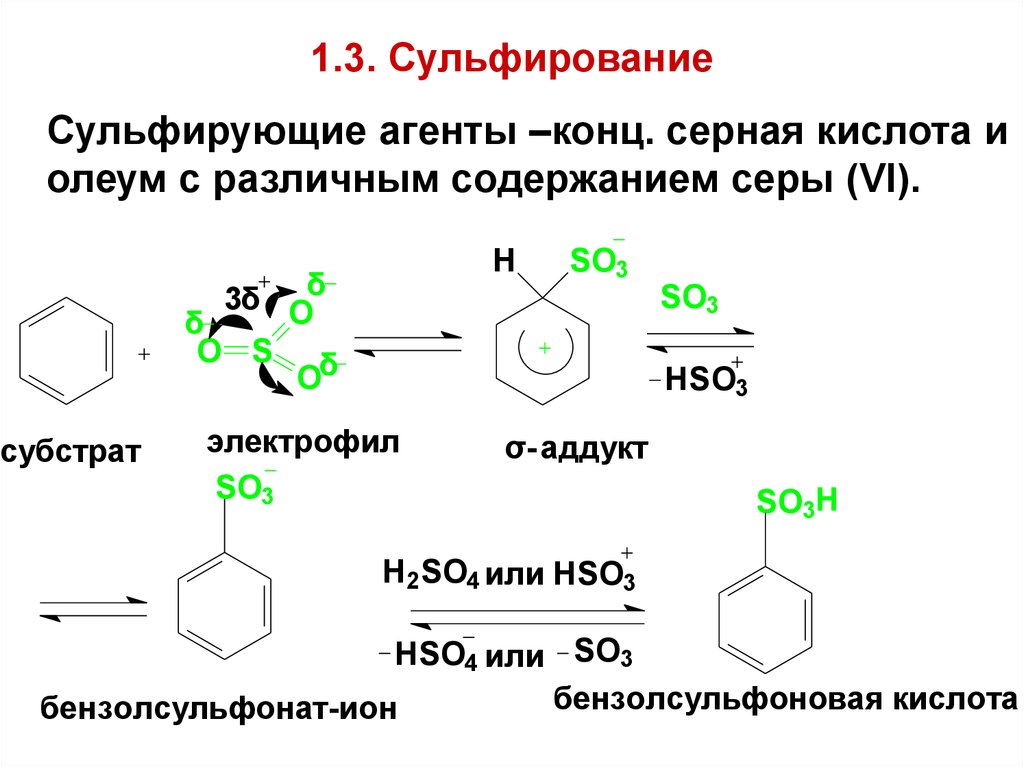
60. 1.3. Сульфирование
Сульфирующие агенты –конц. серная кислота иолеум с различным содержанием серы (VI).
H
3δ Oδ
δ
O S δ
O
субстрат
SO3
SO3
HSO3
электрофил
SO3
σ- аддукт
SO3H
H2SO4 или HSO3
HSO4 или SO3
бензолсульфоновая кислота
бензолсульфонат-ион
61. Каждая стадия сульфирования обратима и в целом весь процесс тоже обратимый. При обработке бензолсульфоновой кислоты перегретым водяным п
Каждая стадия сульфирования обратима и вцелом весь процесс тоже обратимый. При
обработке бензолсульфоновой кислоты
перегретым водяным паром происходит
обратная реакция – десульфирование:
SO3H
H2O
120-150oC
бензолсульфоновая кислота
H2SO4
62.
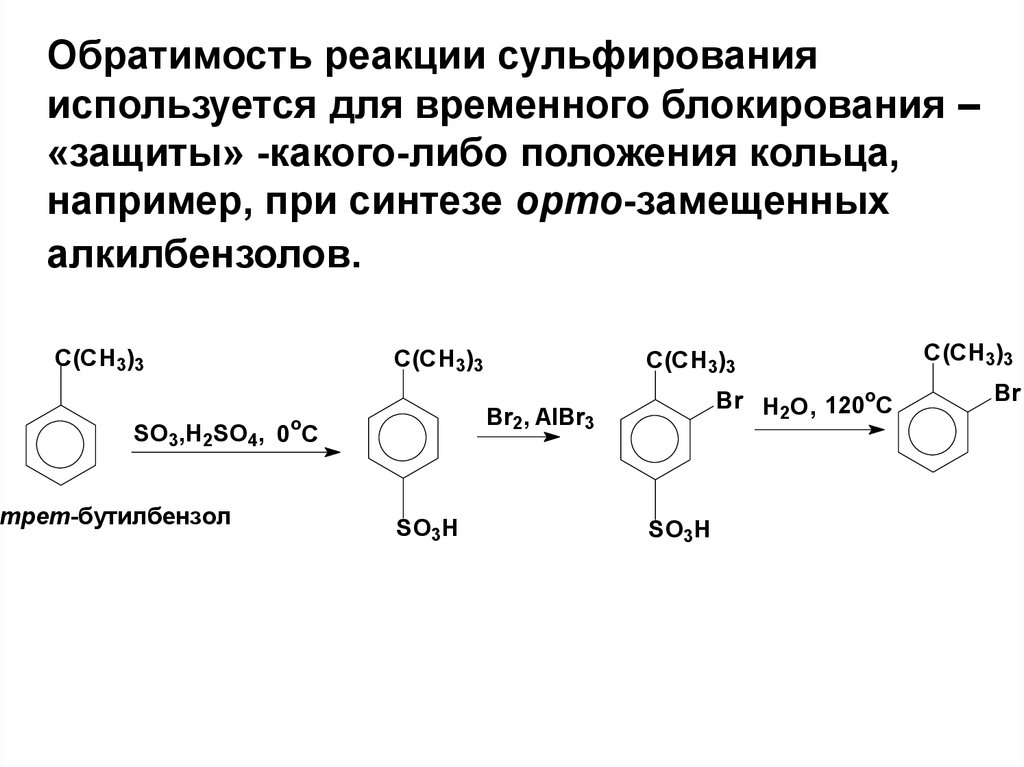
Обратимость реакции сульфированияиспользуется для временного блокирования –
«защиты» -какого-либо положения кольца,
например, при синтезе орто-замещенных
алкилбензолов.
C(CH3)3
C(CH3)3
Br H2O, 120oC
Br2, AlBr3
SO3,H2SO4, 0oC
трет-бутилбензол
C(CH3)3
SO3H
SO3H
C(CH3)3
Br
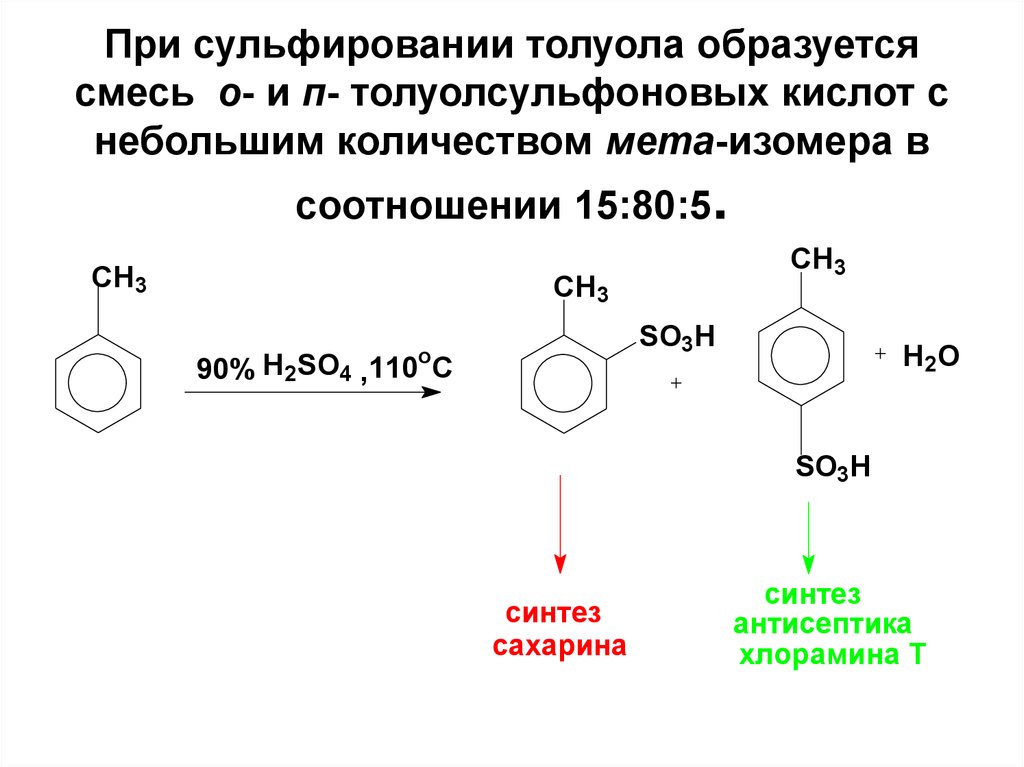
63. При сульфировании толуола образуется смесь о- и п- толуолсульфоновых кислот с небольшим количеством мета-изомера в соотношении 15:80:5.
CH3CH3
CH3
SO3H
o
90% H2SO4 , 110 C
H2O
SO3H
синтез
сахарина
синтез
антисептика
хлорамина Т
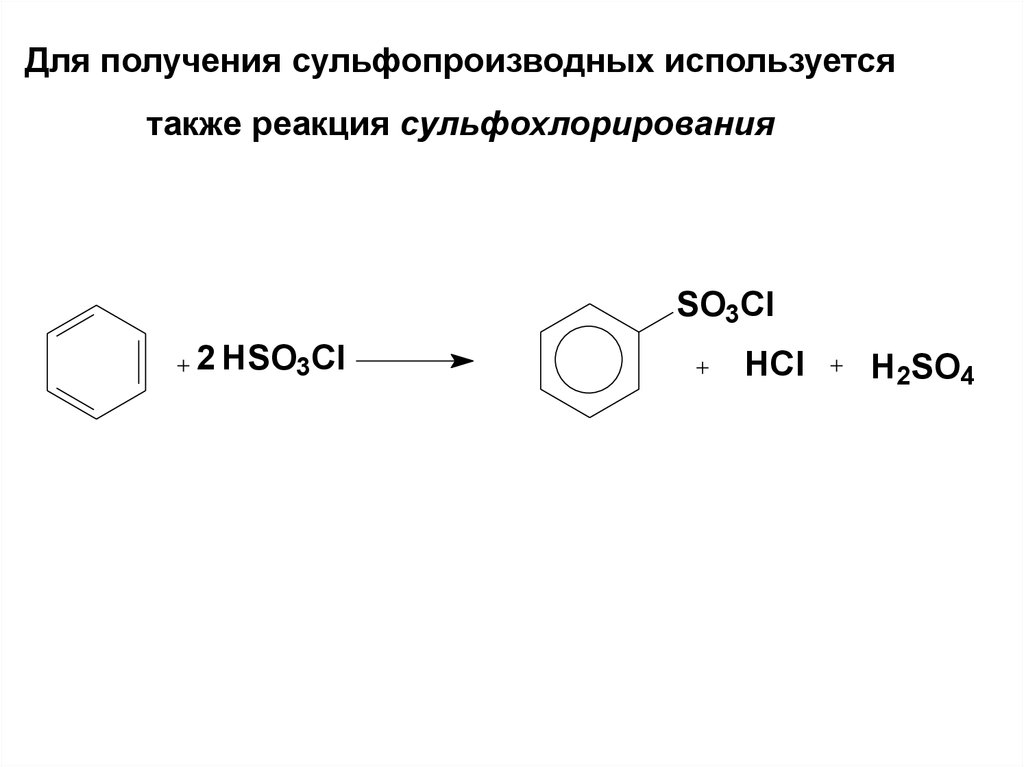
64. Для получения сульфопроизводных используется также реакция сульфохлорирования
SO3Cl2 HSO3Cl
HCl
H2SO4
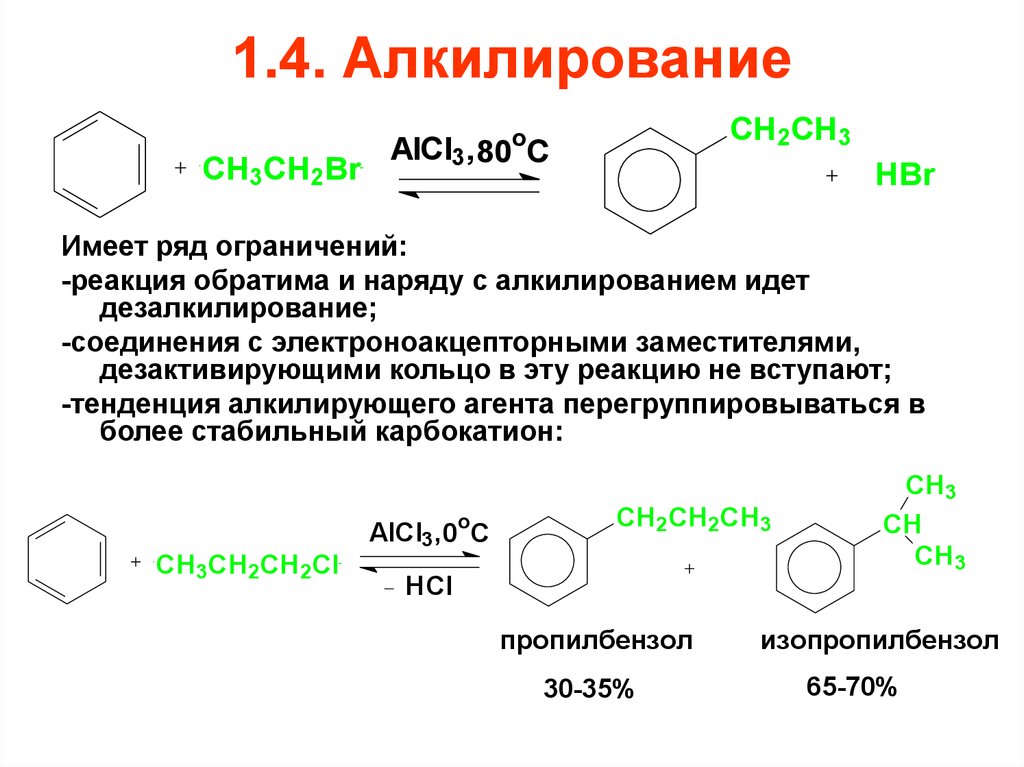
65. 1.4. Алкилирование
СH3CH2BrCH2CH3
o
AlCl3, 80 C
HBr
Имеет ряд ограничений:
-реакция обратима и наряду с алкилированием идет
дезалкилирование;
-соединения с электроноакцепторными заместителями,
дезактивирующими кольцо в эту реакцию не вступают;
-тенденция алкилирующего агента перегруппировываться в
более стабильный карбокатион:
СH3CH2CH2Cl
AlCl3, 0oC
CH2CH2CH3
HCl
пропилбензол
30-35%
CH3
CH
CH3
изопропилбензол
65-70%
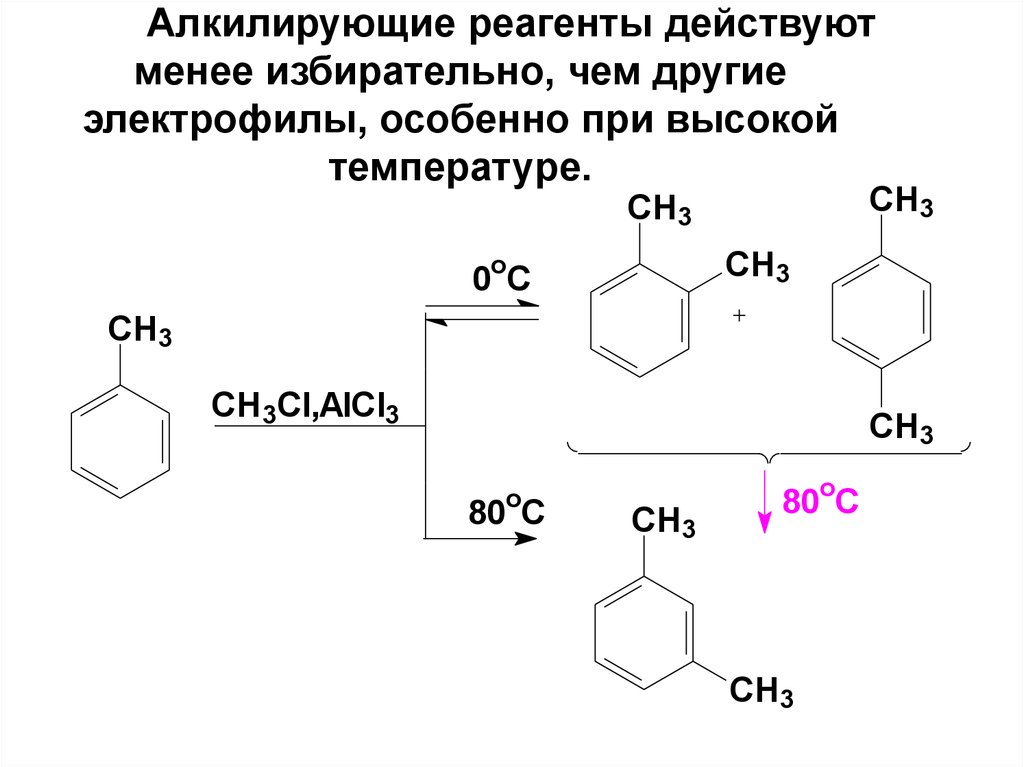
66. Алкилирующие реагенты действуют менее избирательно, чем другие электрофилы, особенно при высокой температуре.
СH3СH3
CH3
o
0 C
СH3
CH3Cl,AlCl3
CH3
o
80 C
СH3
80oC
CH3
67.
Кроме галогеналканов алкилирующимиреагентами могут быть алкены и спирты,
электрофилами в этих случаях являются также
карбокатионы:
CH3CH CH2
(CH3)3C OH
H
H
CH3 CH CH3
(CH3)3C OH2
(CH3)3C
H2O
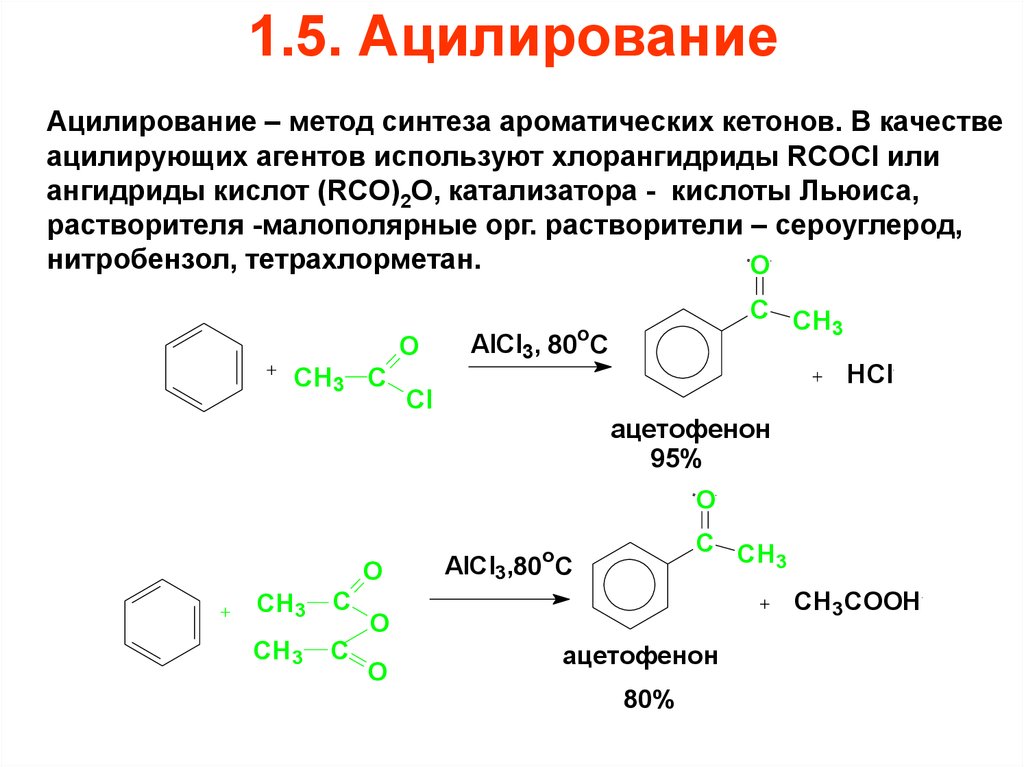
68. 1.5. Ацилирование
Ацилирование – метод синтеза ароматических кетонов. В качествеацилирующих агентов используют хлорангидриды RCOCl или
ангидриды кислот (RCO)2O, катализатора - кислоты Льюиса,
растворителя -малополярные орг. растворители – сероуглерод,
нитробензол, тетрахлорметан.
O
O
CH3 C
C CH
3
AlCl3, 80oC
Cl
HCl
ацетофенон
95%
O
O
CH3
C
CH3
C
C CH
3
o
AlCl3,80 C
CH3COOH
O
O
ацетофенон
80%
69.
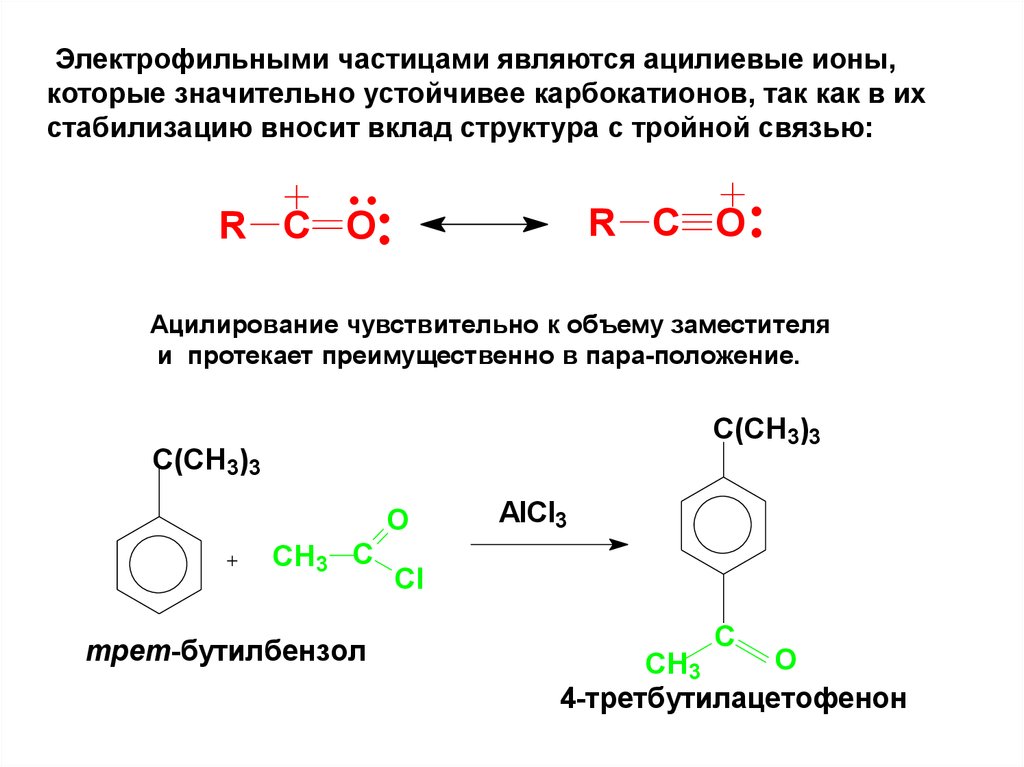
Электрофильными частицами являются ацилиевые ионы,которые значительно устойчивее карбокатионов, так как в их
стабилизацию вносит вклад структура с тройной связью:
R C O
R C O
Ацилирование чувствительно к объему заместителя
и протекает преимущественно в пара-положение.
C(CH3)3
C(CH3)3
O
CH3 C
трет-бутилбензол
AlCl3
Cl
C
O
CH3
4-третбутилацетофенон
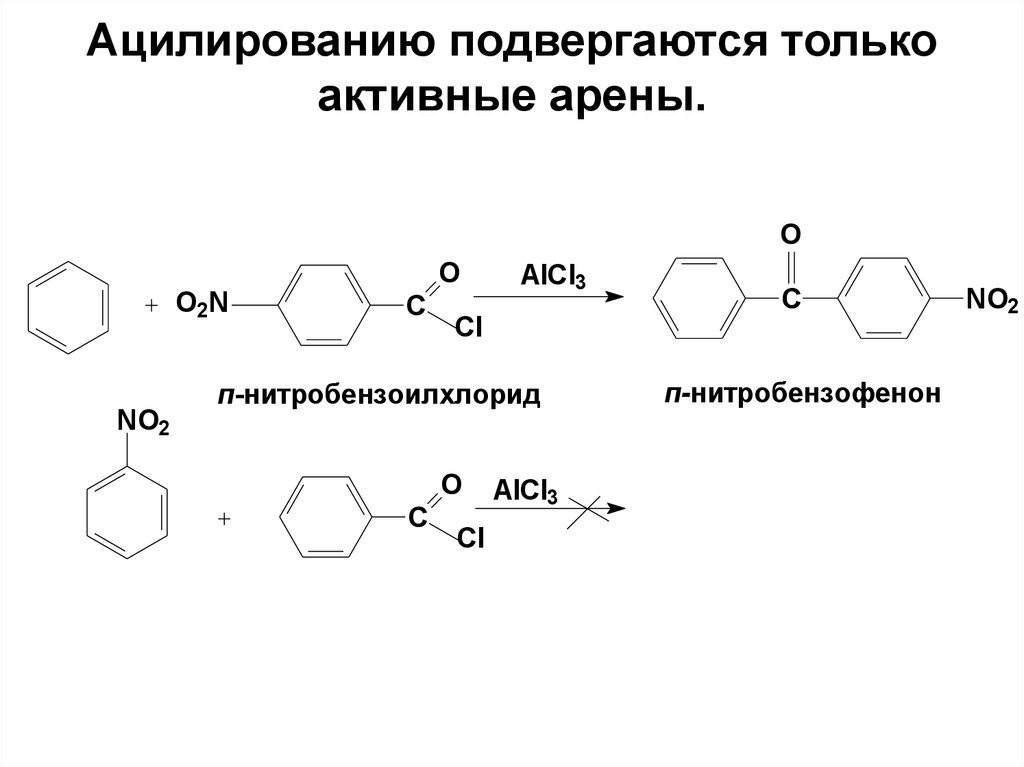
70. Ацилированию подвергаются только активные арены.
OO2N
NO2
O
C
AlCl3
Cl
п-нитробензоилхлорид
O
C
Cl
AlCl3
C
п-нитробензофенон
NO2
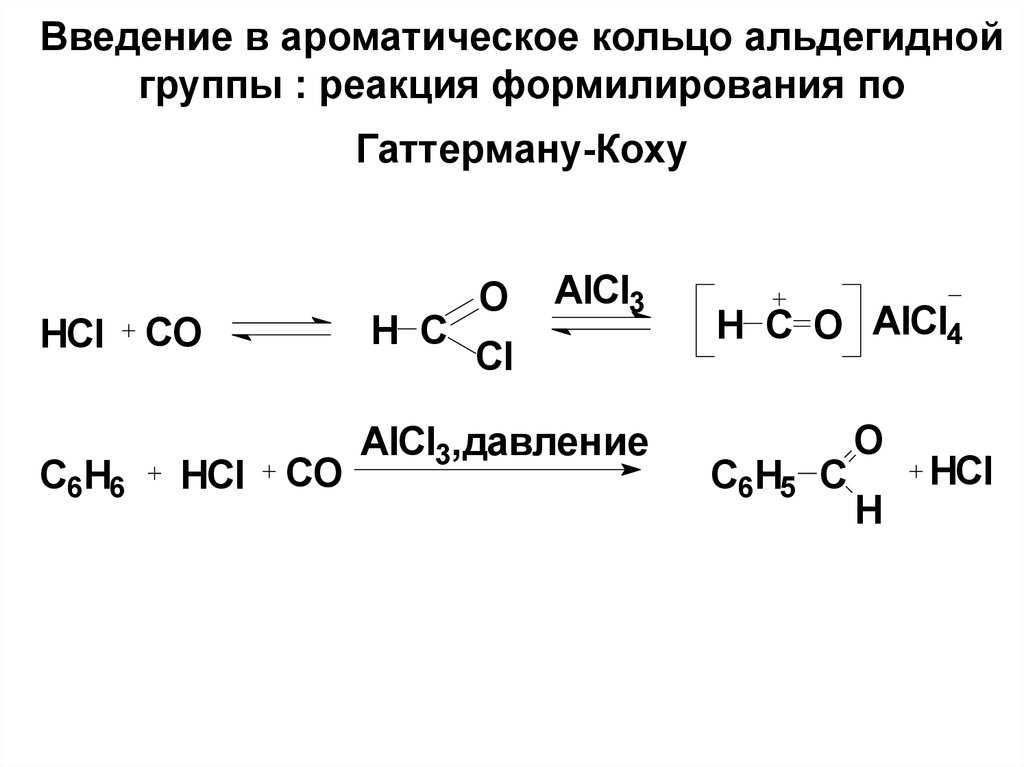
71. Введение в ароматическое кольцо альдегидной группы : реакция формилирования по Гаттерману-Коху
HClC6H6
H C
CO
HCl
CO
O
AlCl3
Cl
AlCl3,давление
H C O AlCl4
С6H5 C
O
H
HCl
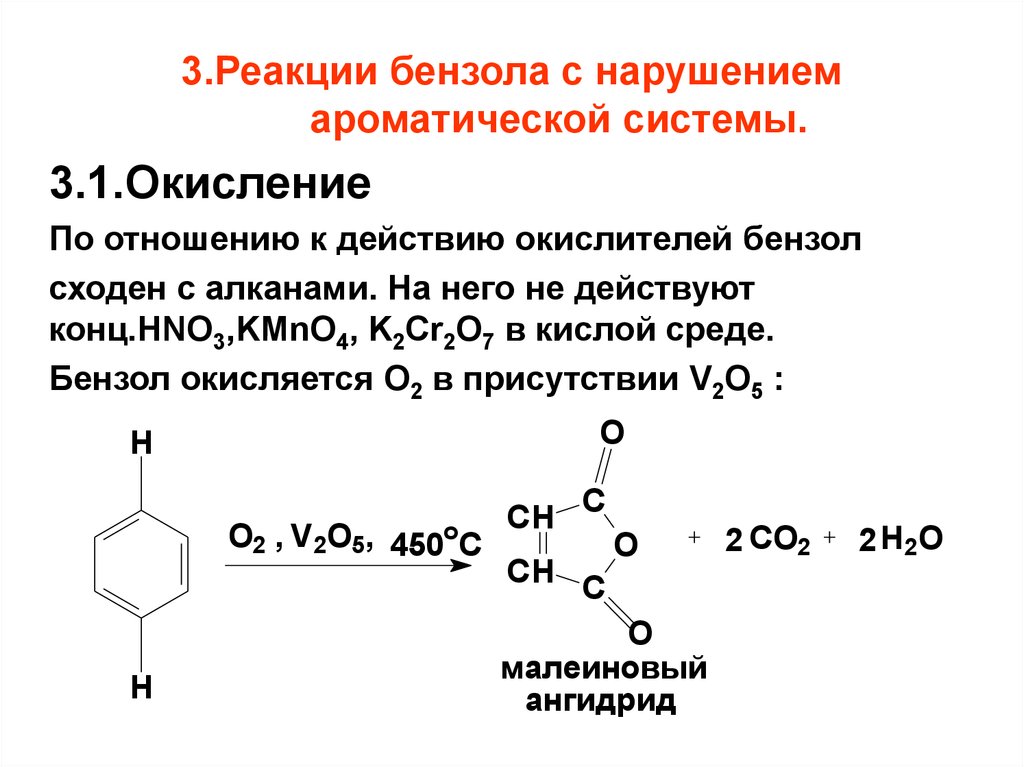
72. 3.Реакции бензола с нарушением ароматической системы.
3.1.ОкислениеПо отношению к действию окислителей бензол
сходен с алканами. На него не действуют
конц.HNO3,KMnO4, K2Cr2O7 в кислой среде.
Бензол окисляется O2 в присутствии V2O5 :
O
H
O2 , V2O5, 450oC
H
CH
CH
C
O
C
O
малеиновый
ангидрид
2 CO2
2 H2O
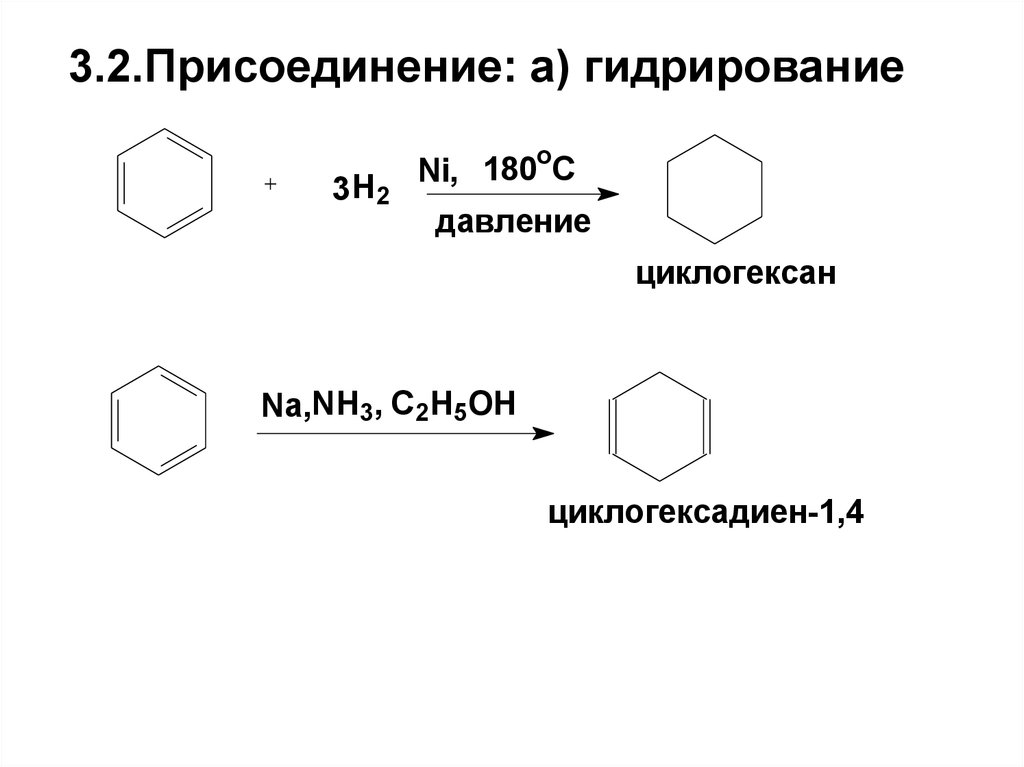
73. 3.2.Присоединение: а) гидрирование
3 H2o
Ni, 180 C
давление
циклогексан
Nа,NH3, C2H5OH
циклогексадиен-1,4
74. б) Присоединение хлора
б) Присоединение Clхлора
3 Cl2
hv
Cl
Cl
Cl
Cl
Cl
1,2,3,4,5,6-гексахлорциклогексан
Cl
Cl
Cl
Cl Cl
Cl
Cl
Cl
Cl
Cl
Cl
γ -гексахлорциклогексан
(гексахлоран)
Cl
Гексахлоран использовался ранее в качестве инсектицида.
Это сильный пищевой и дыхательный яд
(10-12г – смертельная доза для мух). Инсектицидным
действием обладает 1 из 9 стереоизомеров гексахлорциклогексана.
75. 3.3.Реакции боковых цепей в алкилбензолах.
а) Галогенирования (Учебник. Стр. 214-215).Алкилбензолы вступают в реакции радикального
хлорирования и бромирования боковой цепи.
Для инициирования образования радикальных частиц
используется освещение ультрафиолотовым светом (фотолиз)
или высокие температуры -450-500оС (термолиз).
C6H5 CH3
толуол
Cl2
HCl
C6H5 CH2Cl
Cl2
C6H5 CHCl2
Cl2
C6H5 CCl3
HCl
HCl
фенилтрихлорметан
бензилиденхлорид
бензилхлорид
(бензотрихлорид)
При бромировании толуола возможно
замещение не более 2 атомов водорода в боковой цепи.
76.
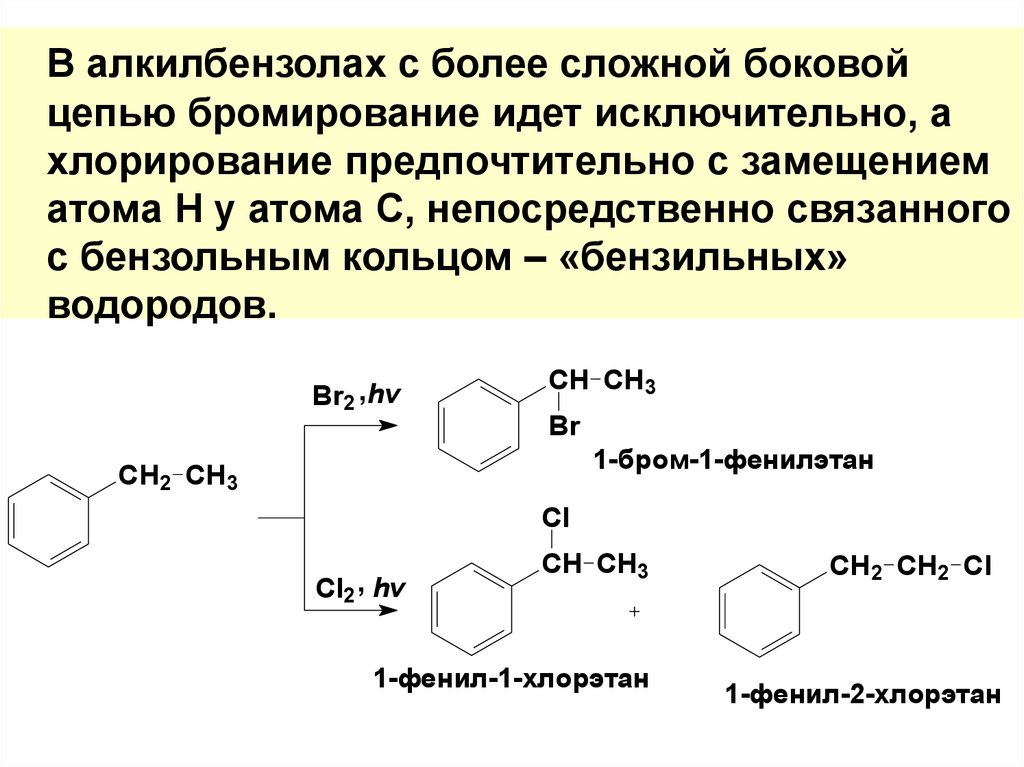
В алкилбензолах с более сложной боковойцепью бромирование идет исключительно, а
хлорирование предпочтительно с замещением
атома Н у атома С, непосредственно связанного
с бензольным кольцом – «бензильных»
водородов.
Br2 , hv
CH CH3
Br
1-бром-1-фенилэтан
CH2 CH3
Cl
Cl2 , hv
CH CH3
1-фенил-1-хлорэтан
CH2 CH2 Cl
1-фенил-2-хлорэтан
77.
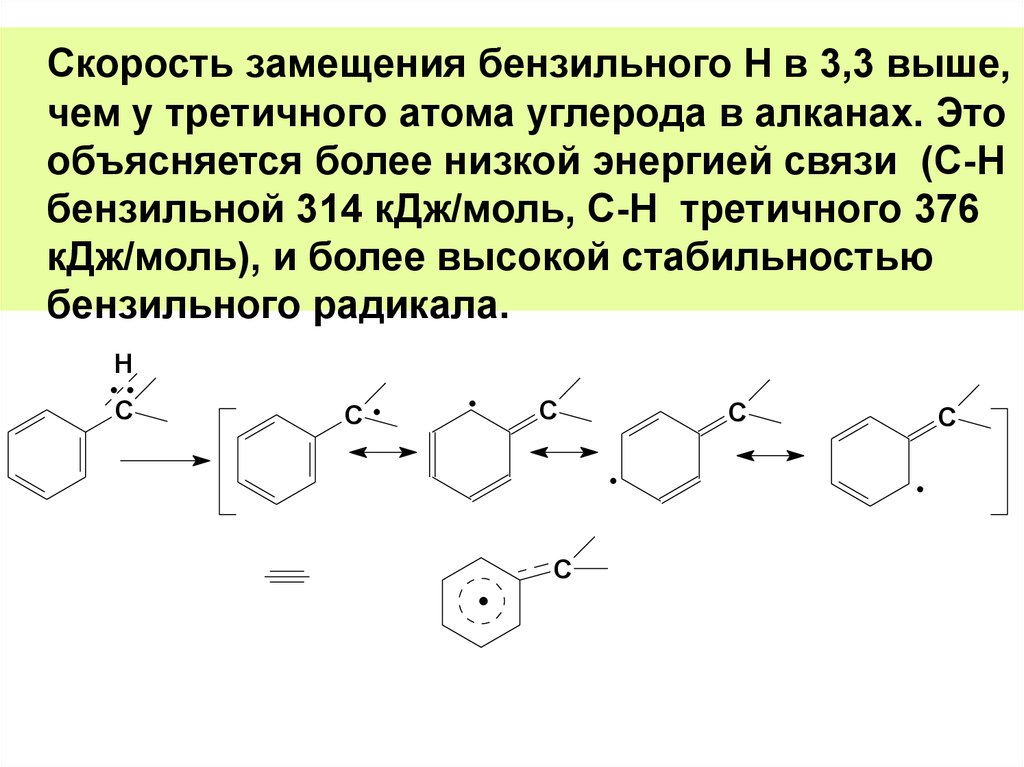
Скорость замещения бензильного Н в 3,3 выше,чем у третичного атома углерода в алканах. Это
объясняется более низкой энергией связи (С-Н
бензильной 314 кДж/моль, С-Н третичного 376
кДж/моль), и более высокой стабильностью
бензильного радикала.
Н
С
С
С
С
С
С
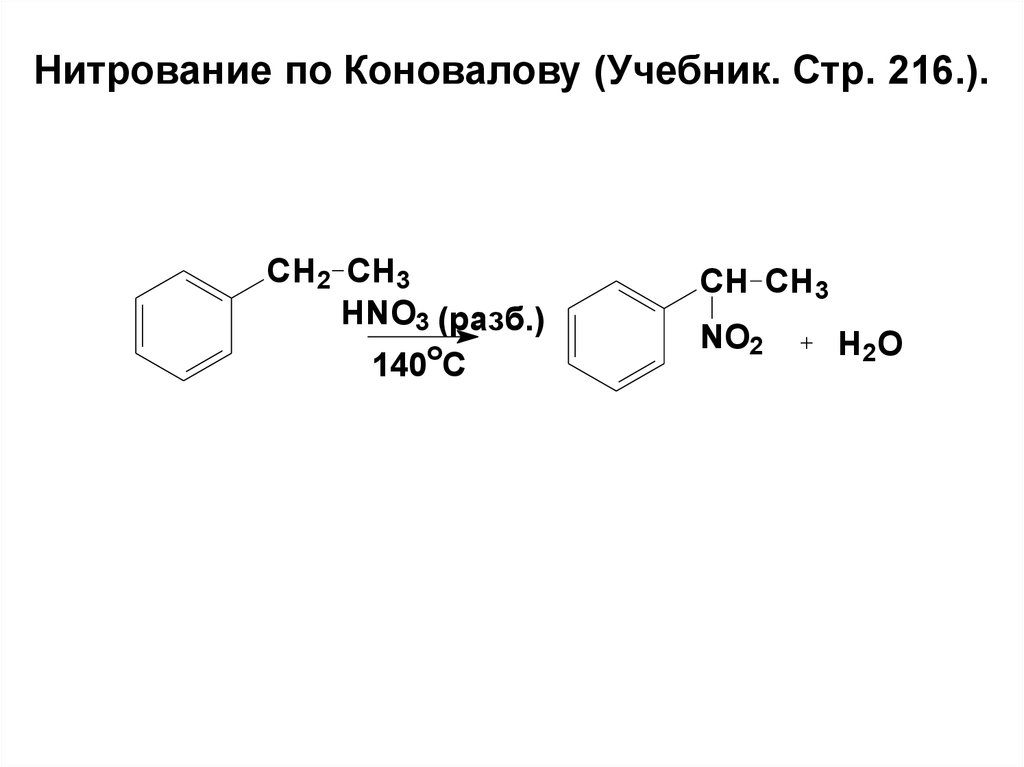
78. Нитрование по Коновалову (Учебник. Стр. 216.).
CH2 CH3HNO3 (разб.)
o
140 C
CH CH3
NO2
H2O
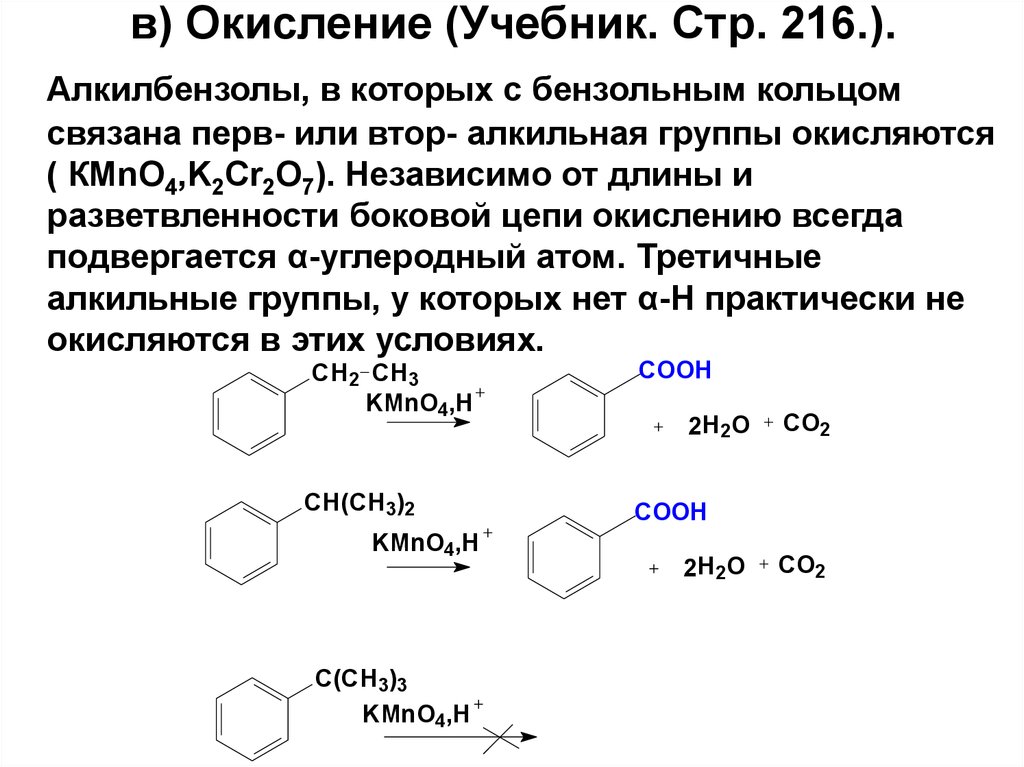
79. в) Окисление (Учебник. Стр. 216.).
Алкилбензолы, в которых с бензольным кольцомсвязана перв- или втор- алкильная группы окисляются
( КМnO4,K2Cr2O7). Независимо от длины и
разветвленности боковой цепи окислению всегда
подвергается α-углеродный атом. Третичные
алкильные группы, у которых нет α-Н практически не
окисляются в этих условиях.
CH2 CH3
KMnO4,H
CH(CH3)2
KMnO4,H
C(CH3)3
KMnO4,H
COOH
2H 2 O
CO2
COOH
2H 2 O
CO2
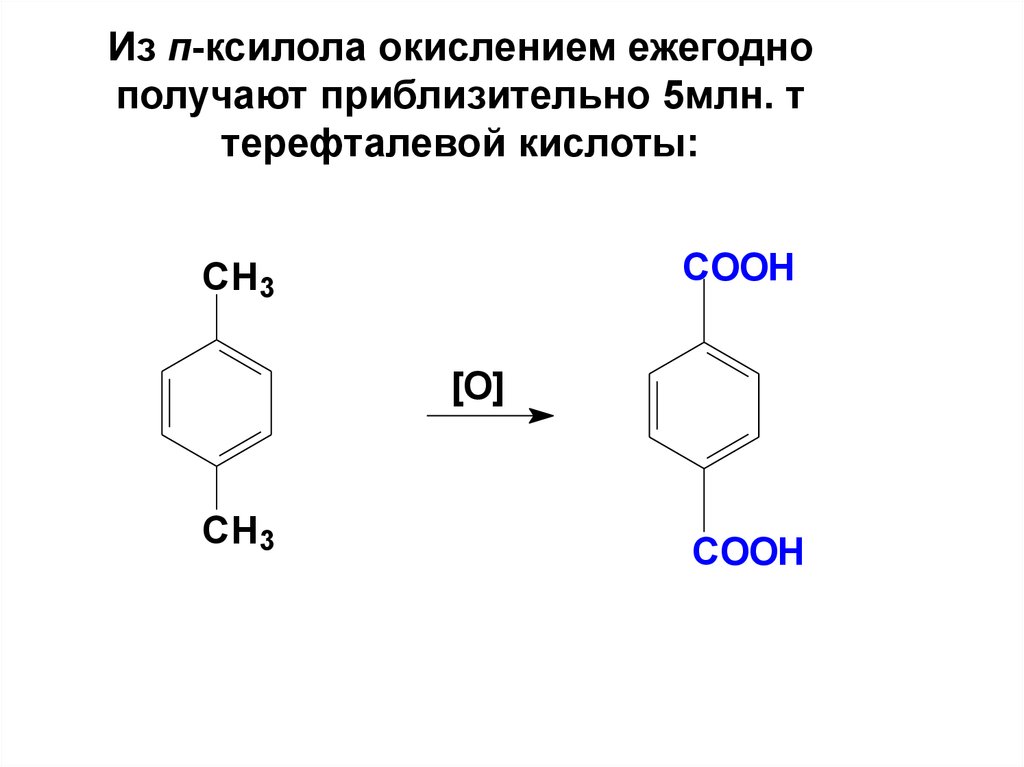
80. Из п-ксилола окислением ежегодно получают приблизительно 5млн. т терефталевой кислоты:
COOHCH3
[O]
CH3
COOH
81. Красители трифенилметанового ряда
N(CH3)2C H
N(CH3)2
[O]
C OH
N(CH3)2
HCl
N(CH3)2
карбинольное основание
малахитового зеленого
лейкооснование
малахитового зеленого
N(CH3)2
N(CH3)2
Cl
C
N(CH3)2
малахитовый зеленый
Cl
C
N(CH3)2
хиноидная структура
малахитового зеленого
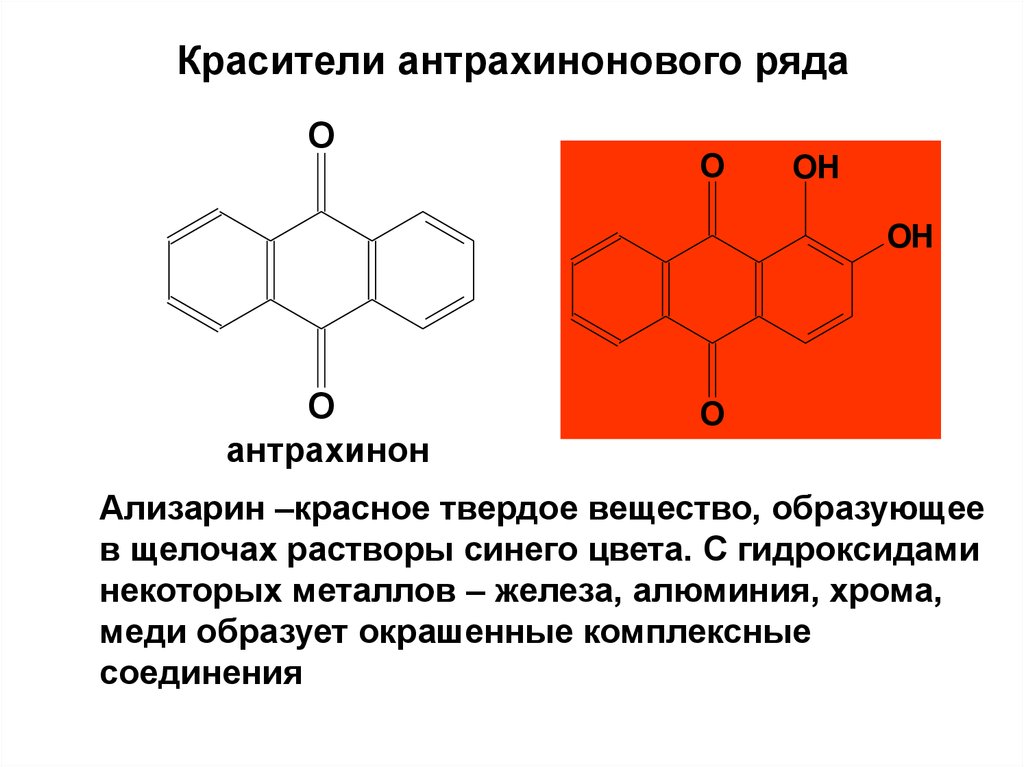
82. Красители антрахинонового ряда
OO
OH
OH
O
антрахинон
O
Ализарин –красное твердое вещество, образующее
в щелочах растворы синего цвета. С гидроксидами
некоторых металлов – железа, алюминия, хрома,
меди образует окрашенные комплексные
соединения




























 Химия
Химия








