Похожие презентации:
Строение и физические свойства металлов
1.
2.
95 из1183.
4.
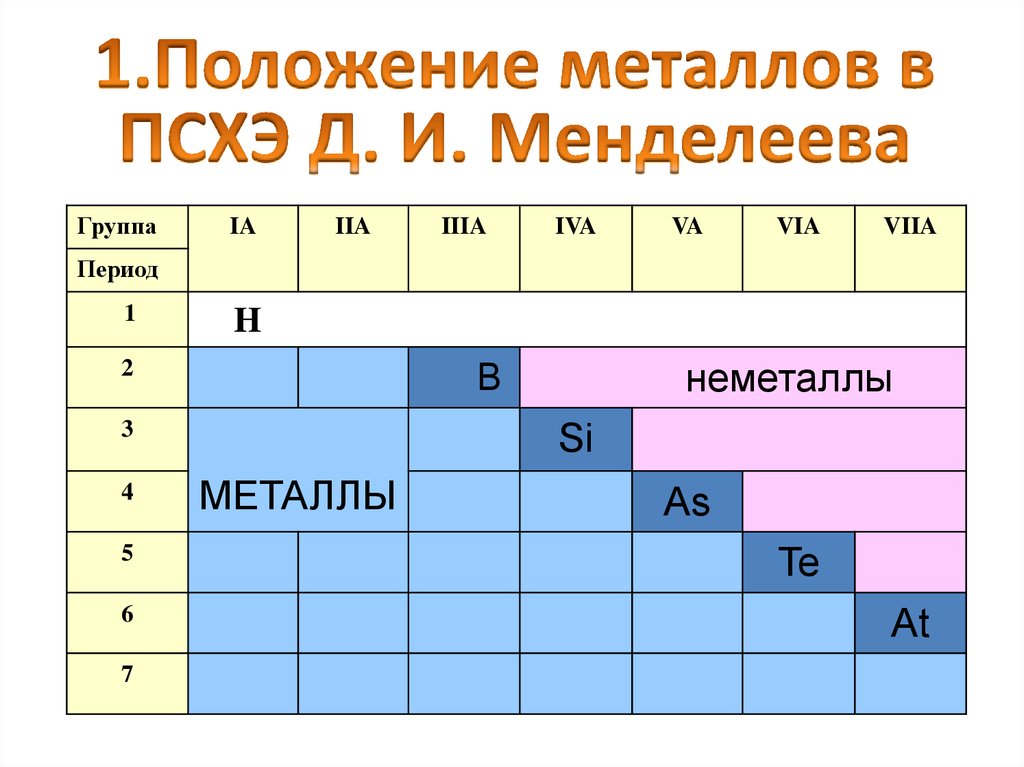
ГруппаIA
IIA
IIIA
IVA
VA
VIA
VIIA
Период
1
H
2
3
4
5
6
7
неметаллы
B
Si
МЕТАЛЛЫ
As
Te
At
5.
Основные группы металловЩелочные
Щелочно -
земельные
Переходные
Другие
• Цезий, Литий, Натрий, Калий
• Бериллий, Магний, Кальций
• Железо, Платина, Медь, Цинк, Золото,
Серебро, Палладий, Ртуть, Никель, Кобальт
• Алюминий, Свинец, Олово
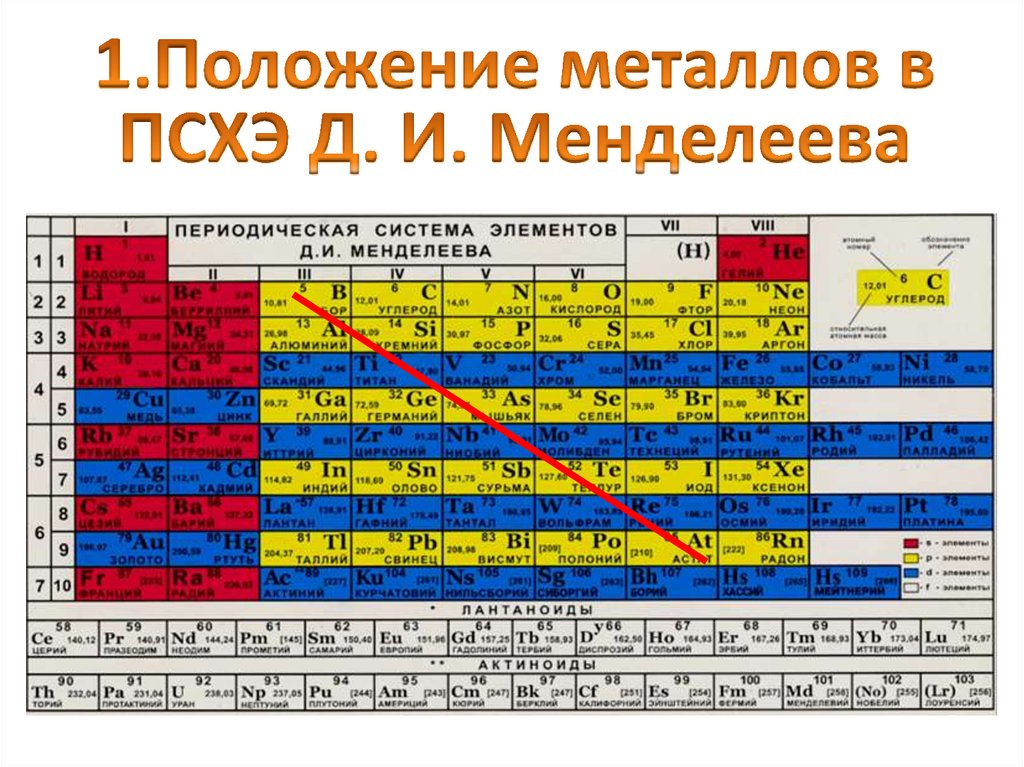
6. Основные группы металлов
К элементам - металлам относятся:s - элементы I и II групп, все d- и f -элементы,
а также p- элементы главных подгрупп:
III (кроме бора),
IV (Ge, Sn, Pb),
V (Sb,Bi) и VI (Po).
Наиболее типичные элементы – металлы
расположены в начале периодов (начиная со
второго).
7.
Из положения в таблице Д.И. Менделееваследует:
1. Атомы металлов на последнем
энергетическом уровне имеют 1 – 3 ē.
8.
2.У
атомов
металлов
большие
размеры
атомных
радиусов.
Поэтому
металлы
легко
отдают
внешние
электроны.
M ne
0
M
Металлы в реакциях
восстановители!
n
9. 2. У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны.
Химическая связь в металлахМеталлическая связь –
это связь в металлах и
сплавах между атомионами металлов,
расположенными в узлах
кристаллической
решётки, осуществляемая
обобществлёнными
внешними электронами.
10. Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической
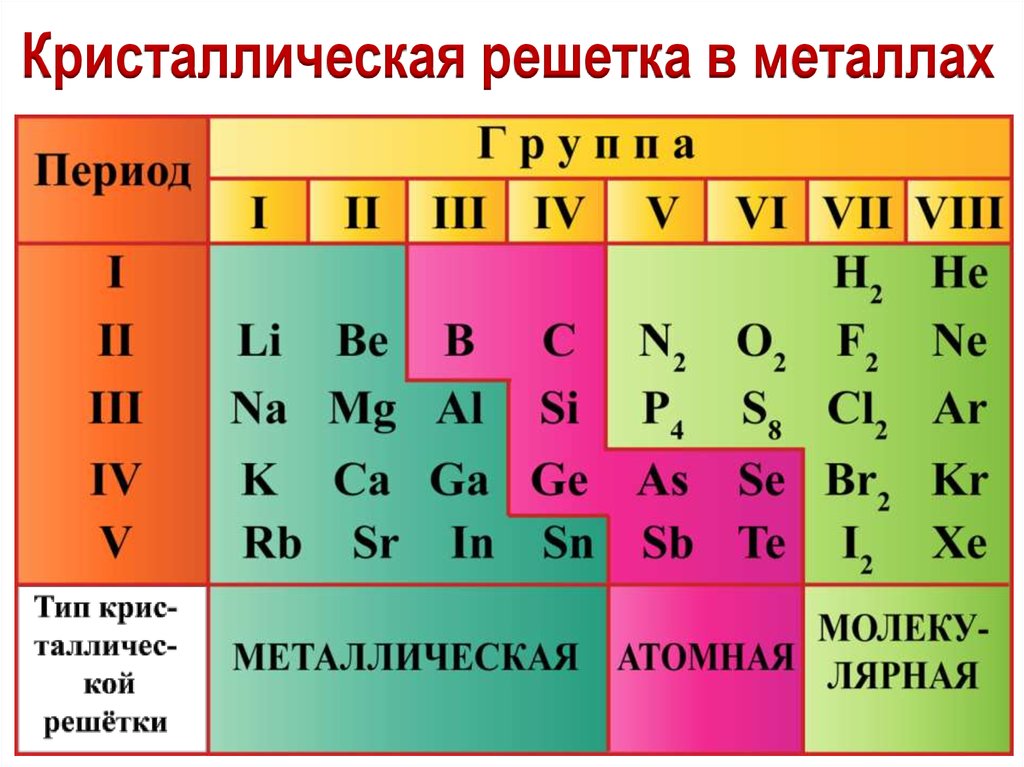
Кристаллическая решетка в металлах11.
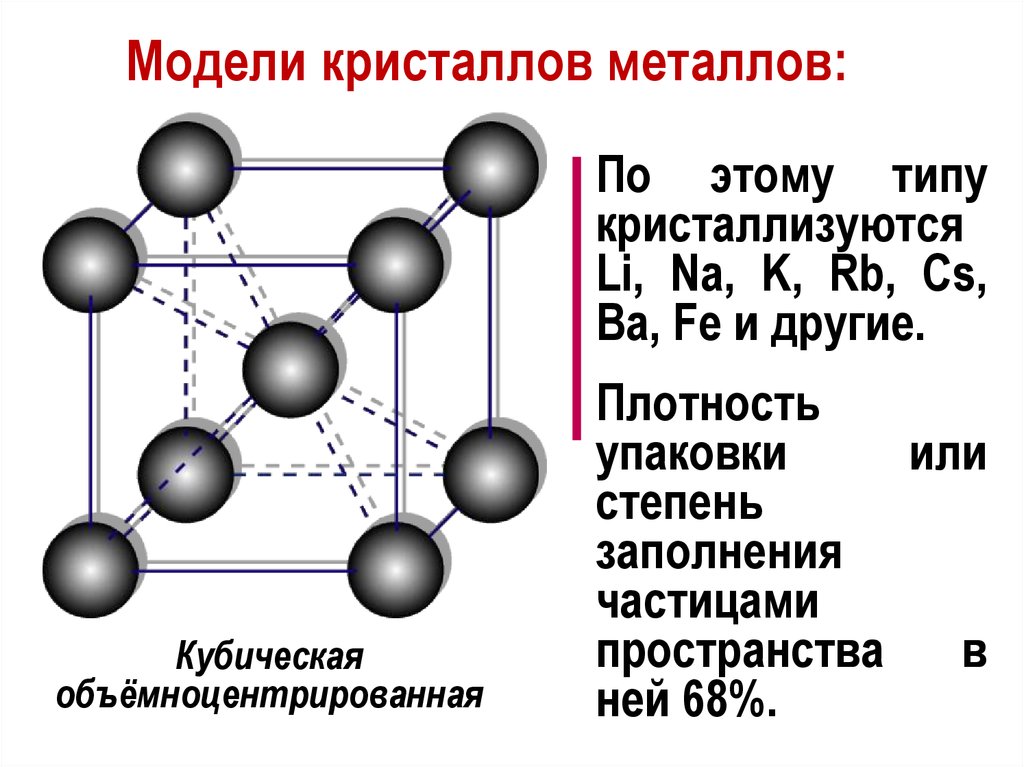
Модели кристаллов металлов:По этому типу
кристаллизуются
Li, Na, K, Rb, Cs,
Ba, Fe и другие.
Кубическая
объёмноцентрированная
Плотность
упаковки
или
степень
заполнения
частицами
пространства в
ней 68%.
12.
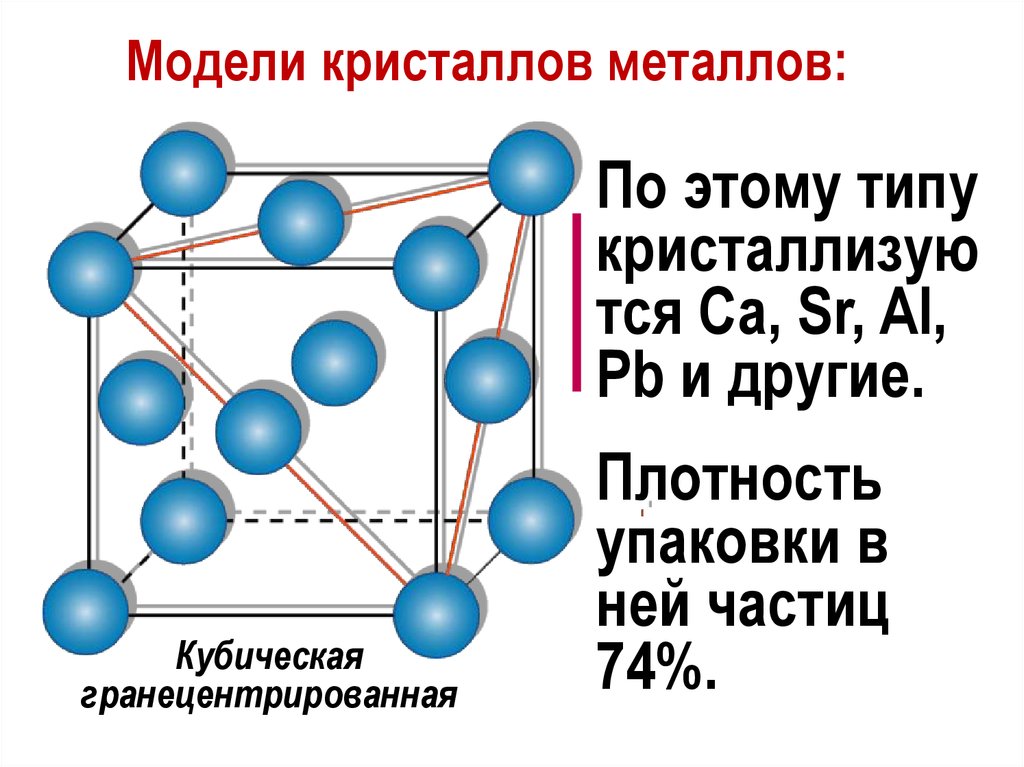
Модели кристаллов металлов:По этому типу
кристаллизую
тся Са, Sr, Al,
Pb и другие.
Кубическая
гранецентрированная
Плотность
упаковки в
ней частиц
74%.
13.
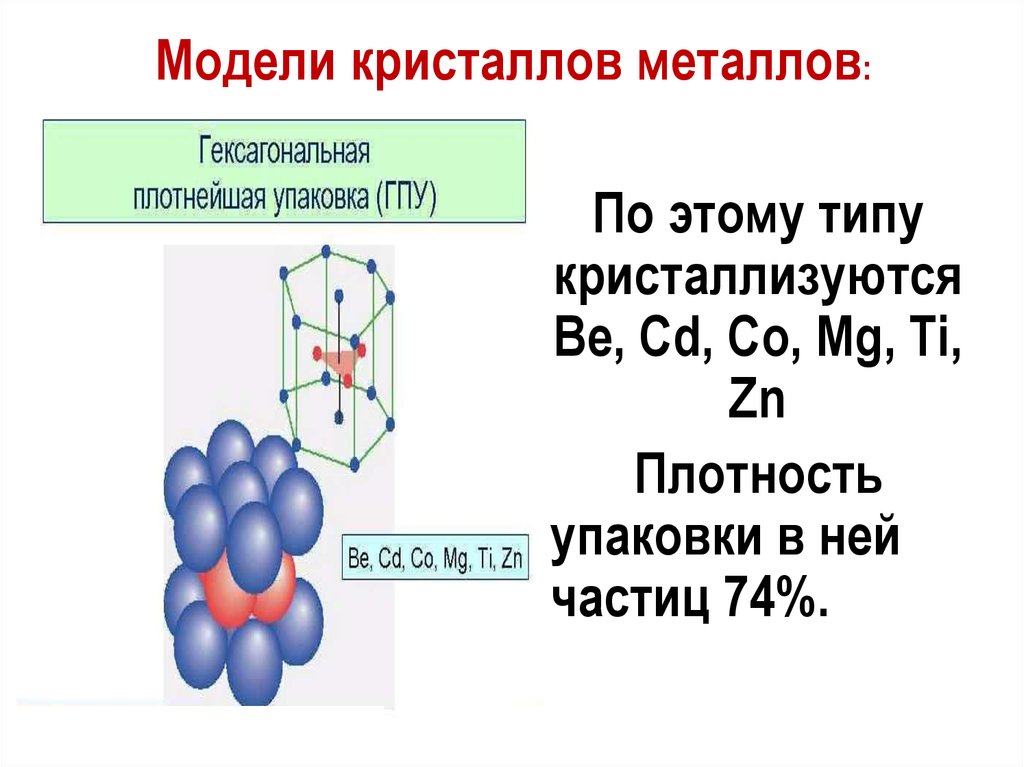
Модели кристаллов металлов:По этому типу
кристаллизуются
Be, Cd, Co, Mg, Ti,
Zn
Плотность
упаковки в ней
частиц 74%.
14.
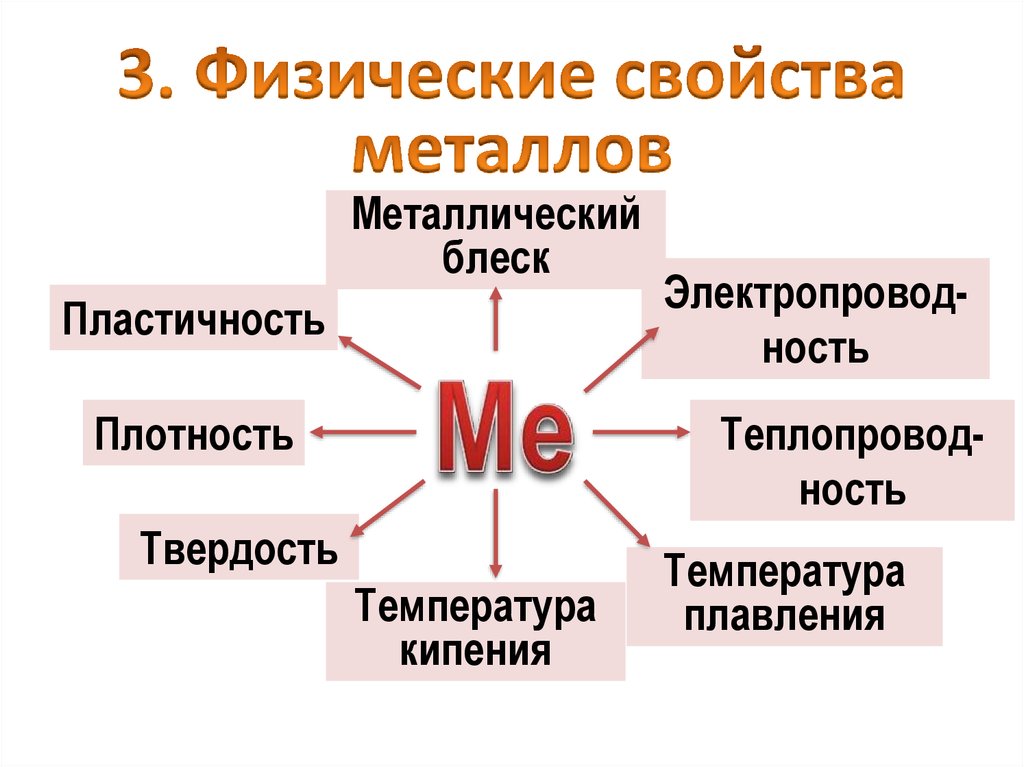
Металлическийблеск
Пластичность
Плотность
Электропроводность
Теплопроводность
Твердость
Температура
кипения
Температура
плавления
15.
1. Металлический блескСамые блестящие металлы – Hg, Ag, Pd.
В порошке все металлы, кроме Al и Mg,
теряют блеск и имеют чёрный или
тёмно-серый цвет.
16.
17.
2. Электропроводностьи теплопроводность
В ряду:
Ag→Cu → Al → Fe уменьшается.
Наименьшая электропроводность в ряду:
Mn → Pb → Hg.
18. 2. Электропроводность и теплопроводность
19.
2. Электропроводностьи теплопроводность
При
нагревании
электропроводность
уменьшается, т.к. с повышением температуры
усиливаются колебания атомов и ионов в узлах
кристаллической решетки, что затрудняет
направленное движение "электронного газа".
20. 2. Электропроводность и теплопроводность
Высокие теплопроводность и электропроводность21.
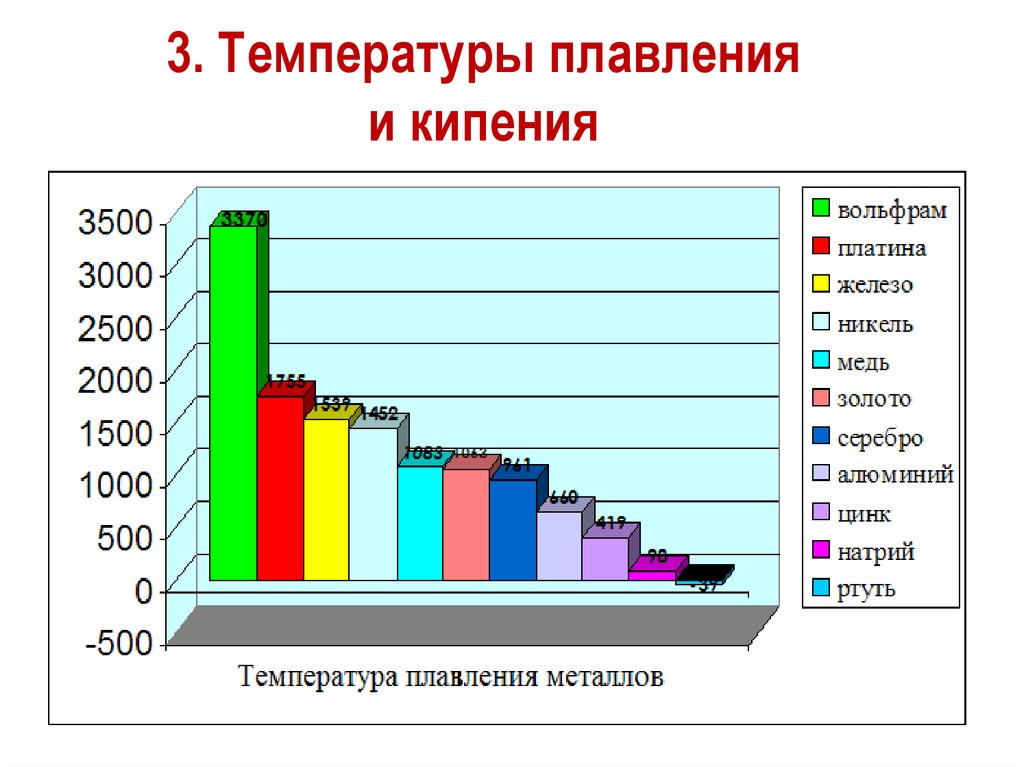
3. Температуры плавленияи кипения
Вольфрам
Калий
Ртуть
22. 3. Температуры плавления и кипения
Самый легкоплавкий металл – ртуть (т.пл. = -39°C),самый тугоплавкий металл –
вольфрам (t°пл. = 3370°C).
Металлы с t°пл. выше 1000°C считаются
тугоплавкими, ниже – низкоплавкими.
23. 3. Температуры плавления и кипения
24. 3. Температуры плавления и кипения
Температура плавления-38,9°С
температура
плавления ртути
Wilco Oelen
Ртуть (Hg)
25.
Температура плавления29°C
29,8°C
Aiyizo
Dnn87
Цезий (Cs)
Галлий (Ga)
26.
Температура плавления3410°С
температура плавления
вольфрама
Вольфрам (W)
27.
Нить накаливания28.
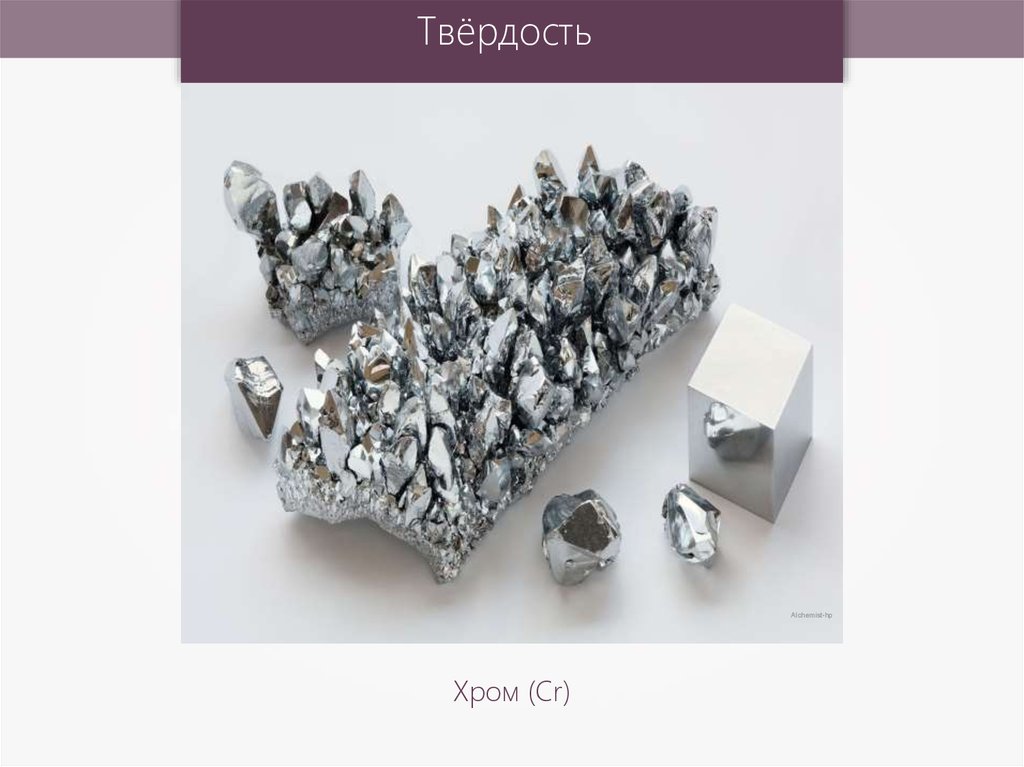
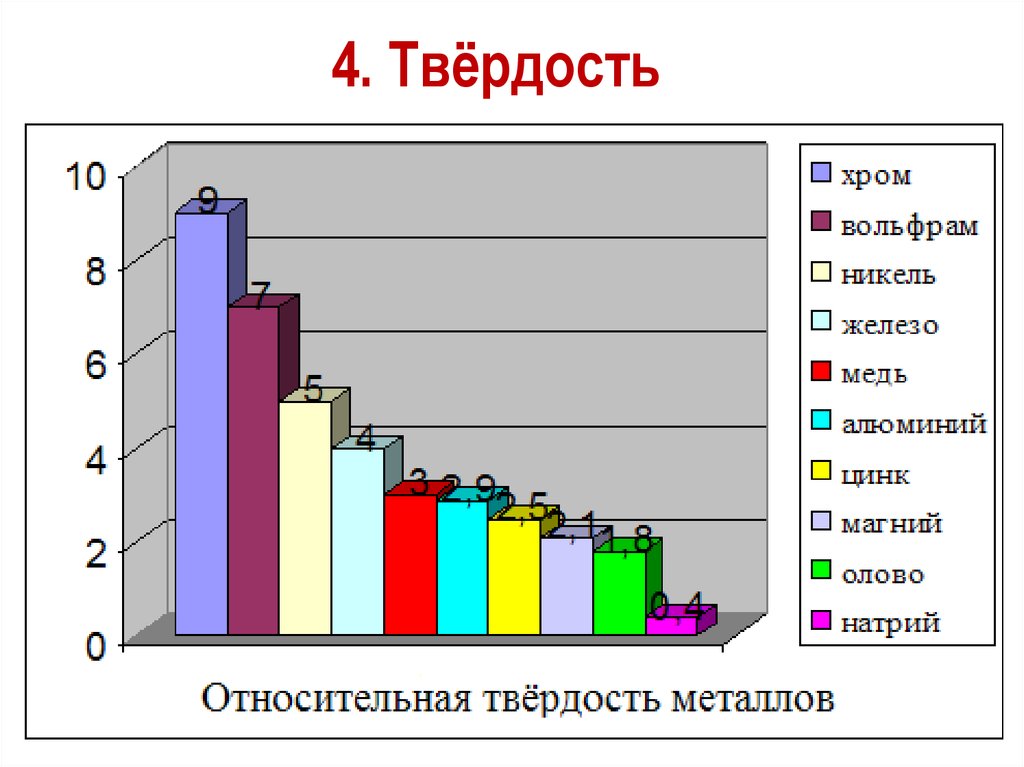
4. ТвёрдостьСамый твердый – хром (режет стекло).
Самые мягкие – щелочные металлы – калий,
натрий, рубидий и цезий – режутся ножом.
29. 4. Твёрдость
Щелочные металлы режутся ножом30. 4. Твёрдость
Хром – самыйтвёрдый металл
31.
ТвёрдостьAlchemist-hp
Хром (Cr)
32.
ТвёрдостьDnn87
Калий (K)
Dnn87
Dnn87
Рубидий (Rb)
Цезий (Cs)
33.
4. Твёрдость34. 4. Твёрдость
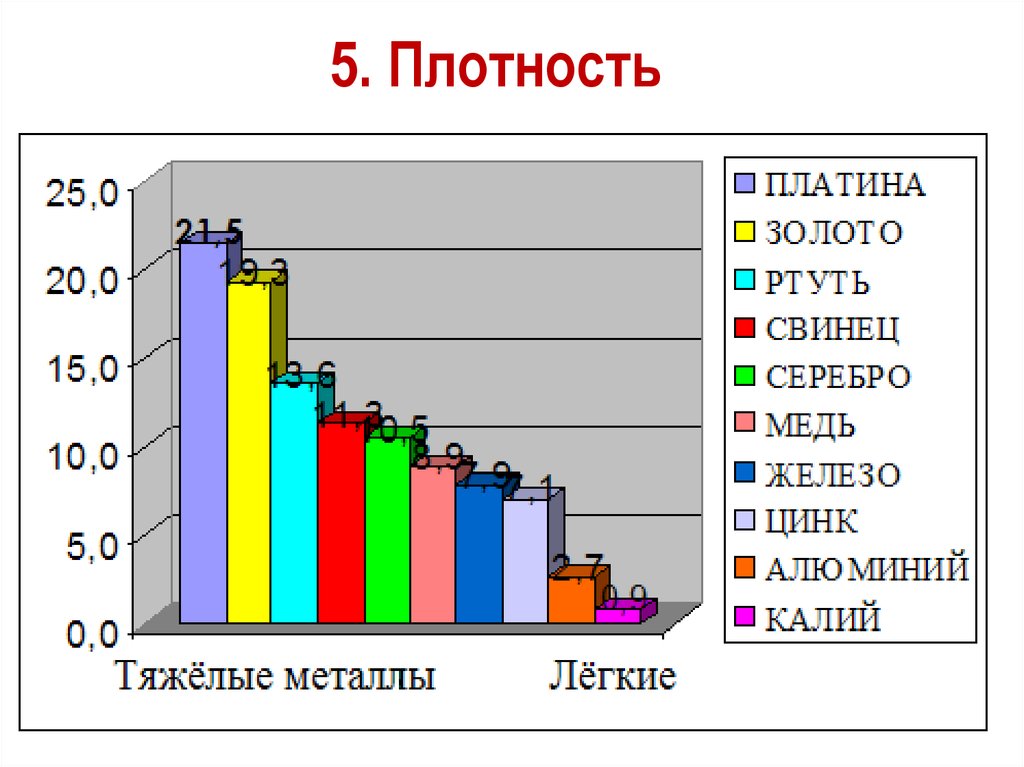
5. ПлотностьПлотность тем меньше, чем меньше атомная
масса металла и чем больше радиус его атома
Платина и золото – одни из тяжёлых металлов
35. 5. Плотность
Самый легкий – литий (ρ =0,533
г/см ), всплывает в керосине.
Самый тяжелый – осмий (ρ =22,6
г/см3).
36. 5. Плотность
Плотность и температура плавления некоторых металлов.Название
Атомный вес
Плотность,
г/см3
Температура
плавления, C
Легкие металлы
Литий
6,939
0,534
179
Калий
39,102
0,86
63,6
Натрий
22,9898
0,97
97,8
Тяжелые металлы
Цинк
65,37
7,14
419
Хром
51,996
7,16
1875
Олово
118,69
7,28
231,9
Железо
55,847
7,86
1539
Медь
63,546
8,92
1083
Серебро
107,868
10,5
960,8
Ртуть
200,59
13,546
-38,87
Вольфрам
183,85
19,3
3380
37. Плотность и температура плавления некоторых металлов.
Литий – самыйлёгкий металл
38.
Осмий – самыйОсмий –металл
самый
дорогой
тяжёлый
(изотопметалл
187)
39.
5. Плотность40. 5. Плотность
6. ПластичностьПластичность - способность изменять форму
при ударе, вытягиваться в проволоку,
прокатываться в тонкие листы. В ряду :
Au→Ag → Cu → Sn → Pb → Zn → Fe
уменьшается.
41. 6. Пластичность
Сусальное золото42.
Выводы :Все металлы имеют металлическую
кристаллическую решетку.
В металлах осуществляется металлическая связь.
Основные физические свойства металлов –
металлический блеск, непрозрачность, электро- и
теплопроводность, пластичность обусловлены
строением металлов.
Металлы проявляют только восстановительные
свойства, потому что в реакциях они всегда отдают
свои электроны.
Металлы используют в основном в виде сплавов.
Металлы имеют важное значение в жизни
человека.
43. Выводы :
Химические свойства металлов44.
Химические реакцииметаллов
Реакции
соединения
Реакции
замещения
45.
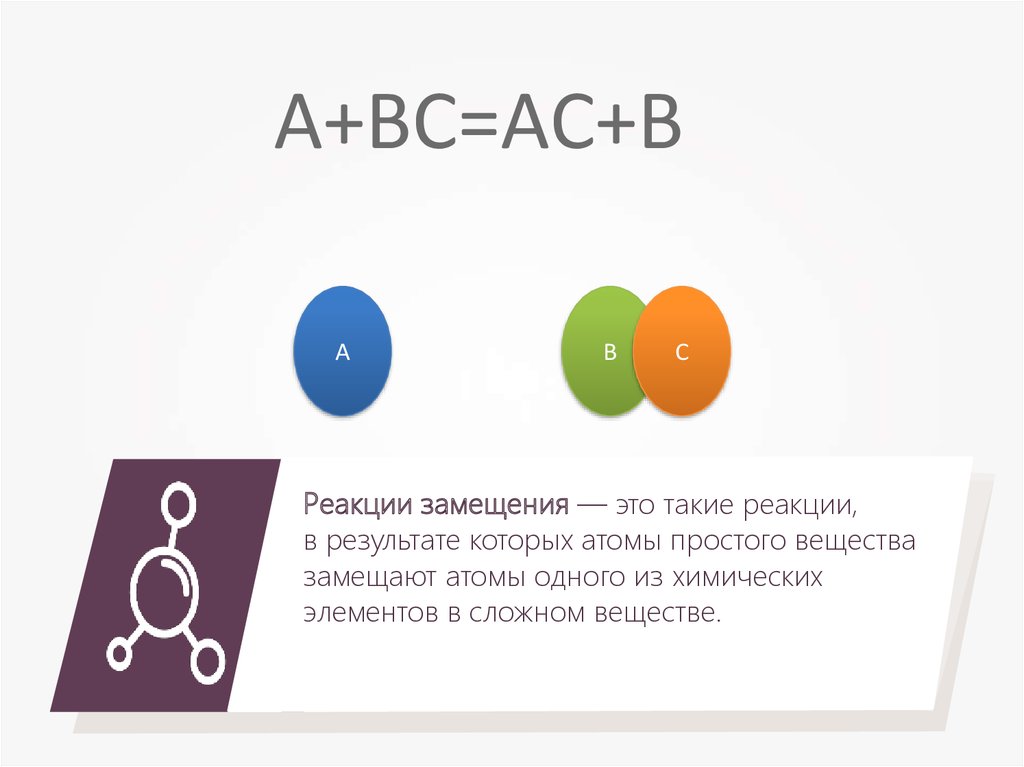
A+BC=AC+BА
В
С
Реакции замещения — это такие реакции,
в результате которых атомы простого вещества
замещают атомы одного из химических
элементов в сложном веществе.
46.
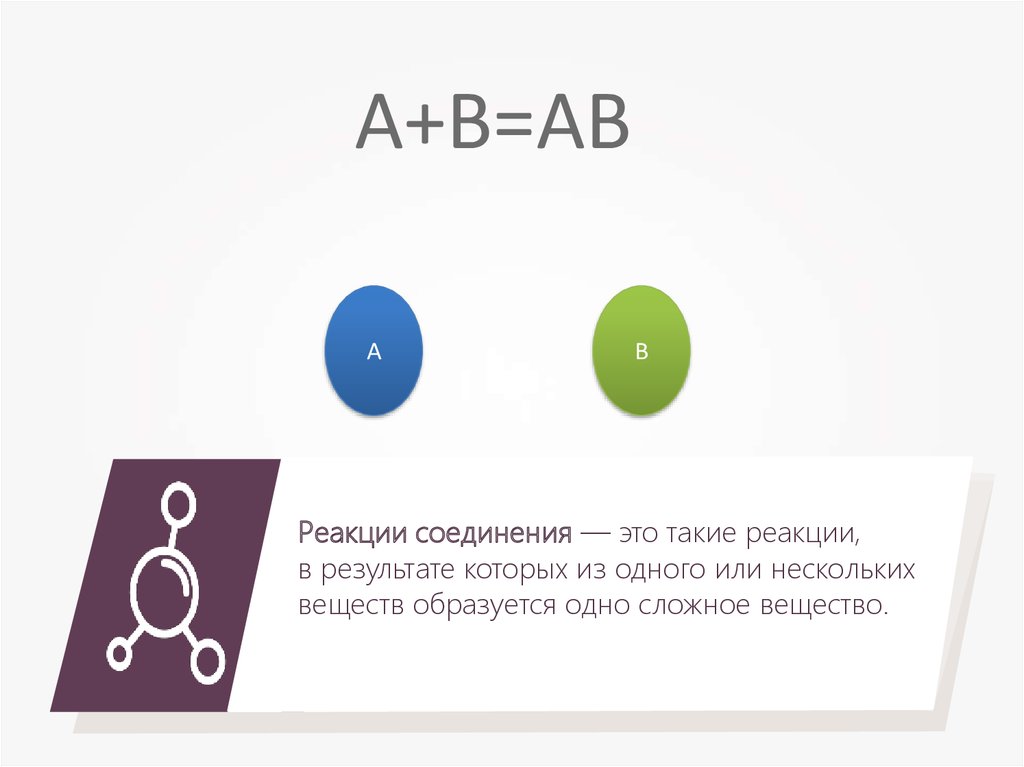
A+B=ABА
В
Реакции соединения — это такие реакции,
в результате которых из одного или нескольких
веществ образуется одно сложное вещество.
47.
Взаимодействие с простыми веществамиС кислородом большинство металлов образует оксиды –
амфотерные и основные:
Щелочные металлы, за исключением лития, образуют
пероксиды:
48.
Взаимодействие с простыми веществамиС галогенами металлы образуют соли галогеноводородных
кислот:
С водородом самые активные металлы образуют ионные
гидриды – солеподобные вещества, в которых водород имеет
степень окисления -1
49.
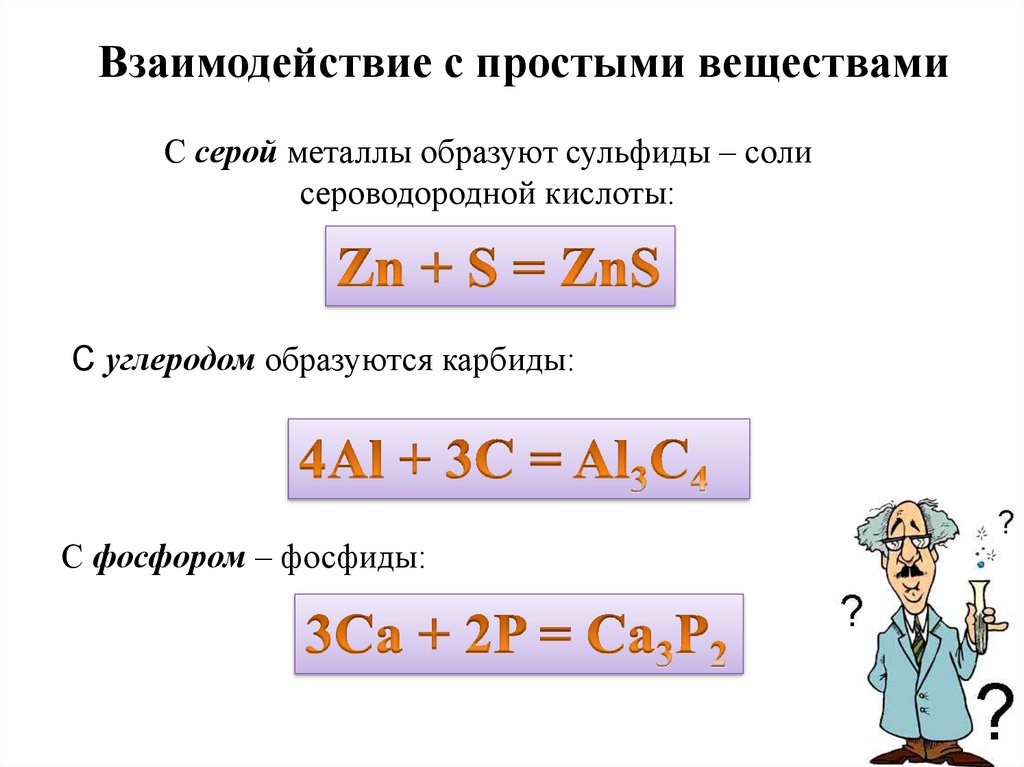
Взаимодействие с простыми веществамиС серой металлы образуют сульфиды – соли
сероводородной кислоты:
С углеродом образуются карбиды:
С фосфором – фосфиды:
50.
Химические свойства металловЕсли металл реагирует с кислотой, то он входит в
состав
образующейся
соли.
Когда
металл
взаимодействует с растворами кислоты, он может
окисляться ионами водорода, имеющимися в этом
растворе. Сокращённое ионное уравнение в общем
виде можно записать так:
51.
52.
Практическое занятие53.
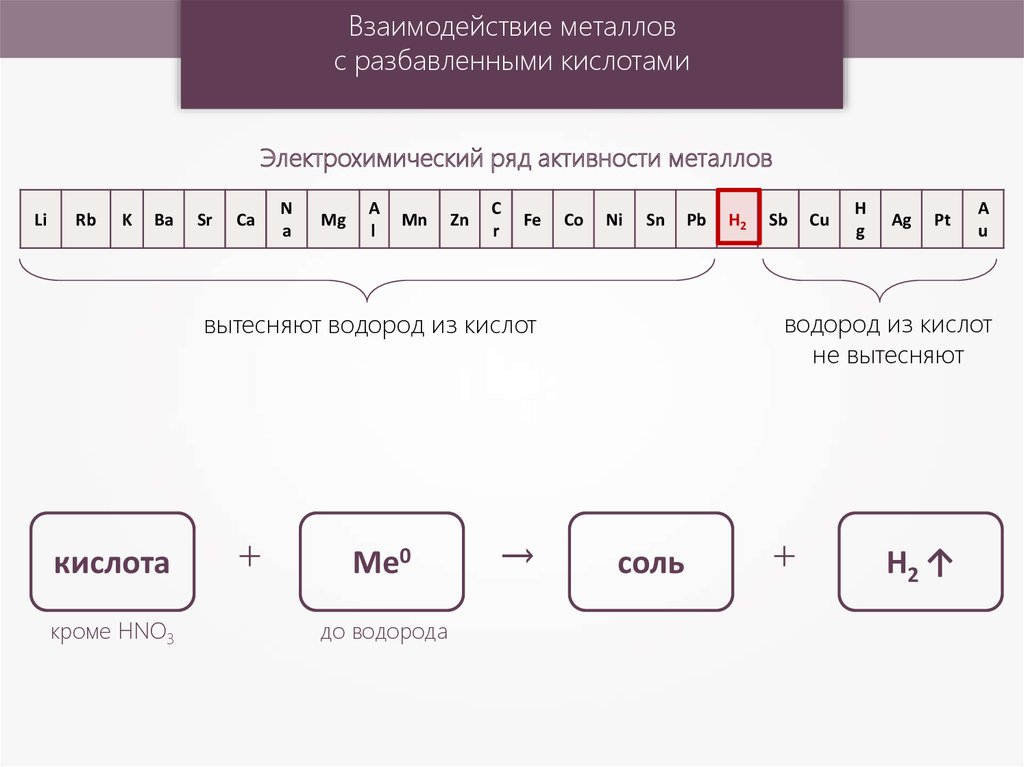
Взаимодействие металловс разбавленными кислотами
Электрохимический ряд активности металлов
Li
Rb
K
Ba
Sr
Ca
N
a
Mg
A
l
Mn
Zn
C
r
Fe
Co
Ni
Sn
кроме HNO3
+
Ме0
до водорода
→
H2
Sb
Cu
H
g
Ag
Pt
A
u
водород из кислот
не вытесняют
вытесняют водород из кислот
кислота
Pb
соль
+
H2 ↑
54.
Взаимодействие цинка с соляной кислотой0
+1
+2
0
Zn + 2HCl = ZnCl2 + H2↑
Соляная
кислота
55.
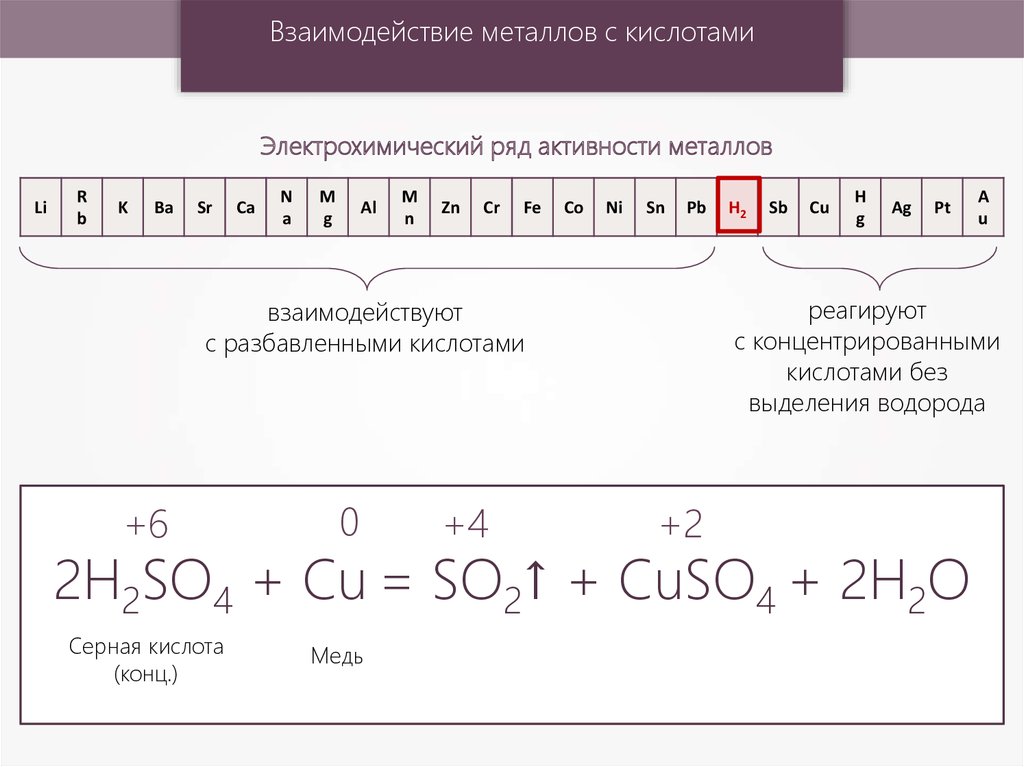
Взаимодействие металлов с кислотамиЭлектрохимический ряд активности металлов
Li
R
b
K
Ba
Sr
Ca
N
a
M
g
Al
M
n
Zn
Cr
Fe
Co
Ni
Sn
Pb
0
+4
Sb
Cu
H
g
Ag
Pt
+2
2H2SO4 + Cu = SO2↑ + CuSO4 + 2H2O
Серная кислота
(конц.)
Медь
A
u
реагируют
с концентрированными
кислотами без
выделения водорода
взаимодействуют
с разбавленными кислотами
+6
H2
56.
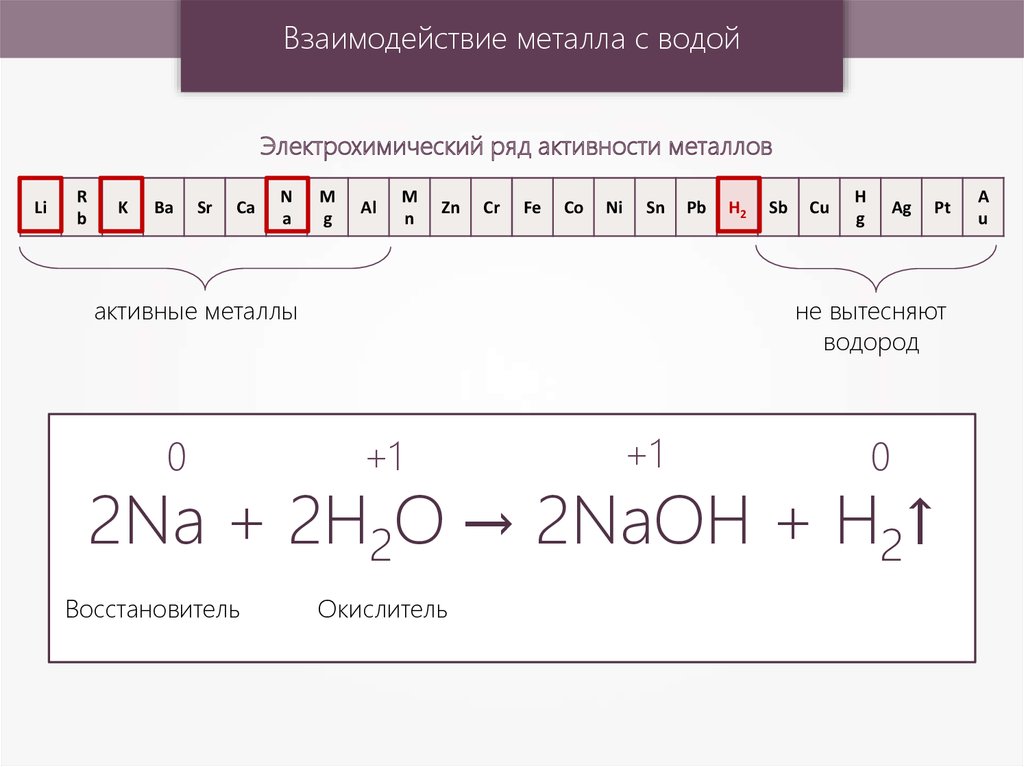
Взаимодействие металла с водойЭлектрохимический ряд активности металлов
Li
R
b
K
Ba
Sr
Ca
N
a
M
g
Al
M
n
Zn
Cr
Fe
Co
Ni
Sn
активные металлы
0
Pb
H2
Sb
Cu
H
g
Ag
Pt
не вытесняют
водород
+1
+1
0
2Na + 2H2O → 2NaOH + H2↑
Восстановитель
Окислитель
A
u
57.
Взаимодействие металлов с растворами солейЭлектрохимический ряд активности металлов
Li
R
b
K
Ba
Sr
Ca
N
a
M
g
Al
M
n
Zn
Cr
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
H
g
Ag
Pt
A
u
взаимодействуют
с растворами солей
0
+1
+2
0
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
58.
Взаимодействие меди с нитратом серебраCu + 2AgNO3 = Cu(NO3)2 + 2Ag
Восстановитель
Окислитель
59.
НеметаллыВода
Металлы
Кислоты
Соли
Электрохимический ряд активности металлов
Li
R
b
K
Ba
Sr
Ca
N
a
M
g
Al
M
n
Zn
Cr
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
H
g
Ag
Pt
A
u









































 Физика
Физика Химия
Химия








