Похожие презентации:
Регистрация ЛС и лицензирования предприятия по их производству: требования к обеспечению качества в процессе производства
1.
С.Ж. АСФЕНДИЯРОВ АТЫНДАҒЫҚАЗАҚ ҰЛТТЫҚ МЕДИЦИНА УНИВЕРСИТЕТІ
КАЗАХСКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ ИМЕНИ С.Д. АСФЕНДИЯРОВА
МОДУЛЬ «ФАРМАЦЕВТ-ТЕХНОЛОГ»
СРС
Тема: «Регистрация ЛС и лицензирования предприятия по их
производству: требования к обеспечению качества в процессе производства »
Выполнила: Кемелбекова А.
Жумабаева Ж.
Ильясова Ж.
Проверила: Жапаркулова К.
Группа: ТФП 13– 001 – 02г
Алматы, 2016 ж.
2. Содержание
I.Введение...............................................................................................................................................................2
II.
Основная часть………………………………………………………………………………………………….2
1.
Государственное регулирование в области здравоохранения осуществляется путем
проведения...........................................................................................................................................................2
2.
Государственная регистрация ЛС, ИМН, и МТ................................................................................................5
3.
Сроки проведения экспертизы ЛС в РК………………………………………………………………………8
4.
Порядок проведения экспертизы при государственной
регистрации………………………………………………………………………………………....…………..9
5.
Нормативная правовая база, регулирующая государственную регистрацию ЛС, ИМН и МТ в условиях Елицензирования…………………………………………………………………………………………………11
6.
Количество зарегистрированных ЛС, ИМН и МТ по состоянию на 01 января 2013 года…………...…….13
7.
Динамика государственной регистрации ЛС, ИМН и МТ в сегменте производителей ……………..…….14
8.
Основные причины отказов……………………………………………………………………………...…….17
9.
Текущая ситуация по гармонизации НПА в ТС и ЕЭП……………………………………………….……...19
IIІ. Заключение................................................................................................................................................................23
Литературы....................................................................................................................................................................24
3. Государственное регулирование в области здравоохранения осуществляется путем проведения:
1)2)
3)
4)
Государственного контроля за медицинской, фармацевтической
деятельностью, санемитарно – эпидемиологического надзора;
Лицензирования медицинской и фармацевтической деятельности;
Аккредитации в области здравоохранения;
Аттестации в области здравоохранения;
4.
5) Государственной регистрации, перерегистрации ивнесения изменений в регистрационное досье ЛС, ИМН,
и МТ, отдельных видов продукции и веществ,
оказывающих вредное воздействие на здоровье человека;
6) Подтверждения соответсвия товаров ( работ, услуг ) в
области здравоохранения требованиям, установленным
техническими регламентами, нормативными
документами по стандартизации условиями договоров;
7) Государственное регулирования цен на ЛС и
медицинские услуги, оказываемые государственными
организациями здравоохранения;
5. Государственная регистрация ЛС, ИМН, и МТ
Требования Казахстана при проведениигосударственной ЛС приближены и гармонизированы
со стандартами Европейского сообщества, стран СНГ
– России, Украины.
Такая система государственного контроля в
Республике Казахстан за оборотом и допуском на
рынок лекарственных средств зффективно работает
уже 10 лет.
6. Нормативная правовая база регулирующая государственную регистрацию ЛС, ИМН и МТ
Кодекс РК «О здоровье народа и системе здравоохранения»Приказ МЗ РК от 18.11.2009 года №735 «Об утверждении Правил
государственной регистрации, перерегистрации и внесения
изменений в регистрационное досье лекарственного средства,
изделий медицинского назначения и медицинской техники»
Приказ МЗ РК от 18.11.2009 года №736 «Об утверждении Правил
проведения экспертизы лекарственных средств, изделий
медицинского назначения и медицинской техники»
7.
Сроки проведения экспертизы ЛС в РКЭкспертиза ЛС при государственной регистрации –
210 календарных дней
Экспертиза государственной перерегистрации ЛС –
120 календарных дней
Экспертиза ЛС вносимых изменений
– 90 календарных дней
Ускоренная экспертиза при государственной
регистрации – 120 календарных дней
8.
После завершения экспертизы ЛС составляется заключение обезопасности, зффективности и качества ЛС
КФК издает приказ о государственной регистрации.
Сведения о ЛС в течение 1 суток заносятся в
государственный реестр ЛС.
Заявителю выдается:
Регистрационное удостоверение
Утвержденная инструкция по медицинскому применению
Нормативный документ по качеству ЛС
Макет упоковки
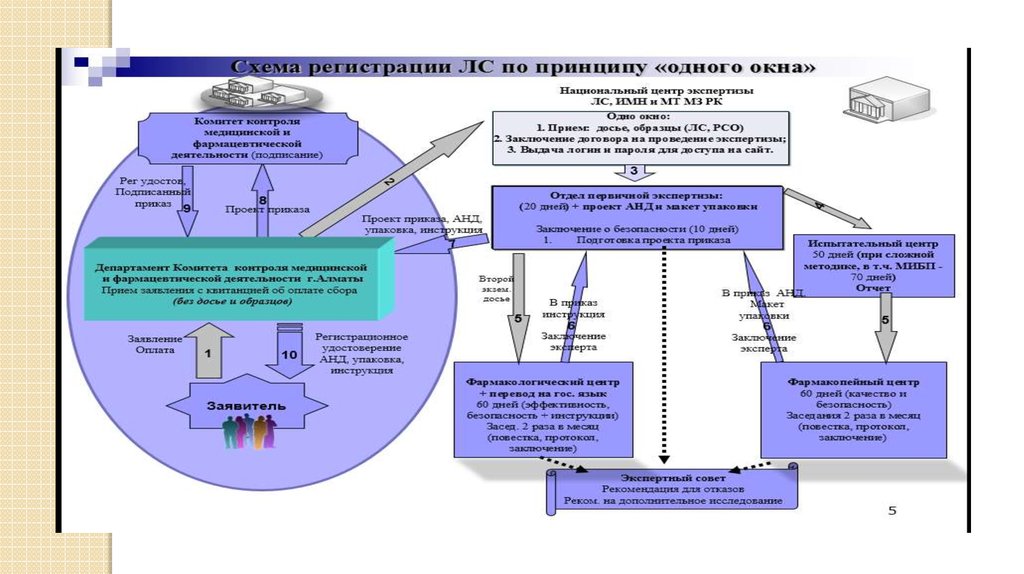
9. Порядок проведения экспертизы при государственной регистрации
Экспертиза ЛСПервичная
экспертиза
На предмет
полноты
комплектности и
правильности
оформления
документов
регистрационного
досье
(20 дней)
Аналитическая
экспертиза
На предмет соответствия
качества ЛС АНД
(физическим, химическим,
биологическим
испытаниям образцов ЛС)
оценку АНД на предмет
воспроизводимости
методик анализа
(50 дней)
Специализированная
экспертиза
Фармацевтическая
На предмет оценки
Безопасности и
качества ЛС,
в том числе
экспертиза НД РК
(60 дней)
Фармакологическая
На предмет
эффективности
и безопасности ЛС,
в том числе
экспертиза
инструкций по
медприменению
(60 дней)
10.
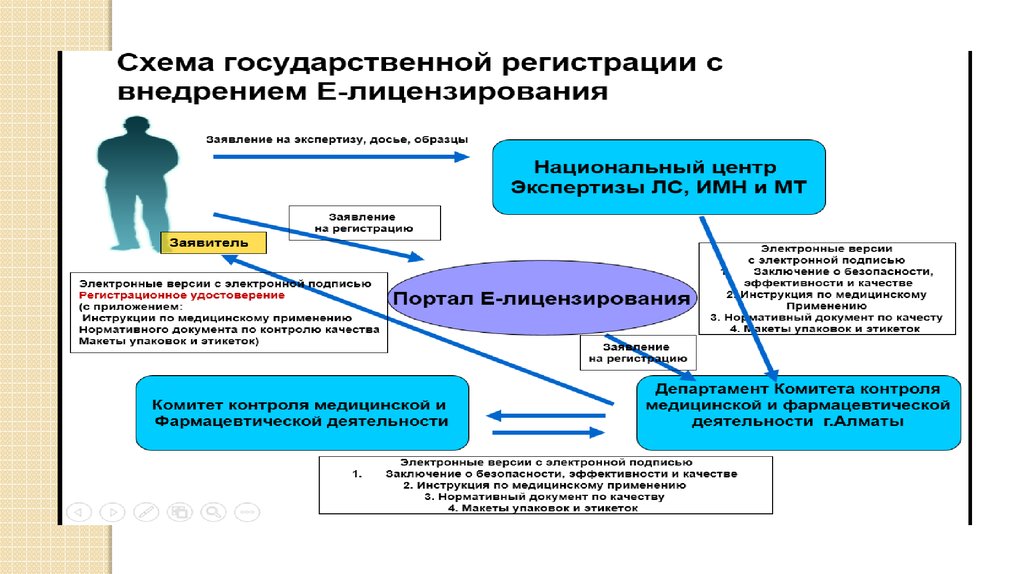
11. Нормативная правовая база, регулирующая государственную регистрацию ЛС, ИМН и МТ в условиях Е-лицензирования
Постановление Правительства РК от 12.02. 2013 года №120 обутверждении новой редакции Стандарта государственной услуги
«Государственная регистрация, перерегистрация и внесение
изменений в регистрационное досье лекарственных средств,
изделий медицинского назначения и медицинской техники»
Приказ МЗ РК «Об утверждении регламента государственной
услуги «Государственная регистрация, перерегистрация и
внесение изменений в регистрационное досье лекарственных
средств, изделий медицинского назначения и медицинской
техники» (находится на согласовании в государственных органах)
12.
13. Количество зарегистрированных ЛС, ИМН и МТ по состоянию на 01 января 2013 года
Всегов Республике Казахстан зарегистрировано
и внесено в Государственный реестр 14 453
наименований ЛС, ИМН и МТ из более чем 80
государств мира
Лекарственных средств – 7 340
Изделий медицинского назначения и
Медицинской техники – 7 113
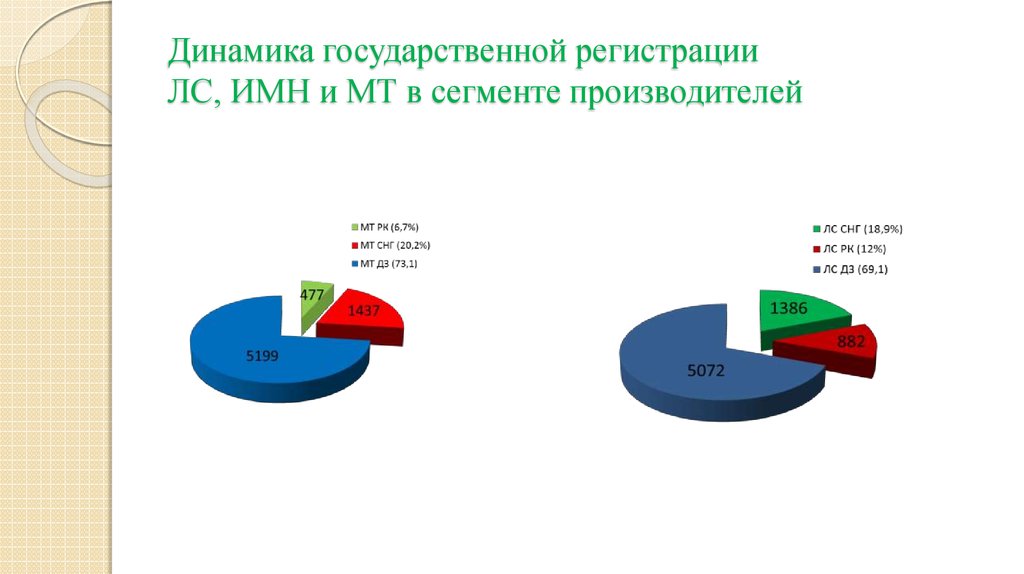
14. Динамика государственной регистрации ЛС, ИМН и МТ в сегменте производителей
15.
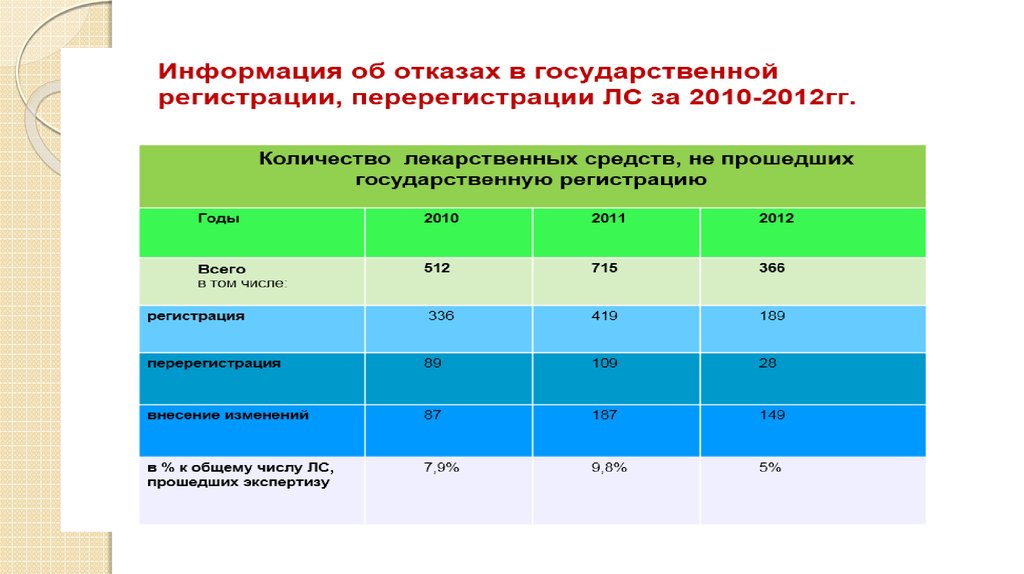
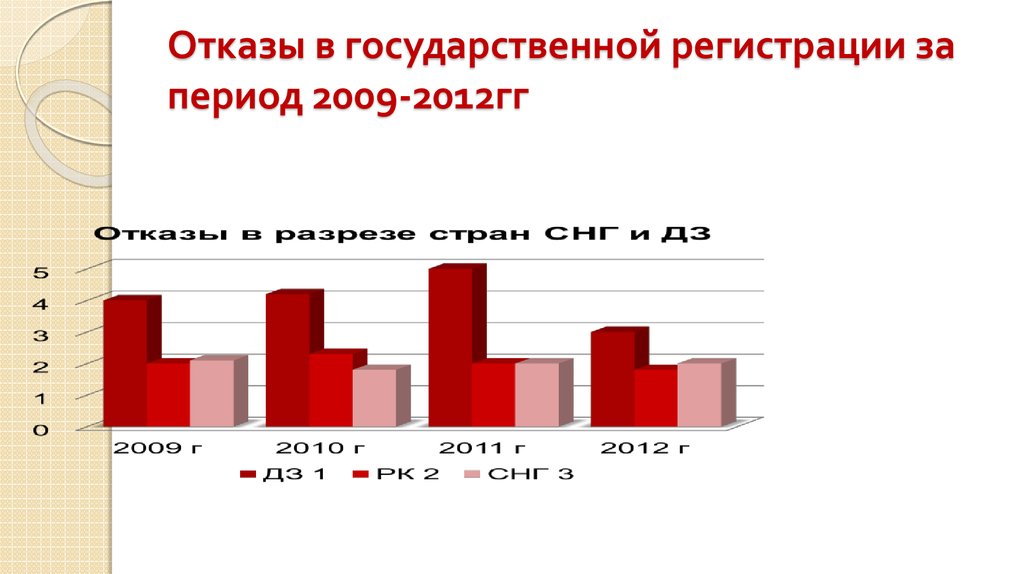
16. Отказы в государственной регистрации за период 2009-2012гг
17. Основные причины отказов
отказ заявителяболее низкой безопасности и эффективности
ЛС по сравнению с ранее
зарегистрированными аналогами
более низких показателей качества и
безопасности, регламентированных ГФ РК
получение отрицательных результатов
клинических и (или) других исследований
наличие в составе лекарственного средства
веществ, запрещенных к применению в РК
наличие в регистрационном досье
недостоверных сведений
несоответствие представленного комплекта
регистрационного досье требуемому
18.
Единые требования к выпуску в обращение лекарственных средств,
включающие разработку и принятие:
Единых требований к Правилам регистрации ЛС на территории Таможенного
союза
Единых требований к перечню документов регистрационного досье, единой
формы регистрационного удостоверения
Единых требований к инструкции по медицинскому применению
Единых требований к маркировке ЛС
Единых фармакопейных требований к качеству ЛС
Единого классификатора лекарственных форм
Единых правил доклинических исследований
Единых правил клинических исследований
Единых правил производства ЛС
Единых требований инспекций производства
Единого Реестра ЛС
19. Текущая ситуация по гармонизации НПА в ТС и ЕЭП
В настоящее время проведено 4 рабочих заседания пообсуждению Положения о рабочей группе и проекта
Соглашения о единых принципах и правилах обращения ЛС на
единой таможенной территории ТС
Достигнута договоренность о поэтапном введении в
действие Соглашения в отношении ЛС, производимых
производителями государств-членов ТС и ввозимых из
третьих стран
Разрабатывается процедура взаимного признания или
децентрализованная процедура регистрации по аналогии с
опытом ЕС
20.
Первым этапомявляется принятие пакета нормативных правовых
актов, определяющих единые требования к
выпуску в обращение лекарственных средств
Вторым этапом
является переход к процедуре регистрации ЛС по
опыту Европейского союза
21. Схема взаимного признания регистрационного удостоверения ЛС в рамках Таможенного союза
22.
Регистрационное досье – комплект документов и материалов установленного содержанияпредставляемый вместе с заявлением на государственную регистрацию перерегистрацию
лекарственного средства и внесение изменений в регистрационное досье. Экспертиза ЛС
при ГР, перерегистрации и внесении изменений в регистрационное досье в соответсвии с
приказом МЗРК от 18.11.2009 года №735 «Об утверждении Правил государственной
регистрации, перерегистрации и внесения изменений в регистрационное досье
лекарственного средства, изделий медицинского назначения и медицинской техники»
Состоит из следующих этапов:
1.
Первичный экспертиза;
2.
Аналитическая экспертиза;
3.
Специализированная фармацевтическая экспертиза;
4.
Специализированная фармакологическая экспертиза;
5.
Заключения о безопасности,эффективности и качества.
Каждый последующий этап этап лекарственного средства проводится на основании
положительного заключения предыдущего этапа экспретизы.Чтобы зарегистрировать
лекарственный препарат, должны проводится все эти этапы в обязательном порядке.
23. Заключение:
И в заключении хотелось бы сказать,что государственной регистрации и перерегистрацииподлежат произведенные в Республике Казахстан, а также ввозимые на ее территорию изделия медицинского
назначения и медицинская техника, с учетом их классификации в зависимости от степени потенциального
риска применения в медицинских целях.Только при наличии государственной регистрации всех
лекарственных средств,изделий медицинского назначения,медицинскую технику можно реализовать на
территории Республики Казахстан. Обязательным условием государственной регистрации, перерегистрации,
внесение изменений в регистрационное досье является проведение экспертизы изделия медицинского
назначения и медицинской техники, осуществляемой государственной экспертной организацией в сфере
обращения лекарственных средств, изделий медицинского назначения и медицинской техники.Экспертизу
проводит государственная экспертная организация, не принимающая непосредственного участия в разработке
и производстве лекарственного средства, изделий медицинского назначения и медицинской техники. При
условии одновременной подачи на государственную регистрацию, перерегистрацию нескольких изделий
медицинского назначения и медицинской техники одного модельного ряда (серии), имеющих один общий
документ, подтверждающий регистрацию в стране-производителе, изготовленных одной организациейпроизводителем, отличающихся друг от друга техническими параметрами, не влияющими на принцип
работы, функциональное назначение, область применения и класс безопасности, заявитель представляет одно
заявление, с указанием объема, размера, цветовой гаммы изделий медицинского назначения и медицинской
техники и одно регистрационное досье. При одновременной подаче на государственную регистрацию,
перерегистрацию различных моделей (типов, видов) однородных изделий медицинского назначения и
медицинской техники, изготовленных одной организацией-производителем, отличающихся друг от друга
конструкцией, принципом работы, заявитель представляет отдельные заявления и регистрационные досье на
каждую модель (тип, вид).
24. Литературы:
В сентябре 2008 года внедрен новый веб – сайтwww.dari.
Материалы сайта представлены на 2 – х языках –
государственном и русском
• РГП на ПХВ «Национальный центр экспертизы
лекарственных средств, изделий медицинского
назначения и медицинской техники»
• Google.kz




















 Медицина
Медицина