Похожие презентации:
Материальные расчеты равновесных ВТП
1.
ЛЕКЦИЯ № 5ПЕРВАЯ ПОСТАНОВКА ЗАДАЧ МР РВТП
Исходные данные:
1) состав исходных компонентов;
2) соотношения расходов отдельных компонентов;
3) перечень химических реакций, равновесием которых
определяется равновесный состав продуктов;
4) термодинамические параметры продуктов: pп, Tп.
Искомые величины – те же, что
и в МР_ИВТП.
1
2.
Пример 3.6Доменная
печь
Равновесная паровая конверсия природного газа
Формулировка задачи сводится к трем группам уравнений:
1. УМБ химических элементов;
2. Уравнение нормировки;
3. Уравнения равновесия.
Исходные данные:
1. состав топлива:
т
т
т
т
т
CH4 , C2H6 , C3H8 , CO2 , N2 , %,
влагосодержание топлива d т 0 , г/м3;
ок
2. состав окислителя: H 2O
100 % ;
3. удельный расход окислителя: Vок , м3/(м3 топлива);
4. перечень химических реакций,
равновесием
равновесный состав продуктов:
1)
CH 4 H 2O CO 3H 2 ,
2)
CO H 2O CO 2 H 2 ;
которых
определяется
5. давление и температура продуктов конверсии: рп.к , Tп.к .
Искомые величины:
VCH4 ; VCO ; VCO2 ; VH2 ; VH2O ; VN2 ; Vп.к , м3/(м3 топлива).
2
3.
Пример 3.6Доменная
печь
Решение
Уравнение материального баланса по углероду
VCH 4 VCO VCO2
т
т
т
т
0,01 CH4 2C 2 H 6 3C3H8 CO2
12
12 , кг С/(м3 топлива);
22,4
22,4
или после преобразований в размерности м3 С /(м3 топлива)
т
т
т
т
VCH4 VCO VCO2 0,01 CH4 2C2H6 3C3H8 CO2 .
(1)
Уравнение материального баланса по кислороду (м3 О /(м3 топлива))
т
VH2O VCO 2VCO2 0,01 2CO2 Vок .
(2)
Уравнение материального баланса по водороду (м3 Н2 /(м3 топлива))
т
т
т
2VCH4 VH2O VH2 0,01 2CH4 3C2H6 4C3H8 Vок .
(3)
Уравнение материального баланса по азоту (м3 N2 /(м3 топлива))
т
VN2 0,01 N 2 .
(4)
3
4.
Пример 3.6Доменная
печь
Уравнение закона действующих масс для реакции 1 (см. выше п.4 исходных
данных)
3
pCO pH2
pCН 4 pH2O
K р1 Tп.к или
3
V COV H2
V CН 4 V H 2O
2
pп.к
K р1 Tп.к .
Vп.к
(5)
Уравнение закона действующих масс для реакции 2 (см. выше п.4 исходных
данных)
pCO2 pH 2
pCO pH2O
K р 2 Tп.к или
V CO2 V H 2
K р 2 Tп.к .
V COV H2O
(6)
Уравнение нормировки
Vп.к V CН4 V CO V CO2 V H2 V H2O V N2 .
(7)
Семь уравнений (1) – (7) и семь неизвестных. Система замкнута.
4
5.
СлучайпечьI
Доменная
Случай I
Продукты процесса – смесь идеальных газов (например, паровая конверсия
метана). Здесь уравнения равновесия – это уравнения закона действующих масс
или уравнения констант равновесия.
В примере 3.6 для уравнения паровой конверсии метана
CH 4 H 2O CO 3H 2
уравнение закона действующих масс имеет вид
3
pCO pH2
pCН 4 pH2O
Парциальные
равенством
давления
и
pj
K р Tп.к .
удельные
Vj
Vп.к
(8)
выходы
компонентов
связаны
pп.к ,
с учетом которого уравнение (8) приводится к виду
2
3
V COV H 2 pп.к
K р Tп.к .
V CН 4 V H 2O Vп.к
(9)
5
6.
Случай печьII
Доменная
Случай II
В продуктах процесса – смесь веществ в различных агрегатных состояниях
(в твердом или жидком виде: СН4, С), но каждое вещество – в чистом виде, не
растворяет и не растворяется в других.
CH 4 C 2H 2
2
Kр
pH2
.
pCН 4
Подходы к рассмотрению других случаев изложены в [1].
6
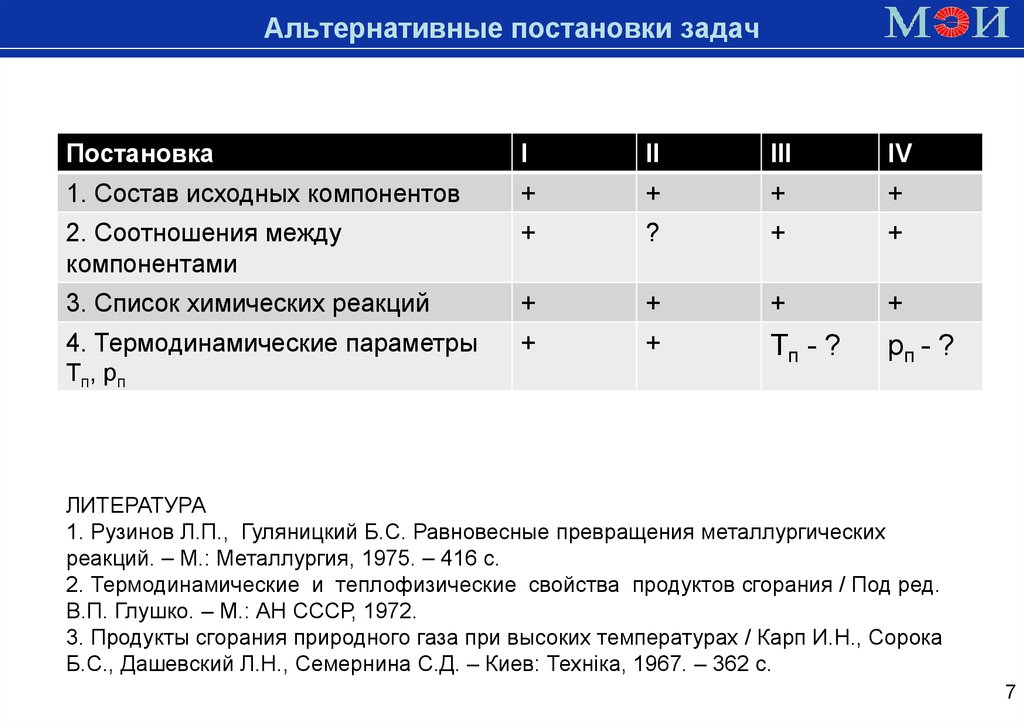
7.
Альтернативныепостановки
Доменная
печь задач
Постановка
I
II
III
IV
1. Состав исходных компонентов
+
+
+
+
2. Соотношения между
компонентами
+
?
+
+
3. Список химических реакций
+
+
+
+
4. Термодинамические параметры
Tп, рп
+
+
Tп - ?
рп - ?
ЛИТЕРАТУРА
1. Рузинов Л.П., Гуляницкий Б.С. Равновесные превращения металлургических
реакций. – М.: Металлургия, 1975. – 416 с.
2. Термодинамические и теплофизические свойства продуктов сгорания / Под ред.
В.П. Глушко. – М.: АН СССР, 1972.
3. Продукты сгорания природного газа при высоких температурах / Карп И.Н., Сорока
Б.С., Дашевский Л.Н., Семернина С.Д. – Киев: Техніка, 1967. – 362 с.
7






 Физика
Физика








