Похожие презентации:
Магнитные наночастицы в современной медицине
1. МАГНИТНЫЕ НАНОЧАСТИЦЫ В СОВРЕМЕННОЙ МЕДИЦИНЕ
2. СТРУКТУРА УЧЕБНОГО СОДЕРЖАНИЯ
1.Определение
2.
Магнитные свойства
3.
Методы получения магнитных наночастиц
3.1. Химические методы синтеза магнитных наночастиц
4.
Стабилизация магнитных наночастиц
5.
Области применения магнитных наночастиц
5.1. Применение магнитных наночастиц в МРТ
5.2. Магнитные наночастицы в тераностике
3. ОПРЕДЕЛЕНИЕ
4. Определение
Магнитные наночастицы (МНЧ) – наночастицы, имеющиепостоянный или наведенный магнитный момент.
Магнитные
наночастицы
могут
состоять
ферримагнитных или суперпарамагнитных материалов.
из
ферро-,
Магнитные наночастицы по своему химическому составу могут
представлять:
Металлы: Co, Ni, Fe
Оксиды металлов: Fe3O4,
Fe2O3, CoFe2O4,
MnFe2O4,
ZnFe2O4
Магнитные сплавы: FePt, FePd, CoPt, CoPt3, NdFeB, SmCo5
5. МАГНИТНЫЕ СВОЙСТВА
6. Магнитные свойства
Вещества проявляют магнитные свойства вследствие внутреннихдвижений электрических зарядов, так называемых круговых токов.
Источниками таких токов, обладающих магнитными моментами,
являются электронные спины и орбитальное вращение электронов в
атомах.
Все вещества так или иначе обладают магнитными свойствами.
Принято выделять две группы: магнитно-неупорядоченные и магнитноупорядоченные.
В класс магнитно-неупорядоченных вещества входят две группы
веществ: диамагнетики и парамагнетики. Диамагнетики отталкиваются
от магнита, а парамагнетики притягиваются к нему. Для более точного
отличия диамагнетика от парамагнетика используют магнитную
восприимчивость (χ).
Магнитная восприимчивость – физическая величина, характеризующая связь между намагниченностью (I) и магнитным полем
вещества (H). Для парамагнетиков χ>0, а для диамагнетиков χ<0.
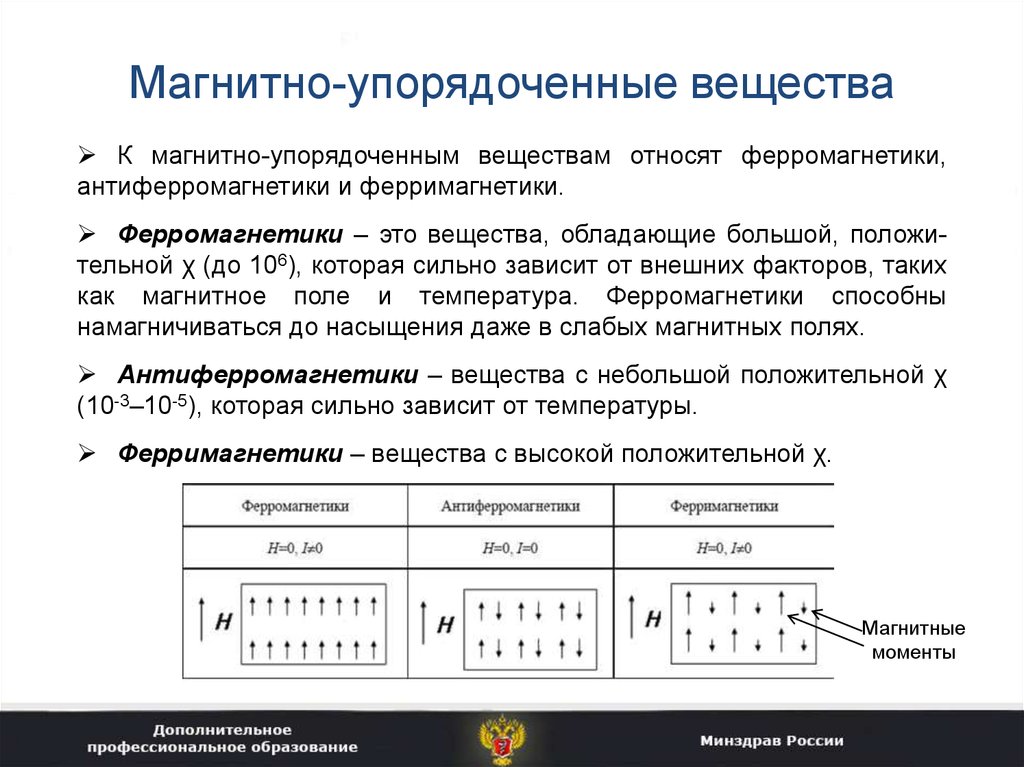
7. Магнитно-упорядоченные вещества
К магнитно-упорядоченным веществам относят ферромагнетики,антиферромагнетики и ферримагнетики.
Ферромагнетики – это вещества, обладающие большой, положительной χ (до 106), которая сильно зависит от внешних факторов, таких
как магнитное поле и температура. Ферромагнетики способны
намагничиваться до насыщения даже в слабых магнитных полях.
Антиферромагнетики – вещества с небольшой положительной χ
(10-3–10-5), которая сильно зависит от температуры.
Ферримагнетики – вещества с высокой положительной χ.
Магнитные
моменты
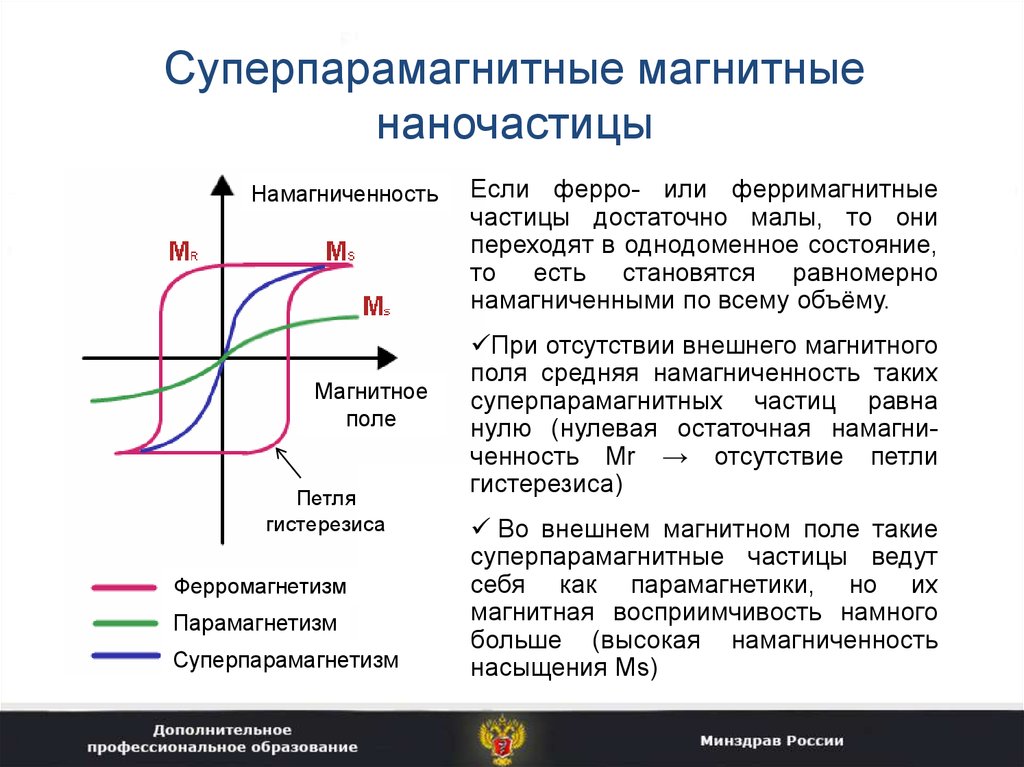
8. Суперпарамагнитные магнитные наночастицы
НамагниченностьМагнитное
поле
Петля
гистерезиса
Ферромагнетизм
Парамагнетизм
Суперпарамагнетизм
Если ферро- или ферримагнитные
частицы достаточно малы, то они
переходят в однодоменное состояние,
то есть становятся равномерно
намагниченными по всему объёму.
При отсутствии внешнего магнитного
поля средняя намагниченность таких
суперпарамагнитных частиц равна
нулю (нулевая остаточная намагниченность Mr → отсутствие петли
гистерезиса)
Во внешнем магнитном поле такие
суперпарамагнитные частицы ведут
себя как парамагнетики, но их
магнитная восприимчивость намного
больше (высокая намагниченность
насыщения Ms)
9. МЕТОДЫ ПОЛУЧЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ
10. Классификация
1. Физические методы (из компактногодиспергирования различными методами)
материала
путем
2. Химические методы
Направленный синтез (из химических соединений путем
направленного изменения их состава с последующей остановкой
роста новой фазы на стадии наноразмеров)
Химическое
превращение
(наночастицы
превращаются в наночастицы другого состава)
одного
состава
3. Микробиологические методы (самоорганизация наноструктур в
живых организмах)
11. Особенности синтеза магнитных наночастиц
В ходе синтеза наночастиц любой природы (в том числе и магнитныхнаночастиц) необходимо учитывать особенность данных систем:
Неравновесность наносистем. Практически все наносистемы
характеризуются термодинамической неустойчивостью, и процесс их
синтеза проходит в условиях, далеких от равновесных, что позволяет
добиться спонтанного зародышеобразования и избежать роста и
агрегации сформировавшихся наночастиц.
Монодисперсность. Т.к. физико-химические, фармакологические и
токсические свойства наночастиц чрезвычайно сильно зависят от их
размера,
для
получения
наносистем
с
оптимальными
функциональными характеристиками необходимо синтезировать
наночастицы с достаточно узким распределением по размерам, избегая
образования сильно полидисперсных систем.
12. Физические методы получения магнитных наночастиц
Механохимический синтез (измельчение с помощью шаровых,вибрационных, планетарных и других мельниц)
Осаждение в газовой фазе (испарение материала под
воздействием плазмы, электрической дуги, лазера с последующей
конденсацией пара наночастиц в инертной атмосфере)
Электронно-лучевая литография (остросфокусированный с
помощью магнитных линз электронный пучок действует на поверхность
слоя полимера (резиста), чувствительного к электронному облучению.
Участки поверхности, на которые попало излучение через специальную
маску, очищаются от резиста с помощью проявителя. Через
полученные окна в плёнке резиста производится вакуумное напыление
подходящего материала, после чего неэкспонированный излучением
резист также смывают другим растворителем)
Электроэррозия (при образовании дуги между электродами,
погруженными в ванну с жидкостью, вещество электродов частично
диспергируется и взаимодействует с жидкостью с образованием
дисперсного порошка)
13. 1. Химические методы получения магнитных наночастиц
14. Химические методы получения магнитных наночастиц
Метод соосаждения и осаждения (соосаждение / осаждение солей изводных растворов при контролируемом добавлении щелочи, окислителей и
пр.)
Термолиз металлсодержащих
соединений (разложение под
действием температуры лабильных прекурсоров металлов, таких как
пентакарбонил, ацетилацетонат и соли длинноцепочечных органических
кислот (олеат, стеарат, пальмитат, и другие) в высококипящих органических
растворителях)
Гидротермальный метод (гидролиз прекурсоров металла при высоких
давлениях и температурах в герметичном автоклаве)
Золь-гель метод (первичное осаждения золя гидроксида металла с
помощью гидролиза прекурсора, после этого спонтанная поликонденсация
гидроксида с образованием геля и отжиг, ведущий к образованию
наночастиц)
Ультразвуковой метод (разложение нестабильных прекурсоров железа
в условиях ультразвукового воздействия)
Синтез в обратных мицеллах (химический синтез наночастиц в
ограниченном объеме нанореактора – мицеллы)
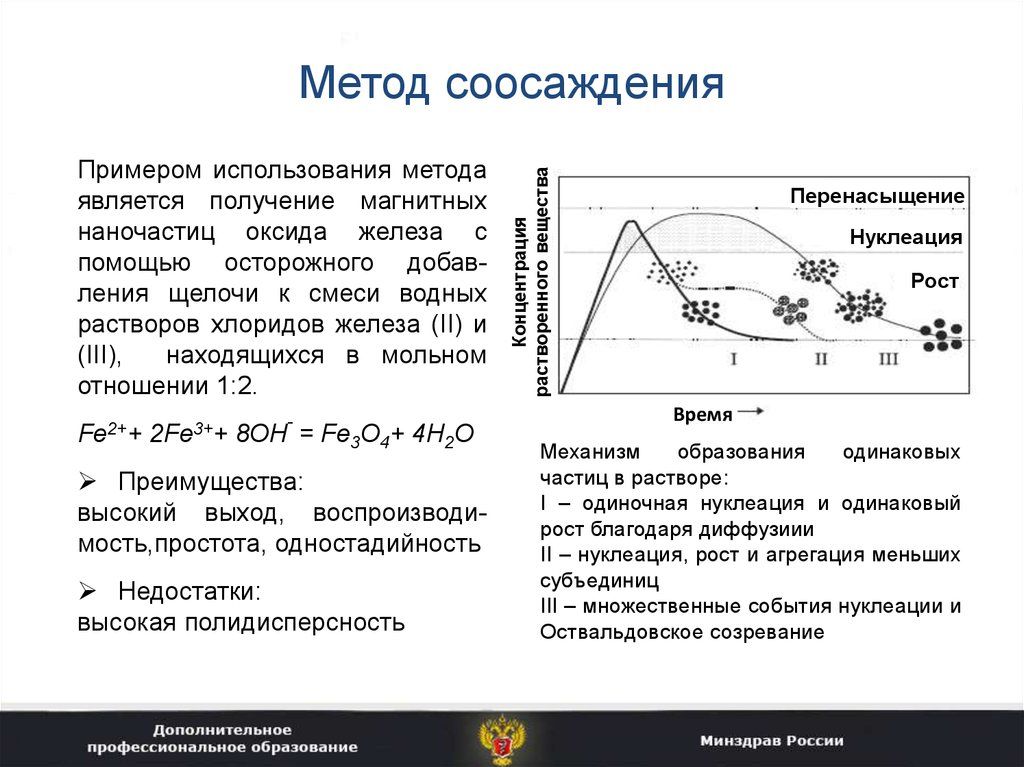
15. Метод соосаждения
Примером использования методаявляется получение магнитных
наночастиц оксида железа с
помощью осторожного добавления щелочи к смеси водных
растворов хлоридов железа (II) и
(III),
находящихся в мольном
отношении 1:2.
-
Fe2++ 2Fe3++ 8OH = Fe3O4+ 4H2O
Преимущества:
высокий выход, воспроизводимость,простота, одностадийность
Недостатки:
высокая полидисперсность
Концентрация
растворенного вещества
Метод соосаждения
Перенасыщение
Нуклеация
Рост
Время
Механизм
образования
одинаковых
частиц в растворе:
I – одиночная нуклеация и одинаковый
рост благодаря диффузиии
II – нуклеация, рост и агрегация меньших
субъединиц
III – множественные события нуклеации и
Оствальдовское созревание
16. Синтез в обратных мицеллах
Мицеллы – термодинамическистабильные коллоиды, образованные
двумя несмешивающимися жидкостями за счет стабилизации границы
раздела монослоем поверхностноактивных веществ.
Нанореактор
Органический
растворитель
Гидрофобная
часть ПАВ
Гидрофильная
часть ПАВ
Обратные мицеллы - мицеллы, в
которых капли воды распределены в
фазе неполярного растворителя.
Размер капель принимает значения порядка десятков нанометров, и
может быть предсказуемо проконтролирован за счет варьирования соотношения вода-растворитель-ПАВ – это
позволяет
регулировать
размер
получаемых наночастиц, и повышать
их монодисперсность.
Наночастица
оксида железа
FeCl3 + FeCl2 + NaOH + H2O
Преимущества:
низкая полидисперсность
Недостатки:
содержит несколько стадий
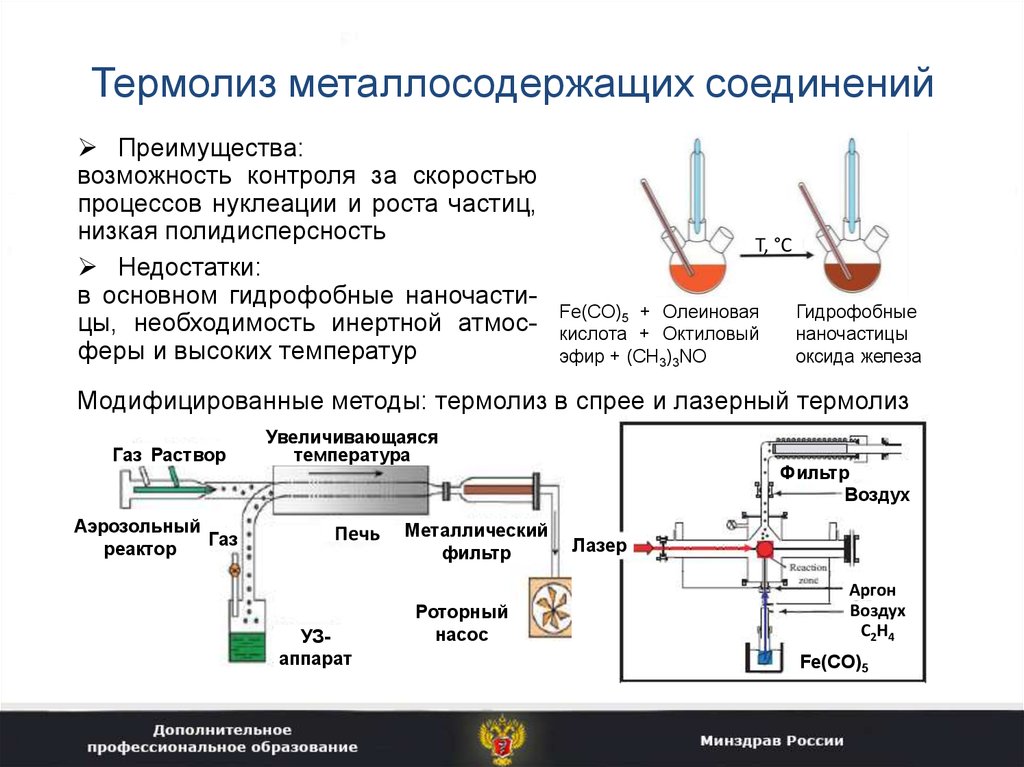
17. Термолиз металлосодержащих соединений
Преимущества:возможность контроля за скоростью
процессов нуклеации и роста частиц,
низкая полидисперсность
Недостатки:
в основном гидрофобные наночастицы, необходимость инертной атмосферы и высоких температур
T, °С
Fe(CO)5 + Олеиновая
кислота + Октиловый
эфир + (CH3)3NO
Гидрофобные
наночастицы
оксида железа
Модифицированные методы: термолиз в спрее и лазерный термолиз
Газ Раствор
Аэрозольный
Газ
реактор
Увеличивающаяся
температура
Печь
УЗаппарат
Металлический
фильтр
Роторный
насос
Фильтр
Воздух
Лазер
Аргон
Воздух
С2Н4
Fe(CO)5
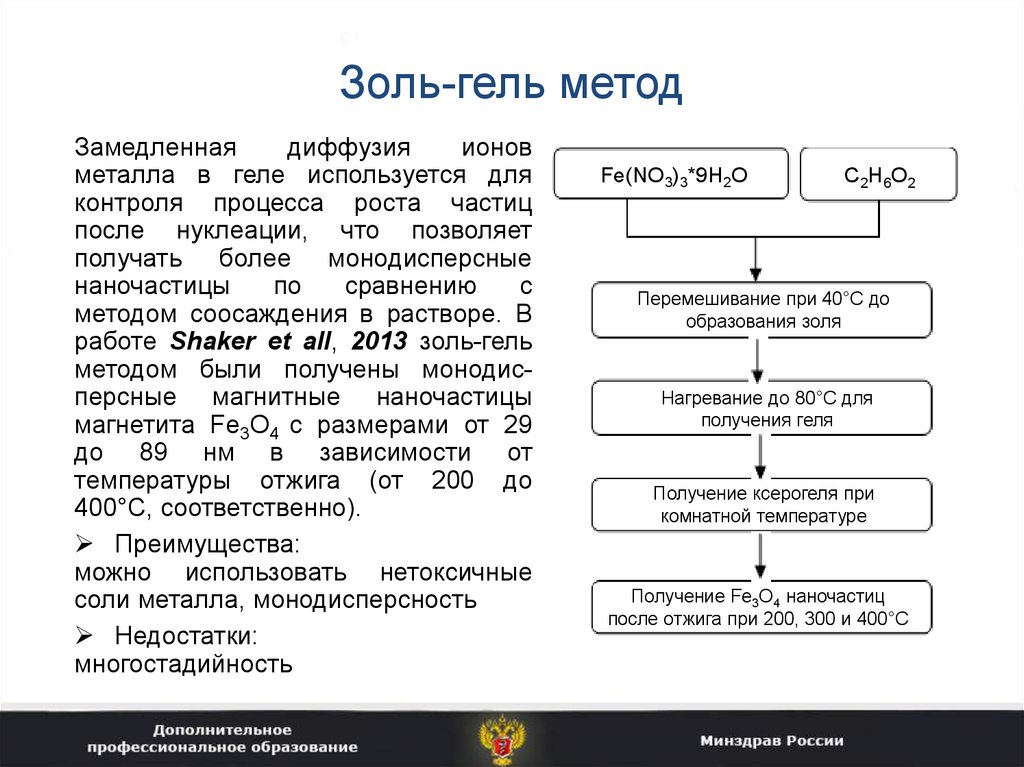
18. Золь-гель метод
Замедленнаядиффузия
ионов
металла в геле используется для
контроля процесса роста частиц
после нуклеации, что позволяет
получать более монодисперсные
наночастицы
по
сравнению
с
методом соосаждения в растворе. В
работе Shaker et all, 2013 золь-гель
методом были получены монодисперсные магнитные наночастицы
магнетита Fe3O4 с размерами от 29
до 89 нм в зависимости от
температуры отжига (от 200 до
400°С, соответственно).
Преимущества:
можно использовать нетоксичные
соли металла, монодисперсность
Недостатки:
многостадийность
Fe(NO3)3*9H2O
C2H6O2
Перемешивание при 40°С до
образования золя
Нагревание до 80°С для
получения геля
Получение ксерогеля при
комнатной температуре
Получение Fe3O4 наночастиц
после отжига при 200, 300 и 400°С
19. Микробиологические методы получения магнитных наночастиц
Живые организмы могут быть использованы как прямой источникультрадисперсных материалов, свойства которых могут быть изменены
путем варьирования биологических условий синтеза или переработки.
В настоящее время ультрадисперсные материалы могут быть
получены из ряда биологических объектов, например, ферритинов и
связанных с ними белков, содержащих железо, магнетических бактерий
и другое.
С помощью микроорганизмов стало возможным проводить
химические реакции для извлечения из руд различных металлов, минуя
традиционные технологические процессы.
20. Сравнение методов получения магнитных наночастиц
Физические методы синтеза (возможно получать магнитныенаночастицы с высоким уровнем поверхностной энергии и более
чистые по химическому составу, но очень дорогостоящие и требует
значительных затрат энергии)
Химические методы синтеза (требуют мало затрат энергии,
процесс синтеза экономичен, можно варьировать параметры
наночастиц в широких пределах путем изменения условий проведения
синтеза, и получать магнитные наночастицы, пригодны как для
применения in vitro, так и для in vivo)
Микробиологические методы синтеза (чрезвычайно хорошо
подходят для in vivo применений, но не универсальны, требуют
тщательного контроля за условиями и еще недостаточно хорошо
изучены)
В связи с этим, наиболее распространенными методами получения
магнитных наночастиц являются химические.
21. СТАБИЛИЗАЦИЯ МАГНИТНЫХ НАНОЧАСТИЦ
22. Стабилизация магнитных наночастиц
Для биомедицинских применений магнитных наночастиц оксидажелеза необходимым шагом является осуществление их покрытия с
целью обеспечения коллоидной стабильности частиц
Для магнитных наночастиц устойчивость к агрегации определятся
суммарным вкладом Ван-дер-Ваальсовых, электростатических и
магнитных взаимодействий между ними. Частицы являются коллоидно
стабильными, когда достаточно велики силы электростатического
отталкивания между ними, определяющиеся зарядом поверхности
частиц.
Например, заряженные группы, присутствующие на поверхности
наночастиц оксида железа, имеют изоэлектрическую точку, близкую к
6.8, и поэтому в физиологических условиях частицы без покрытия
склонны агрегировать.
23. Функции покрытий для магнитных наночастиц
снижение агрегации (увеличение стабильности в водном растворе)увеличение времени циркуляции в крови
облегчение дальнейшей модификации различными молекулами
снижение токсичности
увеличение захвата определенными органами и тканями
придание свойств, нехарактерных для самих магнитных наночастиц
(флуоресценция, плазмонный резонанс, термочувствительность и пр.)
обеспечение контролируемого высвобождения
препаратов из магнитных наночастиц
тонкое управление
форма, заряд)
…
физико-химическими
лекарственных
свойствами
(размер,
24. Требования к покрытиям для магнитных наночастиц
Для осуществления направленной доставки лекарственных препаратови визуализирующих агентов, а также осуществления активного нацеливания
с помощью биомолекул, необходимо их связывание с поверхностью
магнитных наночастиц. В большинстве случаев, прямое взаимодействие
таких молекул с функциональными химическими группами на поверхности
магнитных
наночастиц,
получаемых
вышеописанными
методами,
невозможно, поэтому логичным шагом является введение промежуточного
покрытия, содержащего активные группы, способные к взаимодействию.
Таким образом, оптимальное покрытие магнитных наночастиц для
биомедицинских применений должно обладать следующими свойствами:
гидрофильность и наличие электростатического заряда
физиологических pH для обеспечения коллоидной стабильности
при
наличие функциональных групп, способных взаимодействовать с
лекарственными, визуализирующими или нацеливающими молекулами
биосовместимость
и
магнитных наночастиц
биодеградируемость
для
безопасности
25. Виды покрытий магнитных наночастиц
органические синтетические полимеры (хитозан, декстран,полиэтиленгликоль - ПЭГ, поли-D,L-лактид-ко-гликолид – PLGA,
поливинилпироллидон - ПВП, поливинилсульфон - ПВС и пр.)
белки (альбумины, коллаген, казеин и пр.)
cиланы
(меркаптопропил
триметоксисилан
аминопропил) триэтоксисилан – APTES и пр.)
–
MPTS,
(3-
неорганические соединения (оксид кремния - SiO2, графит – С и пр.)
металлы (золото - Au, гадолиний - Gd и пр.)
органические
мономеры
карбоновые кислоты и пр.)
…
(пирокатехин,
алкилсульфонаты,
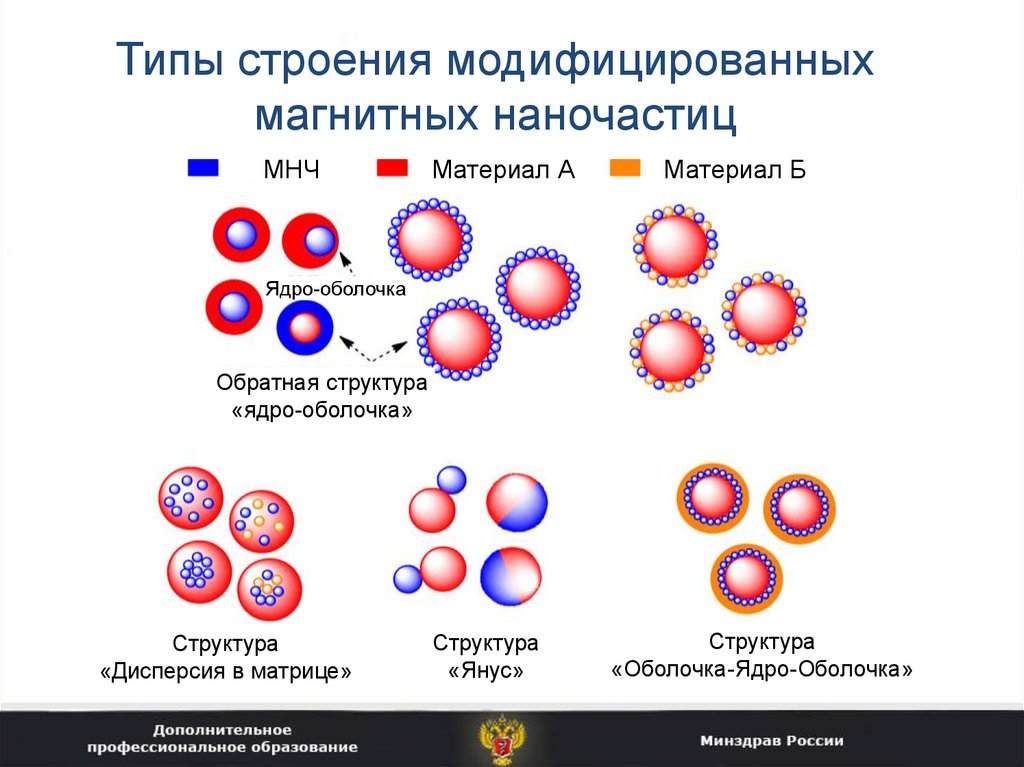
26. Типы строения модифицированных магнитных наночастиц
МНЧМатериал А
Материал Б
Ядро-оболочка
Обратная структура
«ядро-оболочка»
Структура
«Дисперсия в матрице»
Структура
«Янус»
Структура
«Оболочка-Ядро-Оболочка»
27. ОБЛАСТИ ПРИМЕНЕНИЯ МАГНИТНЫХ НАНОЧАСТИЦ
28. Области применения магнитных наночастиц
Магнитно-резонансная томография (МРТ)Магнитная сепарация
Магнитная гипертермия
Магнитная визуализация частиц
Магнитная биодетекция
Доставка лекарств
Магнитофекция
Ультравысокочастотная терапия
…
29. 1. Применение магнитных наночастиц в МРТ
30. Применение магнитных наночастиц в МРТ
Взаимодействие радиочастотного поля с магнитными ядрами,находящимися во внешнем магнитном поле, служит основой метода МРТ. У
биологических объектов роль таких магнитных ядер отведена протонам в
молекулах воды.
МР – изображения можно построить тремя основными способами:
измерение концентрации протонов
измерение
времени
спин-спиновой
релаксации
Т2
(время
энергетического обмена между магнитными ядрами водорода)
измерение времени спин-решеточной релаксации Т1 (время
энергетического обмена между решёткой и магнитными ядрами
Т.к. концентрация протонов в тканях является практически постоянной
величиной, для повышения контраста в МР-изображении используют
контрастные агенты, стимулирующие Т1 или Т2 – релаксации.
Парамагнитные
низкомолекулярные
комплексы,
способные
координировать молекулы воды и ускорять спин-решеточную релаксацию,
являются Т1-контрастными агентами (например, хелаты гадолиния).
Т2-контрастными
агентами
обычно
являются
ферро
и
суперпарамагнитные наночастицы оксида железа, создающие вокруг себя
магнитное поле и уменьшающие время спин-спиновой релаксации.
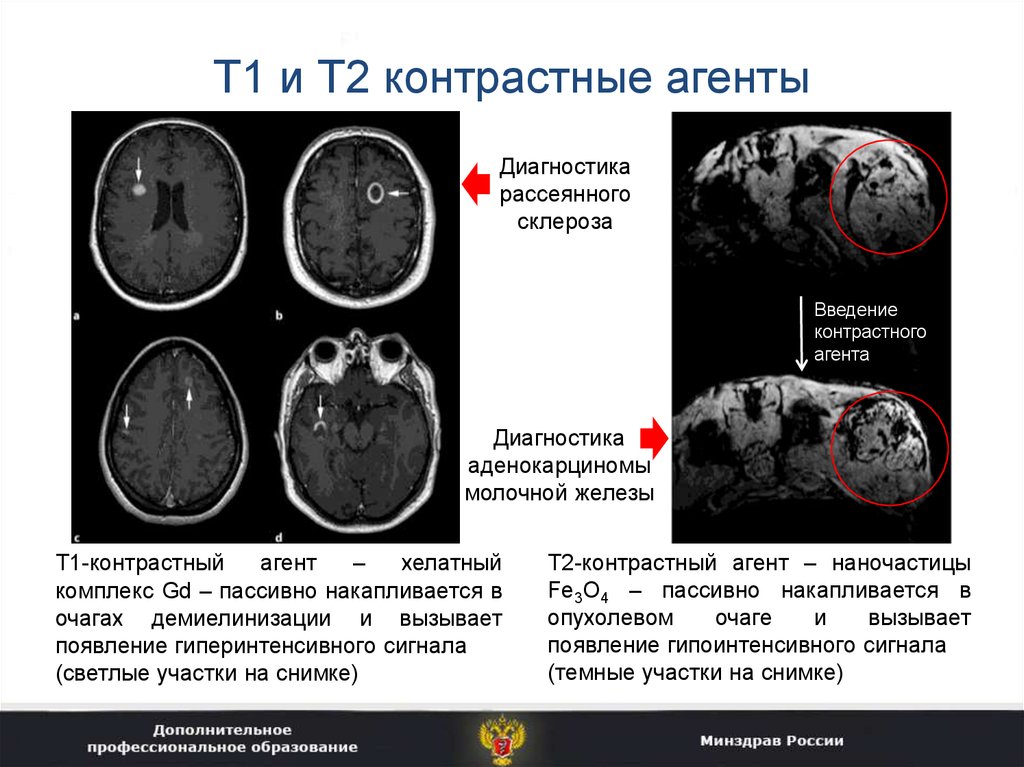
31. Т1 и Т2 контрастные агенты
Диагностикарассеянного
склероза
Введение
контрастного
агента
Диагностика
аденокарциномы
молочной железы
Т1-контрастный
агент
–
хелатный
комплекс Gd – пассивно накапливается в
очагах демиелинизации и вызывает
появление гиперинтенсивного сигнала
(светлые участки на снимке)
Т2-контрастный агент – наночастицы
Fe3O4 – пассивно накапливается в
опухолевом
очаге
и
вызывает
появление гипоинтенсивного сигнала
(темные участки на снимке)
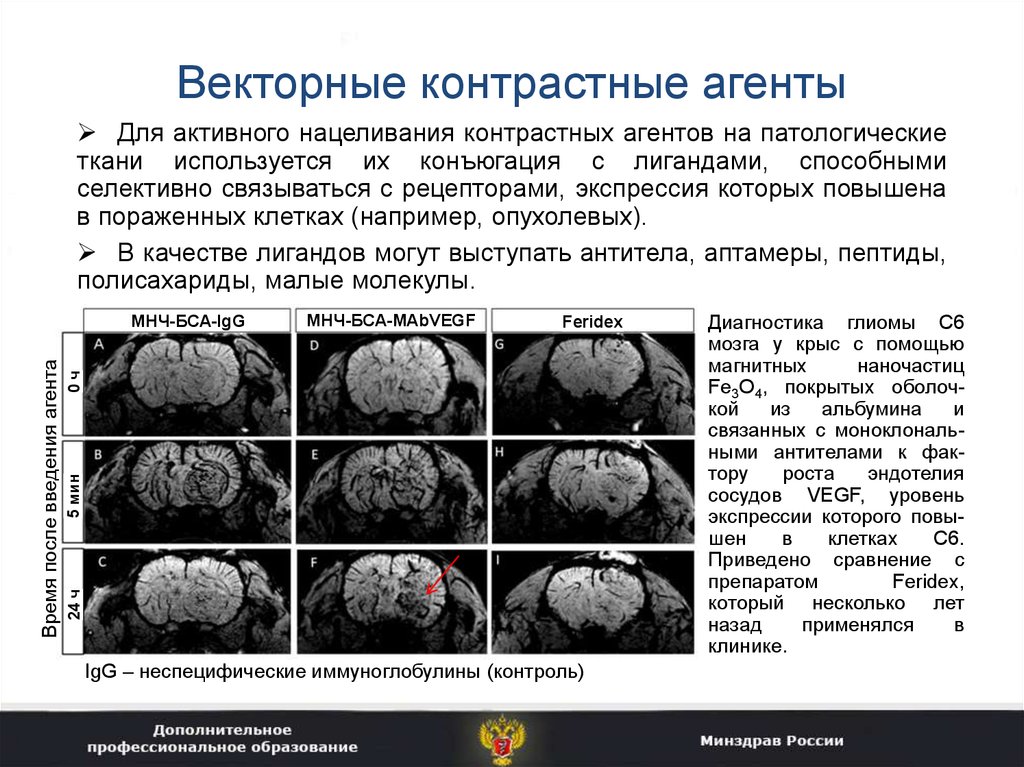
32. Векторные контрастные агенты
Для активного нацеливания контрастных агентов на патологическиеткани используется их конъюгация с лигандами, способными
селективно связываться с рецепторами, экспрессия которых повышена
в пораженных клетках (например, опухолевых).
В качестве лигандов могут выступать антитела, аптамеры, пептиды,
полисахариды, малые молекулы.
Feridex
5 мин
0ч
МНЧ-БСА-MAbVEGF
24 ч
Время после введения агента
МНЧ-БСА-IgG
IgG – неспецифические иммуноглобулины (контроль)
Диагностика глиомы С6
мозга у крыс с помощью
магнитных
наночастиц
Fe3O4, покрытых оболочкой
из
альбумина
и
связанных с моноклональными антителами к фактору
роста
эндотелия
сосудов VEGF, уровень
экспрессии которого повышен
в
клетках
С6.
Приведено сравнение с
препаратом
Feridex,
который несколько лет
назад
применялся
в
клинике.
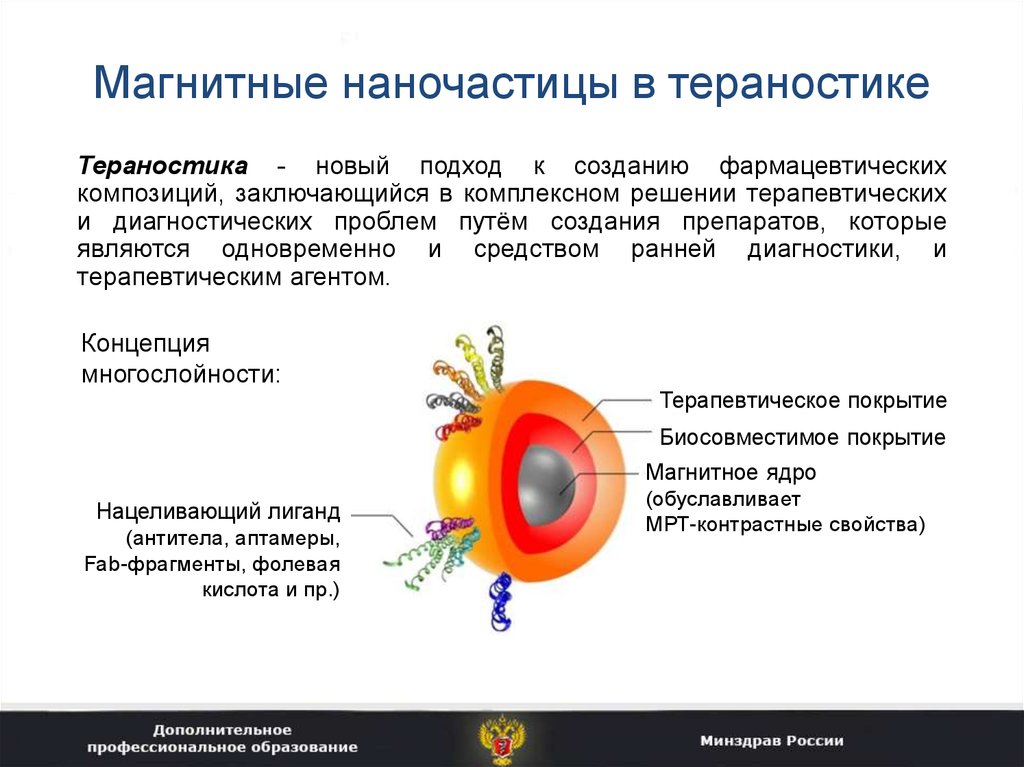
33. 2. Магнитные наночастицы в тераностике
34. Магнитные наночастицы в тераностике
Тераностика - новый подход к созданию фармацевтическихкомпозиций, заключающийся в комплексном решении терапевтических
и диагностических проблем путём создания препаратов, которые
являются одновременно и средством ранней диагностики, и
терапевтическим агентом.
Концепция
многослойности:
Терапевтическое покрытие
Биосовместимое покрытие
Магнитное ядро
Нацеливающий лиганд
(антитела, аптамеры,
Fab-фрагменты, фолевая
кислота и пр.)
(обуславливает
МРТ-контрастные свойства)
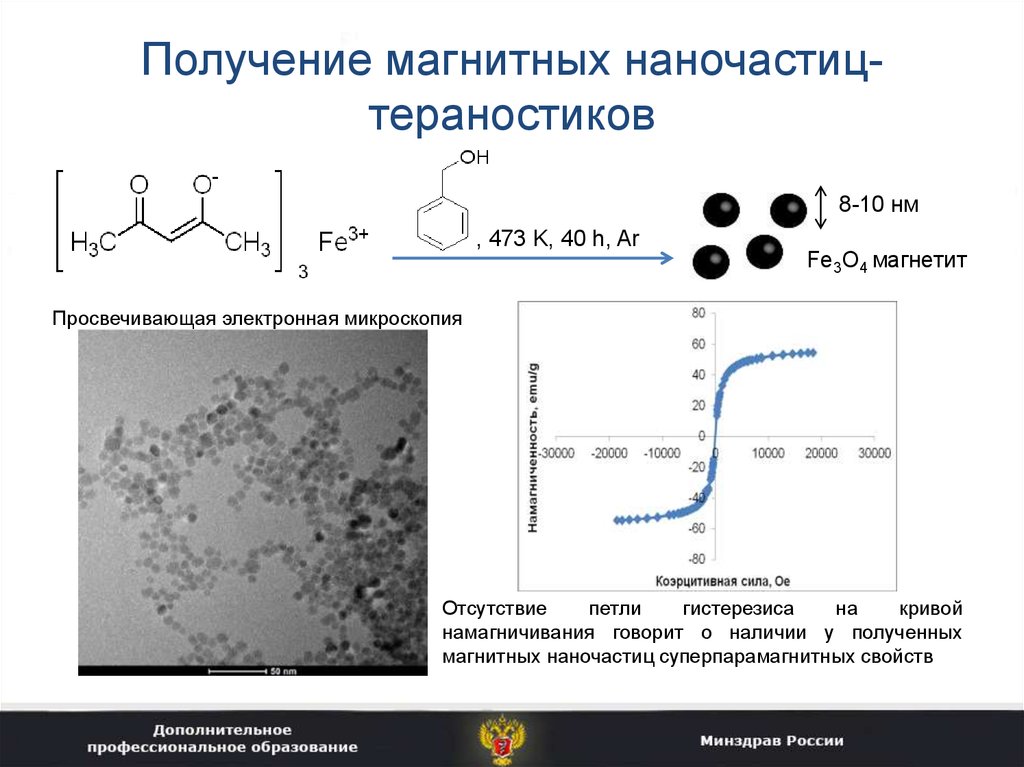
35. Получение магнитных наночастиц-тераностиков
Получение магнитных наночастицтераностиков8-10 нм
, 473 K, 40 h, Ar
Fe3O4 магнетит
Просвечивающая электронная микроскопия
Отсутствие
петли
гистерезиса
на
кривой
намагничивания говорит о наличии у полученных
магнитных наночастиц суперпарамагнитных свойств
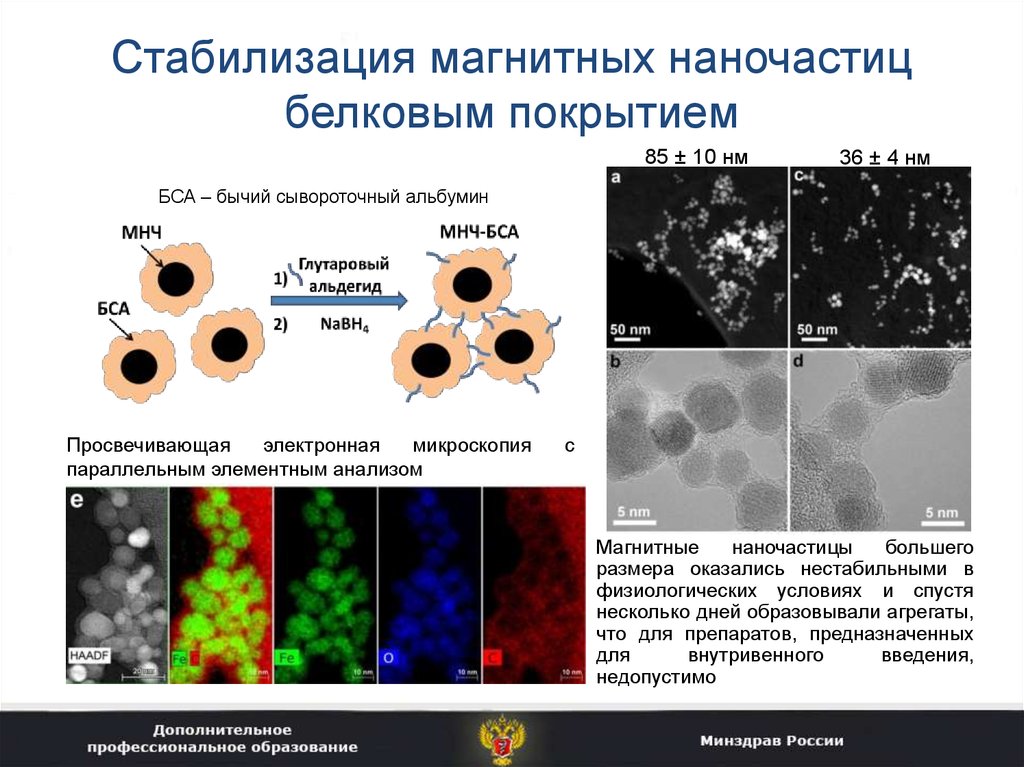
36. Стабилизация магнитных наночастиц белковым покрытием
85 ± 10 нм36 ± 4 нм
БСА – бычий сывороточный альбумин
Просвечивающая
электронная
микроскопия
параллельным элементным анализом
с
Магнитные
наночастицы
большего
размера оказались нестабильными в
физиологических условиях и спустя
несколько дней образовывали агрегаты,
что для препаратов, предназначенных
для
внутривенного
введения,
недопустимо
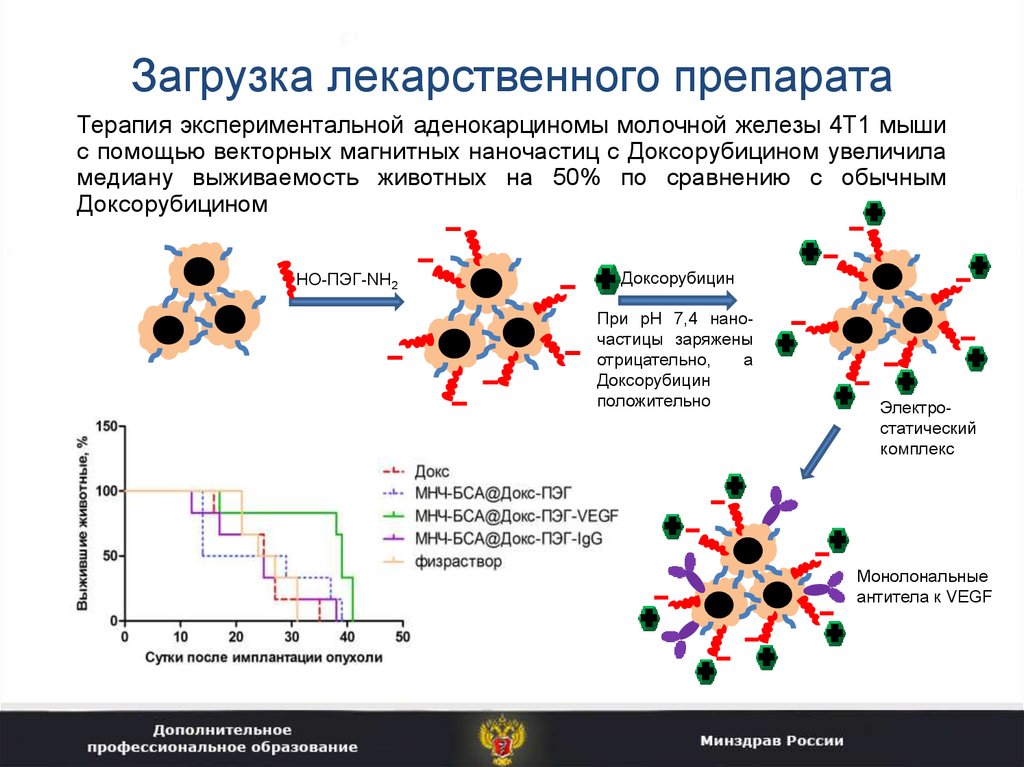
37. Загрузка лекарственного препарата
Терапия экспериментальной аденокарциномы молочной железы 4T1 мышис помощью векторных магнитных наночастиц с Доксорубицином увеличила
медиану выживаемость животных на 50% по сравнению с обычным
Доксорубицином
HO-ПЭГ-NH2
Доксорубицин
При рН 7,4 наночастицы заряжены
отрицательно,
а
Доксорубицин
положительно
Электростатический
комплекс
Монолональные
антитела к VEGF
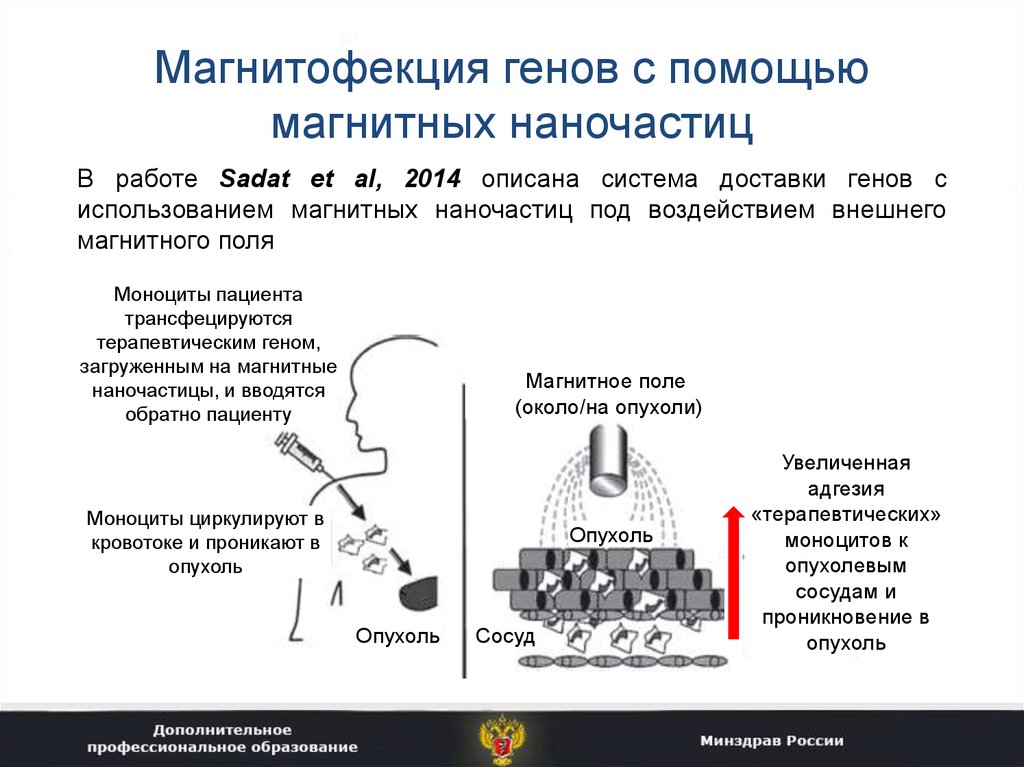
38. Магнитофекция генов с помощью магнитных наночастиц
В работе Sadat et al, 2014 описана система доставки генов сиспользованием магнитных наночастиц под воздействием внешнего
магнитного поля
Моноциты пациента
трансфецируются
терапевтическим геном,
загруженным на магнитные
наночастицы, и вводятся
обратно пациенту
Магнитное поле
(около/на опухоли)
Моноциты циркулируют в
кровотоке и проникают в
опухоль
Опухоль
Опухоль
Сосуд
Увеличенная
адгезия
«терапевтических»
моноцитов к
опухолевым
сосудам и
проникновение в
опухоль
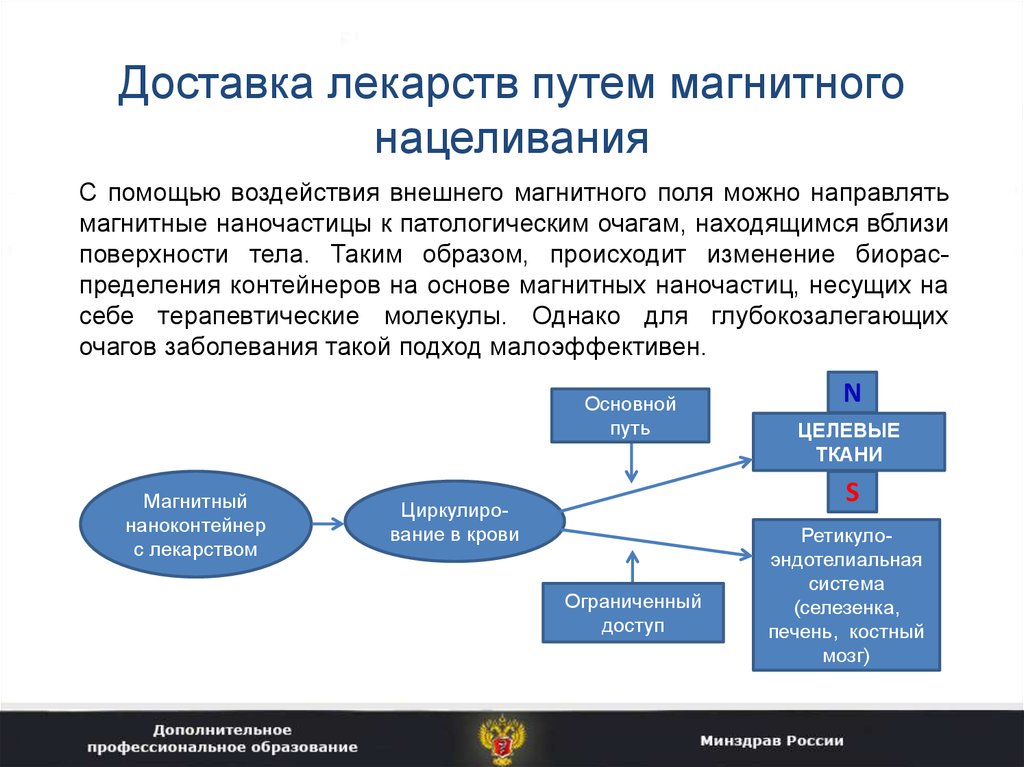
39. Доставка лекарств путем магнитного нацеливания
С помощью воздействия внешнего магнитного поля можно направлятьмагнитные наночастицы к патологическим очагам, находящимся вблизи
поверхности тела. Таким образом, происходит изменение биораспределения контейнеров на основе магнитных наночастиц, несущих на
себе терапевтические молекулы. Однако для глубокозалегающих
очагов заболевания такой подход малоэффективен.
Основной
путь
Магнитный
наноконтейнер
с лекарством
N
ЦЕЛЕВЫЕ
ТКАНИ
S
Циркулирование в крови
Ограниченный
доступ
Ретикулоэндотелиальная
система
(селезенка,
печень, костный
мозг)
40. Магнитная гипертермия
Механизм действия магнитной гипертермии основан на повышеннойчувствительности опухолевых клеток к воздействию высокой температуры
(43-45°С) по сравнению со здоровыми. Это связано с тем фактом, что
стремительно делящиеся клетки, образующие раковую опухоль, находятся
в состоянии нехватки кислорода (гипоксии) и избытка кислых продуктов
обмена веществ (ацидоза). При повышенных температурах оба процесса
становятся более ярко выраженными, приводя к гибели раковых клеток.
Наиболее перспективной является гипертермия с применением
магнитных наночастиц. С физической точки зрения это означает
превращение магнитной энергии в тепло при перемагничивании частиц в
высокочастотном магнитном поле.
Нагрев Лекарство
Если магнитные наночастицы загрузить
химиопрепаратом, то можно одновременно
оказывать на опухоль гипертермический и
цитостатический эффект
Апоптоз
Опухолевая
клетка
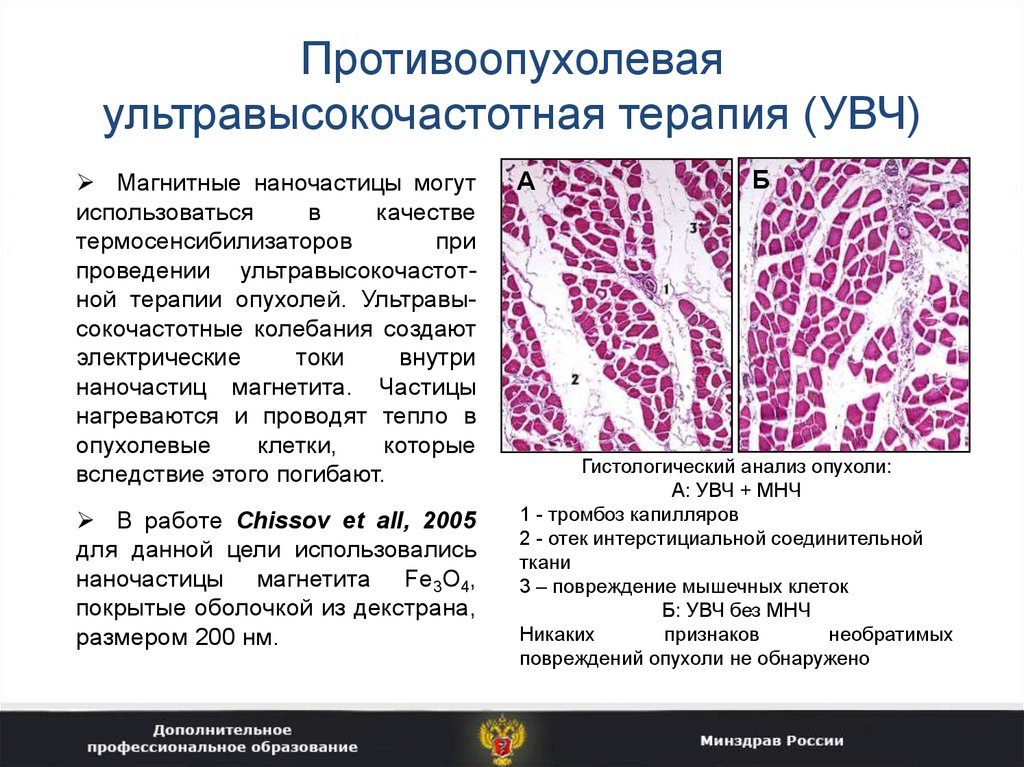
41. Противоопухолевая ультравысокочастотная терапия (УВЧ)
Магнитные наночастицы могутиспользоваться
в
качестве
термосенсибилизаторов
при
проведении ультравысокочастотной терапии опухолей. Ультравысокочастотные колебания создают
электрические
токи
внутри
наночастиц магнетита. Частицы
нагреваются и проводят тепло в
опухолевые
клетки,
которые
вследствие этого погибают.
В работе Chissov et all, 2005
для данной цели использовались
наночастицы магнетита Fe3O4,
покрытые оболочкой из декстрана,
размером 200 нм.
А
Б
Гистологический анализ опухоли:
А: УВЧ + МНЧ
1 - тромбоз капилляров
2 - отек интерстициальной соединительной
ткани
3 – повреждение мышечных клеток
Б: УВЧ без МНЧ
Никаких
признаков
необратимых
повреждений опухоли не обнаружено
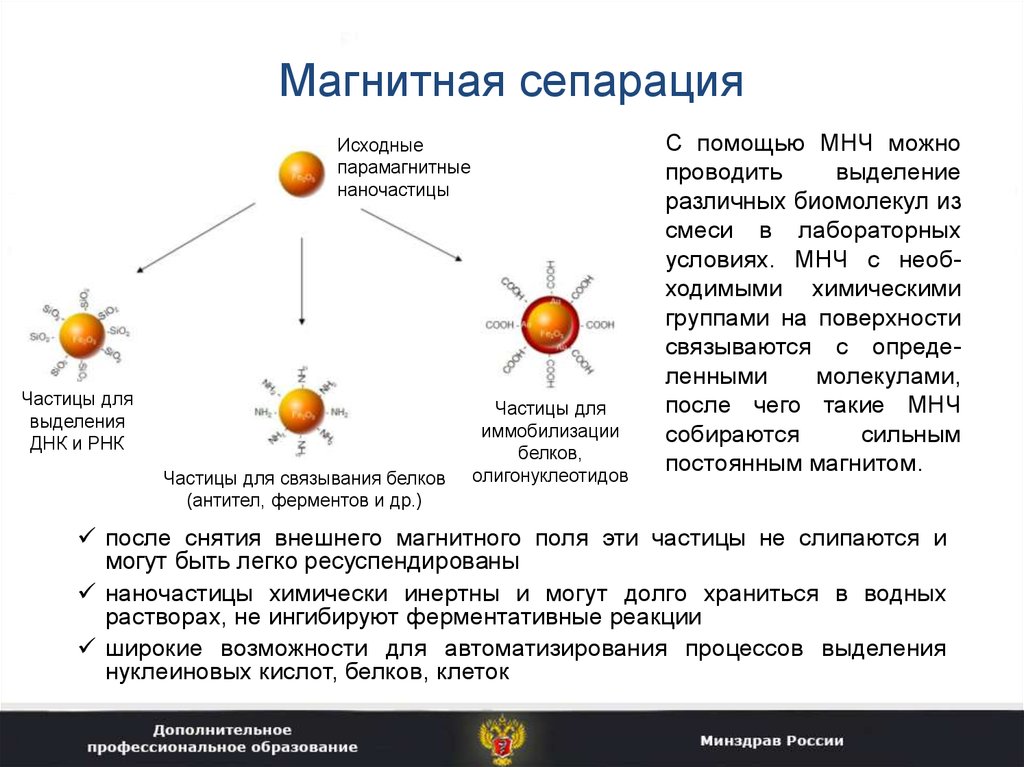
42. Магнитная сепарация
Исходныепарамагнитные
наночастицы
Частицы для
выделения
ДНК и РНК
Частицы для связывания белков
(антител, ферментов и др.)
Частицы для
иммобилизации
белков,
олигонуклеотидов
С помощью МНЧ можно
проводить
выделение
различных биомолекул из
смеси в лабораторных
условиях. МНЧ с необходимыми химическими
группами на поверхности
связываются с определенными
молекулами,
после чего такие МНЧ
собираются
сильным
постоянным магнитом.
после снятия внешнего магнитного поля эти частицы не слипаются и
могут быть легко ресуспендированы
наночастицы химически инертны и могут долго храниться в водных
растворах, не ингибируют ферментативные реакции
широкие возможности для автоматизирования процессов выделения
нуклеиновых кислот, белков, клеток


























 Медицина
Медицина Биология
Биология Физика
Физика