Похожие презентации:
Щелочноземельные металлы
1. Щелочноземельные металлы
Вторая группа главная подгруппа наряду с семействомщелочноземельных металлов включает и два типических
элемента –бериллий и магний
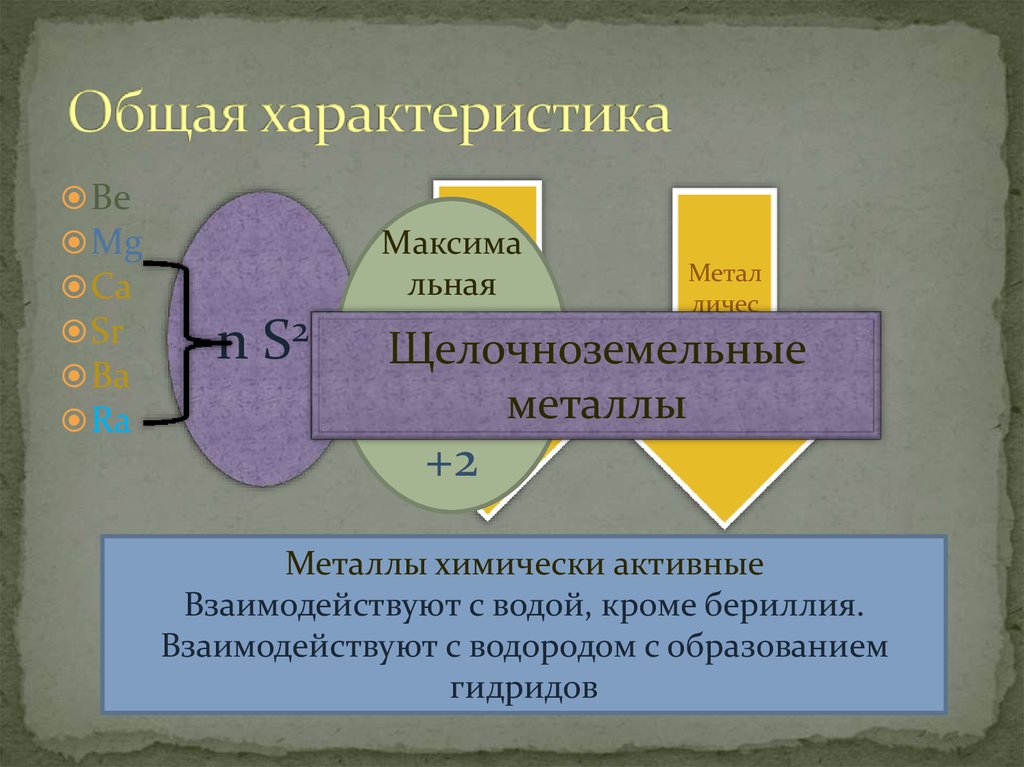
2. Общая характеристика
BeMg
Ca
Sr
Ba
Ra
n S2
Максима
Метал
льная
личес
Радиус
степень
кие
атома
Щелочноземельные
свойст
окислен
ия металлы ва
+2
Металлы химически активные
Взаимодействуют с водой, кроме бериллия.
Взаимодействуют с водородом с образованием
гидридов
3. Бериллий
сходствует с алюминием имагнием…Получил своё название потому, что
находится в минерале берилле. Металл называют
также глицием от греческого слова «сладкий»,
потому что соли его имеют сладковатый вкус.
Д.И.Менделеев
4. Распространение в природе
АлександритКажется, что
если вглядеться в
Хризоберилл
аквамарин,
то камень.
увидишь Его
тихое
редкий
Берилл
BeAl
море
водой цвета звёзд
2O4 спроизводят
и
3Be * Al2O3
ИзумрудК.Г.Паустовский
«
искусственным
*6SiO2
Аквамарин
Такой цвет
ему придаёт
»
путём,
однако
идёт
Александрит
небольшая примесь
Александрит впервые
Благодаря насыщенному
ине на продажу, а
найденный
на Урале в 1830 зелёному цвету
он
двухвалентного железа
твёрдости
очень популярен у ювелиров,
году
в день совершеннолетия
на использование в
аэрокосмической
образует кристаллы в форме шестигранных
отрасли
аквамаринпризм
александрит
изумруд
чудеснаяАлександра
окраска вызвана
царевича
II был наличием ионов
хрома
или
назван
его ванадия.
именем Зелёный минерал
5. Получение
В виде простого вещества бериллий получили в1828году немецкий учёный Фридрих Вёлер и
французский химик Антуан Бюсси. Они
действовали калием на безводный хлорид
бериллия
BeCl2+2K=Be+2KCl
6.
BeF2+Mg=Be+MgF2В настоящее время бериллий
получают, восстанавливая его
фторид магнием, либо электролизом
расплава смеси хлоридов бериллия и
натрия.
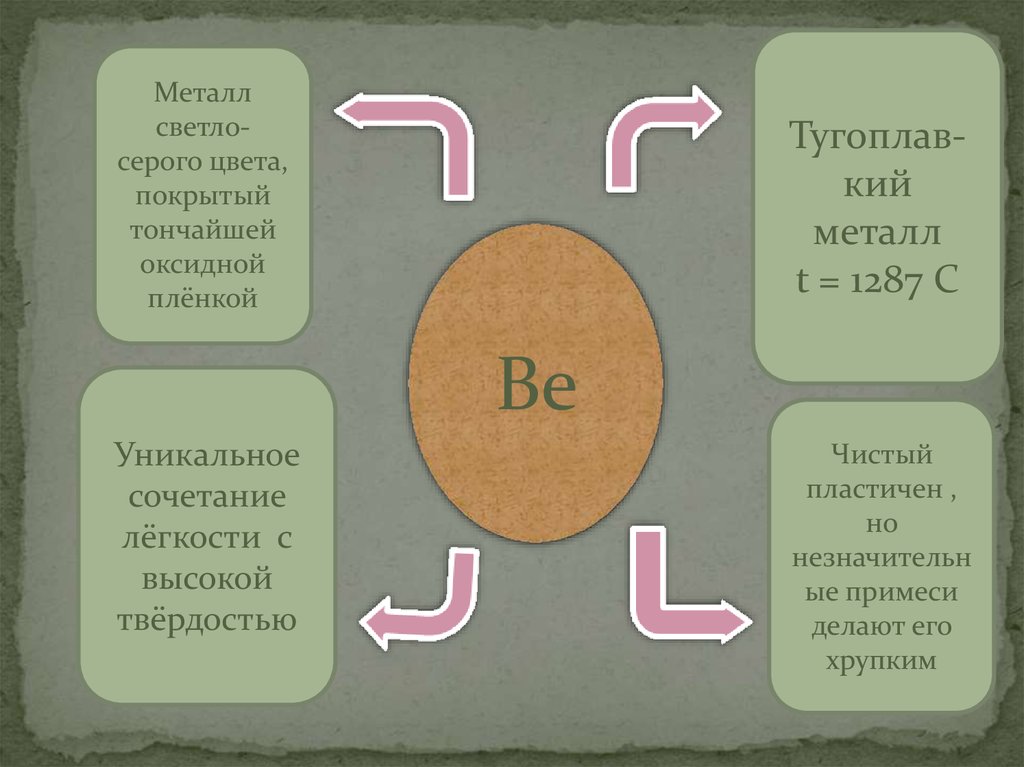
7.
Металлсветлосерого цвета,
покрытый
тончайшей
оксидной
плёнкой
Тугоплавкий
металл
t = 1287 C
Be
Уникальное
сочетание
лёгкости с
высокой
твёрдостью
Чистый
пластичен ,
но
незначительн
ые примеси
делают его
хрупким
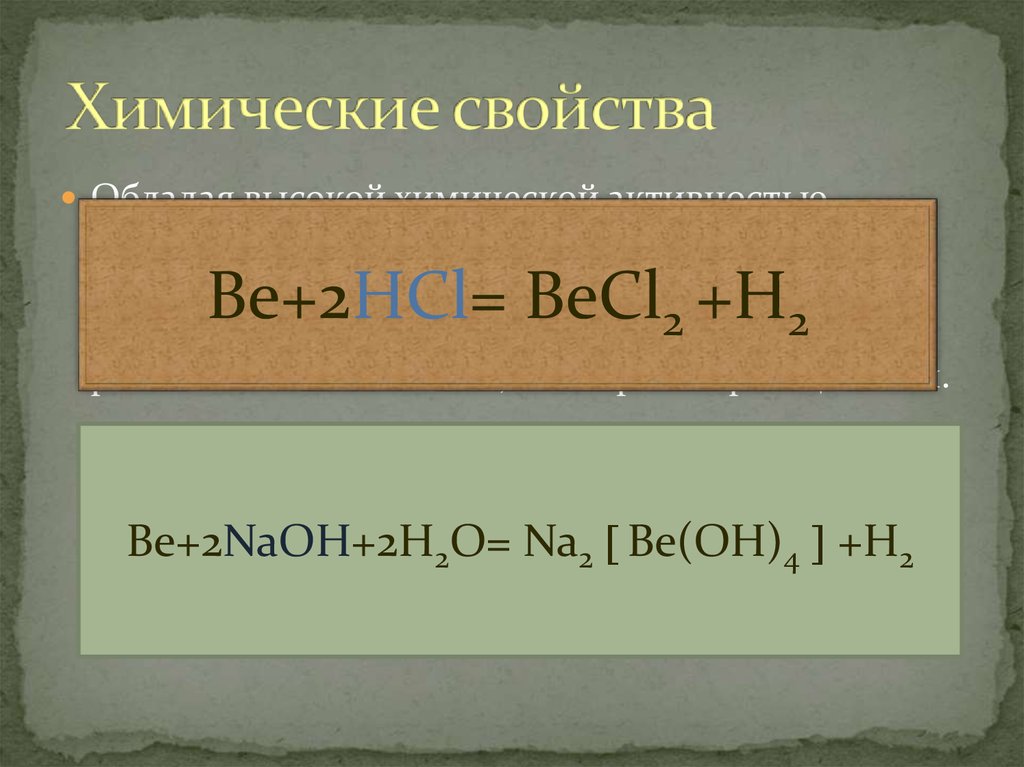
8. Химические свойства
Обладая высокой химической активностьюбериллий вступает в реакции с галогенами, серой
и азотом. Вода на него не действует, зато подобно
алюминию он легко растворяется 2как в 2
разбавленных кислотах , так в растворах щелочей.
Be+2HCl= BeCl +H
Be+2NaOH+2H2O= Na2 Be(OH)4 +H2
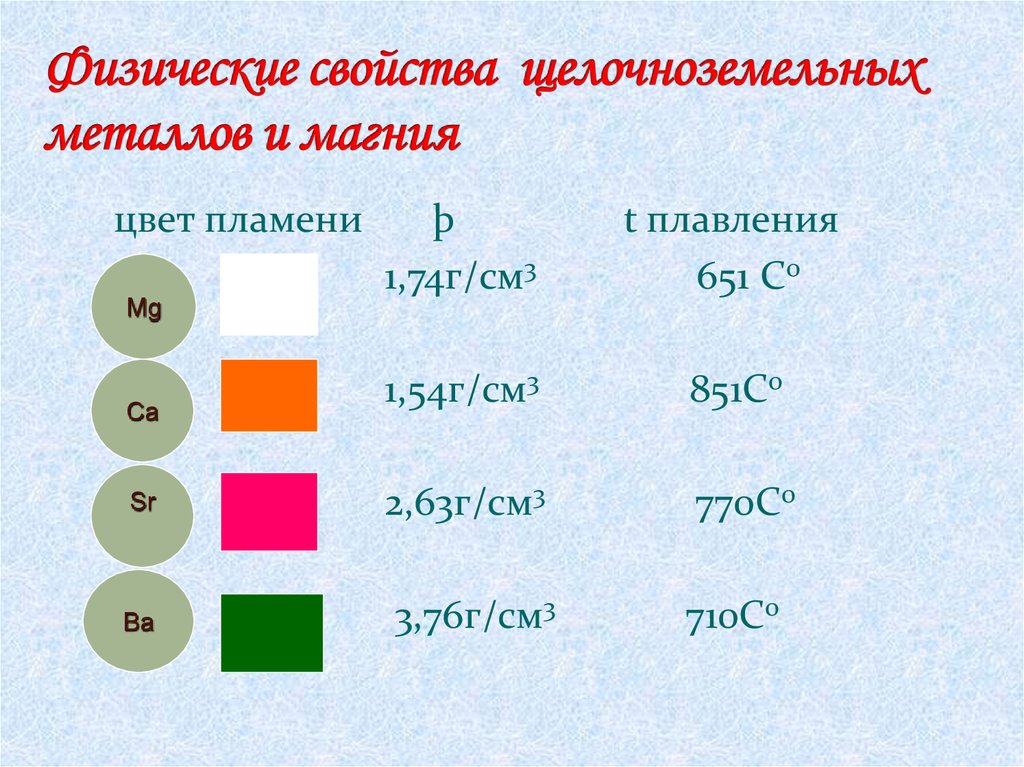
9.
цвет пламениMg
Ca
Sr
Ba
þ
1,74г/см3
t плавления
651 С0
1,54г/см3
851С0
2,63г/см3
770С0
3,76г/см3
710С0
10. Магний
был открыт при анализе воды изминерального источника вблизи города Эпсом в
Англии. Горькая на вкус, она привлекла внимание
исследователей, при упаривании такой воды на
стенках сосуда образовывалась белая корка
вещества, соль MgSO4 7H2O
11. Получение
Впервые магний был получен в 1808г Гемфри Девипри электролизе влажной магнезии . По его
предложению элемент назвали Magnium
12. Физические свойства
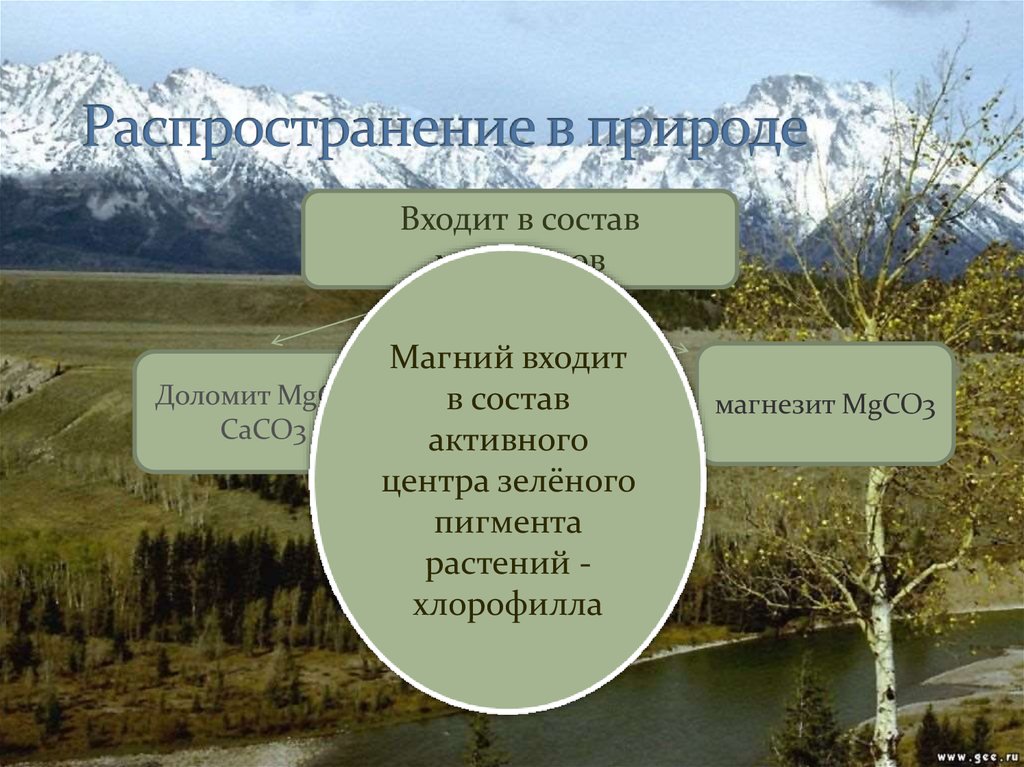
Mg13. Распространение в природе
Входит в составминералов
Магний входит
Доломит MgCO3
в состав
CaCO3
активного
центра зелёного
пигмента
растений хлорофилла
магнезит MgCO3
14. Химические свойства
Горение на воздухе2Mg+ O2=2MgO
Химическине взаимодействует с
При комнатной температуре
активен
водой, лишь при кипячении
Сильный
Mg+ H2O=Mg(OH)2
+H2
восстановитель
Магний легко взаимодействует
с разбавленными
2
кислотами
15. Применение
Твёрдые и прочныесплавы с алюминием
магналий- 30 Mg
Электрон –включает
цинк, марганец,
медь
Mg
В медицине
Оксид магния -для
понижения
кислотности желудка
Сульфат магния слабительное
Автомобильная ,
авиационная и
ракетная
промышленность
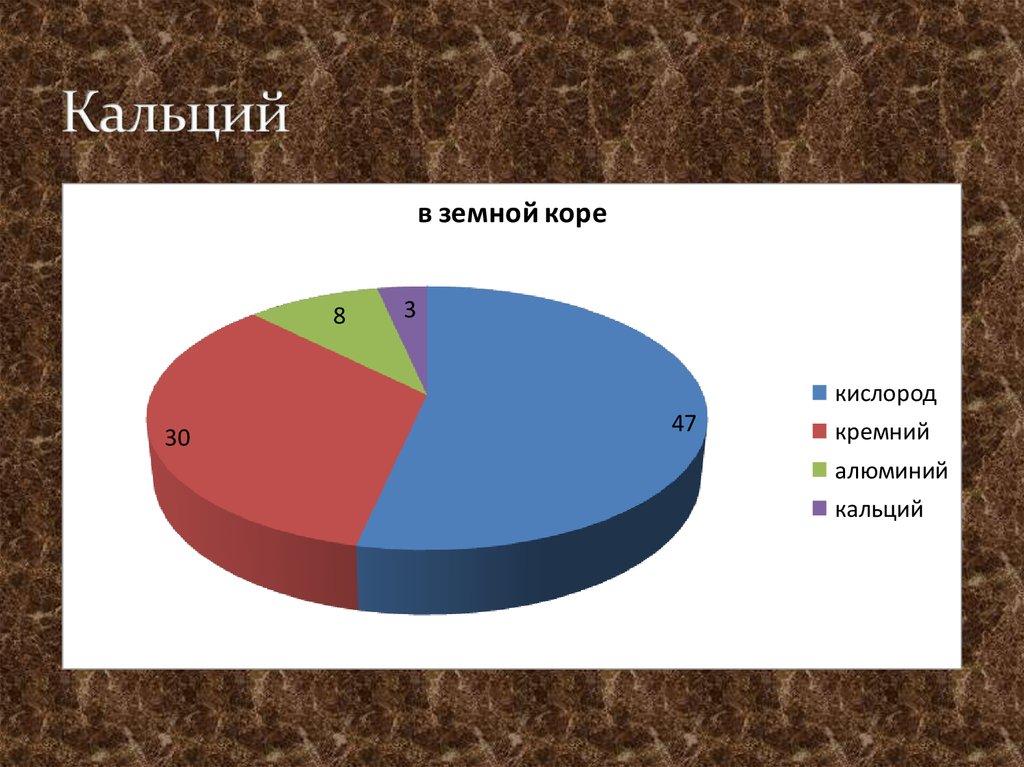
16. Кальций
в земной коре8
3
кислород
30
47
кремний
алюминий
кальций
17. Распространение в природе
Гипс CaSO42H2O
апатит
Ca5(PO4)3(OH
)
мел, мрамор,
известняк CaCO3
Флюорит CaF2
18. Получение
Электролиз расплавов солей
Металлический кальций был
CaCl2 =Ca+Cl2
получен в 1808 году при
• Алюмотермия
электролизе смеси влажной
CaO + Al=CaAl O + Ca
гашёной извести с оксидом
ртути
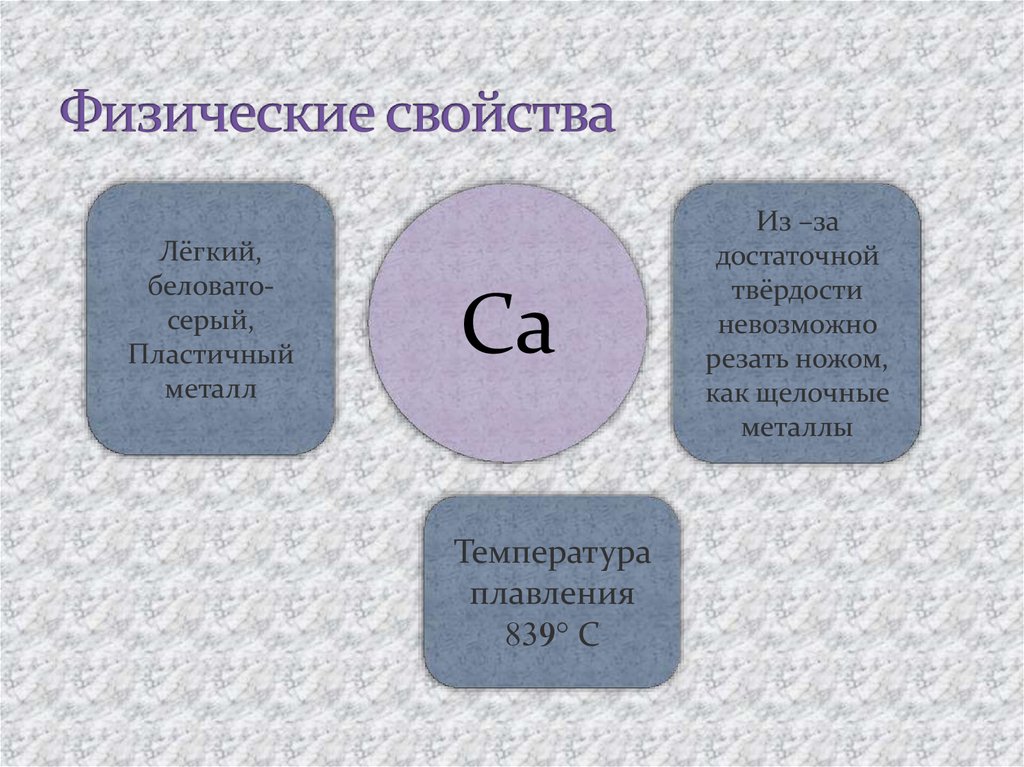
19. Физические свойства
Лёгкий,беловатосерый,
Пластичный
металл
Ca
Температура
плавления
С
Из –за
достаточной
твёрдости
невозможно
резать ножом,
как щелочные
металлы
20. Химические свойства
С простыми веществамиCa+H2=CaH2
Ca+Cl2=CaCl2
Ca+N2=Ca3N
Ca+O2= CaO
Кирпично-красное
пламя
21. Химические свойства
Со сложными веществамиCa+ NH3=Ca(NH2)2 +H2
Ca+ H2O=Ca(OH)2+H2
Ca+ HCl=CaCl2+H2 любая
кислота кроме азотной
22. Стронций и барий
Стронцийвстречается
в своё
природе в виде
Стронций
получил
минерала
целестина-сульфата
название
от шотландской стронция
деревни красивые
Стронциан,розово-красные
близь
образующего
которой
был найден редкий
или
бледно-голубые
кристаллы
В виде простых
минерал
стронцианит
веществ барий и
стронций были
Впервые барий был в виде
Барий
встречается
выделены
Г.Деви вхимиком
обнаружен
шведским
1808
году
барита
шпата)
Карлом(тяжёлого
Вильгельмом
Шееле
и
его учеником в тяжёлом шпате
и получил название «барис»
тяжёлый.
BaSO4
23. Применение
Используют в производствеСоединения кальция, стронция и
бария
белой
краски литопон,
высокой кроющей
применяют в разных отрасляхобладающей
промышленности
и
способностью
строительстве.
Соединения стронция(нитрат, карбонат ,хлорид,
оксалат) используют в производстве
Добавка в производстве бумаги
осветительных ракет, химического
исортовтермически
дорогих
денежных
знаков входит
и документов
устойчивого стекла. Оксид стронция
в
состав эмалей для защиты металлических
предметов.
BaSO4
Изготовление защитных
материалов для рентгеновских
установок, в медицине















 Химия
Химия








