Похожие презентации:
р-элементы V группы (пниктогены) N, P, As, Sb, Bi
1.
Лекция 23р-элементы V группы
(пниктогены)
N, P, As, Sb, Bi
Сборная 8 классов по химии
Лицей 1502 при МЭИ
Подготовил: Назаров М.А.
2.
23. Общая характеристика
N2s22p3
P
3s23p3
типические
rа
Еион.
Метал. cв-ва
As
4s24p3
Sb
Bi
5s25p3 6s26p3
полные электронные аналоги
увеличиваются
уменьшается
увеличиваются
4. Общая характеристика
N - неметаллP – неметалл,
Pчерный – п/п
As, Sbжелтый- немет.
- мет.
Sbсерый
Bi - металл
5. Общая характеристика
P + HNO3(конц.) → H3PO4 + NO2 + H2OAs + HNO3(конц.) → HAsO3 + NO2 + H2O
Sb + HNO3(конц.) → HSbO3 + NO2 + H2O
Bi + HNO3(разб.) → Bi(NO3)3 + NO + H2O
6. Степени окисления
ХарактерныеN
-3 ÷ +5
P
As
Sb
Bi
-3 +1 +3 +5
-3
+3 +5
-3
+3 +5
-3
+3 +5
Устойчивые
+5
+5
+3,+5
+3
7. Природные cоединения
NКларк 0,04
P
0,09
As
5·10-
NaNO3 Ca3(PO4)2 4
KNO3 Ca3(PO4)2·CaF
As2S
23
N2 78.09% в атмосфере
Sb
5·10-
Bi
2·10-5
5
Bi2S3
Sb2S3
8. Азот, его свойства и значение
9.
Азототрицание
жизнь
10.
nitrogeniumселитра
рождающий
11. Открытие азота
• 12 сентября 1772 года — ДаниельРезерфорд
• 1771 - 1773 гг. — Г. Кавендиш и Дж.
Пристли
• 1770 -1777 гг. — К. Шееле
• 1787 год — А. Лавуазье, Л. Гитоном де
Морво и А. Фуркруа было предложено
название «азот» (от греч., означающего
безжизненный)
Антуан Лоран Лавуазье
12.
Периодическая таблица химических элементов Д.И. МенделееваПорядковый номер
Знак химического элемента
ММЦ 74212
13.
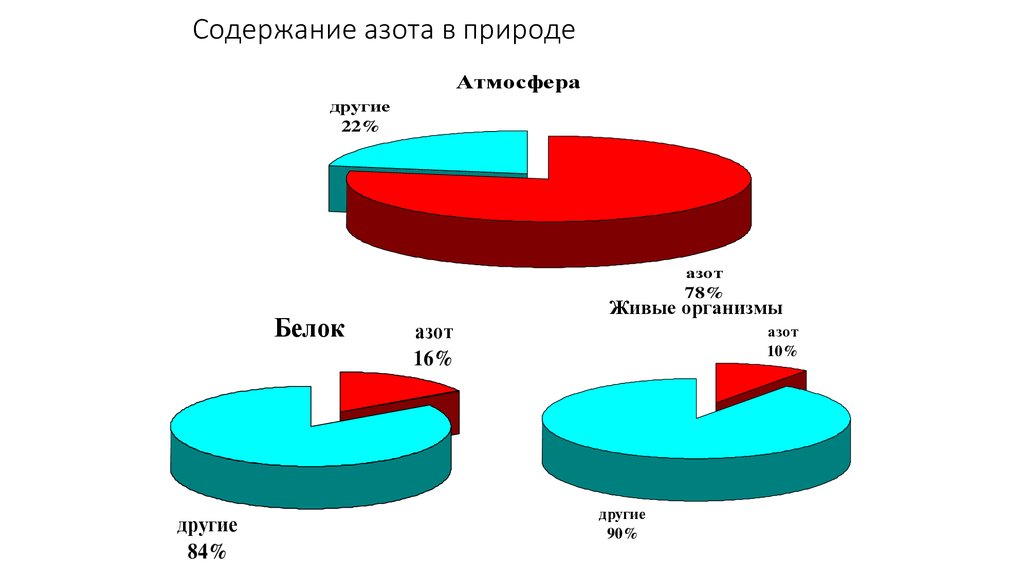
Круговорот азота в природе14. Содержание азота в природе
Атмосферадругие
22%
азот
78%
Белок
другие
84%
Живые организмы
азот
16%
азот
10%
другие
90%
15.
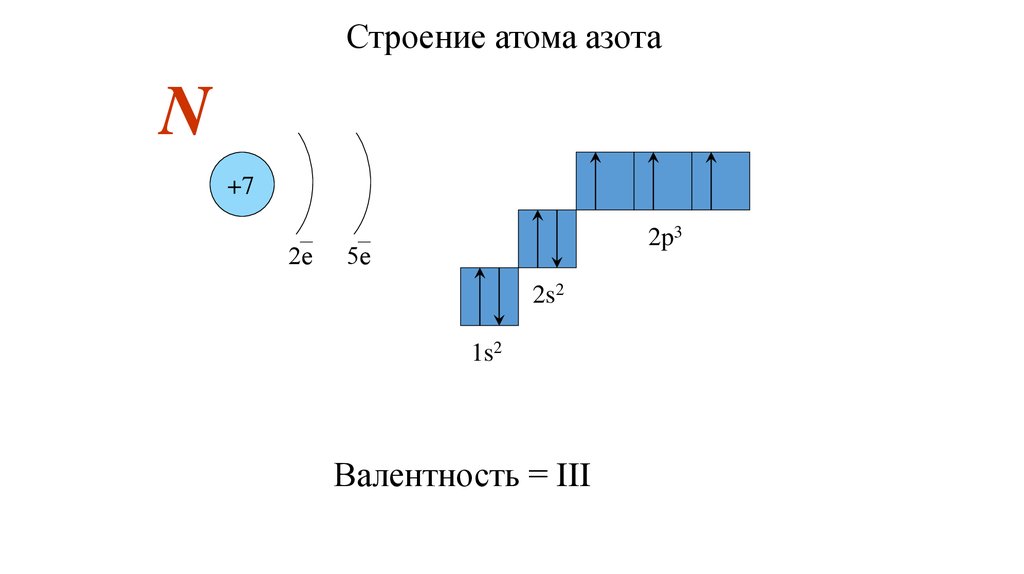
Строение атома азотаN
+7
2е
2p3
5е
2s2
1s2
Валентность = III
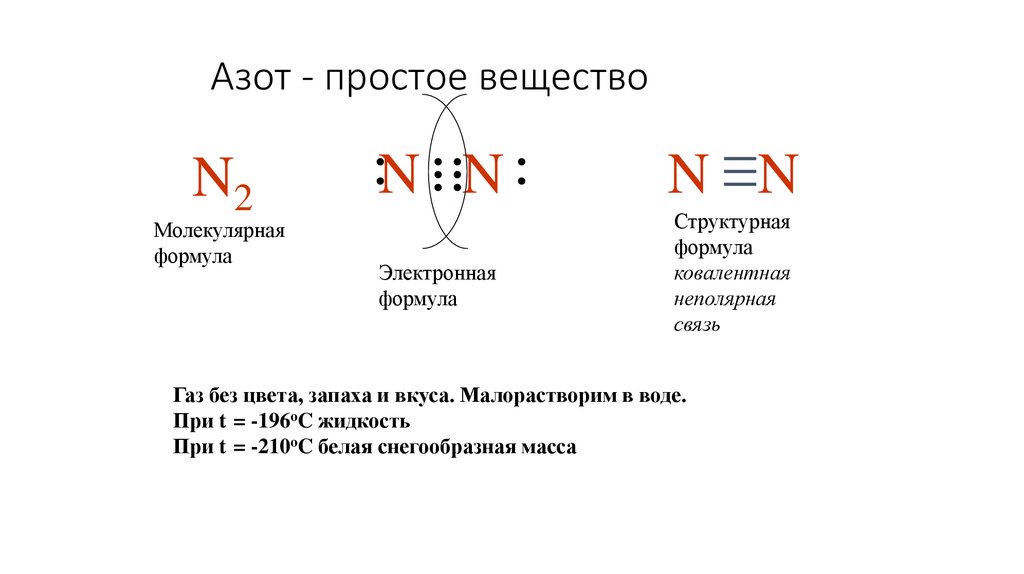
16. Азот - простое вещество
N2Молекулярная
формула
N N
Электронная
формула
N N
Структурная
формула
ковалентная
неполярная
связь
Газ без цвета, запаха и вкуса. Малорастворим в воде.
При t = -196oC жидкость
При t = -210oC белая снегообразная масса
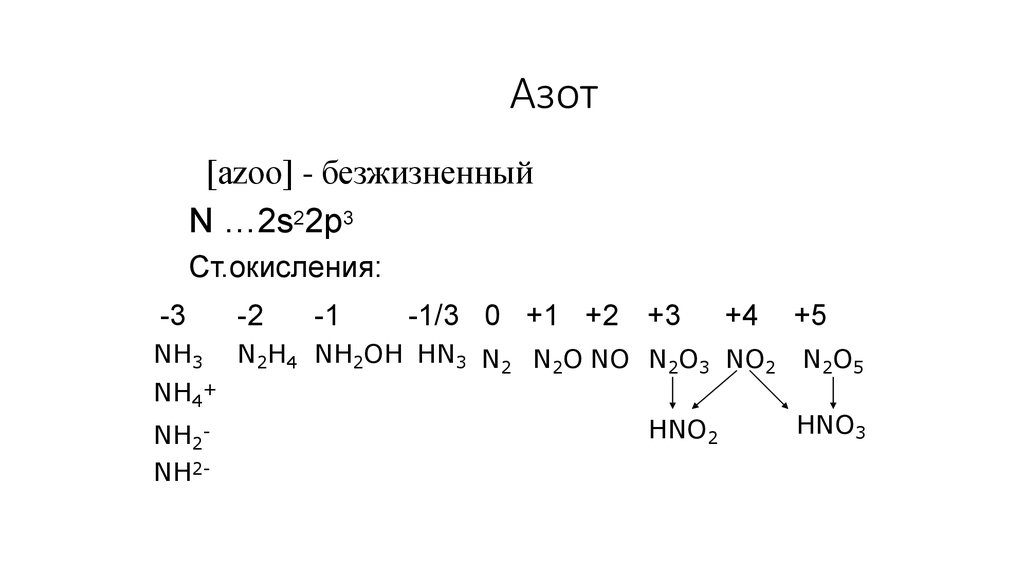
17. Азот
[аzоо] - безжизненныйN …2s22p3
Ст.окисления:
-3
-2
-1
-1/3 0 +1 +2 +3
+4
+5
NH3 N2H4 NH2OH HN3 N2 N2O NO N2O3 NO2 N2O5
NH4+
HNO3
HNO2
NH2NH2-
18.
Me3NМе3N2
МеxNу*
C2N2
Ме t
C
Н2
t
t
N2
P
t
P3N5
электрический разряд
NH3
S
t
не реагирует
Hal2
t
O2 t
NO
(t=12000)
NF3
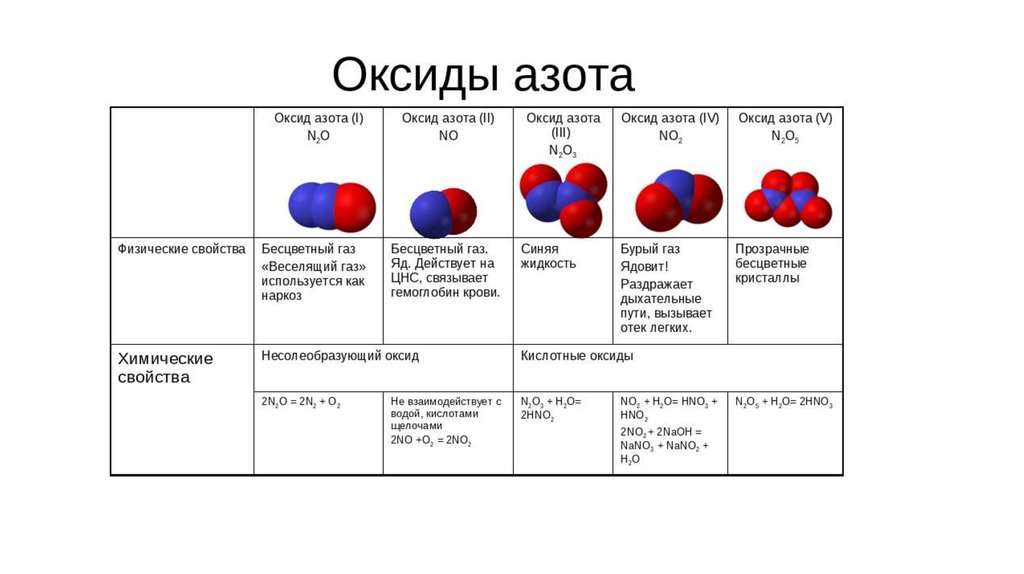
19. Химические свойства атома азота
Окислительные свойстваN0+3e
Восстановительные свойства
N-3
N+5
N+4
Ca3N2
AlN
H3N
N - ne
нитриды
N+3
N+2
(аммиак)
N+1
NO; N2O5; NF3
20.
21. Химические свойства вещества азота
Окислительные свойства• Взаимодействие с металлами (to, с
литием при комнатной to):
0
0
+2
-3
3Mg + N2 = Mg3N2 нитрид магния
в-ль
о-ль
0
N2 + 3H2
о-ль
в-ль
• Взаимодействие с кислородом
0
Kat.
-3 +1
2NH3 + Q
аммиак
Классификация реакции:
•соединения
•обратимая
•каталитическая
•ОВР
•экзотермическая
•гомогенная
0
N2 + O2
в-ль
• Взаимодействие с водородом:
0
Восстановительные свойства
о-ль
3000 - 4000oС
+2 -2
2NO - Q
22. Применение азота
Производствоминеральных
удобрений
Синтез аммиака
N2
Производство
взрывчатых
веществ
Холодильное
оборудование
23. Удобрения, содержащие азот
АзотныеАммиачные
•Жидкий аммиак
•Аммиачная вода
Аммонийные
•Хлорид аммония
•Сульфат аммония
Амидные
•мочевина
24. Получение азота
• Сжижение воздуха• Взаимодействие нитрита натрия с хлоридом аммония
25. Сжижение воздуха
T кипения = -196oCT кипения = -183oC
26. Реакция получения N2
NaNO2 + NH3Cl = NaCl + N2 + 2H2Oнитрит
натрия
хлорид
аммония
27.
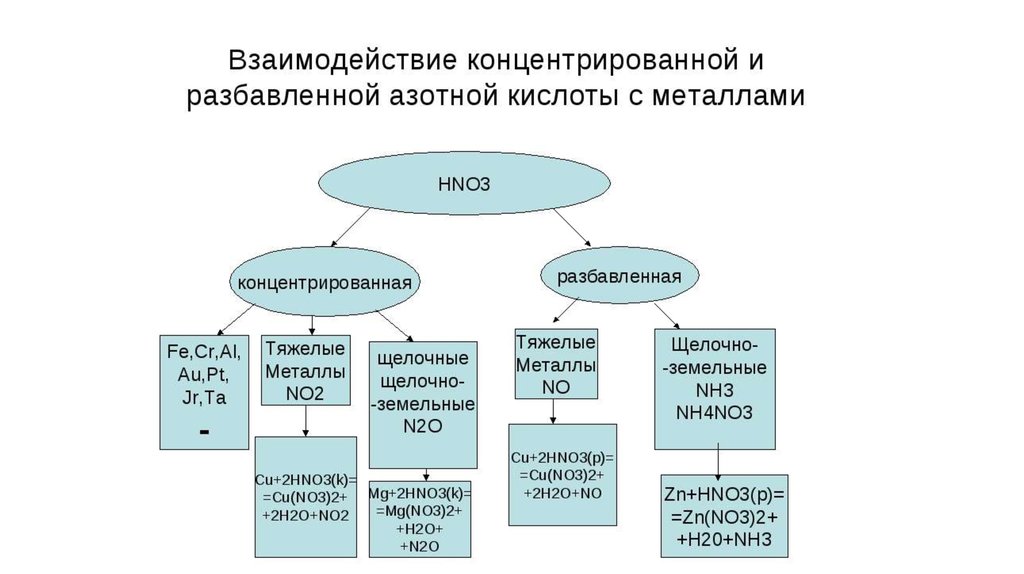
28. Азотная кислота
29.
30.
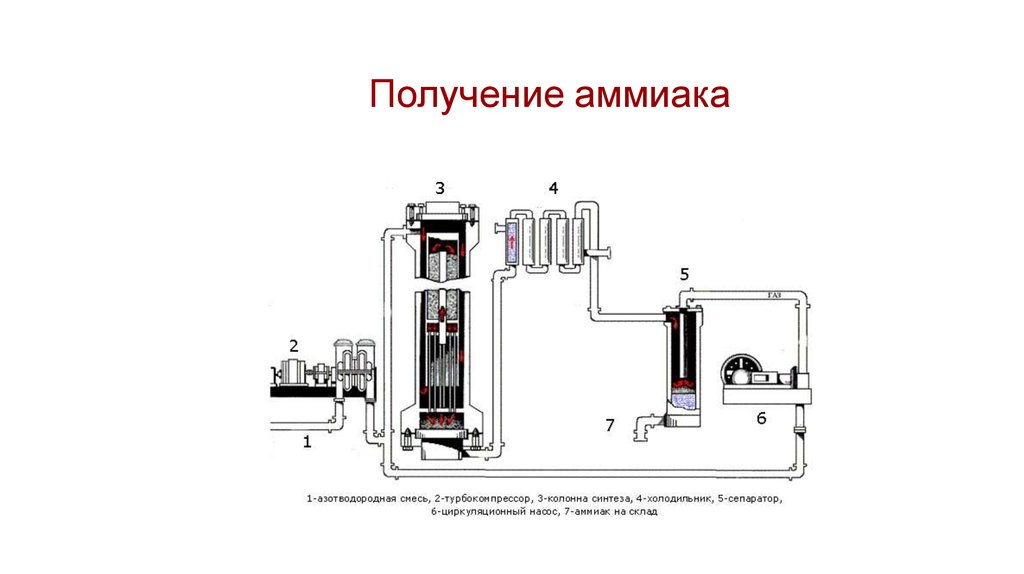
31. Получение аммиака
N2 + 3H2 ↔ 2NH3•Катал.: Fe
t = 850оС Р = 5000 атм
t = 450оС Р = 300 атм
Выход аммиака: 30%
Циркуляционный процесс
32. Получение аммиака
33. Физические cв-ва NH3
Газ, с резким запахом, токсичен.tк = - 33оС
33
34. Химические cв-ва аммиака
NH3 - восстановитель, т.к. N-3но:
+1
0
+1
NH3 (ж) + Nа → NаNH2 + H2
0
NH3 + O2 N2 + H2O
→t
t
NH3 + O2 → NO + H2O
Pt
NH3 + Cl2 → N2 + HCl
34
35. Химические cв-ва аммиака
NH3 - основание ЛьюисаNH3 + HCl
NH4Cl
NH3 + H2SO4 (разб.) →
NH3 + H3PO4 →
35
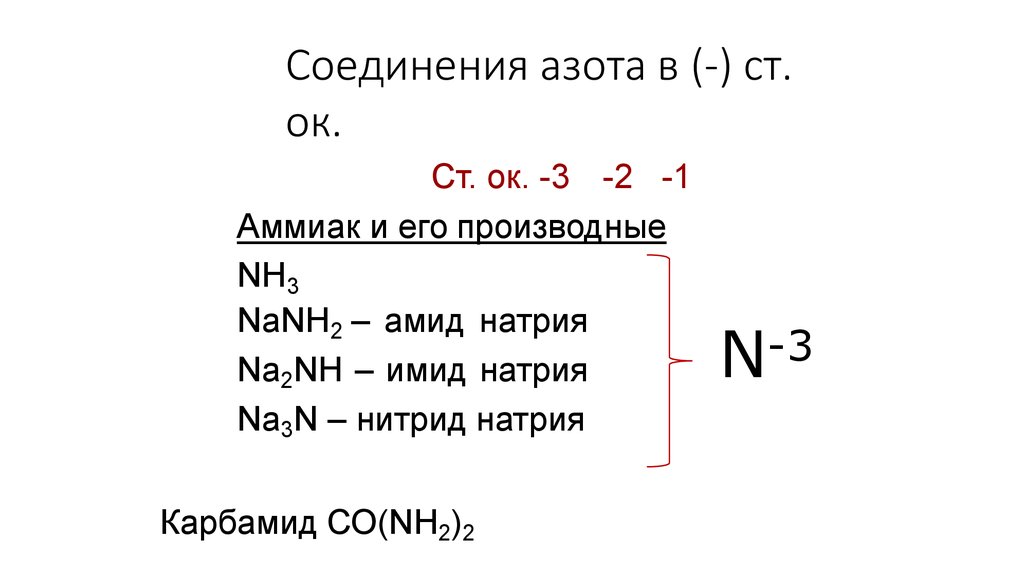
36. Соединения азота в (-) ст. ок.
Ст. ок. -3 -2 -1Аммиак и его производные
NH3
NaNH2 – амид натрия
Na2NH – имид натрия
Na3N – нитрид натрия
Карбамид СО(NH2)2
-3
N
37. Соединения азота в (-) ст. ок.
2Na + 2NH3(ж) = 2NaNH2 +H2 NaNH2
+
H2O = NaOH + NH3 М + N2
(toC) = МxNy
ионные нитриды:Ca3N2, Na3N, Mg3N2
ковалентные нитриды: BN, AlN, Sn3N4
Металлоидные нитриды: d-мет.
38. Гидразин - N2H4
C.о. азота -238
39.
N2H4 – жидкостьN2H4 +H2O<=>N2H5OH<=> OH- + N2H5+
гидроксид гидрозония
N2H5Cl - хлорид гидрозония
(N2H5)2SO4 - сульфат гидрозония
N2H4 - более сильный вос-ль, чем NH3
N2H4+4KMnO4+4KOH=N2+4K2MnO4+4H2O
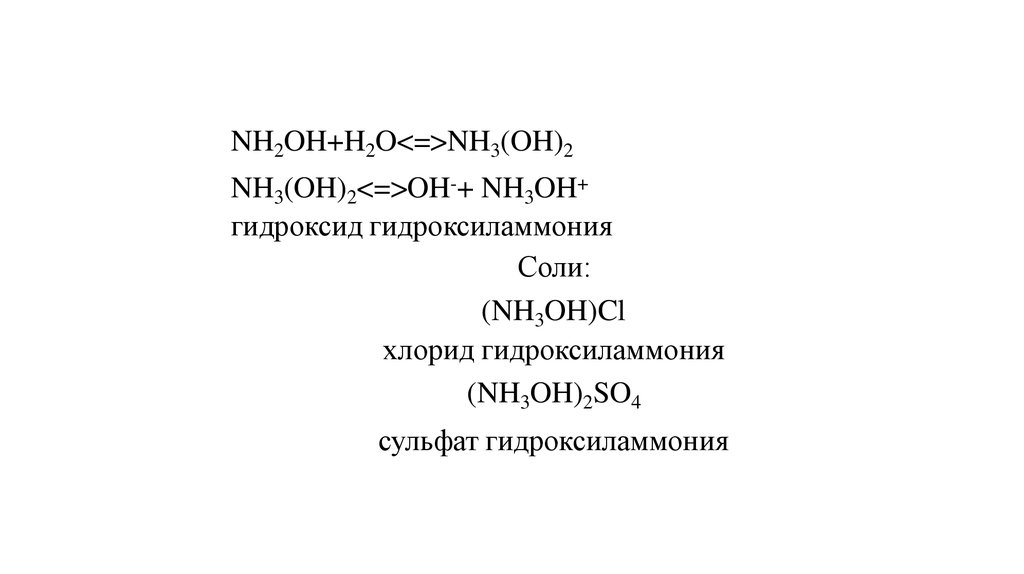
40. Гидроксиламин - NH2OH
С.о. азота -141.
NH2OH+H2O<=>NH3(OH)2NH3(OH)2<=>OH-+ NH3OH+
гидроксид гидроксиламмония
Соли:
(NH3OH)Cl
хлорид гидроксиламмония
(NH3OH)2SO4
сульфат гидроксиламмония
42. Ок-вос. свойства NH2OH
2NH2OH+2OH- -2e=N2+4H2O = -3,04ВNH2OH+2H2O+2e=NH4OH + 2OH- =0,42В
NH2OH+K2SO3 = N2+ S +2KOH+5H2O
вос-ль
K2S+NH2OH+2H2O=NH4OH + S + KOH
ок-ль
3NH2OH (toС) = NH3 + N2 +H2O
42
































 Химия
Химия