Похожие презентации:
Разработка технологии получения раствора коагулянта в условиях филиала «Азот» АО «ОХК «УРАЛХИМ»
1. ТЕМА: «РАЗРАБОТКА ТЕХНОЛОГИИ ПОЛУЧЕНИЯ РАСТВОРА КОАГУЛЯНТА В УСЛОВИЯХ ФИЛИАЛА «АЗОТ» АО «ОХК «УРАЛХИМ»
ПЕРМСКИЙ НАЦИОНАЛЬНЫЙИССЛЕДОВАТЕЛЬСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Березниковский филиал
Выпускная квалификационная работа бакалавра
ТЕМА: «РАЗРАБОТКА ТЕХНОЛОГИИ ПОЛУЧЕНИЯ
РАСТВОРА КОАГУЛЯНТА В УСЛОВИЯХ ФИЛИАЛА
«АЗОТ» АО «ОХК «УРАЛХИМ»
Выполнила: студентка гр. ТНВ-12Д Красных В.Ю.
Руководитель: доцент, к.т.н. Куликов М.А.
2. Цель выпускной квалификационной работы:
• Исследование возможности приготовлениякоагулянта с использованием отходов
производства
ЗАДАЧИ:
•провести анализ литературных данных по
реагентам для осветления речной воды;
•изучить
возможность
использования
отработанного катализатора синтеза аммиака
для приготовления раствора сульфата железа.
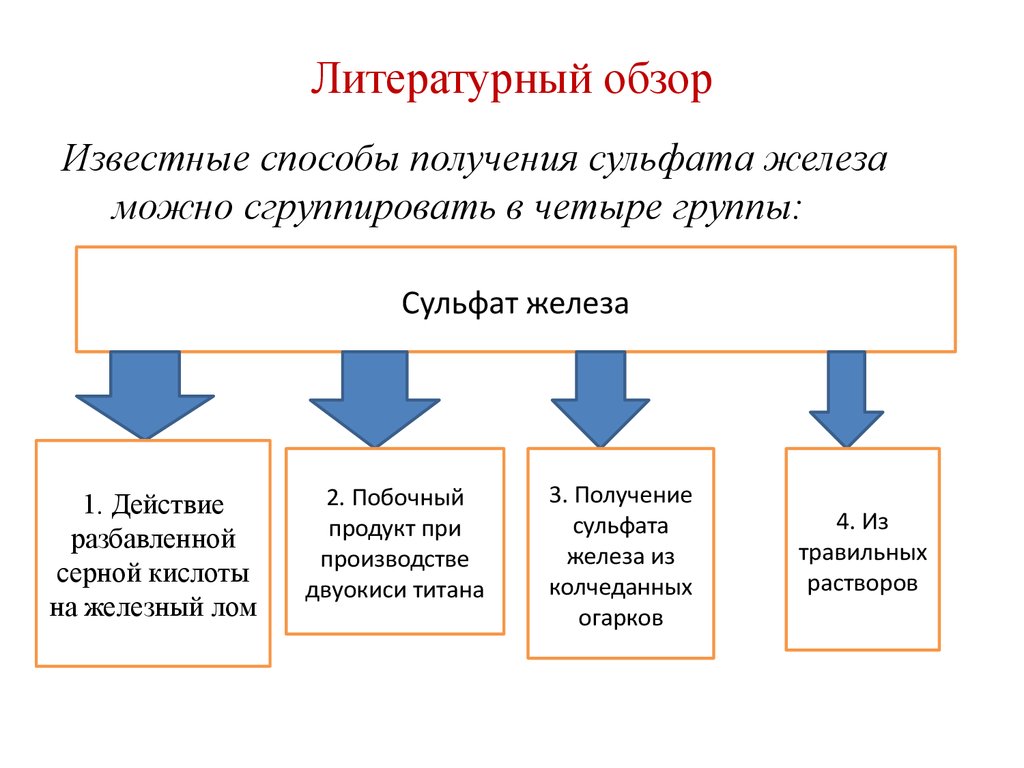
3. Литературный обзор
Известные способы получения сульфата железаможно сгруппировать в четыре группы:
Сульфат железа
1. Действие
разбавленной
серной кислоты
на железный лом
2. Побочный
продукт при
производстве
двуокиси титана
3. Получение
сульфата
железа из
колчеданных
огарков
4. Из
травильных
растворов
4. ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Цель теоретического анализа –•Определение принципиальной возможности протекания реакции.
Отработанный катализатор из цеха 1Б имеет состав:
Fe – 62,2%
FeO – 21,1%
Fe2O3 – 9,5%
Al2O3 – 1,9%
CaO – 2,8%
K2O – 2,4%
Отработанный катализатор такого состава может быть использован для
осветления воды. Для этого необходимо его растворить в серной кислоте.
При этом будут протекать реакции с образованием основного и побочных
продуктов.
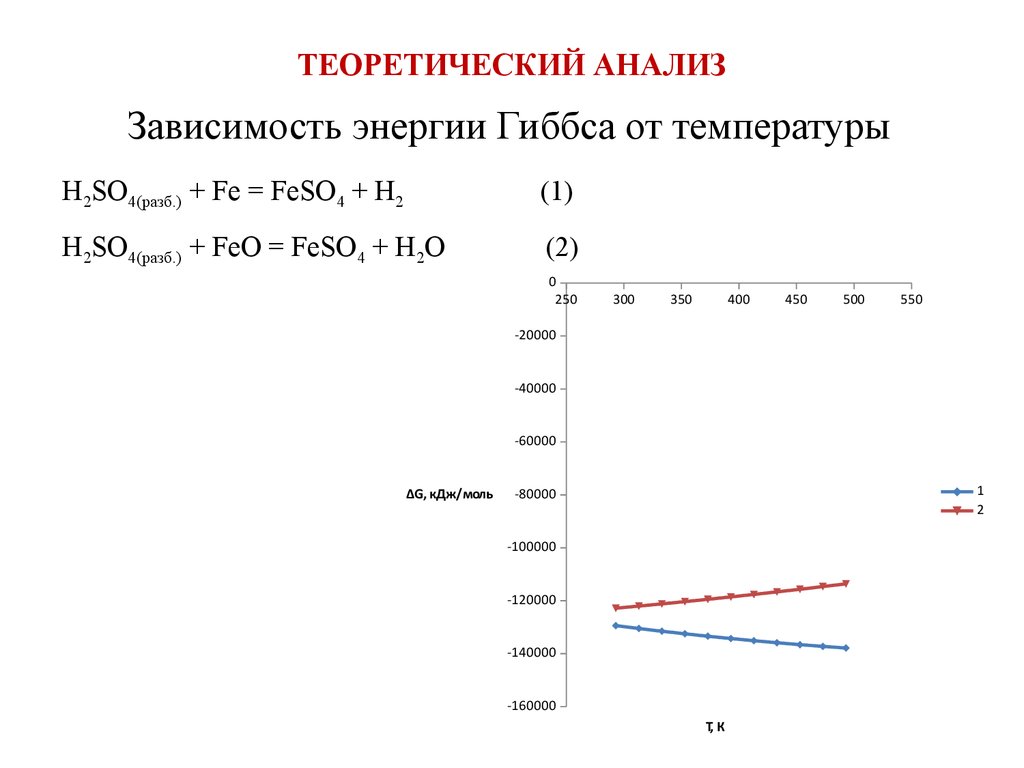
5. ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Зависимость энергии Гиббса от температурыH2SO4(разб.) + Fe = FeSO4 + H2
(1)
H2SO4(разб.) + FeO = FeSO4 + H2O
(2)
0
250
300
350
400
450
500
550
-20000
-40000
-60000
∆G, кДж/моль
1
2
-80000
-100000
-120000
-140000
-160000
T, К
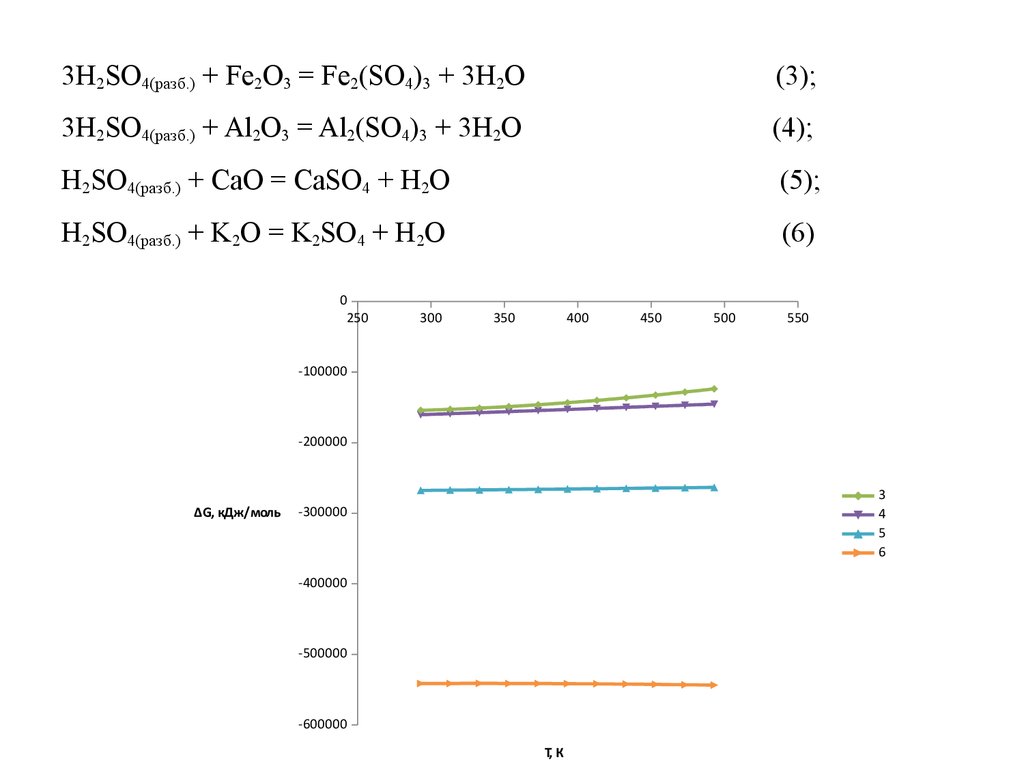
6.
3H2SO4(разб.) + Fe2O3 = Fe2(SO4)3 + 3H2O(3);
3H2SO4(разб.) + Al2O3 = Al2(SO4)3 + 3H2O
(4);
H2SO4(разб.) + CaO = CaSO4 + H2O
(5);
H2SO4(разб.) + K2O = K2SO4 + H2O
(6)
0
250
300
350
400
450
500
550
-100000
-200000
∆G, кДж/моль
3
4
5
6
-300000
-400000
-500000
-600000
T, К
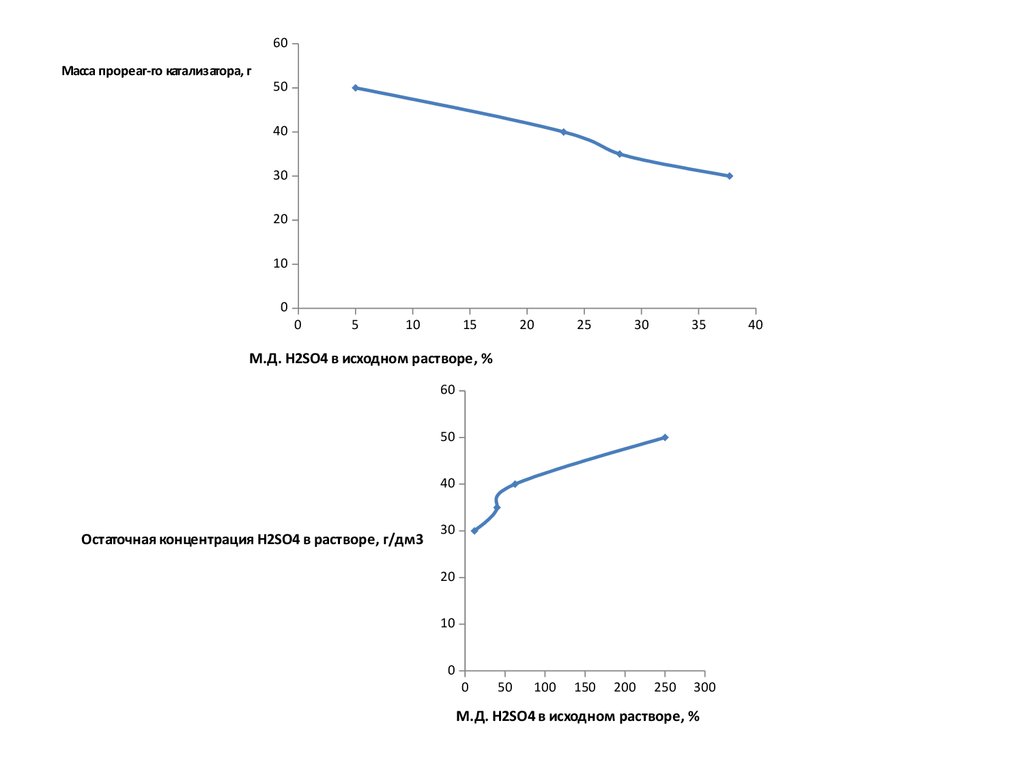
7.
60Масса прореаг-го катализатора, г
50
40
30
20
10
0
0
5
10
15
20
25
30
35
М.Д. H2SO4 в исходном растворе, %
60
50
40
Остаточная концентрация H2SO4 в растворе, г/дм3
30
20
10
0
0
50
100
150
200
250
300
М.Д. H2SO4 в исходном растворе, %
40
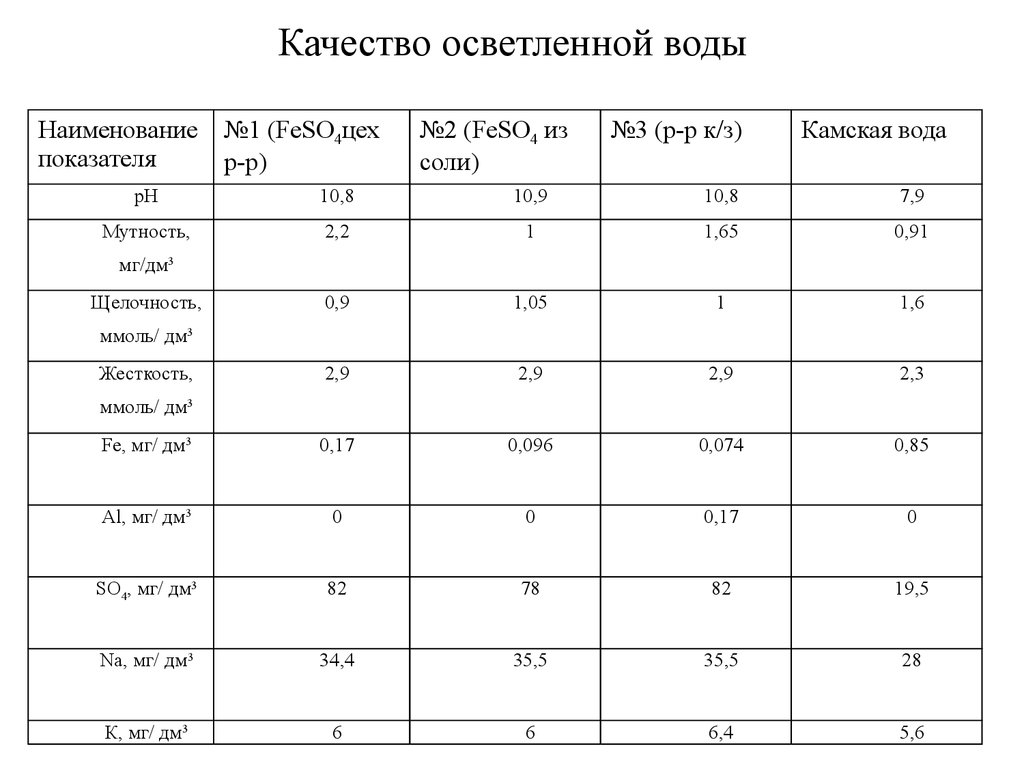
8. Качество осветленной воды
Наименованиепоказателя
№1 (FeSO4цех
р-р)
№2 (FeSO4 из
соли)
№3 (р-р к/з)
Камская вода
pH
10,8
10,9
10,8
7,9
Мутность,
2,2
1
1,65
0,91
0,9
1,05
1
1,6
2,9
2,9
2,9
2,3
Fe, мг/ дм3
0,17
0,096
0,074
0,85
Al, мг/ дм3
0
0
0,17
0
SO4, мг/ дм3
82
78
82
19,5
Na, мг/ дм3
34,4
35,5
35,5
28
К, мг/ дм3
6
6
6,4
5,6
мг/дм3
Щелочность,
ммоль/ дм3
Жесткость,
ммоль/ дм3
9.
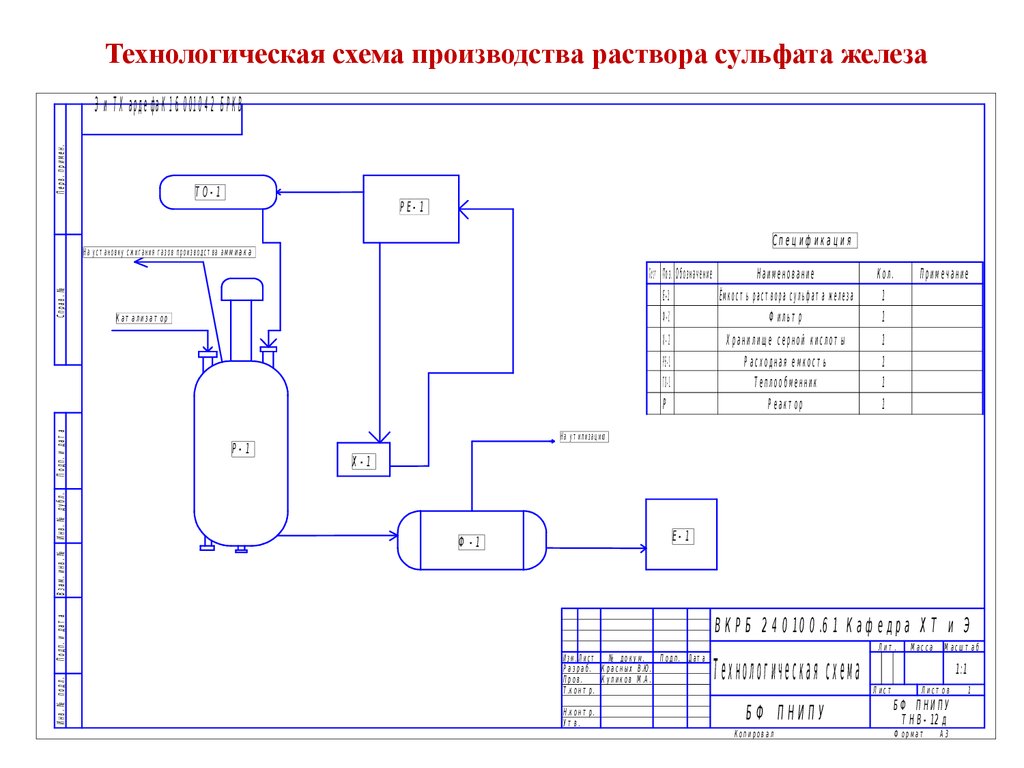
Технологическая схема производства раствора сульфата железаПерв. примен.
Э и Т Х а р д е ф а К 1 .6 0 0 1 0 4 2 Б Р К В
Т О- 1
Р Е- 1
Спец иф икац ия
На ус т ановку с жиг ания г азов произ водс т ва ам м и а к а
Кат ализат ор
Р-1
Наименование
Кол.
Е- 1
Ёмкос т ь раст вора сульф ат а железа
1
Ф-1
Ф ильт р
1
Х- 1
Х ранилищ е серной кислот ы
1
РЕ-1
ТО-1
Р ас ходная емкос т ь
Т еплообменник
1
1
Р
Р еакт ор
1
Примечание
На ут илизац ию
Х-1
Е- 1
Ф -1
Инв. № подл.
П одп. и да т а
Взам. инв. №
Инв. № дубл.
Подп. и дат а
Справ . №
Лис т Поз. Об о зна ч е ние
В К Р Б 2 4 0 10 0 .6 1 К а ф е д р а Х Т и Э
Изм. Л ис т
№ докум.
П одп. Дат а
Р а з р а б . К р а с н ы х В .Ю .
Пров.
К у л и к о в М .А .
Т .к о н т р .
Н .к о н т р .
Ут в.
Т ехнологическая схема
БФ ПНИПУ
Копировал
Л ит .
М асса
М асш т аб
1:1
Л ис т
Л ист ов
БФ ПНИПУ
Т Н В - 12 д
Ф ормат
A3
1
10. Реактор
Перв. примен.Э и Т Х а р д е ф а К 2 6. 0 0 1 0 4 2 Б Р К В
1
2
Справ. №
8
Т ехническая характ ерист ика
1. Х и м и ч е с к и й р е а к т о р п р е д н а з н а ч е н д л я п р о в е д е н и я х и м и ч е с к и х
процессов или
химичес ких реакц ий жидких компонент ов при инт енс ивном перемеш ивании.
2 . П ривод, с по мощ ью к от оро г о вал с м еш алкой приво дят с я в движение
предс т ав ля ют
с обой верт икальный мот ор редукт ор.
3 . Об ъ е м с о с у да , м 3 - 6 .
4 . Ч а с т о т а в р а щ е н и я в а л а , о б / м и н - 18 0 .
5 . М о щ н о с т ь н а в а л у м е ш а л к и - 10
6 . Т емпе рат ура в аппа рат е, г рад - 7 0
5
3
По дп. и да т а
№ Обозначение Н а и м е н о в а н и е К о л - в о П р и м е ч а н и е
Инв. № дубл.
Сборо ч ные единиц ы
В зам. инв. №
4
6
П одп. и да т а
Инв. № подл.
1
2
3
4
5
6
7
8
7
Привод мешалки
Корпус
Якорная меш алка
О по ра а п па ра т а (л а п ы)
В ал меш алки
Г ладкая рубаш ка
Д нищ е
Крашка
1
1
1
4
1
1
1
1
В К Р Б 2 4 0 10 0 .6 2 К а ф е д р а Х Т и Э
Изм. Л ис т
№ докум.
Подп. Дат а
Р а з р а б . К р а с н ы х В .Ю .
Пров.
К у л и к о в М .А .
Т .к о н т р .
Н .к о н т р .
У т в.
А ппарат с механичес ким
пе ре ме ш ив а ющ им у с т ро й с т в о м
Ч ерт еж общ ег о вида
БФ ПНИПУ
Копировал
Л ит .
М асса
М асшт аб
1:15
Л ист
Л ист ов
БФ ПНИПУ
Т Н В - 12 д
Ф ормат
A3
1
11. Заключение
Цель ВКР – исследование возможности приготовлениякоагулянта с использованием отходов производства –
достигнута.
Для достижения поставленной цели:
- Изучены механические, химические, гидрохимические и
биологические способы очистки сточных вод;
- Изучены реагенты для осветления воды, и выбран наиболее
оптимальный в наших условиях;
- Изучена
возможность
применения
отработанного
катализатора для приготовления раствора сульфата железа, и
последующего его применения в качестве коагулянта в
процессах водоподготовки.
Мероприятие может быть реализовано в условиях филиала
«Азот» АО «ОХК «УРАЛХИМ»
12.
Спасибо завнимание






 Химия
Химия








