Похожие презентации:
Химия элементов IVA группы
1. Химия элементов IVA группы
2.
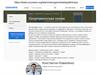
Электронные конфигурации в основном и возбужденном состоянииПериодическая система элементов Д. И. Менделеева (длинная форма)
Пе
ри
од
ы
1
2
3
4
5
6
7
Группы элементов
1
IA
2
IIA
3
IIIB
4
IVB
5
VB
6
7
VIB VIIB
8
9
VIIIB
10
11
IB
12
IIB
13
14
IIIA IVA
15
VA
16
17
18
VIA VIIA VIIIA
(1H)
3Li 4Be
5B
6C
7N
11Na 12Mg
13Al 14Si 15P
19K 20Ca 21Sc 22Ti 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn 31Ga 32Ge 33As
37Rb 38Sr 39Y 40Zr 41Nb 42Mo 43Tc 44Ru 45Rh 46Pd 47Ag 48Cd 49In 50Sn 51Sb
*
55Cs 56Ba 57La 72Hf 73Ta 74W 75Re 76Os 77Ir 78Pt 79Au 80Hg 81Tl 82Pb 83Bi
**
… …
87Fr 88Ra 89Ac 104Db 105Jl 106Rf 107Bh 108Hn 109Mt 110
111
112
s1
s2
d1
d2
d3
d4
s
d5
d6
d7
d8
d9
d10
p1
p2
d
8O
16S
1H
2He
9F
10Ne
17Cl 18Ar
34Se 35Br 36Kr
52Te
53I
54Xe
84Po 85At 86Rn
p3
p4
p5
p6
p
*Лантаноиды
2
ns2np
58Сe
59Pr
60Nd
61Pm
62Sm
63Eu
64Gd
65Tb
66Dy
67Ho
68Er
69Tm 70Yb
71Lu
98Cf
99Es
100Fm
101Md 192No
103Lr
Актиноиды
**
90Th
91Pa
92U
93Np 94Pu
95Am
96Cm
CO, CN-
97Bk
CH4, CS2, CO2, CH3CH2OH
Валентность = 3
2 связи за счет обобщения электронов
+ 1 связь донорно-акцепторная
Валентность = 4
3.
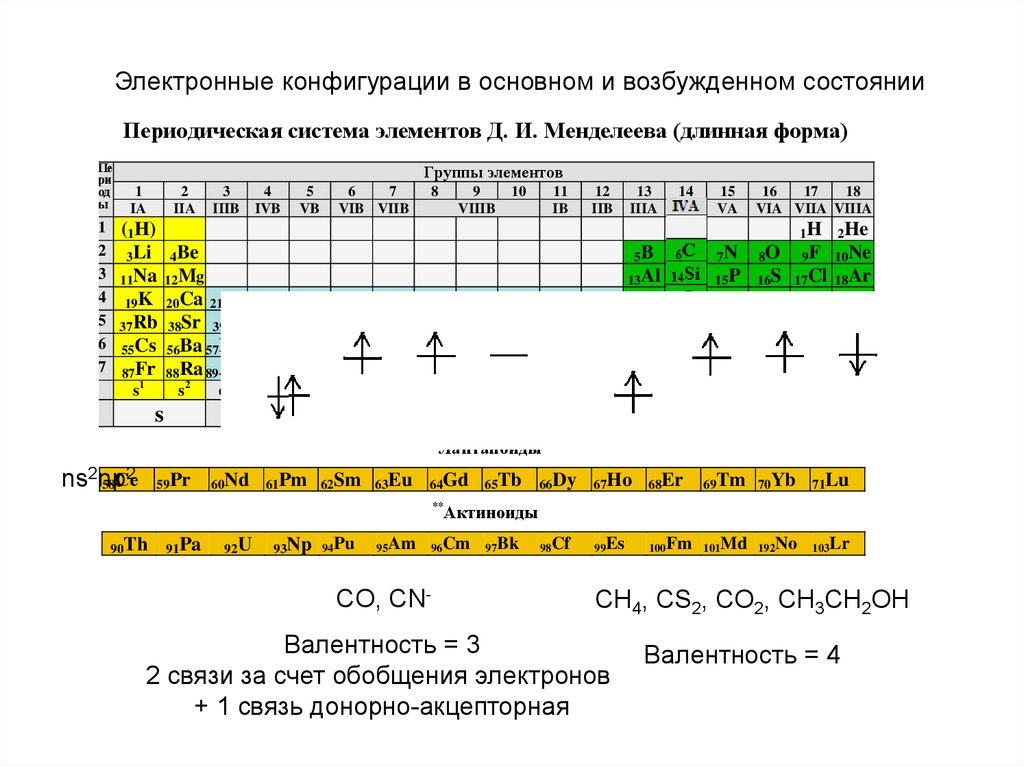
Простые веществаУглерод богат на аллотропные модификации простого вещества!
- графит
ns2np2
- алмаз
- лонсдейлит
4.
Простые веществаУглерод богат на аллотропные модификации простого вещества!
- Аморфный углерод
Сажа
Кокс
Древесный уголь
ns2np2
- фулурен
- карбин
5.
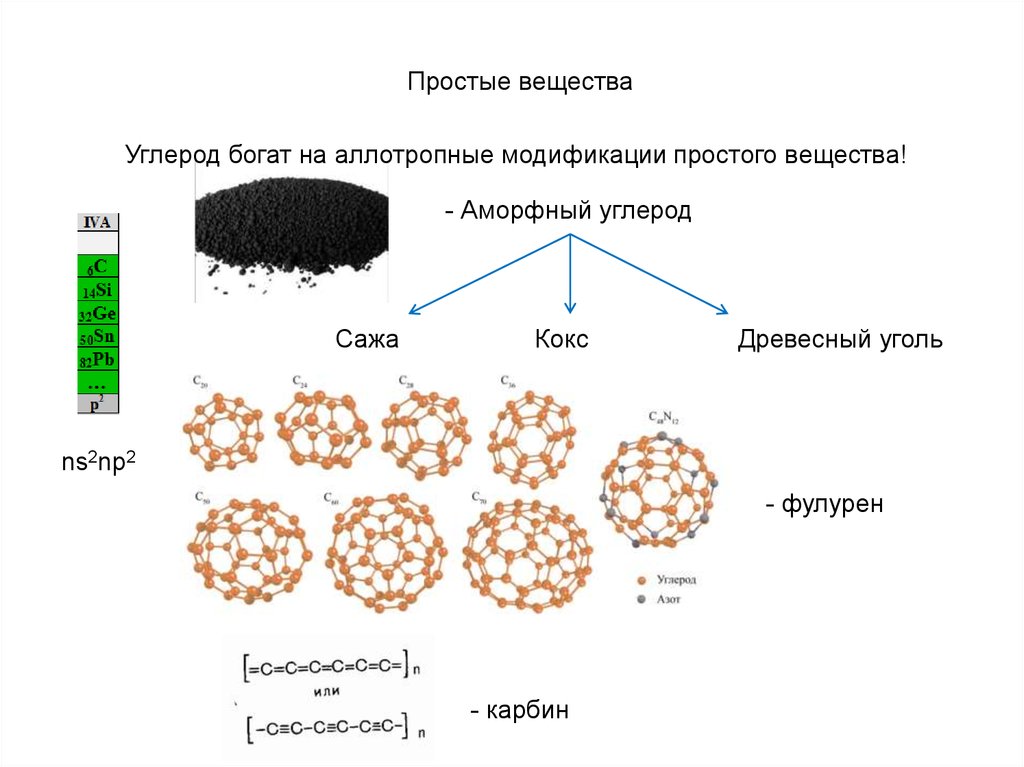
Структуры аллотропных модификацийуглерода
a — алмаз, b — графит, c — лонсдейлит (гексагональный алмаз),
d — карбин, e — фуллерен C60, f — аморфный углерод,
g — одностенная углеродная нанотрубка
6.
Простые веществаАНДРЕЙ ГЕЙМ И КОНСТАНТИН НОВОСЕЛОВ
ns2np2
Скотч-метод!
Известный лжеученый
«академик» Петрик
7.
Простые веществаСинтез алмазов
Резкая кристаллизация чугуна
Изображение синтетических алмазов
Детонационный синтез
алмазов
Рост алмазов из газовой фазы (плазмы)
8.
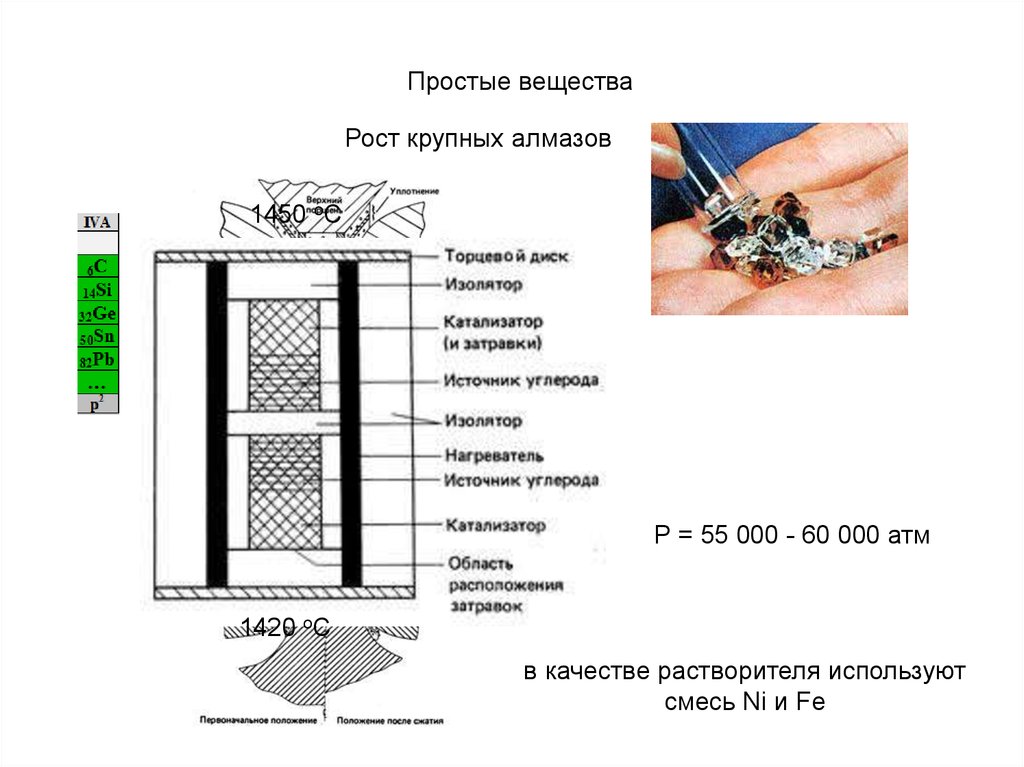
Простые веществаРост крупных алмазов
1450 oС
Р = 55 000 - 60 000 атм
1420 oС
в качестве растворителя используют
смесь Ni и Fe
9.
Основные степени окисленияS = C = N- ↔ S- ‒ C Ξ N
+4
CO2, COCl2, CCl4, SCN-, Na2CO3, KHCO3
+2
CN-, CO
0
C
-1
CaC2
-4
Al4C3
{C Ξ C} 2-
Карбид кальция
Ацителенид кальция
Карбид алюминия
Метанид
10.
КарбидыКарбиды подразделяются на следующие виды:
ионные / солеобразные (CaC2, Al4C3),
ковалентные (карборунд SiC, В4С),
металлоподобные, имеющие нестехиометрический состав
(цементит Fe3C, TiC, WC и ZrC)).
11.
ОВ свойства соединений углеродаПолуреакция
C
Е , В
CO2 + 2e + 2H+ = CO + H2O
0,12
CO2 + 2e + 2H+ = HCOOH
0,20
2CO2 + 2e + 2H+ = H2C2O4
0,49
CH3COOH + 2e + 2H+ = CH3CHO + H2O
0,12
CH3CHO + 2e + 2H+ = C2H5OH
0,19







 Химия
Химия