Похожие презентации:
Гидролиз. Лекция 03-2
1.
Кафедра общей и медицинской химии"Гидролиз"
1
2.
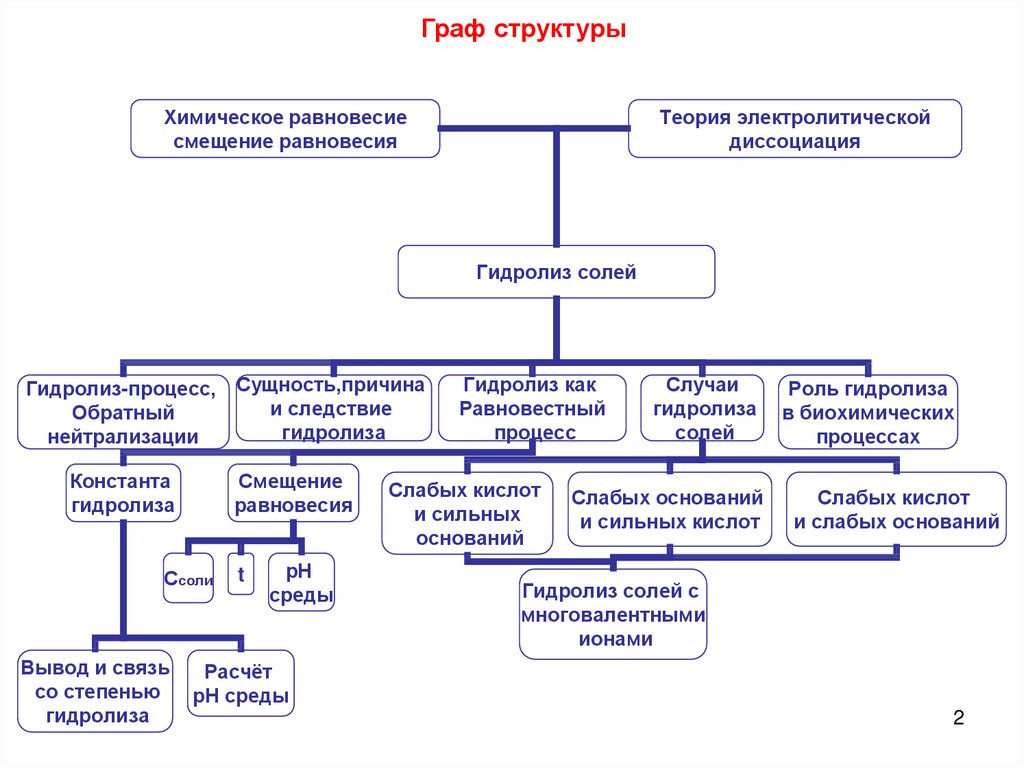
Граф структурыХимическое равновесие
смещение равновесия
Теория электролитической
диссоциация
Гидролиз солей
Гидролиз-процесс,
Обратный
нейтрализации
Константа
гидролиза
Смещение
равновесия
Ссоли
Вывод и связь
со степенью
гидролиза
Сущность,причина
и следствие
гидролиза
t
рН
среды
Гидролиз как
Равновестный
процесс
Слабых кислот
и сильных
оснований
Случаи
гидролиза
солей
Слабых оснований
и сильных кислот
Роль гидролиза
в биохимических
процессах
Слабых кислот
и слабых оснований
Гидролиз солей с
многовалентными
ионами
Расчёт
рН среды
2
3.
В общем случае кгидролизу относятся
процессы взаимодействия
частей вещества с ионами
Н+ и ОН– воды.
3
4.
рН слезы 7.6 - 7.8NaCl - ???
4
5.
Гидролиз солей - процесс взаимодействия ионов соли ссоставными частями воды (Н+ и ОН–).
Причина-образование малодиссоциированных соединений
(слабых электролитов)
Следствие – сдвиг равновесия диссоциации (ионизации)
воды, который сопровождается изменением кислотности
среды вследствие накопления Н+ или ОН– ионов.
5
6.
Гидролиз – процесс:обратимый ( ↔ )
ступенчатый
эндотермический (-Q), так как обратен реакции
нейтрализации.
Гидролиз идет по слабому компоненту соли!
Кислотность определяет сильный компонент!
Количественно гидролиз характеризуется
гидролиза Кг и степенью гидролиза h.
константой
6
7.
Варианты гидролиза:1.
Соль образована одноосновной слабой кислотой и
однокислотным сильным основанием (NaСN, CH3COONa,
NaNO2…) – среда щелочная
CH3COONa H 2O NaOH CH3COOH
CH3COO H 2O OH CH3COOH
Константа гидролиза Кг
[OH ][CH3COOH]
Кр
[H 2O][CH3COO ]
Так как [H2O] практически постоянна,
[OH ][CH3COOH]
К р [ H 2 O] К г
[CH3COO ]
7
8.
Связь Кг с ионным произведением воды и Кд[OH ][CH3COOH]
Кг
[CH3COO ]
Домножим числитель и знаменатель на [H+]:
[H ][OH ][CH 3COOH] K H 2O
Кг
[H ][CH 3COO ]
К д (к)
Кг
K H 2O
К Д CH 3COOH
10 14
10
Кг
5
,
7
·
10
1,75·10 5
Значение Кг показывает, что в момент равновесия произведение
концентраций исходных веществ примерно в миллиард раз
больше, чем продуктов реакции, что говорит об относительно
8
небольшой степени протекания гидролиза.
9.
Вывод степени гидролиза hCH3COO H 2O OH CH3COOH
[OH-]=[CH3COOH]
[OH ][CH3COOH]
Кг
[CH3COO ]
[OH ]2
Кг
Сс
Кг
(1)
K H 2O
К д(к)
(2)
Приравнивая формулы (1) и (2), получим:
2
K H 2O
[OH ]
(3)
Cc
К Д (к)
9
10.
CH3COO H 2O OH CH3COOHh
Cгидр
Cc
;
[OH ]
h
[OH ] Cc ·h
Cc
[OH ]2 K H 2O
(3)
Cc
К Д (к)
[OH ] Cc ·h
Подставим
2
c
в уравнение (3)
2
K H 2O
K H 2O
C ·h
h
Cc
К Д(к)
Cc ·К Д ( к )
10
11.
Вывод формулы для расчёта pH[OH ]2 K H 2O
(3)
Cc
К Д (к)
CH3COONa ( рН>7 )
[OH ]
K H 2O ·Cc
Kд к
1
1
1
pOH lg K H 2O lg Cc lg K д к
2
2
2
pH 14 pOH
1
1
pH 7 pКд к lg Cc
2
2
11
12.
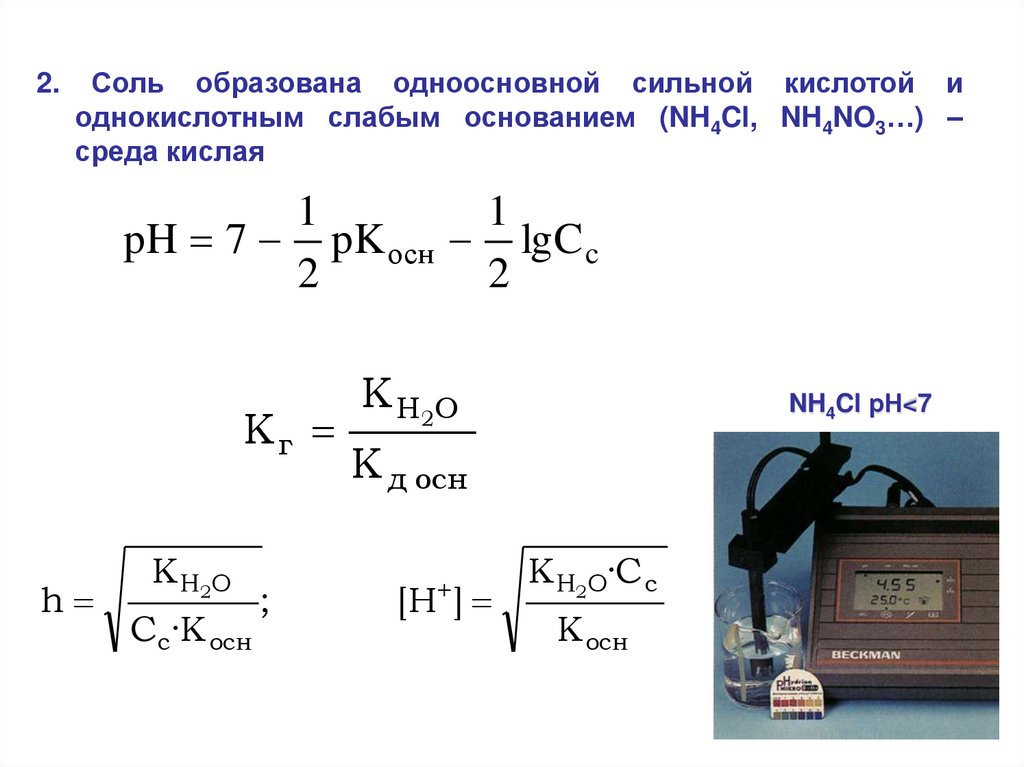
2.Соль образована одноосновной сильной кислотой и
однокислотным слабым основанием (NH4Cl, NH4NO3…) –
среда кислая
1
1
pH 7 pK осн lgC c
2
2
Кг
h
K H2O
Cc·K осн
;
K H2O
NH4Cl рН<7
K д осн
[H ]
K H2O·C c
K осн
12
13.
3. Соль образована слабым однокислотным основанием ислабой одноосновной кислотой (NH4CN, CH3COONH4…) –
среда ≈ нейтральная рН не зависит от концентрации соли,
гидролиз проходит достаточно глубоко
1
1
pH 7 pK к pК осн
2
2
h
Кг
K H 2O
К к·Kосн
;
K H 2O
K NH4OH ·K HCN
[H ]
CH3COONН4+ ( рН ≈ 7 )
K H 2O·К к
K осн
10 14
0,9
10
5
6,2·10 ·1,75·10
13
14.
Гидролиз кислых солейПараллельно с гидролизом в растворах кислых солей
протекает диссоциация кислотного остатка, поэтому при
оценке значения рН необходимо сравнить константы
гидролиза (Кг) и диссоциации кислоты по второй ступени (К2):
NaHSO 3 H 2O
NaOH H 2SO3
Кг
а) HSO3 H 2O
OH H 2SO3
К2
б) HSO3
H SO3
В данном случае
намного меньше, чем
Кг
K H 2O
K1( H 2SO3 )
2
10 14
13
6
,
3
·
10
1,6·10 2
K 2( H2SO3 ) 6,3·10
следовательно, среда будет слабокислой.
8
14
15.
Растворы кислых солей имеют различный характер среды:Na2HPO4 - щелочная
NaH2PO4 – кислая
Раствор питьевой соды NaHCO3 имеет слабощелочную среду
и используется в медицине для предотвращения ацидозов
Расчет степени гидролиза концентрации ионов водорода и
рН среды для кислых солей
1
1
pH pK 1 к pK 2 к
2
2
K2 к
h 2
;
К1 к
[H ] К1 к ·K 2 к
15
16.
Ступенчатый гидролизВ случае солей многоосновных кислот или
многокислотных оснований процесс гидролиза протекает
ступенчато
1- я ступень: Na 2СO3 H 2O NaOH NaHCO 3
2
CO3 H 2O OH HCO3
2-я ступень:
NaHСO 3 H 2O NaOH H 2CO3
HCO3 H 2O OH H 2CO3
K H 2O
K H 2O
4
Кг 1
2,1·10 ;
Кг 2
2,2·10 8
Kд 2
Kд1
1
1
pH 7 pKд2 к lg Cc
2
2
Сравнение величин Кг1 и Кг2 показывает, что практически гидролиз
протекает только по первой ступени.
Cмещением равновесия вправо ( нагреванием и разбавлением
раствора – согласно принципу Ле-Шателье) можно добиться в ряде
16
случаев реализации гидролиза по второй и даже по третьей ступени.
17.
Смещение равновесияобратимого гидролиза
17
18.
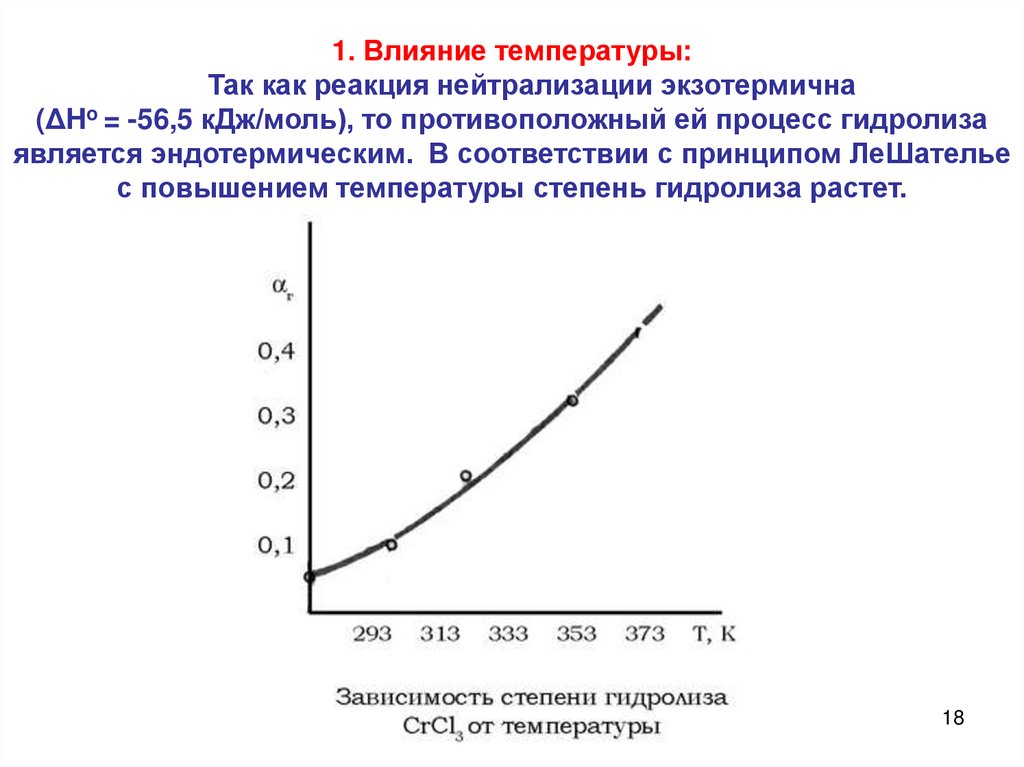
1. Влияние температуры:Так как реакция нейтрализации экзотермична
(ΔHo = -56,5 кДж/моль), то противоположный ей процесс гидролиза
является эндотермическим. В соответствии с принципом ЛеШателье
с повышением температуры степень гидролиза растет.
18
19.
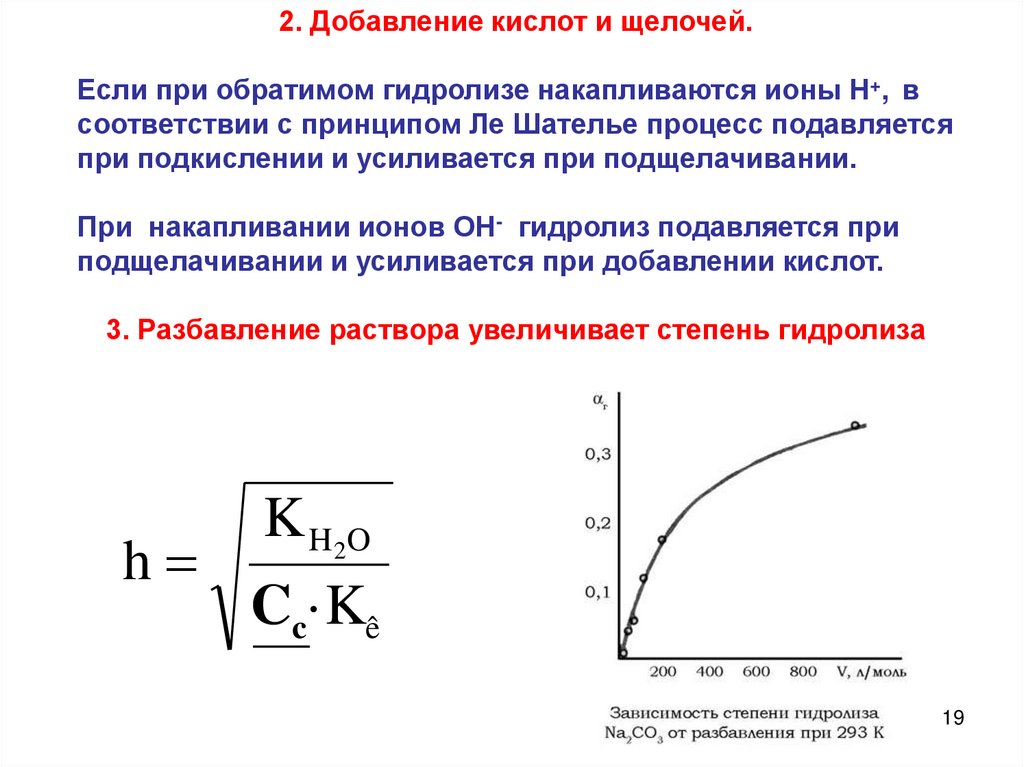
2. Добавление кислот и щелочей.Если при обратимом гидролизе накапливаются ионы Н+, в
соответствии с принципом Ле Шателье процесс подавляется
при подкислении и усиливается при подщелачивании.
При накапливании ионов ОН- гидролиз подавляется при
подщелачивании и усиливается при добавлении кислот.
3. Разбавление раствора увеличивает степень гидролиза
h
K H 2O
Cc·Kê
19
20.
Необратимый гидролизЕсли какое-либо из образующихся в процессе гидролиза
веществ накапливается в растворе в таких количествах, что
станет возможным выделение его в осадок или
улетучивание в виде газа, то гидролиз будет необратимым,
что приведет к полному разложению соли водой:
Al 2S3 6H 2O 2Al(OH) 3 3H 2S
2AlCl 3 3Na 2CO3 3H 2O 2Al(OH) 3 3CO 2 6 NaCl
или
2Al3 3CO32- 3H 2O 2Al(OH) 3 3CO2
Соли, подвергающиеся необратимому гидролизу:
Cr2S3 , Al 2 (CO 3 )3 , Cr2 (CO 3 )3 , Fe 2 (CO 3 )3
20
21.
Роль гидролиза биоорганических соединенийв процессах жизнедеятельности
1. Каждый из ферментов активен при строго определенных
значениях рН:
пепсин желудочного сока активен при рН 1,5–2,0,
каталаза крови – при рН 7,0;
тканевые кетапсины при реакции среды, близкой
к нейтральной, катализируют синтез белка,
а при кислой реакции расщепляют его.
2. Ионы водорода катализируют гидролиз сложных
сахарозы.
жиров,
21
22.
3. Без ферментативного гидролиза невозможно усвоениепищевых продуктов (жиры, углеводы, белки) , так как
всасываться в кишечнике способны только относительно
небольшие молекулы.
Жиры в желудочно-кишечном тракте расщепляются водой на
более мелкие фрагменты.
R1—О—R2 + H2O → R1—ОН + R2—ОН
R1, R2 — фрагменты биоорганической молекулы
Усвоение полисахаридов и дисахаридов становится
возможным лишь после полного их гидролиза ферментами
до моносахаридов.
Белки гидролизуются до веществ, которые лишь потом могут
усваиваться.
22
23.
4. Гидролиз АТФ - источник энергии в организмеЧеловек получает энергию как за счет многостадийного процесса
окисления пищи — белков, жиров и углеводов, так и за счет
гидролиза некоторых сложных эфиров, амидов, пептидов и
гликозидов.
Космические ракеты высотой с
башню устремляются в небо за счет
громадной энергии, что выделяется
при сжигании водорода в чистом
кислороде.
Эта же энергия поддерживает
жизнь и в клетках нашего тела. В
них реакция окисления протекает
поэтапно. Кроме того, сначала
вместо тепловой и кинетической
энергии наши клетки создают
клеточное «топливо» — АТФ.
23
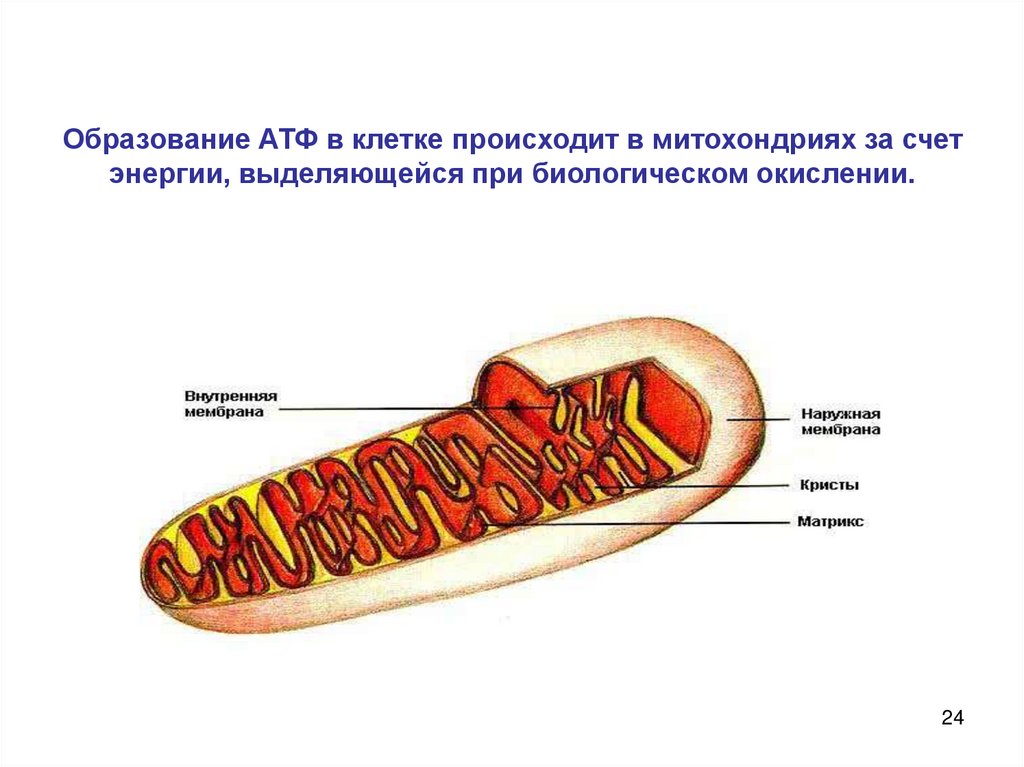
24. Образование АТФ в клетке происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
2425.
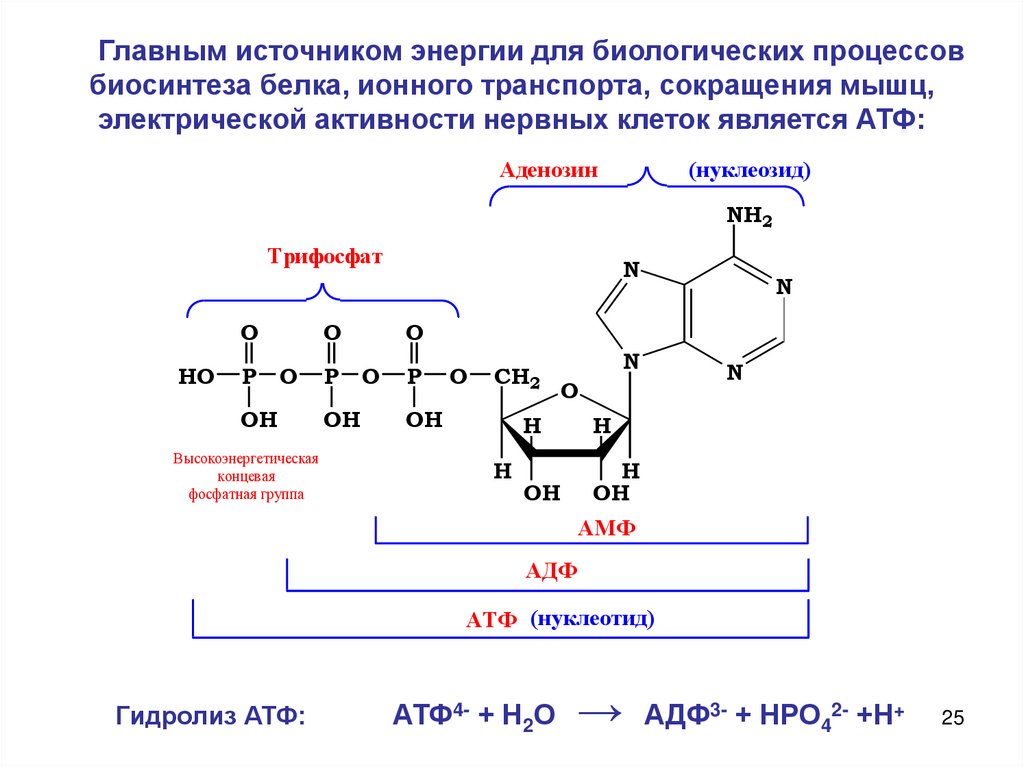
Главным источником энергии для биологических процессовбиосинтеза белка, ионного транспорта, сокращения мышц,
электрической активности нервных клеток является АТФ:
Аденозин
(нуклеозид)
NH2
Трифосфат
HO
N
O
O
O
P O
P O
P
OH
OH
OH
Высокоэнергетическая
концевая
фосфатная группа
O
CH2
H
N
N
N
O
H
H
OH
H
OH
АМФ
АДФ
АТФ (нуклеотид)
Гидролиз АТФ:
АТФ4- + Н2О
→
АДФ3- + НРО42- +Н+
25
26.
NH2O
HO
P
OH
O
O
P
N
O
O
OH
P
O
CH2
OH
H
N
O
H
H
OH
H
OH
O
→
Цитозинтрифосфат
(нуклеотид)
NH2
N
HOCH2
H
N
O
H
H
OH
H
OH
+ Σ фосфатов
O
Цитозин
(нуклеозид)
26
27.
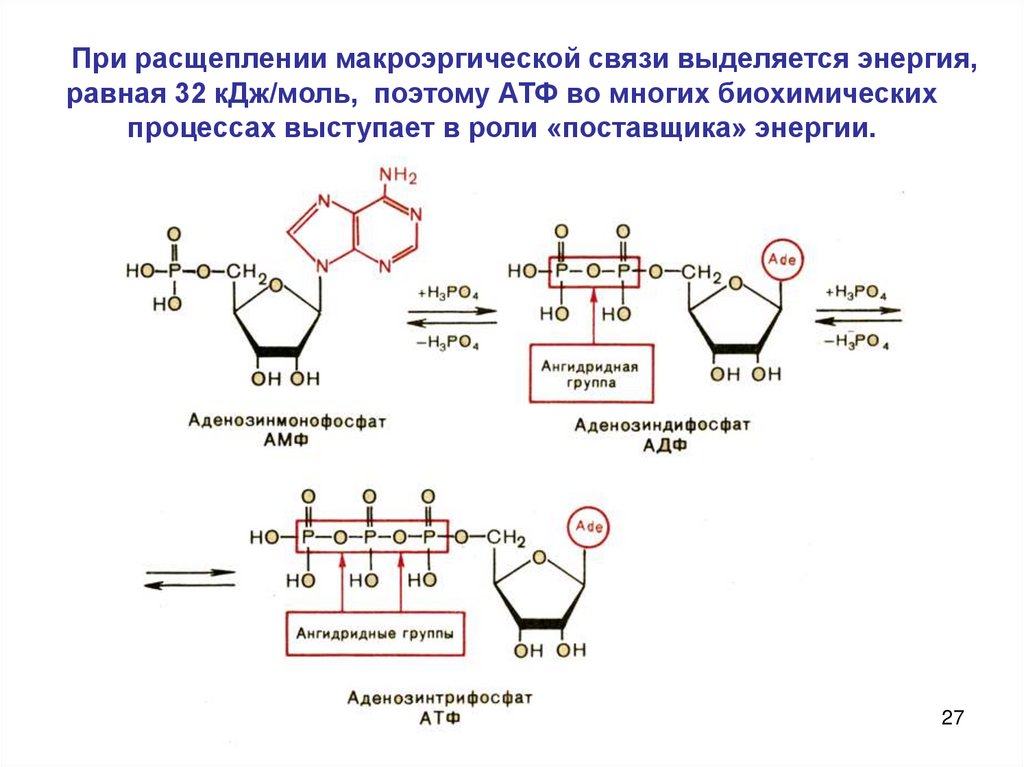
При расщеплении макроэргической связи выделяется энергия,равная 32 кДж/моль, поэтому АТФ во многих биохимических
процессах выступает в роли «поставщика» энергии.
27
28.
5. Гидролиз –один из важнейших путей метаболизмалекарственных препаратов и пищевых продуктов
Процесс гидролиза может
идти:
В плазме крови
На клеточных мембранах
В цитоплазме клеток
Во внутренних органеллах,
в частности в лизосомах
28
29.
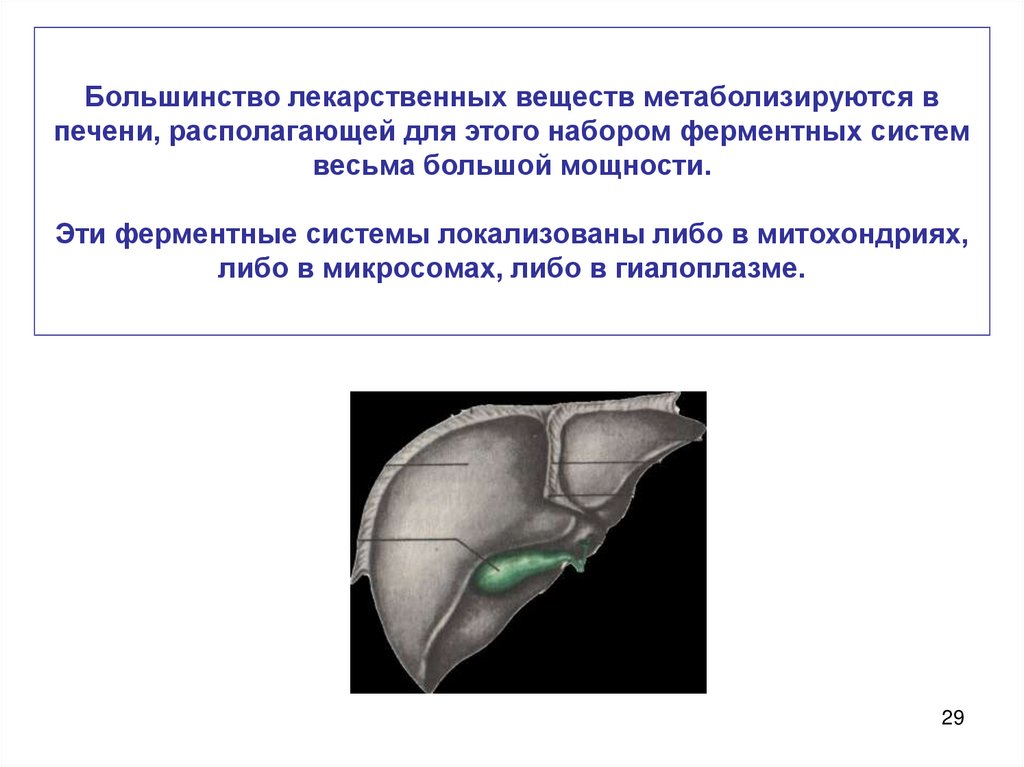
Большинство лекарственных веществ метаболизируются впечени, располагающей для этого набором ферментных систем
весьма большой мощности.
Эти ферментные системы локализованы либо в митохондриях,
либо в микросомах, либо в гиалоплазме.
29
30.
Гидролиз ацетилсалициловой кислотыO
C
H+
O
C
O
H2O
OH
OH + CH3
O
C
OH
COOH CH
3
30
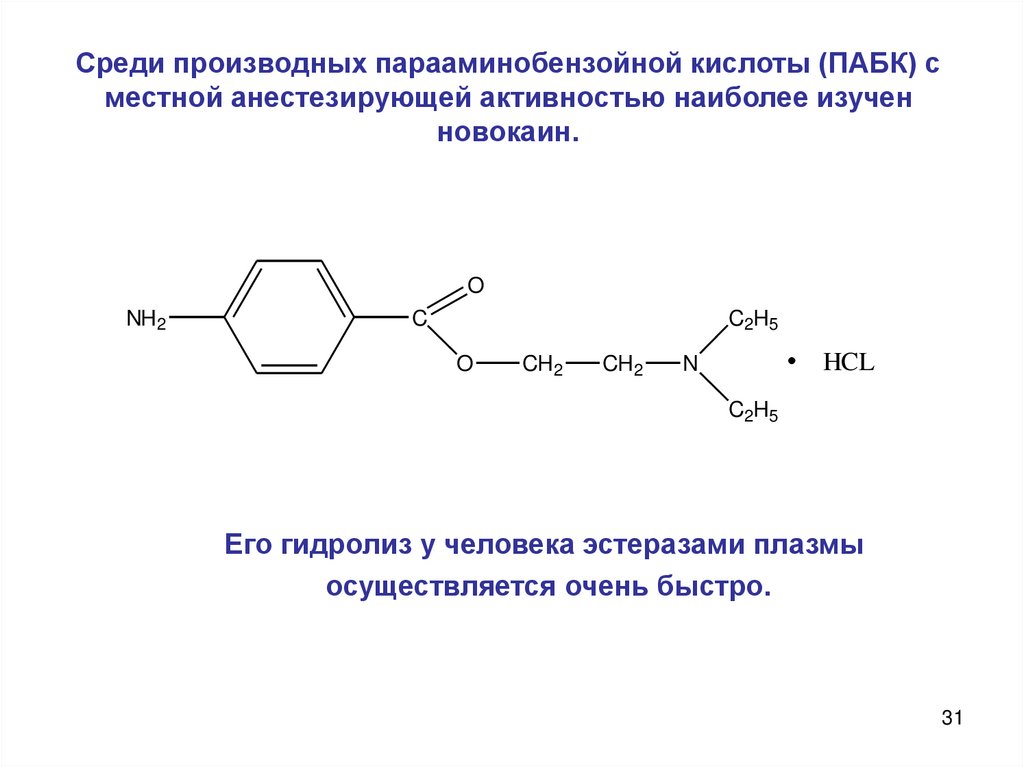
31. Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин.
ONH 2
C
C2H5
O
CH 2
CH 2
HCL
N
C2H5
Его гидролиз у человека эстеразами плазмы
осуществляется очень быстро.
31
32.
Новокаинамид (вторичный амин)имеет алифатический заместитель при атоме азота.
O
NH 2
C
C2H5
NH
CH 2
CH 2
HCL
N
C2H5
Гидролиз его в организме по сравнению с новокаином
протекает намного медленнее.
Новокаинамид более стоек, чем новокаин, и менее токсичен.
Способен понижать возбудимость и проводимость сердечной
мышцы. Применяется при расстройствах сердечного ритма.
32
33.
Гидролиз сложных эфировOH
O
C
O
CH3
Анестезин, местный анестетик
O
C
H3C
O
H2Ñ
Бензилацетат, ответственен за запах жасмина
33
34.
OCH2 O
C
O
(CH2)16 CH3
C
O
C
O
(CH2)16 CH3
CH23 O
C
(CH2)16 CH3
Тристеарин – компонент
сала и некоторых твердых
растительных жиров
34
35.
CH3C
O
O
(CH2)4
CH3
Пентилацетат
35
36.
CH3C
O
O
(CH2)7
CH3
Октилацетат
36
37.
NH 2C
O
O
CH3
Метилантранилат
37
38.
OHO
C
O
CH3
Метилсалицилат
O
CH3
C
O
CH2 CH3
Этилацетат
(растворитель для удаления
маникюрного лака)
38
39.
OCH3CH2CH2 C
O
CH2CH3
Этилбутанат
O
CH3
C
O
CH2
CH2
CH
CH3
CH3
Изопентилацетат
39
40.
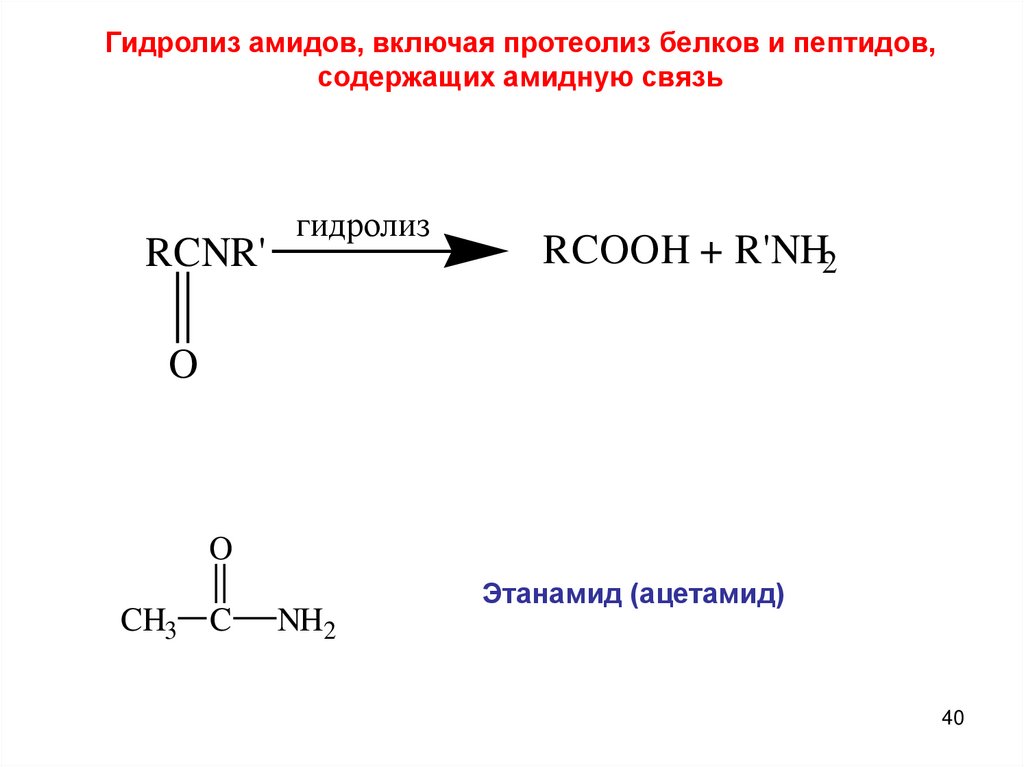
Гидролиз амидов, включая протеолиз белков и пептидов,содержащих амидную связь
RCNR'
гидролиз
RCOOH + R'NH2
O
O
CH3 C
NH2
Этанамид (ацетамид)
40
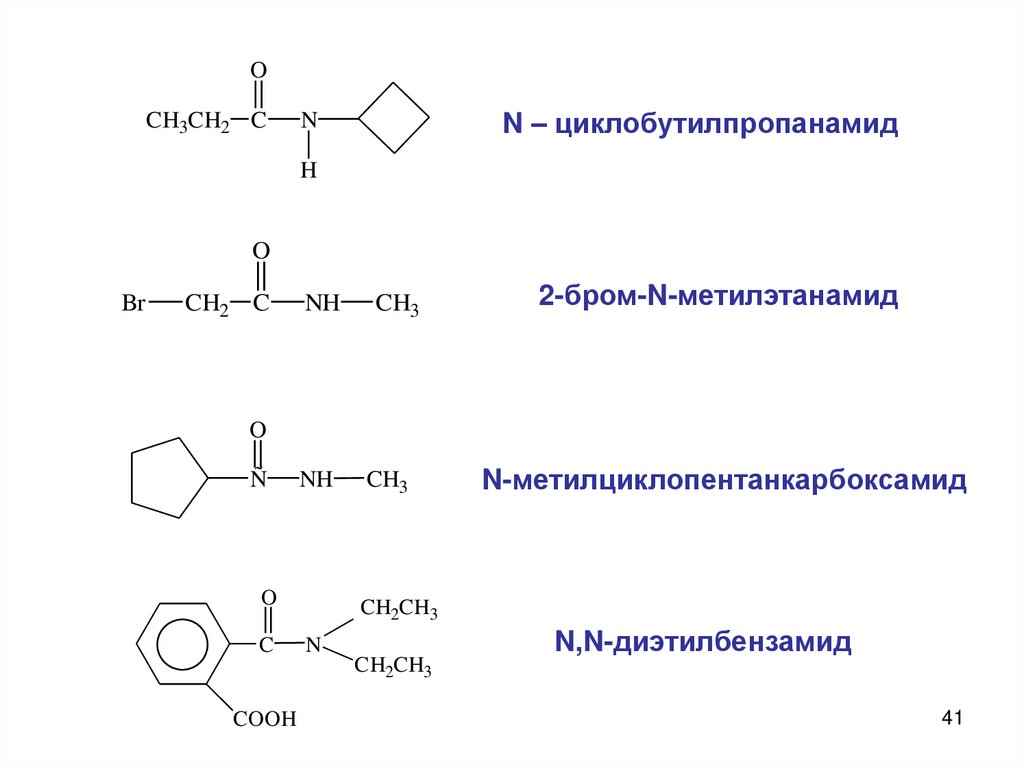
41.
OCH3CH2 C
N – циклобутилпропанамид
N
H
O
Br
CH2 C
NH
CH3
2-бром-N-метилэтанамид
O
Ñ
NH
O
C
CH3
CH2CH3
N
CH2CH3
COOH
N-метилциклопентанкарбоксамид
N,N-диэтилбензамид
41
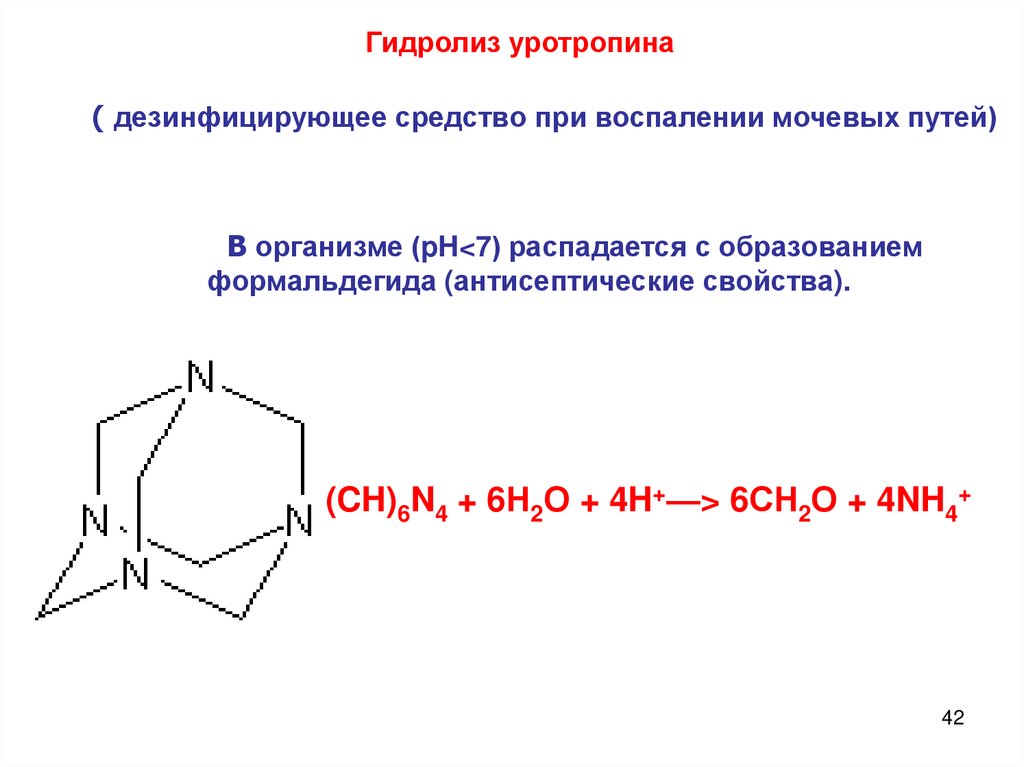
42.
Гидролиз уротропина( дезинфицирующее средство при воспалении мочевых путей)
В организме (pH<7) распадается с образованием
формальдегида (антисептические свойства).
(CH)6N4 + 6Н2О + 4H+—> 6СН2О + 4NH4+
42
43.
Гидролиз мочевины(амид угольной кислоты)
NH2 – CO – NH2 + H2O → 2NH3 + CO2
43
44.
Гидролиз сахарозыГлюкоза- один из основных
источников энергии для всех
клеток.
Образует полисахариды:
в клетках растений- крахмал,
в клетках животных- гликоген.
CH 2 OH
H
О
H
OH H
H
1
OH
H
CH 2 OH
H
H
OH
+
OH О
О
OH 2
CH 2 OH
H
Сахароза
+
H2 O
T0 , H
CH 2 OH
CH 2 OH О
H
H
OH
OH
OH С
CH 2 OH
H
Фруктоза
2
+
H H
OH
OH
H
О
H
H
OH
OH
Глюкоза
44


































 Химия
Химия








