Похожие презентации:
Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12
1.
Национальный исследовательский университет МЭИКафедра Химии и электрохимической энергетики
Равновесие в реакциях гидролиза
и трудно растворимых
электролитов
Доцент, к.х.н.
Камышова В. К.
2011
Лекция 12
2.
ПЛАН ЛЕКЦИИ1
Гидролиз солей.
2
Количественные характеристики процесса гидролиза.
3
Гидролиз по катиону и аниону.
4
Расчет рН гидролиза.
5
Трудно растворимые сильные электролиты.
6
Произведение растворимости.
3.
Реакции обменного разложения солей водойГидролиз – результат поляризационного взаимодействия ионов
соли с их гидратной (Н2О) оболочкой
Соли – сильные электролиты – диссоциируют полностью:
КА Кm+ + An-
Гидролиз:
Кm+ + НOH КОН(m-1)+ + H+
или
An- + НОH HA(n-1)- + OHмалодиссоциированные
частицы
изменение рН раствора
4.
Чем заряд и радиус ионавзаимодействие с диполями Н2О сильнее
процесс гидролиза сильнее.
Нг 0 – эндотермический процесс
с увеличением температуры гидролиз усиливается
5.
Количественная характеристика гидролизаСтепень гидролиза : отношение концентрации
гидролизованной части соли к общей ее концентрации
cГ
β
с0
(для разбавленных растворов а = с)
Гидролиз – обратимый равновесный процесс :
Кm+ + НOH КОН(m-1)+ + H+
K равн K Г
С KOH( m 1) C H
CK m
6.
K равн K ГС KOH( m 1) C H
CK m
Константа гидролиза КГ зависит от:
• природы реагентов
• температуры
Сi – равновесные концентрации
Т. к. НГ 0 с температуры КГ выход продуктов
гидролиза растет
7.
Закон разведения Оствальда для процесса гидролиза:2 c0
KГ
1
Если
ᵦ существенно меньше 1
K Г 2 c0
(1 – β) ~ 1
8.
Гидролизу подвергаются соли, образованные:CuSO4
CuSO3
Na2SO3
Cu(OH)2
H2SO4
NaOH
H2SO3
H2SO3
Cu(OH)2
слабым
сильной
сильным
слабой
слабой
слабым
основанием кислотой основанием кислотой основанием кислотой
9.
Соли, образованные сильной кислотой и сильным основанием,гидролизу не подвергаются
Na2SO4 Na+ + SO42NaOH
сильное основание
H2SO4
сильная кислота
раствор нейтральный: рН 7
10.
Форма записи процесса гидролиза:Диссоциация соли: СН3СООNa CH3COO- + Na+
CH3COOH
слабая кислота
NaOH
сильное основание
Гидролиз – по иону слабого электролита:
CH3COO- + НОН CH3COOH + ОН-
KГ
CCH3COOH COH
CCH COO
3
рН˃7
- выражение константы гидролиза
11.
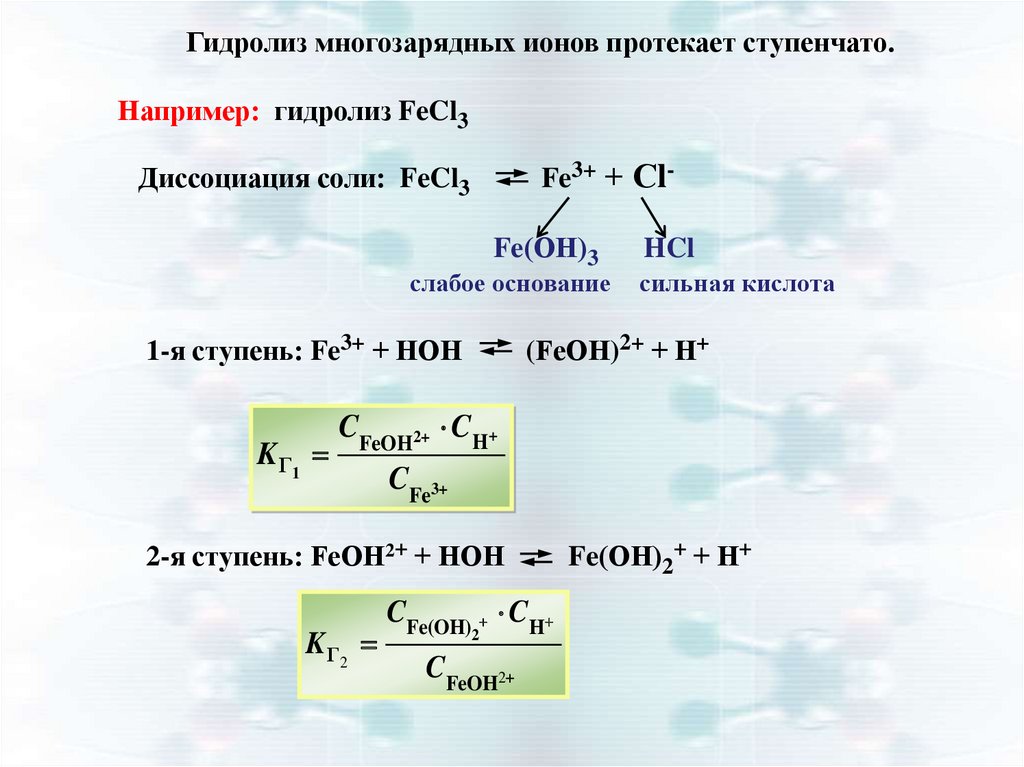
Гидролиз многозарядных ионов протекает ступенчато.Например: гидролиз FeCl3
Fe3+ + Сl-
Диссоциация соли: FeCl3
Fe(ОН)3
слабое основание
1-я ступень: Fe3+ + НОН
K Г1
HCl
сильная кислота
(FeОН)2+ + Н+
CFeOH2+ CH+
CFe3+
2-я ступень: FeОН2+ + НОН
K Г2
CFe(OH) CH
2
CFeOH2
Fe(ОН)2+ + Н+
12.
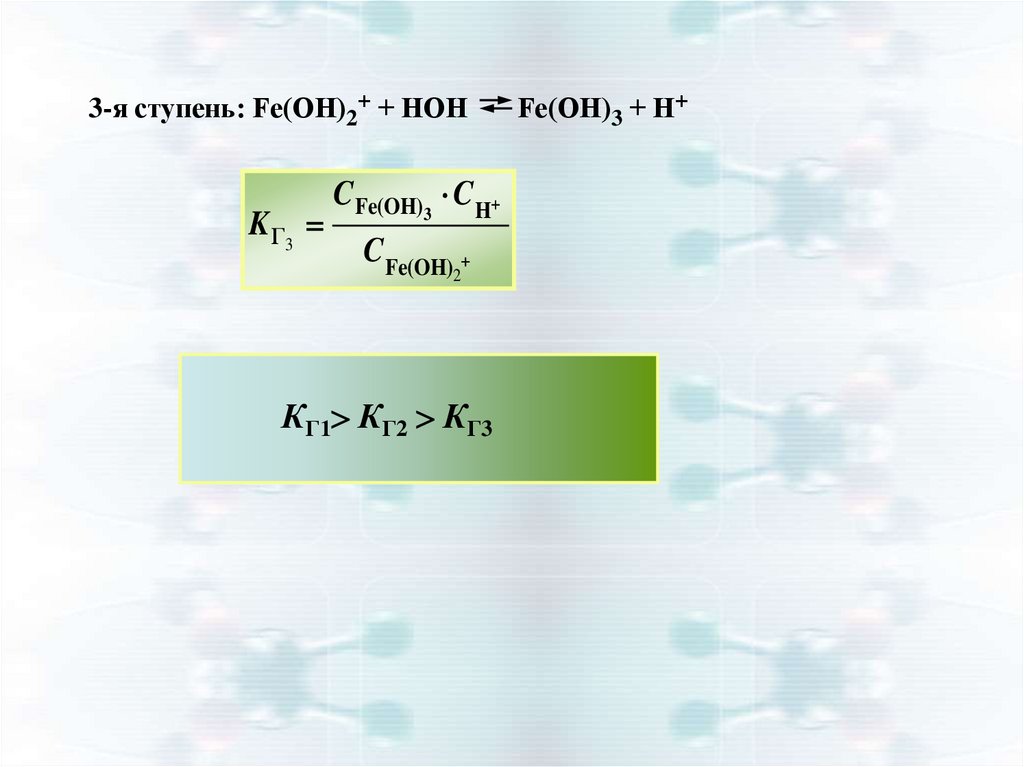
3-я ступень: Fe(ОН)2+ + НОНK Г3
CFe(OH)3 C H
CFe(OH)
2
КГ1 КГ2 КГ3
Fe(ОН)3 + Н+
13.
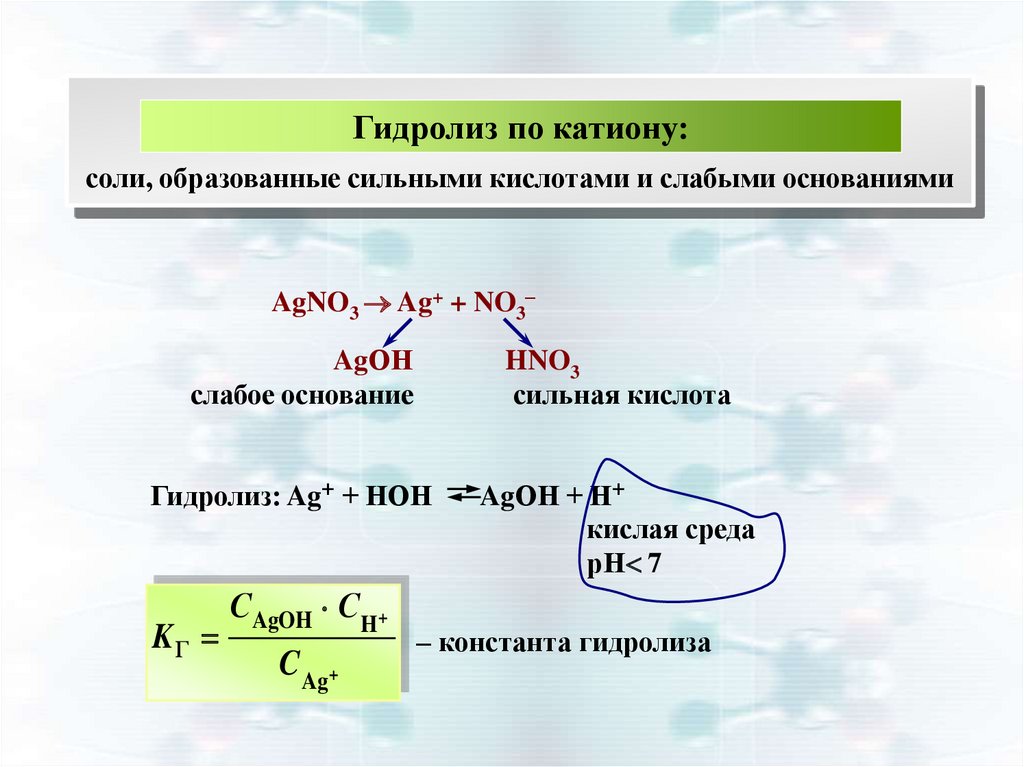
Гидролиз по катиону:соли, образованные сильными кислотами и слабыми основаниями
AgNO3 Ag+ + NO3–
AgОН
слабое основание
HNO3
сильная кислота
Гидролиз: Ag+ + НОН
KГ
С AgOH C H+
C Ag+
AgОН + Н+
кислая среда
рН 7
– константа гидролиза
14.
Умножим числитель и знаменатель на одну и ту же величину СОН-KГ
С AgOH C H+
C Ag+
С AgOH C H+ COH-
KW
C Ag+ COH-
КД(AgOH) : AgOH ↔ Ag+ + OH-
KГ
KW
K Д ( основания )
– константа гидролиза по катиону
Если КГ (1-ой ступени) КД (последней ступени)
Если КГ (последней ступени) КД (1-ой ступени)
15.
Расчет рН гидролиза по катиону:КГ1 = КW / КД осн посл ст = 2 С0 β ? СН+ = С0 рН = –lgCH+
16.
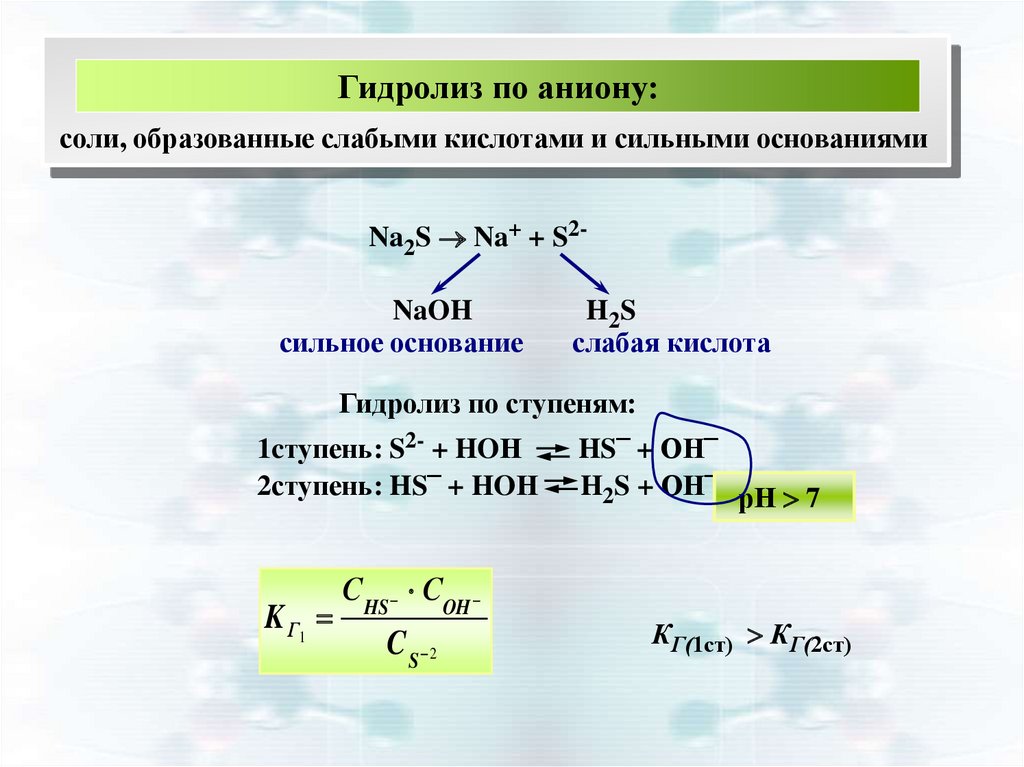
Гидролиз по аниону:соли, образованные слабыми кислотами и сильными основаниями
Na2S Na+ + S2NaOH
сильное основание
H2 S
слабая кислота
Гидролиз по ступеням:
1cтупень: S2- + HOН
2ступень: HS– + HOН
K Г1
С HS COH
C S 2
HS– + ОН–
H2S + ОН– рН 7
КГ(1ст) КГ(2ст)
17.
Умножим числитель и знаменатель на одну и ту же величину СН+K Г1
С HS COH
C S 2
С HS COH C H
КД2
KГ
KW
K Дкислоты
кw
C S 2 C H
H2S
HS-
HS- + H+ ; КД1
H+ + S2- ; КД2
– константа гидролиза по аниону
Если КГ1 первой ступени, то КД кислоты последней ступени
18.
Расчет рН гидролиза по аниону:КГ1 = КW /КДк-ты посл ст = 2 С0 ? СОН- = С0
рН = 14 + lgCОH-
19.
Гидролиз и по катиону и по аниону:соли, образованные слабым основанием и слабой кислотой
(NН4СN, РbCO3, Аl2S3)
Например: NН4СN → NН4+ + CN
Гидролиз и по катиону и по аниону:
СN + НОН
NН4+ + НОН
НСN + ОН–
NН4ОН + Н+
Σ: NН4+ + СN + Н2О
NН4ОН + НСN
20.
KГС HCN C NH 4OH
C NH CCN
4
С HCN COH C NH4OH C H
C NH CCN C H COH
4
KW
KГ
K Д кислоты K Д основания
КД(NH OH)=1,79 10-5 > КД(НСN) =7,9 10-10 pH > 7
4
Концентрация соли не влияет на
KГ
21.
Расчет рН гидролиза по катиону и аниону:рН = 7 – ½ lgКД(к-ты) + ½ lgКД(осн)
Если в результате гидролиза труднорастворимые или
газообразные вещества гидролиз необратимым:
Например: PbCO3 + Н2О Pb(ОН)2 + CO2
22.
Степень гидролиза ( ) увеличивается:1) при температуры:
т.к. НГ 0 с температуры КГ = 2 С0
2) с разбавлением раствора (концентрация )
3) при концентрации иона, определяющего среду
Например гидролиз КСN: СN- + НОН НСN + ОНДобавляем в раствор НСl:
НСl Cl- + H+
Н2 О
23.
Пример 5Рассчитать КГ, и рН 0,01 М раствора К2SО3.
Решение
Диссоциация сильного электролита К2SО3:
К2SО3 2К+ + SО32
КОН
Н2SО3
сильное основание слабая кислота
Гидролиз по SО32 :
1-я ступень: SО32 + НОН
K Г1
KW
K Д ( HSO )
3
KW
K Д 2H
2 SO3
НSО3 + ОН
10 14
7
1
,
59
10
6, 3 10 8
24.
2-я ступень: НSО3 + Н2ОK Г2
KW
K Д 1H
2 SO3
Н2SО3 + ОН
10 14
13
5
,
9
10
1, 7 10 2
K Г1 K Г2
K Г / с0 1, 59 10 7 / 10 2 4 10 3 1
расчет по приближенной
формуле правомерен.
СOH- = c0 = 4 10 3 10 2 = 4 10 5
рН = 14 + lg СOH- = 14 – 4,4 = 9,6
25.
МАЛОРАСТВОРИМЫЕ ЭЛЕКТРОЛИТЫВ насыщенных растворах сильных электролитов АnBm равновесие:
АnBm(тв)
n Am+(p-р) + m Bn (p-р) – гетерогенный пр.
т. к. аАnВm(тв) = const , то константа равновесия:
m
K a nAm aB
n ПР
ПРАnBm – произведение растворимости:
произведение активностей ионов, содержащихся в
насыщенном растворе электролита, в степенях, равных
стехиометрическим коэффициентам, есть величина
постоянная при данной температуре
26.
Например для Zn(OH)2 : ПР = аZn2+ ·а2ОН-ПР зависит:
• от природы электролита
• от природы растворителя
• от температуры
ПР не зависит:
• от активностей ионов.
ПР(250С) – табличные величины
27.
Произведение растворимости некоторых мало растворимых веществвещество
ПР
AgOH
t 0C
18
1,24·10-8
Ca(OH)2
18
7,4·10-7
Fe(OH)2
13
4,8·10-16
Fe(OH)3
18
3,8·10-38
Hg(OH)2
18
1,1·10-17
Mg(OH)2
18
6·10-10
Mn(OH)2
18
4·10-14
Zn(OH)2
25
1,3·10-17
FeS
18
3,7·10-19
AgCl
20
1,61·10-10
AgI
25
0,97·10-16
CaSO4
10
6,1·10-5
PbCO3
18
3,3·10-14
BaSO4
25
1,08·10-10
28.
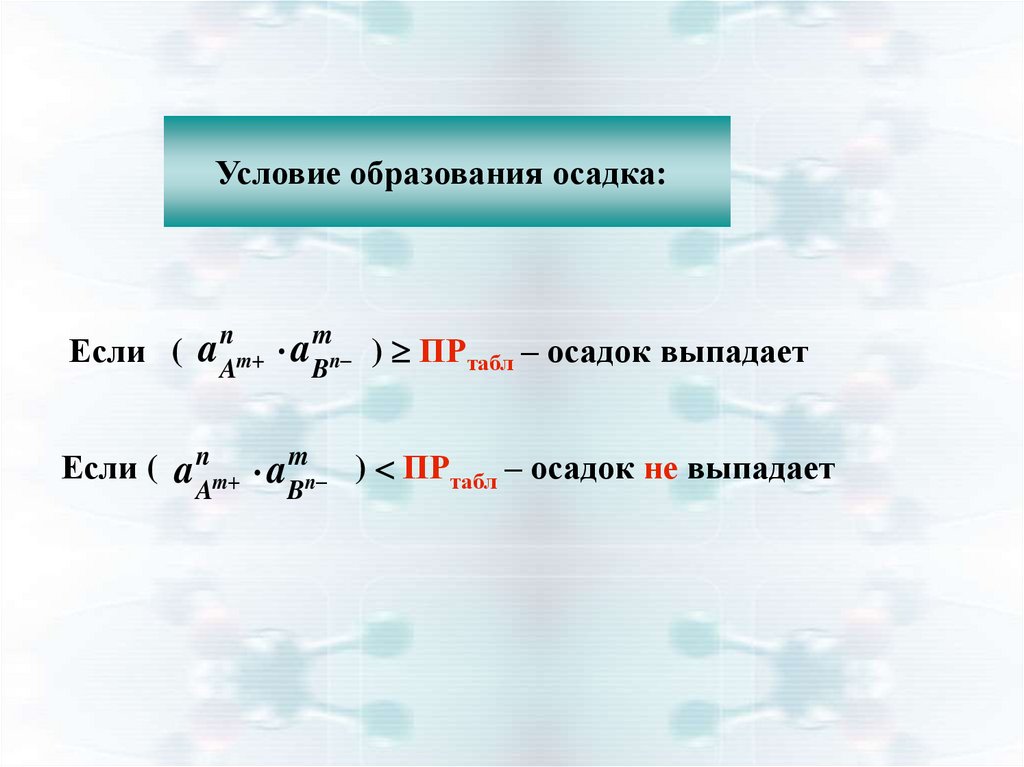
Условие образования осадка:Если ( a Am aBn ) ПРтабл – осадок выпадает
n
m
Если ( a n m a mn ) ПРтабл – осадок не выпадает
A
B
29.
Пример 6:Можно ли приготовить раствор Ag2SO4 с = 0.1 моль/л ?
Решение
Ag2SO4(тв)
2Ag+(р-р) + SO42-(р-р)
с
2с
ПР ( табл ) a 2
Ag
Пусть а = с →
с
a SO 2 7, 7 10 5
4
(2с) 2 с 4с3 7, 7 10 5
с 0, 027 моль / л -мах концентрация вещества
в насыщенном растворе
2,7.10-2 < 10-1 , следовательно, раствор приготовить нельзя
30.
Растворимость (CР):концентрация насыщенного раствора электролита
В насыщенном растворе электролита:
АnBm(тв)
СР
ПР = a Am aBn
n
m
n Am+(нас. p-р) + m Bn (нас. p-р)
nсР
mсР моль/л
= ( А m+ n сР)n ( B n m сР)m =
= ( А m+)n ( B n )m nn mm (сР)n+m
31.
растворимость трудно растворимого сильного электролитаПР
C P n m
( Am )n ( Bn )m nn m m
если 1
сP n m ПР / nn m m
32.
Пример 7Определить растворимость сР MgF2, если (Mg2+) = 0,7, (F–) = 0,96
MgF2
Mg2+ (нас. р-р) + 2F–(нас. р-р)
Из таблицы: ПР(MgF2) = 4 10-9
ПР(MgF2) =
a Mg 2 aF2
аi = γi ·сi
ПР = Mg2+
СP
3
cMg2+ cF–2 F–2
4 10 9
9
2
3
1
,
55
10
0
,
54
10
моль/л
2
2
0, 7 0, 96 2 1
33.
Растворимость СР зависит от:1. ионной силы раствора:
при введения хорошо растворимого электролита
(не имеющего общих ионов с исходным раствором)
увеличивается ионная сила раствора ( I )
С ионной силы раствора (I)
коэффициент активности ( i )
CР (ПР = const при Т)
ПР
C P n m
( Am )n ( Bn )m nn m m
34.
2) от введения одноименного ионаMgF2 (тв)
NaF
Mg2+ (нас. р-р) + 2F-(нас. р-р)
Na+ (р-р) + F-(р-р)
с концентрации СF- равновесие смещается влево СР
На этом явлении основано разделение элементов методом
осаждения: растворимость СаСО3 и МgСО3 уменьшается при
введении в раствор хорошо растворимых К2СО3 или Nа2СО3
ионы жесткости Са2+ и Мg2+ удаляются из раствора.





























 Химия
Химия








