Похожие презентации:
Химические реакции. Закон сохранения массы веществ
1.
Химическиереакции
2.
ЯвленияФизические
Химические
Одни вещества
превращаются в
другие.
Признаки химических реакций:
1. Образование осадка или газа
2. Изменение цвета
3. Выделение или поглощение
теплоты
4. Появление запаха
3.
Реакции, протекающие свыделением теплоты и света,
называют реакциями горения.
Горение серы
Горение магния
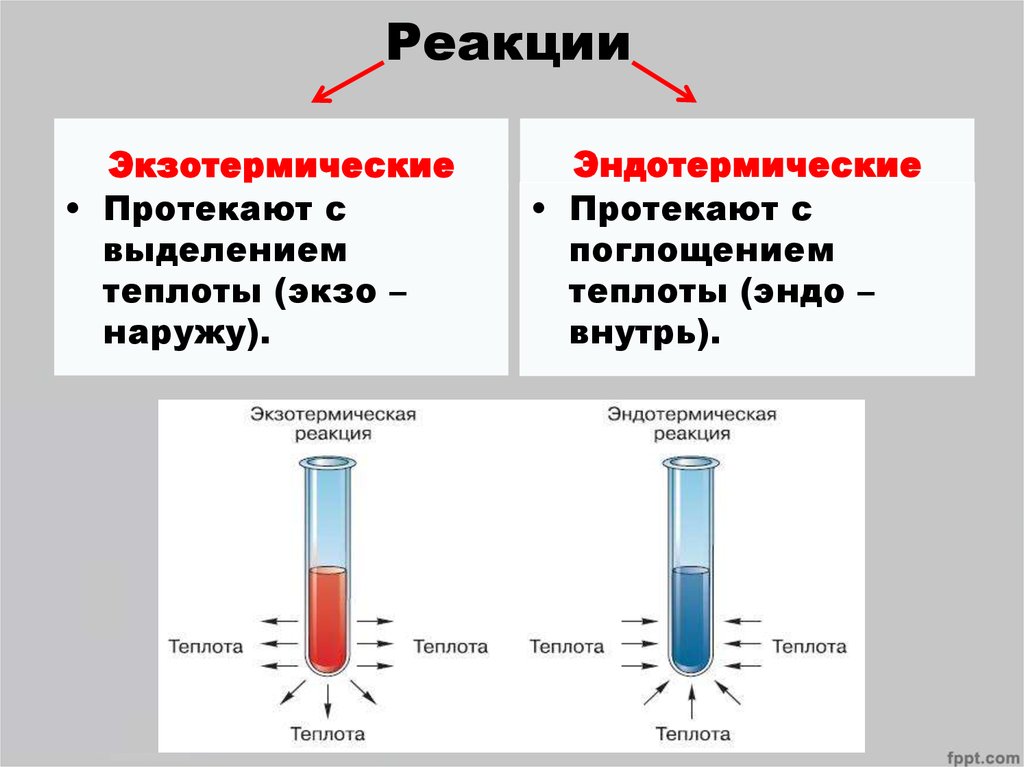
4. Реакции
Экзотермические• Протекают с
выделением
теплоты (экзо –
наружу).
Эндотермические
• Протекают с
поглощением
теплоты (эндо –
внутрь).
5. Эндотермическая реакция
Реакция разложения ртути6. Закон сохранения массы веществ
7.
В печи сожгли уголь массой10кг, а масса образовавшейся
золы составила всего 3кг.
Почему?
8.
В течение тысячелетийлюди верили в то, что
вещество может
бесследно исчезать, а
также возникать из
ничего.
Это чисто житейское
утверждение подтвердил и
такой известный ученый,
как Роберт Бойль.
9. Бойль проделал множество опытов по прокаливанию металлов в незапаянных ретортах и всякий раз масса оказывалась больше массы
прокаливаемого металла.10. Подобно Бойлю русский ученый М.В.Ломоносов делал опыты в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды
как до, так и после прокаливания, невскрывая.
11.
12.
13. Химические уравнения.
Химические уравнения.Химическое уравнение – это условная
запись химической реакции
посредством химических формул и
коэффициентов.
14.
Исходные вещества, принимающиеучастие в химических реакциях
называются реагентами.
Новые вещества,
образующиеся в результате
химической реакции
называются продуктами.
15. Алгоритм составления уравнения химической реакции.
4P+ 5O2 = 2 P2O5
Помните! Молекулы большинства простых
газообразных веществ двухатомны –
H2; N2; O2; F2; Cl2; Br2; I2.
16. Расставьте коэффициенты в следующих уравнениях:
Расставьте коэффициенты в следующих уравнениях:1) СuCl2 + Al = AlCl3 + Cu
2) Н2 + N2 = NH3
3) CuOH = Cu2O + H2O
4) CS2 +O2 = CO2 + SO2
5) C2H2 + O2 = CO2 + H2O
6) Fe2 (SO4)3 + KOH = Fe(OH)3 + K2SO4
17.
• Уравнять следующие реакции:1)
2)
3)
4)
5)
6)
Cl2O7 = Cl2 + O2
KClO3 = KCl + O2
C3H8 + O2 = CO2 + H2O
CO + O2 = CO2
AlCl3 + KOH = Al(OH)3 + KCl
H2SO4 + KOH = K2SO4 + H2O
18.
Домашнее задание:Выучить § 27, 28.
Стр. 166 вопр. 1, 2, 3

















 Химия
Химия








