Похожие презентации:
Соли и классы химических веществ
1.
ХИМИЯ8 класс
Соли и классы химических
веществ
Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
1
2.
Классы неорганических веществСложные
неорганические
вещества
Оксиды
Основания
Кислоты
Соли
Соли - это сложные вещества, образованные атомами металлов и кислотными
остатками.
3.
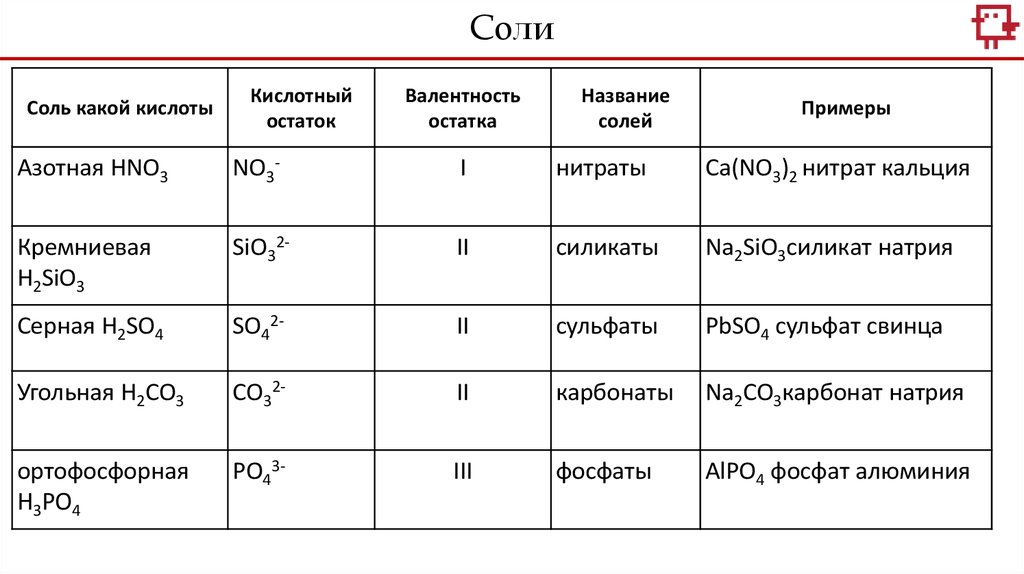
СолиСоль какой кислоты
Кислотный
остаток
Валентность
остатка
Название
солей
Примеры
Азотная HNO3
NO3-
I
нитраты
Ca(NO3)2 нитрат кальция
Кремниевая
H2SiO3
SiO32-
II
силикаты
Na2SiO3силикат натрия
Серная H2SO4
SO42-
II
сульфаты
PbSO4 сульфат свинца
Угольная H2CO3
CO32-
II
карбонаты
Na2CO3карбонат натрия
ортофосфорная
H3PO4
PO43-
III
фосфаты
AlPO4 фосфат алюминия
4.
СолиИсключение соли аммония, в которых с кислотными остатками связаны не
атомы металла, а частицы NH4+
Соли аммония - это сложные вещества, в состав которых входят ионы
аммония NH4+, соединённые с кислотными остатками.
Например,
NH4Cl – хлорид аммония
(NH4)2SO4 - сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
5.
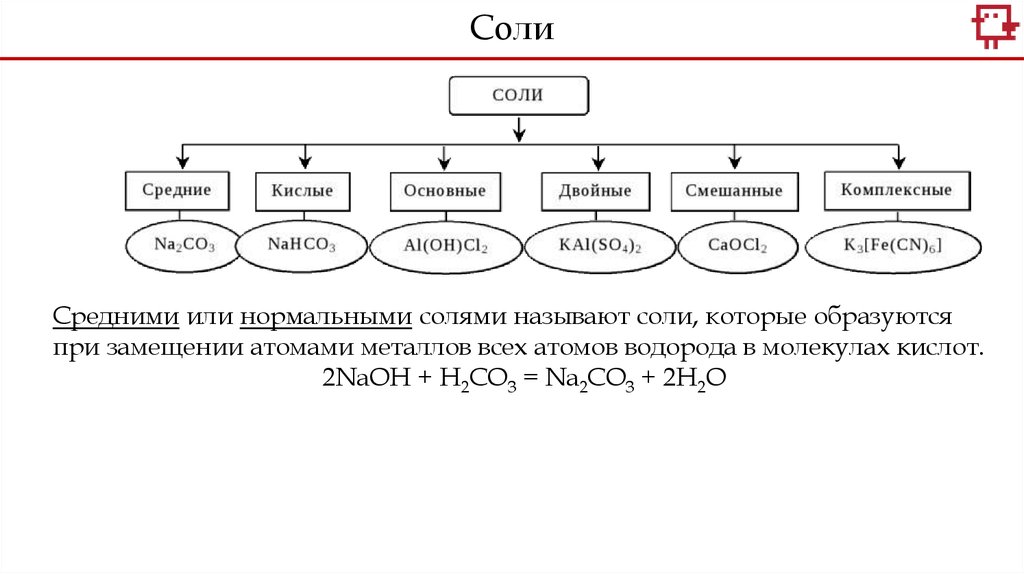
СолиСредними или нормальными солями называют соли, которые образуются
при замещении атомами металлов всех атомов водорода в молекулах кислот.
2NaOH + H2CO3 = Na2CO3 + 2H2O
6.
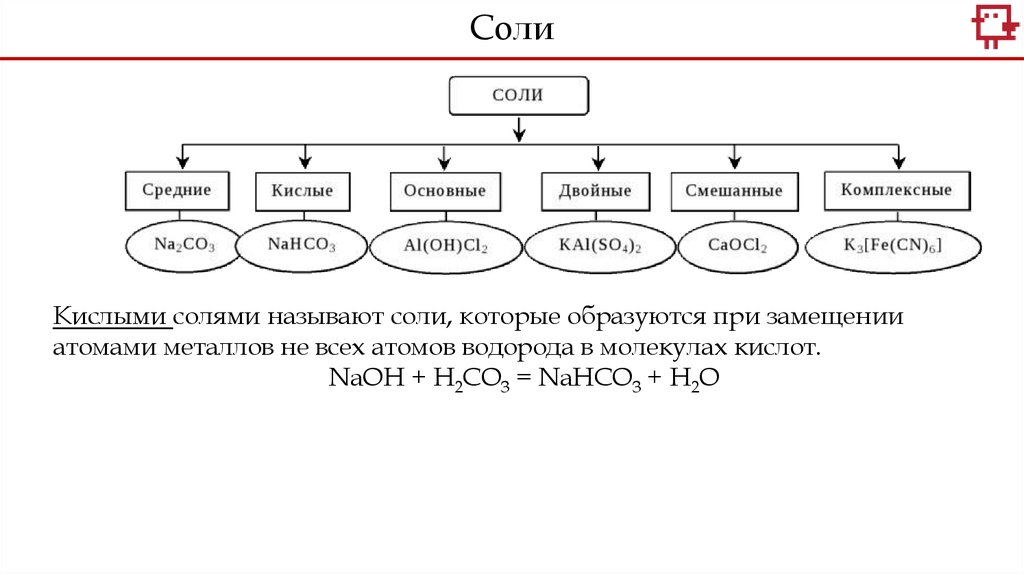
СолиКислыми солями называют соли, которые образуются при замещении
атомами металлов не всех атомов водорода в молекулах кислот.
NaOH + H2CO3 = NaНCO3 + H2O
7.
СолиОсновными солями называют соли, которые это продукты неполного
замещения гидроксидных групп в молекулах многокислотных оснований
кислотными остатками
Al(OH)3 + HCl = Al(OH)Cl2+ H2O
8.
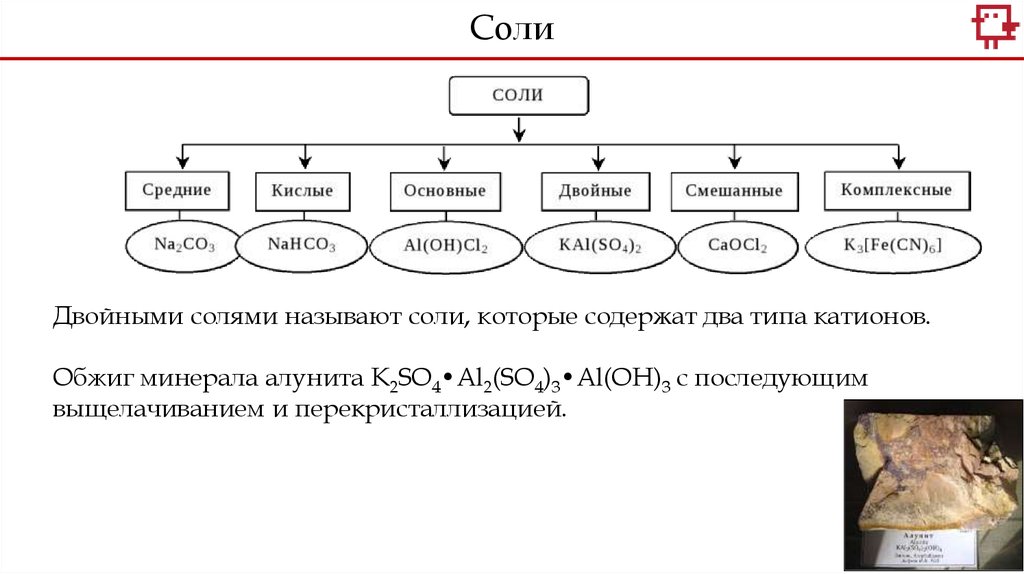
СолиДвойными солями называют соли, которые содержат два типа катионов.
Обжиг минерала алунита K2SO4•Al2(SO4)3•Al(OH)3 с последующим
выщелачиванием и перекристаллизацией.
9.
СолиОбжиг минерала алунита K2SO4•Al2(SO4)3•Al(OH)3
выщелачиванием и перекристаллизацией.
Совместная кристаллизация сульфатов алюминия и калия.
с
последующим
10.
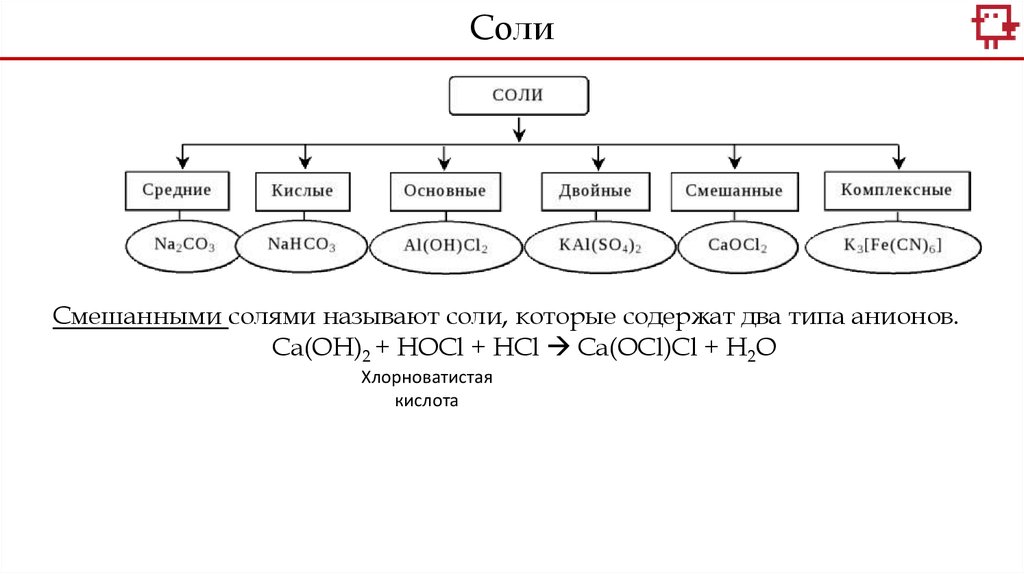
СолиСмешанными солями называют соли, которые содержат два типа анионов.
Ca(OH)2 + HOCl + HCl Ca(OCl)Cl + H2O
Хлорноватистая
кислота
11.
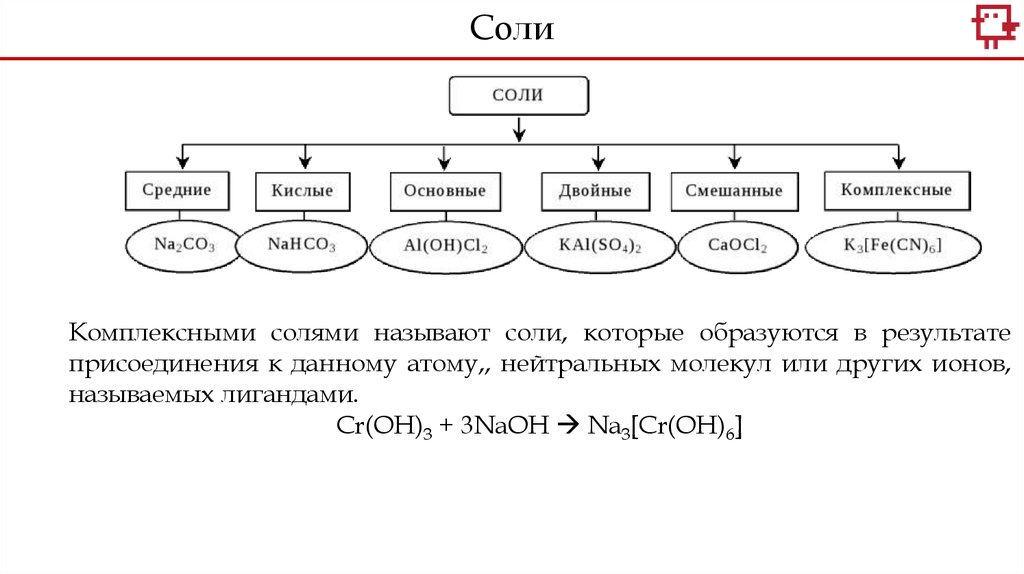
СолиКомплексными солями называют соли, которые образуются в результате
присоединения к данному атому,, нейтральных молекул или других ионов,
называемых лигандами.
Cr(OH)3 + 3NaOH Na3[Cr(OH)6]
12.
Химические свойства1. Действие кислот на металлы,
основания:
Fe + H2SO4(разб.) =
H2SO4
H2SO4
основные
оксиды
FeSO4
H2
+
и
+ CuO = CuSO4 + H2O
+
2 KOH
=
K2SO4
+ 2 H2O
2. Реакция кислотных оксидов со щелочами или основными
оксидами:
Ca(OH)2
CaO
+ CO2 = CaCO3↓ + H2O
+ SO3 =
CaSO4
13.
Химические свойства3. Взаимодействие солей с кислотами, щелочами, металлами,
нелетучими кислотными оксидами и другими солями:
Ca3(PO4)2 +3H2SO4 = 3CaSO4 +2H3PO4
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
CuSO4 + Fe = FeSO4 + Cu
CaCO3 + SiO2 = CaSiO3 + CO2
Al2(SO4)3 + 3BaCl2 = 3BaSO4 +2AlCl3
4. Взаимодействие металлов с неметаллами:
2K
+
Cl2
=
2 KCl
14.
Химические свойства15.
Химические свойства1.
2.
3.
4.
C какими из перечисленных ниже металлов будет взаимодействовать соляная кислота: 1)
алюминий; 2) серебро; 3) ртуть; 4) олово?
Составьте уравнения реакций между серной кислотой и следующими веществами: а) магнием;
б) оксидом магния; в) оксидом алюминия; г) оксидом калий; д) цинком.
Дайте названия следующим соединениям (солям): а) KCl; б) CaCO3; в) K3PO4; г) H2CO3; д) FeSO4;
е) Fe2(SO4)3; ж) Cu(NO3)2.
Напишите уравнения реакций, с помощью которых можно осуществить следующие
превращения:









 Химия
Химия








