Похожие презентации:
Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД)
1. Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД).
2.
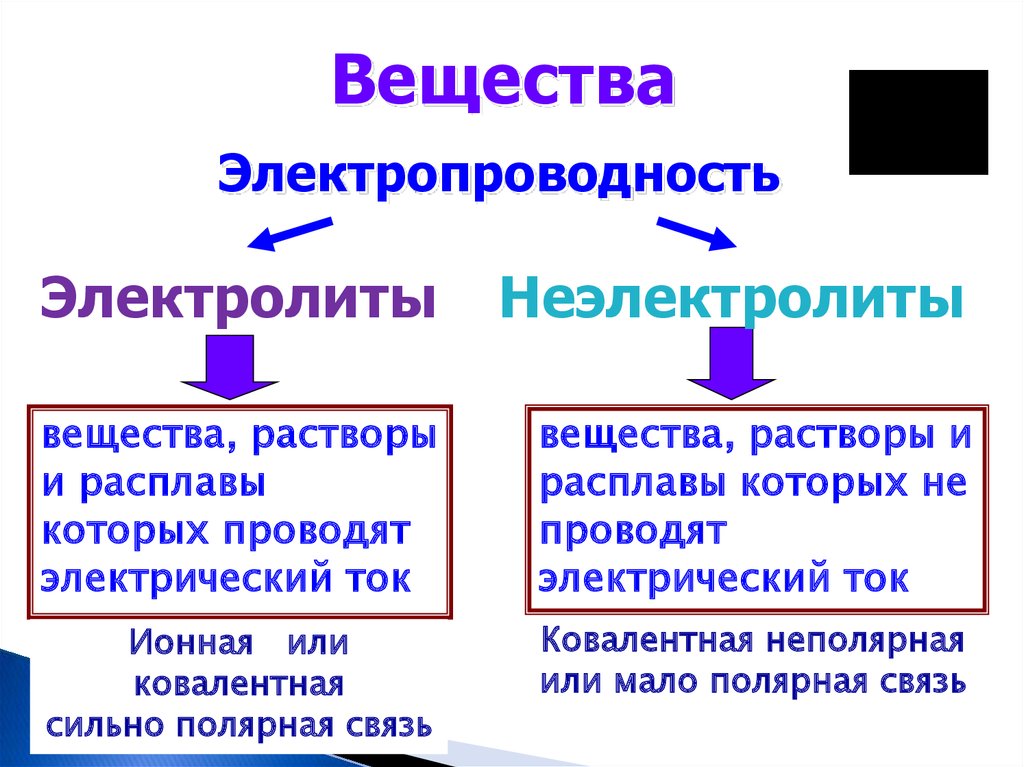
ВеществаЭлектропроводность
Электролиты
Неэлектролиты
вещества, растворы
и расплавы
которых проводят
электрический ток
вещества, растворы и
расплавы которых не
проводят
электрический ток
Ионная или
ковалентная
сильно полярная связь
Ковалентная неполярная
или мало полярная связь
3. Основные положения ТЭД:
1) При растворении в воде эл-тыдиссоциируют (распадаются) на ⊕ и ⊖
ионы. Процесс распада эл-та на ионы
называют электролитической
диссоциацией (ЭД).
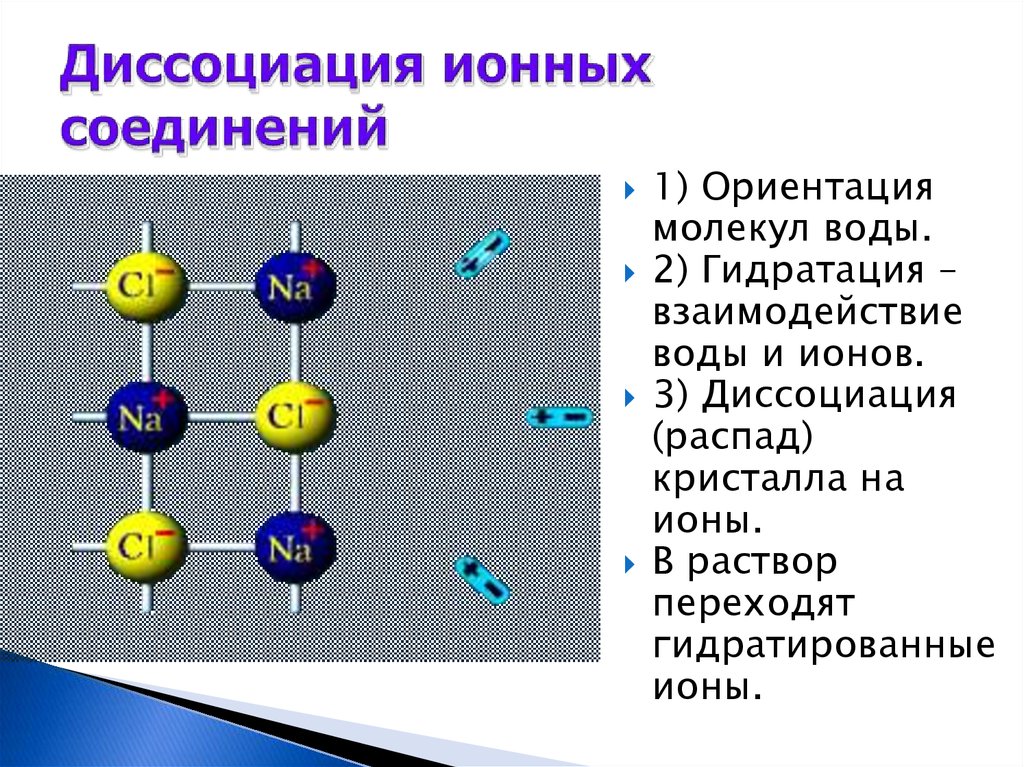
4. Диссоциация ионных соединений
1) Ориентациямолекул воды.
2) Гидратация –
взаимодействие
воды и ионов.
3) Диссоциация
(распад)
кристалла на
ионы.
В раствор
переходят
гидратированные
ионы.
5. Диссоциация соединений с ковалентной полярной связью:
1)Ориентация
молекул воды вокруг
полюсов эл-та.
2) Гидратация –
взаимодействие воды
молекулы эл-та.
3) Ионизация
молекулы эл-та.
4) Диссоциация
(распад) молекулы элта на ионы.
В раствор переходят
гидратированные
ионы.
6.
2. Причиной дис-ции эл-та в водном р-реявляется его гидратация, т. е.
взаимодействие эл-та с молекулами воды
и разрыв химической связи в нем. ⇒ по
наличию водной оболочки ионы делят на
гидратированные и негидратированные.
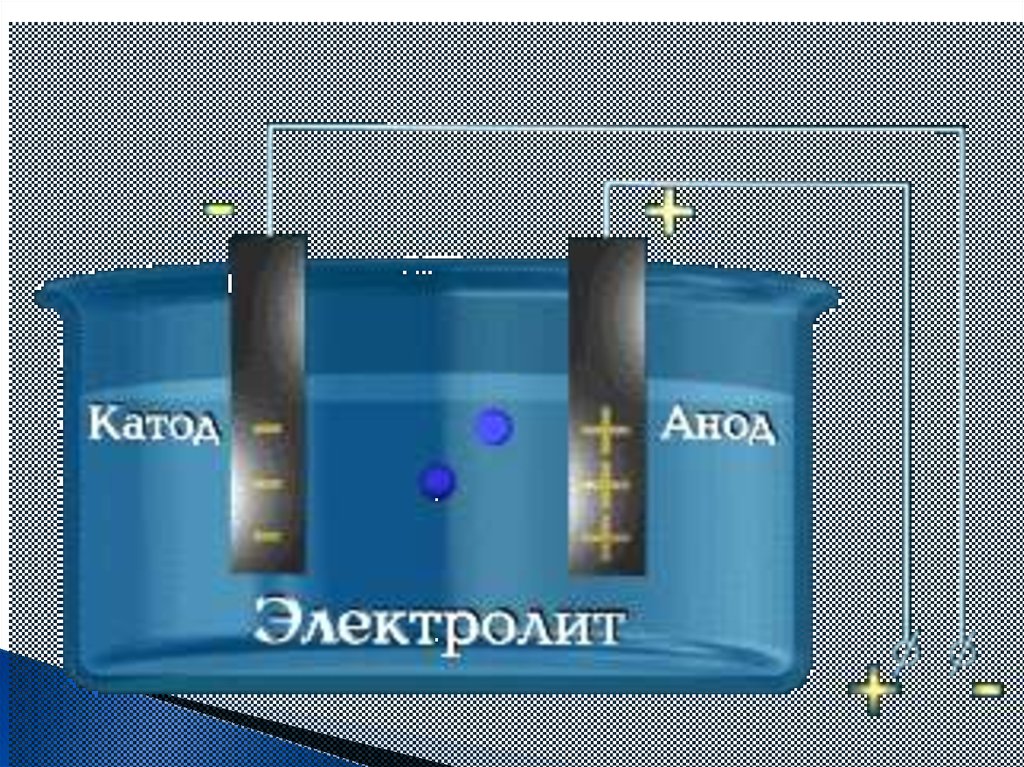
3. Под действием электрического тока ⊕
заряженные ионы движутся к ⊖
заряженному полюсу – катоду, поэтому
называют катионами, ⊖ заряженные ионы
движутся к ⊕ заряженному полюсу – аноду,
поэтому называются анионами.
7.
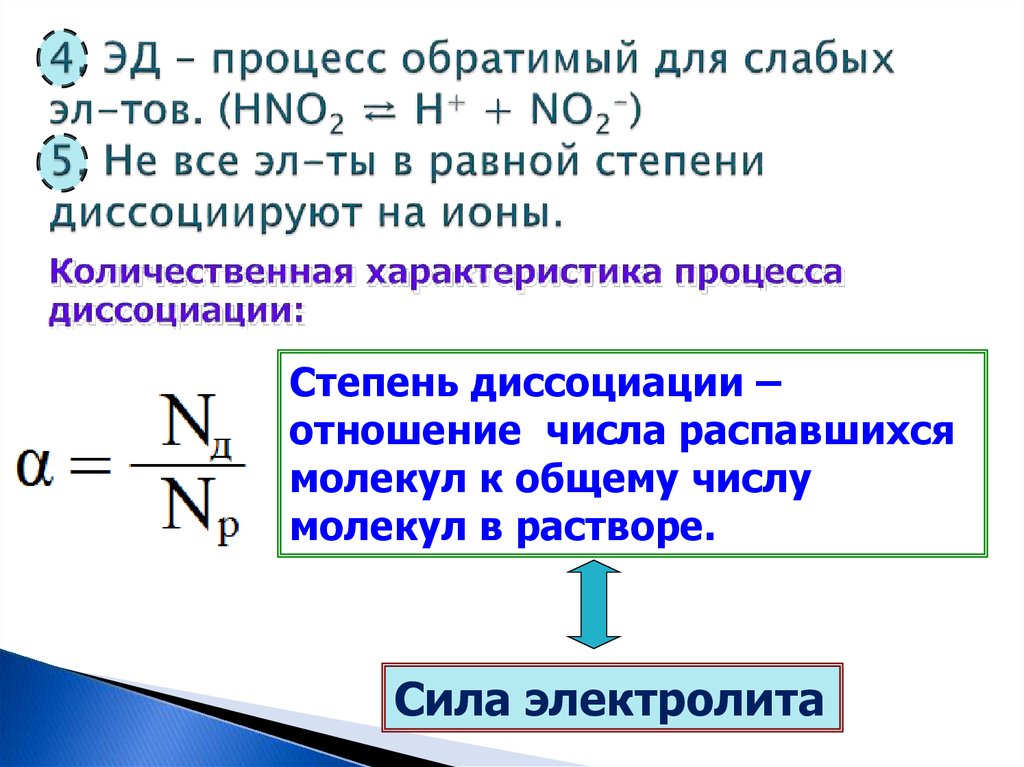
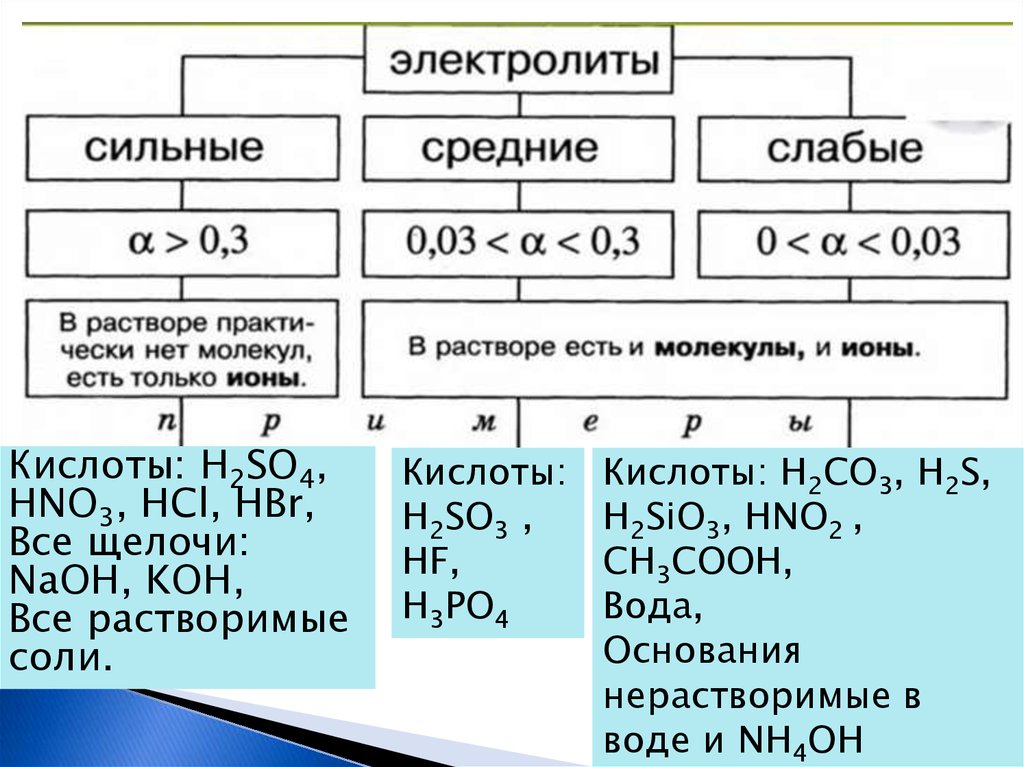
8. 4. ЭД – процесс обратимый для слабых эл-тов. (HNO2 ⇄ H+ + NO2-) 5. Не все эл-ты в равной степени диссоциируют на ионы.
Степень диссоциации –отношение числа распавшихся
молекул к общему числу
молекул в растворе.
Сила электролита
9.
Кислоты: H2SO4,HNO3, HCl, HBr,
Все щелочи:
NaOH, KOH,
Все растворимые
соли.
Кислоты:
H2SO3 ,
HF,
H3PO4
Кислоты: H2CO3, H2S,
H2SiO3, HNO2 ,
CH3COOH,
Вода,
Основания
нерастворимые в
воде и NH4OH
10. 6. Химические св-ва р-ров эл-тов определяются св-ами тех ионов, которые образуются при дис-ции:
∗ Кислотами называют эл-ты, которые придис-ции образуют катионы водорода и
анионы кислотного остатка:
HCl → H+ + Cl Многоосновные кислоты диссоциируют
ступенчато:
I H3PO4 ⇄ H+ + H2PO4 II H2PO4- ⇄ H+ + HPO42 По второй ступени дис-ция происходит
слабее, по третьей при обычных условиях
не происходит.
11. ∗ Основаниями называют эл-ты, которые при дис-ции образуют катионы металла и гидроксид-анионы:
NaOH → Na+ + OHCa(OH)2 → Ca+ + 2OH∗ Солями называют эл-ты, которые придис-ции образуют катионы металла (или
аммония NH4+) и анионы кислотного
остатка. В отличие от кислот средние
соли диссоциируют полностью и не
ступенчато:
(NH4)3PO4 → 3(NH4)+ + PO43NaCl → Na+ + Cl-







 Химия
Химия








