Похожие презентации:
Основные положения теории электролитической диссоциации
1. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
8 КЛАСС2. Цели урока
• Обобщить сведения об ионах• Закрепить умение записывать
процесс диссоциации при помощи
химических знаков и формул
• Сформулировать основные
положения теории
электролитической диссоциации
3. ПРОВЕРЬ СВОИ ЗНАНИЯ
• Вещества, растворы которых проводятэлектрический ток, называют ………
• Процесс распада электролита на ионы
называют ……..
• Вещества, растворы которых не проводят
электрический ток, называют ……….
• Отношение числа частиц, распавшихся на
ионы, к общему числу растворенных
частиц называют …………
4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему)
ЭЛЕКТРОЛИТЫ(по степени электролитической диссоциации )
5. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
ЭЛЕКТРОЛИТЫНЕЭЛЕКТРОЛИТЫ
?
?
?
?
?
?
?
6. Расскажите о последовательности процессов, происходящих при диссоциации:
Веществ с ионной
связью
1)
2)
3)
Ориентация
Гидратация
Диссоциация
Веществ с
ковалентной
полярной связью
1)
2)
3)
4)
Ориентация
Гидратация
Ионизация
Диссоциация
7. История открытия теории электролитической диссоциации
В 1887 годушведский химик
Сванте Аррениус
сформулировал
основные
положения теории
электролитической
диссоциации
8. Основные положения ТЭД
1. При растворении в водеэлектролиты диссоциируют
(распадаются) на положительные и
отрицательные ионы.
NaCl = Na+ + ClИоны – это одна из форм
существования химического элемента
9.
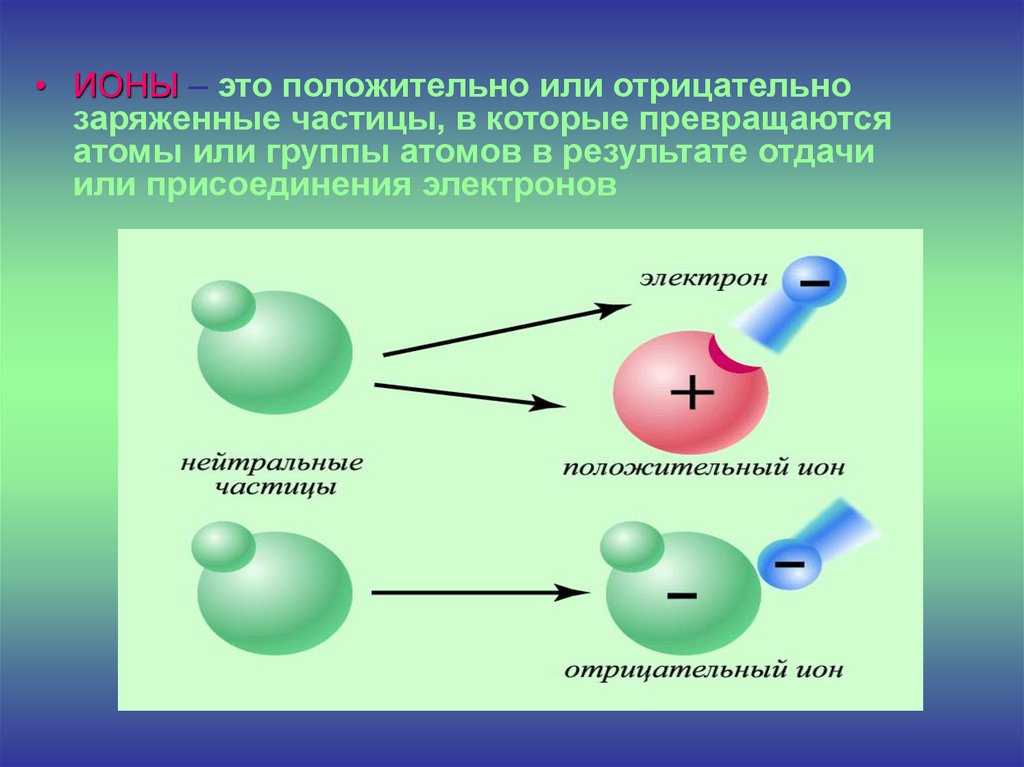
• ИОНЫ – это положительно или отрицательнозаряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи
или присоединения электронов
10. ЭЛЕКТРОННЫЕ ФОРМУЛЫ
0 2ē 8ē 1ēNa
+11
атом
0 2ē 8ē 7ē
Cl
+17
атом
+ 2ē 8ē
Na
+11
ион
0 2ē 8ē 8ē
Cl
+17
ион
11. ИОНЫ (по составу)
• ПРОСТЫЕНапример:
• Cl• K+
• СЛОЖНЫЕ
Например:
• NO3• SO42-
12. Основные положения ТЭД
2. Причиной диссоциации электролитав водном растворе является его
гидратация, т.е. взаимодействие
электролита с молекулами воды и
разрыв химической связи в нем.
13. ИОНЫ (по наличию водной оболочки)
• ГИДРАТИРОВАННЫЕ• НЕГИДРАТИРОВАННЫЕ
Например:
В растворах и
кристаллогидратах
CuSO4 * 5H2O
Na2SO4* 10H2O
Например:
В безводных солях
Cu2+SO42Na+NO3-
14. Основные положения ТЭД
3. Под действием электрического токаположительно заряженные ионы
движутся к отрицательному полюсу
источника тока – катоду, поэтому их
называют катионами, а отрицательно
заряженные ионы движутся к
положительному полюсу источника
тока – аноду, поэтому их называют
анионами.
15. ИОНЫ (по знаку заряда)
• КАТИОНЫположительно
заряженные
частицы
• АНИОН
отрицательно
заряженные
частицы
16. Основные положения ТЭД
4. Электролитическая диссоциация –процесс обратимый для слабых
электролитов.
Наряду с процессом диссоциации
протекает и обратный процесс –
ассоциация (соединение ионов)
HNO2
H+ + NO2-
17. Основные положения ТЭД
5. Не все электролиты в одинаковоймере диссоциируют на ионы.
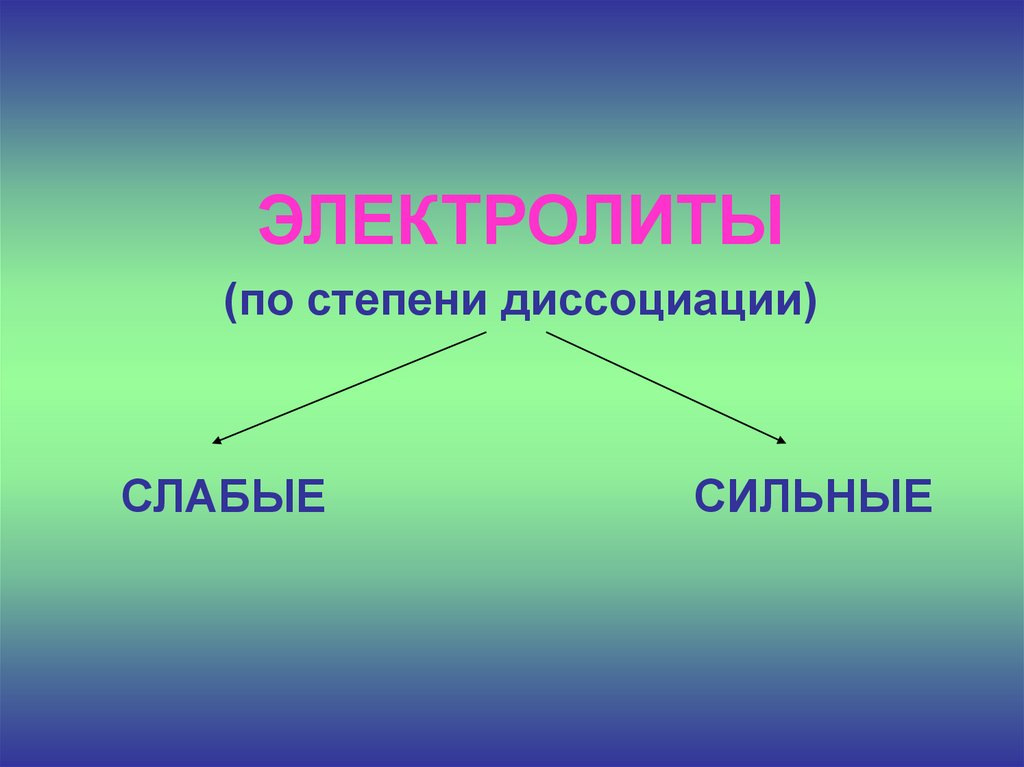
18.
ЭЛЕКТРОЛИТЫ(по степени диссоциации)
СЛАБЫЕ
СИЛЬНЫЕ
19. Основные положения ТЭД
6. Химические свойства растворовэлектролитов определяются
свойствами тех ионов, которые они
образуют при диссоциации.
20. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)
КИСЛОТЫОСНОВАНИЯ
СОЛИ
21. ЗАДАНИЕ
Составьте возможные уравненияэлектролитической диссоциации
веществ в водных растворах.
1) HCl
2) HNO3 3) Н2SiO3
22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ
Кислоты – это электролиты, которыедиссоциируют на катионы
и анионы
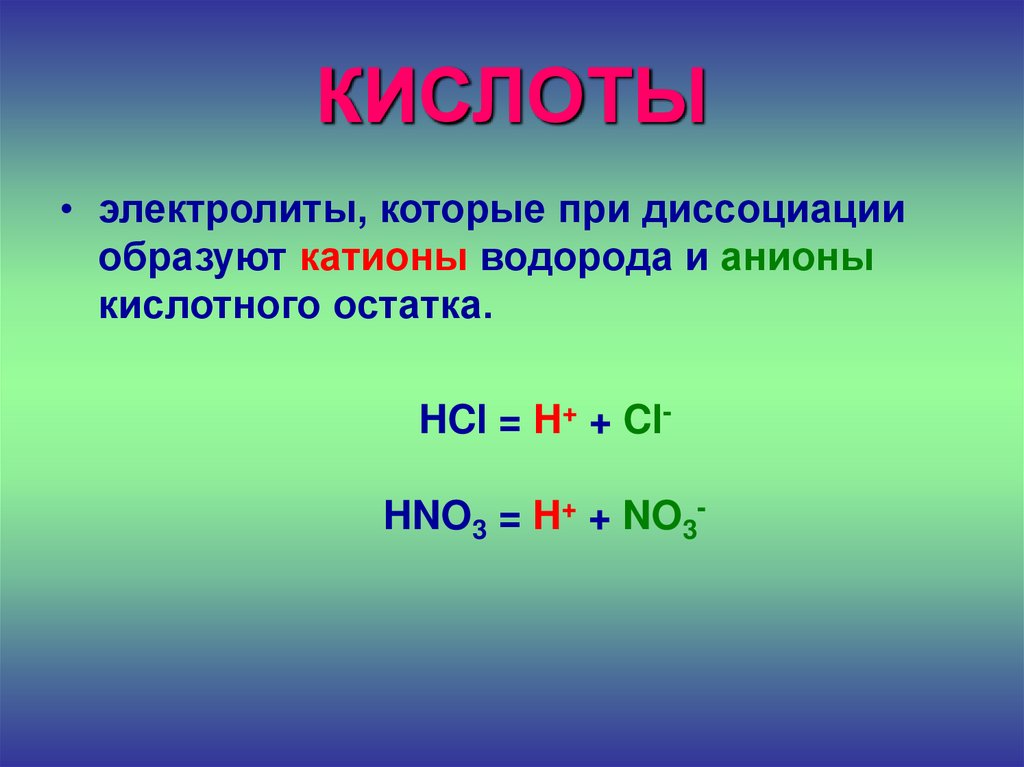
23. КИСЛОТЫ
• электролиты, которые при диссоциацииобразуют катионы водорода и анионы
кислотного остатка.
HCl = H+ + ClHNO3 = H+ + NO3-
24. Многоосновные кислоты диссоциируют ступенчато
H3PO4 (фосфорная кислота)1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+ + H2PO42) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO423) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
25. ЗАДАНИЕ
Составьте возможные уравненияэлектролитической диссоциации
веществ в водных растворах.
1) NaOH 2) KOH 3) Fe(OH)2
26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ
Основания – это электролиты,которые диссоциируют
на катионы
и анионы
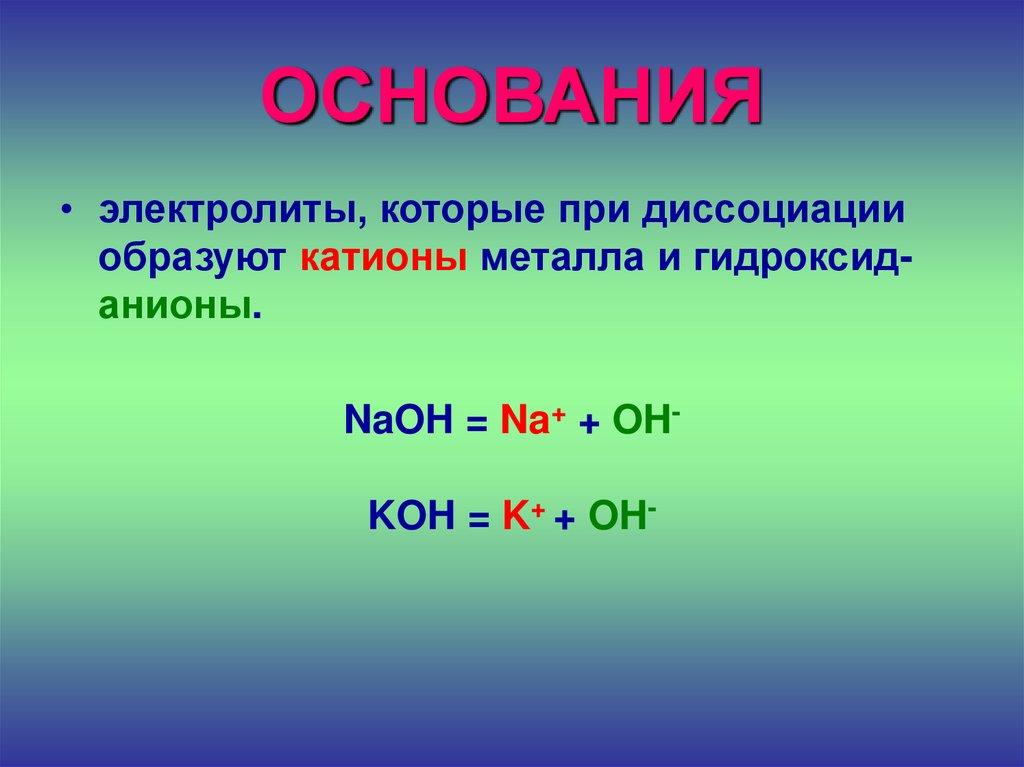
27. ОСНОВАНИЯ
• электролиты, которые при диссоциацииобразуют катионы металла и гидроксиданионы.
NaOH = Na+ + OHKOH = K+ + OH-
28. Многокислотные основания диссоциируют ступенчато
Ba(OH)2 (гидроксид бария)1) Образование гидроксо-ионов бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
29. ЗАДАНИЕ
Составьте возможные уравненияэлектролитической диссоциации
веществ в водных растворах.
1) NaCl 2) KNO3 3) BaSO4
30. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ
Cоли – это электролиты, которыедиссоциируют на катионы
и анионы
31. СОЛИ
электролиты, которые придиссоциации образуют катионы
металла (или аммония NH4) и анионы
кислотных остатков.
K3PO4 = 3K+ + PO43NH4Cl = NH4+ + Cl-
32. ПРОВЕРЬ СВОИ ЗНАНИЯ
• Пользуясь таблицей растворимости,приведите примеры трех веществ,
которые в растворах образуют
сульфат-ионы. Запишите уравнения
электролитической диссоциации
этих веществ.
1) H2SO4 ↔ H+ + HSO42) HSO4- ↔ H+ + SO42-
33. ДОМАШНЕЕ ЗАДАНИЕ
• § 37, положения ТЭД записать втетрадь, выучить наизусть
• Определения кислот, оснований,
солей выучить наизусть
• Задание №5, страница 203
(письменно)




























 Химия
Химия








