Похожие презентации:
Две основные теории специфичности ферментов
1. Различают две основные теории специфичности ферментов:
• «жесткого соответствия»• «индуцированного соответствия»
2. 1-ая теория предложена Э. Фишером
предусматривает наличиеабсолютного совпадения А и S
(«ключ-замок»): S является как
бы «ключом», соответствующим
«замку» – А
3. «Ключ к замку»
4.
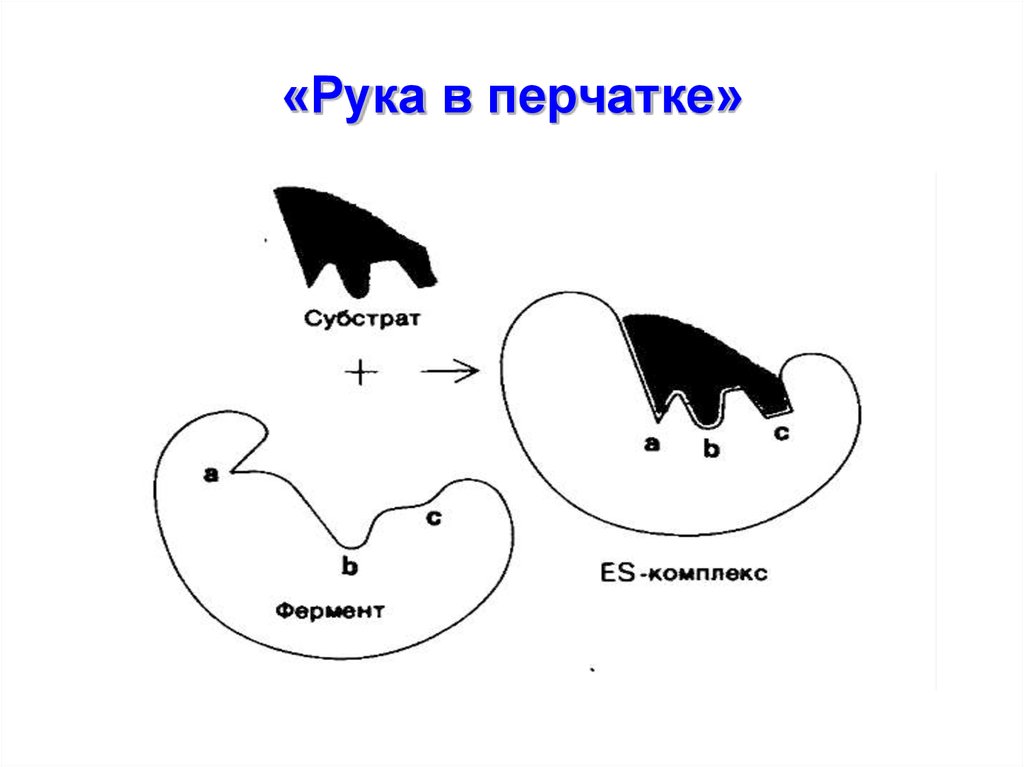
5. 2-ую теорию предложил Кошленд
• По данной теории молекулафермента является гибкой,
конформация фермента и
активного центра могут
изменяться при присоединении
субстрата, т.е. взаимодействие
происходит как бы «перчатка на
руке»
6. «Рука в перчатке»
7.
Модуль «Ферменты»Лекция 2
Механизм действия
ферментов.
Кинетика ферментативных
реакций .
8.
Рассмотрим механизм действияферментов:
• с точки зрения изменения
энергетики химических реакций
• с точки зрения событий в
активном центре
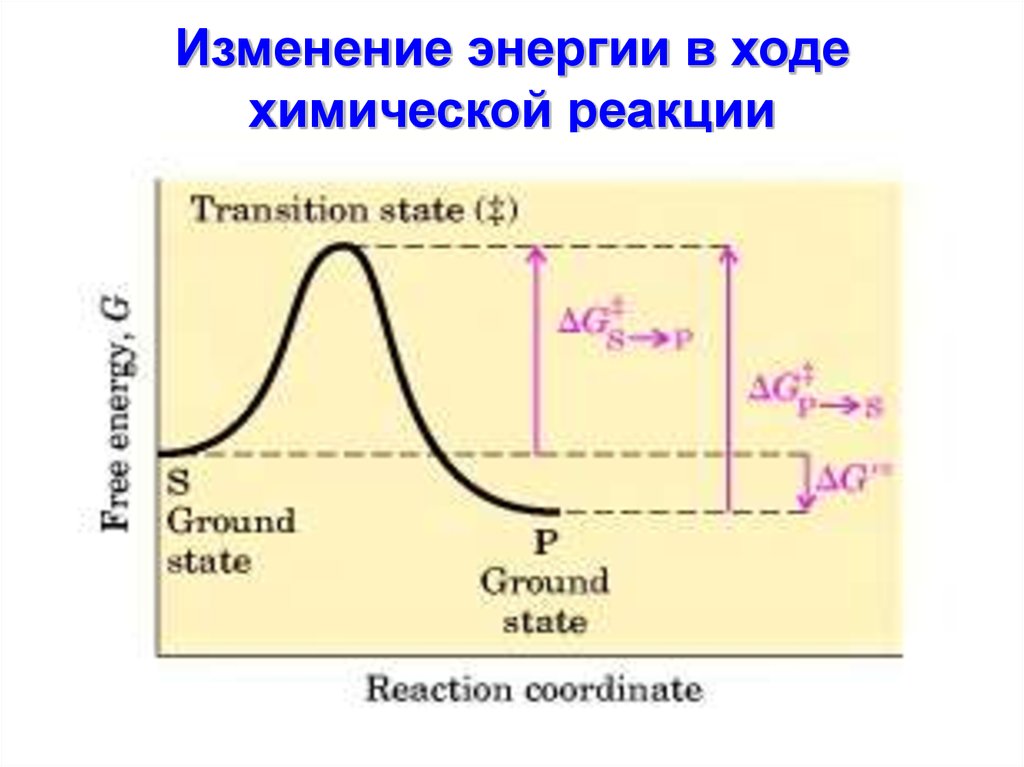
9. Изменение энергии в ходе химической реакции
10.
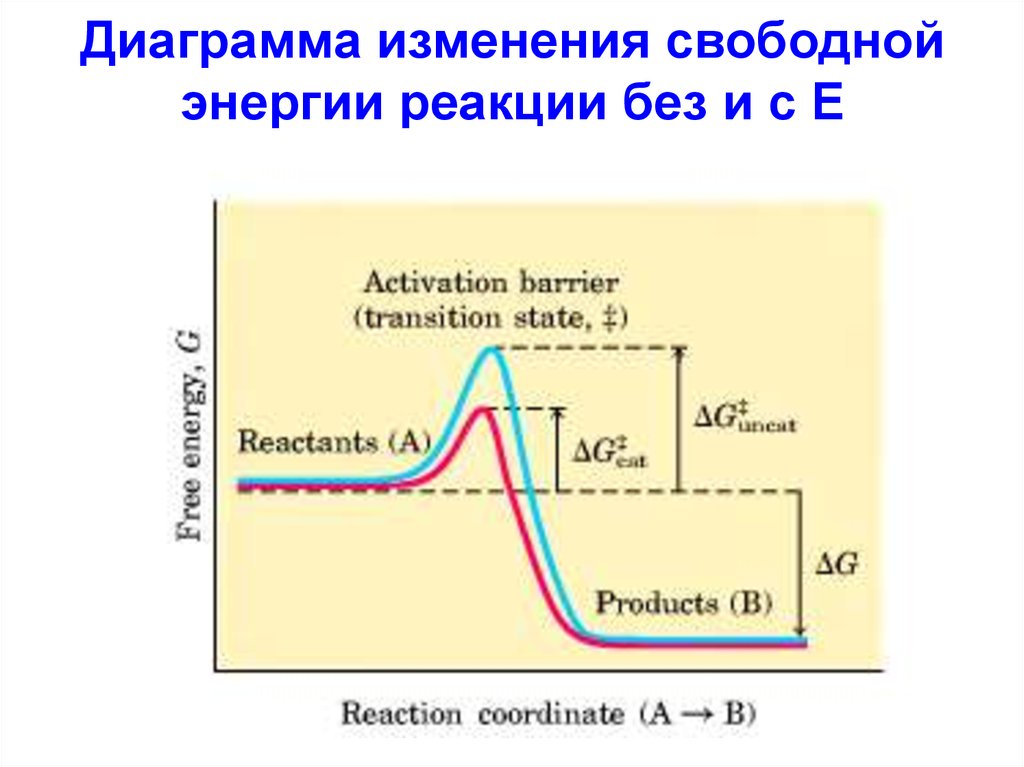
• Ферменты, как истинныекатализаторы значительно
повышают V определенных
химических реакций, которые в
их отсутствии протекают очень
медленно.
11. Диаграмма изменения свободной энергии реакции без и с Е
12.
13.
V реакции зависит отэнергетического барьера,
который реагирующим
веществам нужно преодолеть.
E + S = ES → E + P
E – фермент, S – субстрат,
P – продукт реакции.
14.
При образовании [E-S] комплексапроисходит перераспределение
электронной плотности в S и
ослабление разрываемой связи
→
под действием фермента (Е)
энергетический барьер (Ea)
снижается и → реакция
протекает очень быстро.
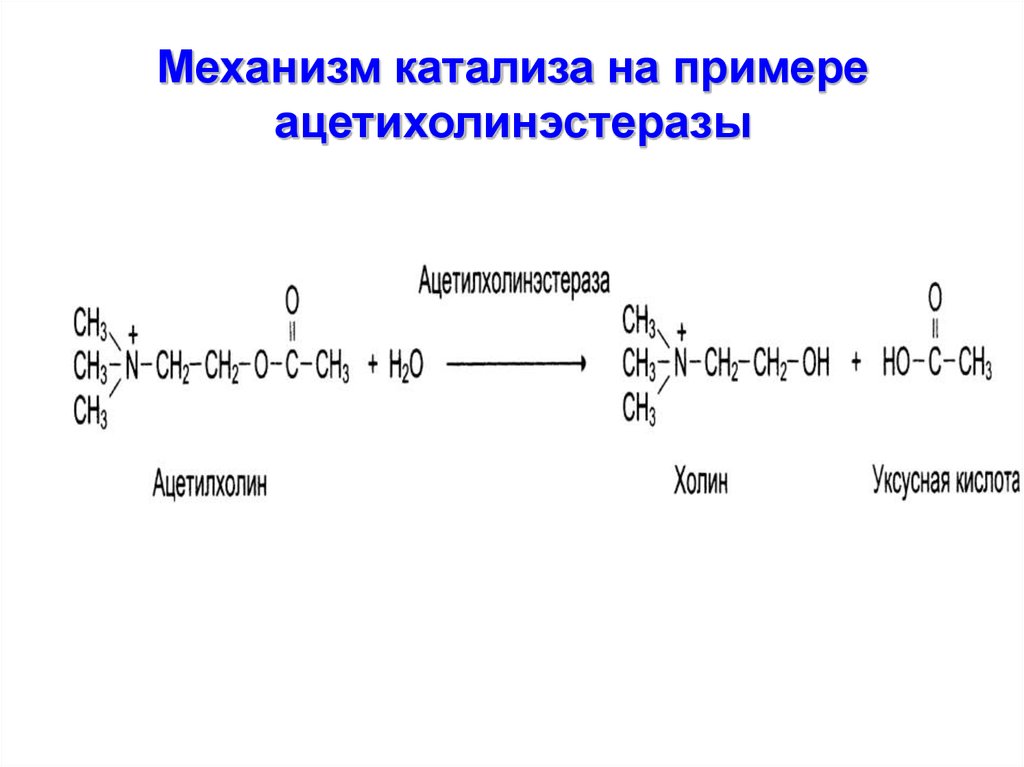
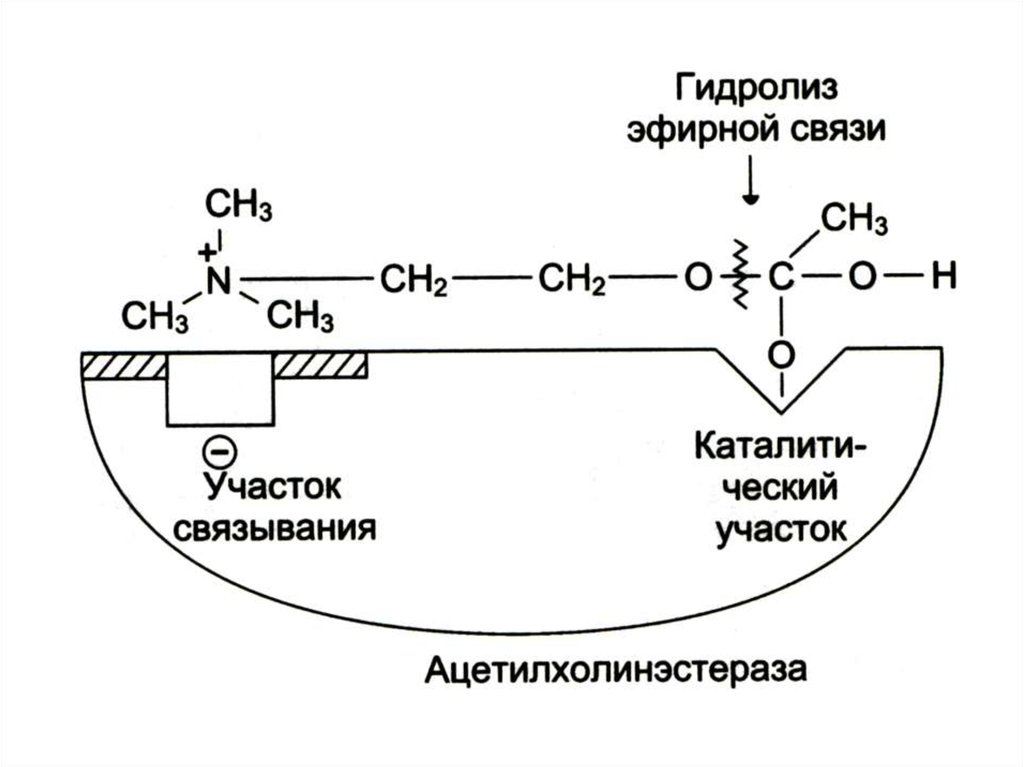
15. Механизм катализа на примере ацетихолинэстеразы
16.
17.
Для выражения активностиферментов используют:
международную единицу,
катал, удельную активность,
молярную активность
18. Единицы ферментативной активности
Международная единица – этотакое количество Е, которое
катализирует 1 мкмоль S или
образование 1 мкмоль P за 1 мин
при оптимальных условиях (t,
pH, [S]), обозначается буквой Е
1Е = 1 мкМ/мин
19. В системе СИ выражение активности фермента в каталах
1 катал (кат) – это такаякаталитическая активность
фермента, при которой 1 моль S
превращается в P за 1 сек
1 кат = 1 М/сек
20.
• 1 кат = 1 М/сек = 60 М /мин =60∙106 мкМ/мин = 6∙107 Е
• 1 Е = 1 мкМ/мин = 1/60 мкМ/сек
= 1/60 мккат (·103) ≈ 16,67 нкат
21.
Удельная активность –ферментативная активность
на единицу массы белка:
Е/мг или
кат/кг
22.
Молярная активность(число оборотов фермента) –
количество молекул S, которое
превращается в P одной
молекулой фермента за 1 сек
(при полном насыщении
фермента субстратом)
23. Ферментативная кинетика
Основы кинетикиферментативных
реакций были
заложены в
работах
Л.Михаэлиса
и М. Ментен
24. Ферментативная кинетика
k1k3
E + S ↔ ES → E +P
k2
По закону действующих масс:
V1 = k1 [E]·[S]
V2 = k2 [ES]
V3 = k3 [ES]
25.
В момент наступленияравновесия:
V1 = V2 + V3
k1·[E]·[S] = k2·[ES] + k3·[ES]
k1·[E]·[S] = (k2 + k3)·[ES]
[E]·[S]/[ES] = (k2 + k3)/[k1] = Кm
Кm - константа Михаэлиса
26.
Кm – основная характеристикаферментативной реакции,
характеризует сродство E к S.
Чем > Кm, тем < сродство E к S
Кm измеряется в молях (10-5-10-6 М)
27.
Бриггс и Холдейн вывелиматематическое выражение
зависимости V реакции от [S]:
V = Vmax · [S] / (Кm+ [S])
Это уравнение Михаэлиса-Ментен
(Бриггса-Холдейна)
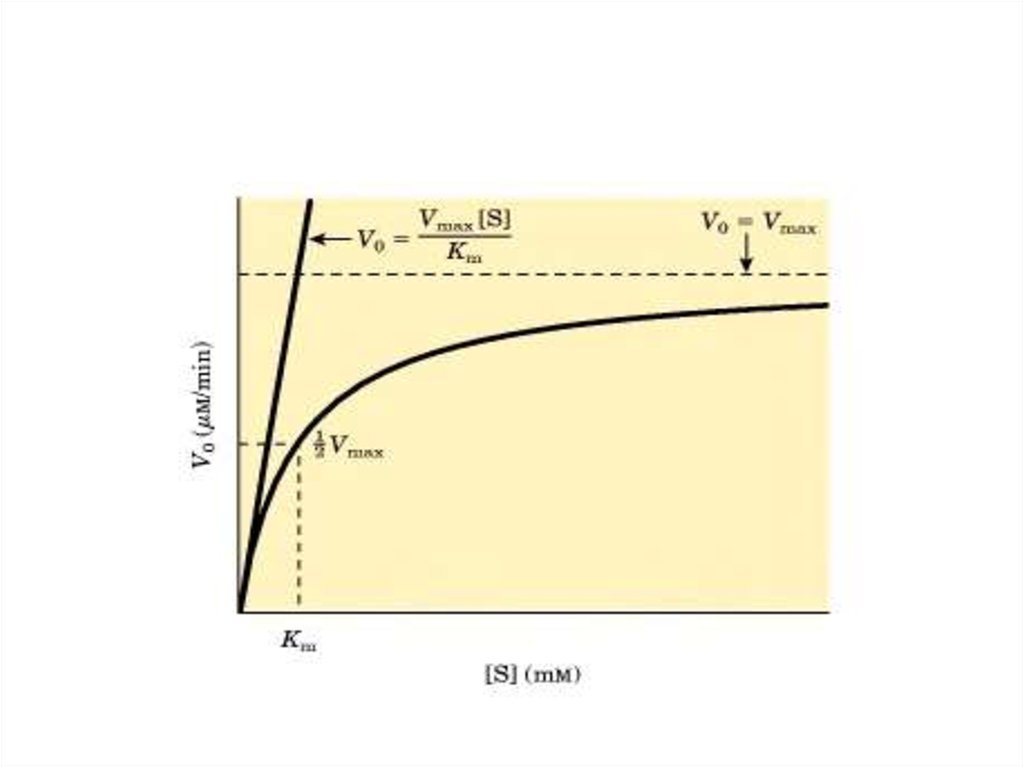
28. Графическая зависимость V от [S]
29. Возможно 3 варианта решения уравнения Михаэлиса:
• 1. [S] > Кm →V = Vmax·[S]/ [S] = Vmax
• 2. Кm > [S] →
V = Vmax·[S]/ Кm = К1 [S]
т.е. V прямо пропорциональна [S]
• 3. [S] = Кm →
V = Vmax·[S]/([S] + [S]) = Vmax/2
30.
31.
Физический смысл Кmзаключается в том, что Кm
численно равна [S], при которой
V ферментативной реакции
равна 1/2 Vmax
32.
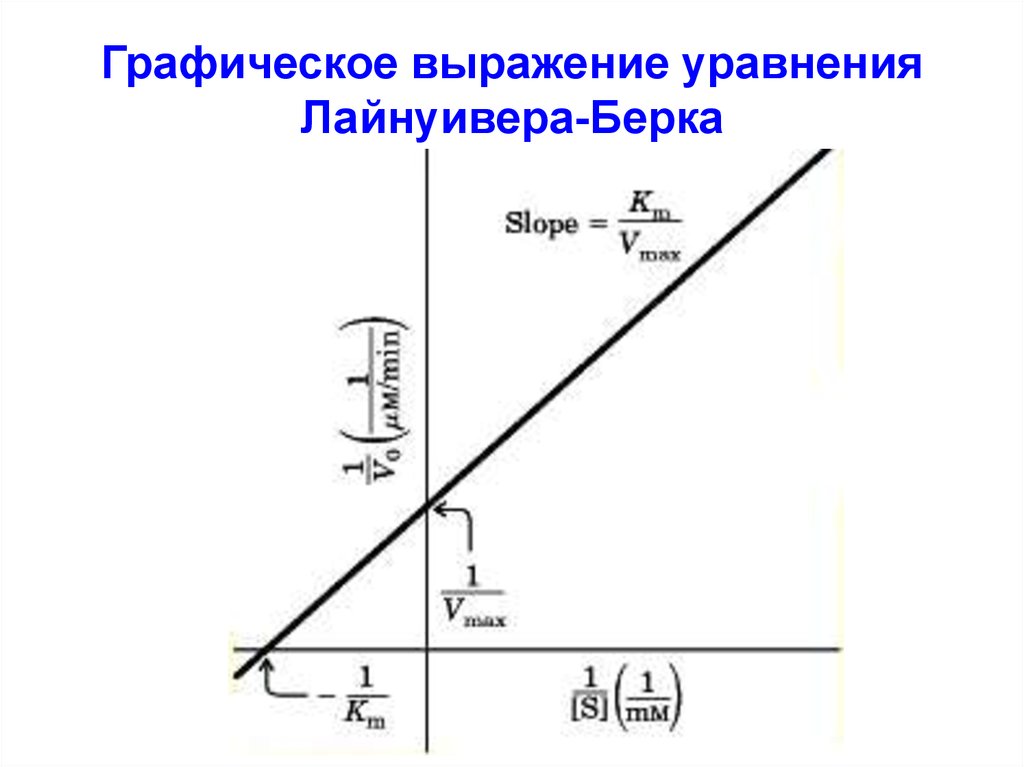
Г. Лайнуивер и Д. Беркпреобразовали уравнение
Михаэлиса-Ментен, выразив обе
части уравнения в виде
обратных величин:
1/V = Кm/(Vmax·[S]) +
[S]/(Vmax·[S])
или:
1/V = Кm/Vmax·1/[S]) + 1/Vmax
Уравнение Лайнуивера-Берка
33. Графическое выражение уравнения Лайнуивера-Берка
34. Зависимость скорости реакции от концентрации фермента
35. Зависимость скорости реакции от температуры
36. Правило Вант-Гоффа справедливо лишь до 50-60о С
37. Зависимость скорости ферментативной реакции от рН
38.
pH среды влияет на скоростьдиссоциации различных
функциональных группировок,
входящих в активный центр
фермента (COOH, NH2)
39.
• При изменении pH изменяетсяколичество ионных связей в
молекуле, а, значит, и
конформация активного центра,
что отражается на V реакции.
• Обычно оптимальное значение
pH находится в ИЭТ.
40. Оптимумы рН для некоторых ферментов
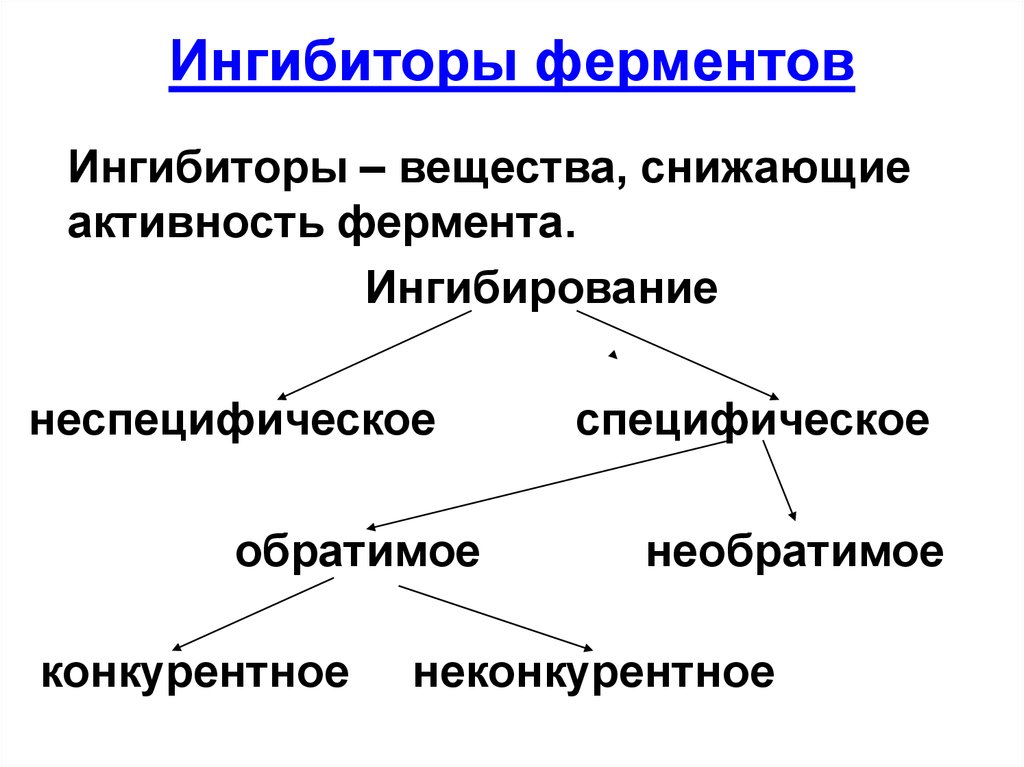
41. Ингибиторы ферментов
Ингибиторы – вещества, снижающиеактивность фермента.
Ингибирование
неспецифическое
обратимое
конкурентное
специфическое
необратимое
неконкурентное
42. Неспецифическое
Обусловлено денатурациейфермента под влиянием
физических и химических
факторов: to, кислот, щелочей,
ионизирующего излучения и т.д.
Неспецифические ингибиторы (I)
могут действовать на все
ферменты.
43. Специфическое
Избирательный процесс, прикотором I действует только на
определенный фермент в низкой
концентрации
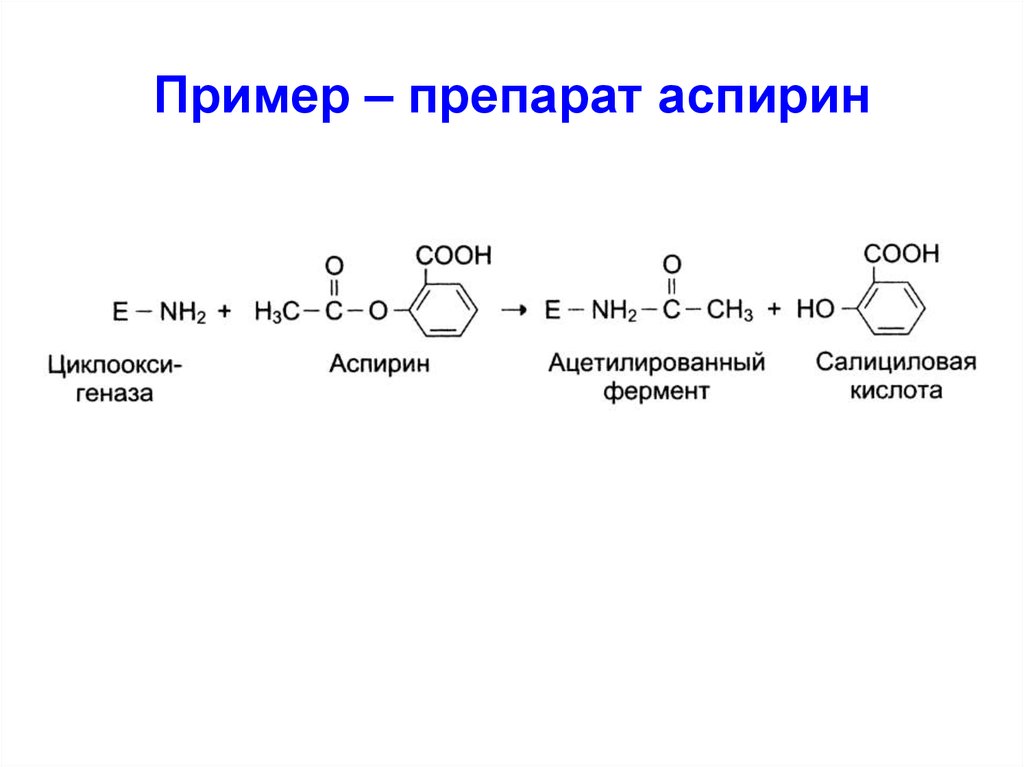
Необратимое
I образует с E комплекс за счет
прочных ковалентных связей,
который не диссоциирует.
Активность E после этого не
восстанавливается.
44. Пример – препарат аспирин
45.
ОбратимоеI связывается с E
нековалентными связями → [IE]
легко распадается, активность E
при этом восстанавливается
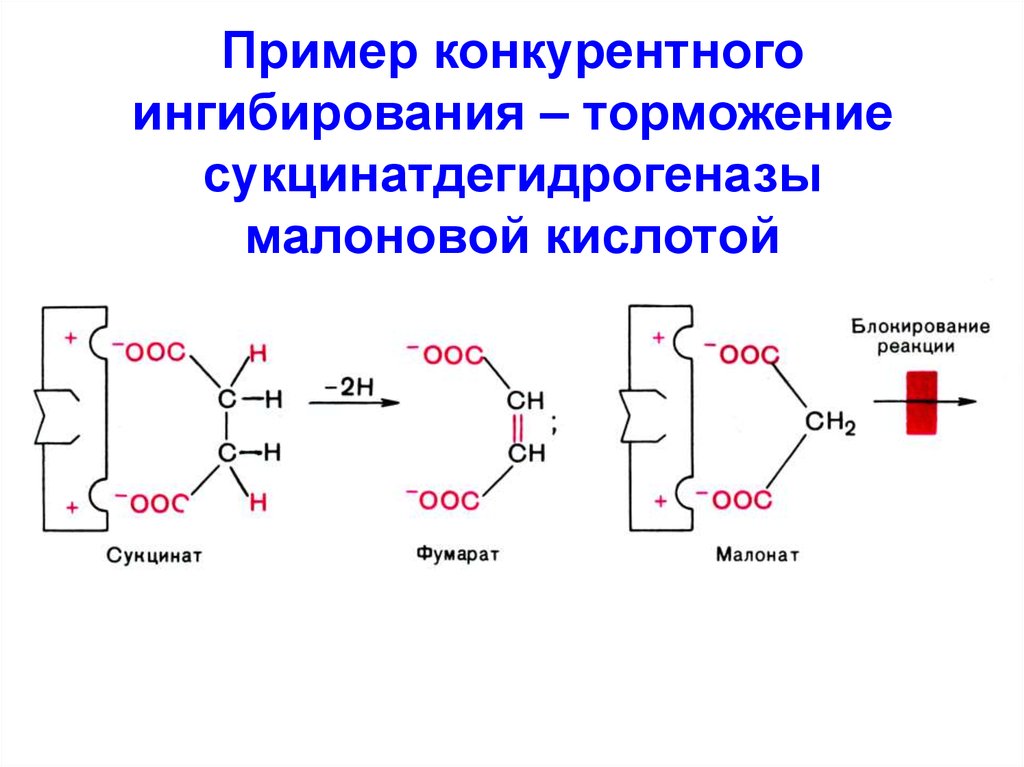
46. Конкурентное (изостерическое)
I - структурный аналог S
I связывается с активным
центром E → между I и S
возникает конкуренция за
активный центр
47. Пример конкурентного ингибирования – торможение сукцинатдегидрогеназы малоновой кислотой
48.
Для устранения действияконкурентного I необходимо
увеличить концентрацию S
или удалить I
49. Конкурентное ингибирование графически выражается с помощью кривой Михаэлиса (а) и прямой Лайнуивера-Берка (б):
50.
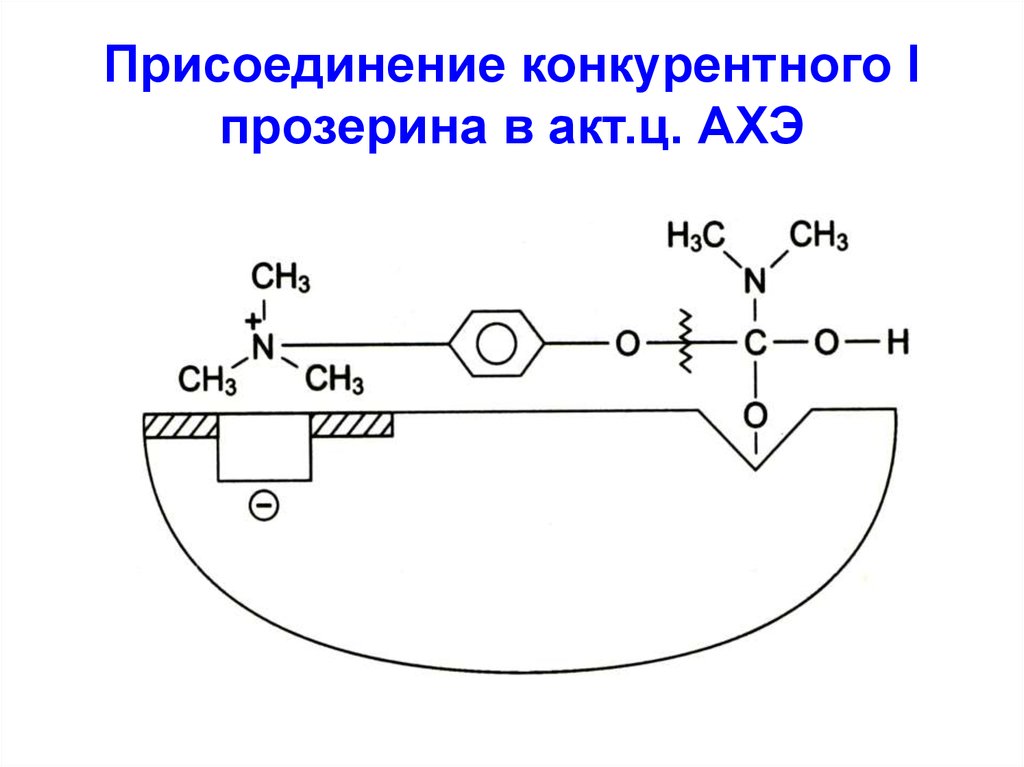
На принципе конкурентногоингибирования основано
действие многих ЛВ, например,
группа ацетилхолинэстеразных
препаратов, являющихся
конкурентными I АХЭ по
отношению к его S
ацетилхолину: прозерин,
физостигмин, севин и др.






















![Графическая зависимость V от [S] Графическая зависимость V от [S]](https://cf2.ppt-online.org/files2/slide/s/SOe2sXMd8YKt5a3wlkjirnUWJIopFVQGTHEf46bxN/slide-27.jpg)

















 Биология
Биология








