Похожие презентации:
Ферменты-2. Кинетика ферментативных реакций
1. ФЕРМЕНТЫ-2
Наумов А.В.2. Кинетика ферментативных реакций
Кинетика – изучает скорость химическойреакции и её зависимость от факторов
o
- t , pH, активаторов, ингибиторов.
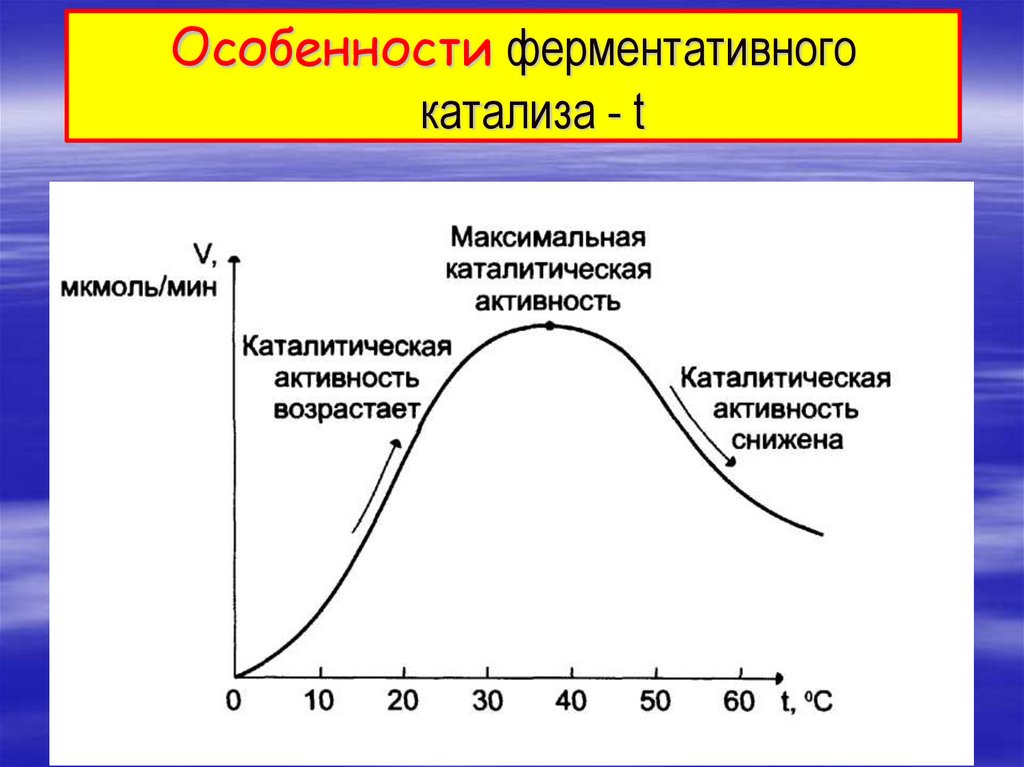
3. Особенности ферментативного катализа - t
4.
Особенности ферментативногокатализа - pH
5.
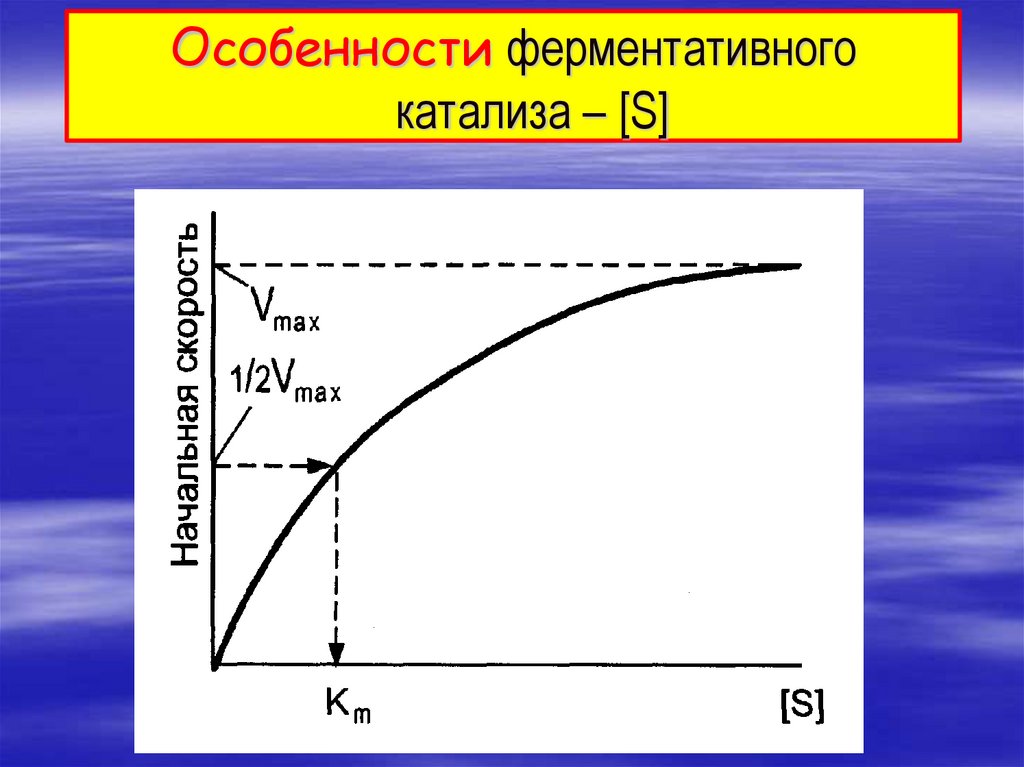
Особенности ферментативногокатализа – [S]
6.
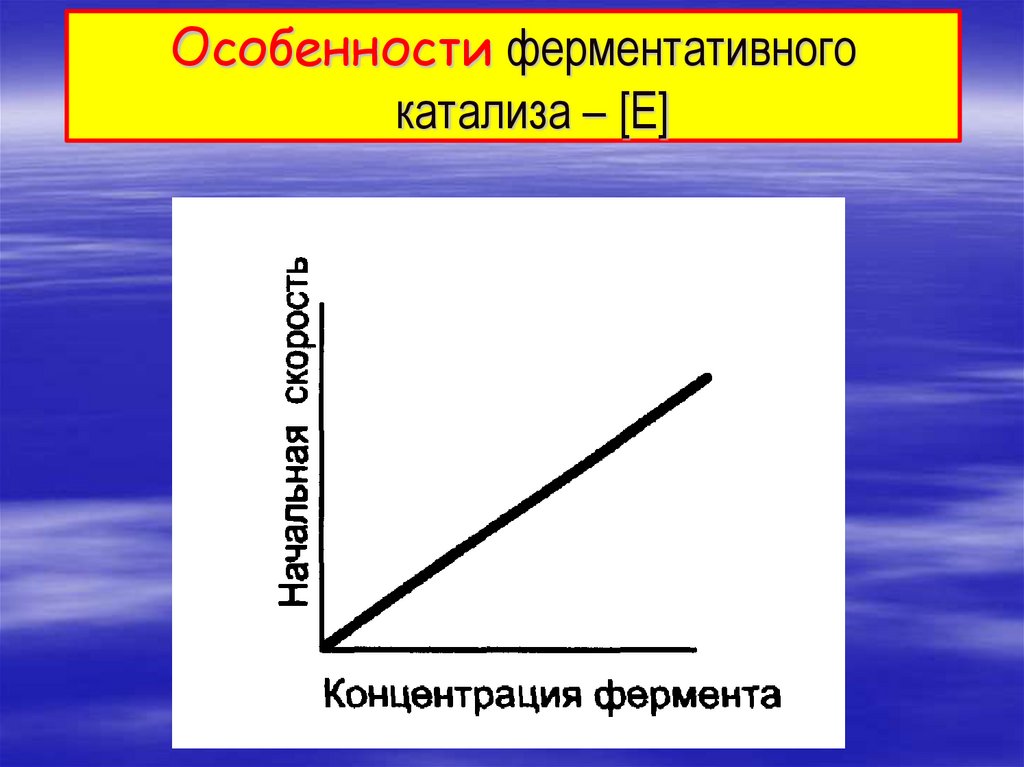
Особенности ферментативногокатализа – [E]
7. Кинетика ферментативных реакций
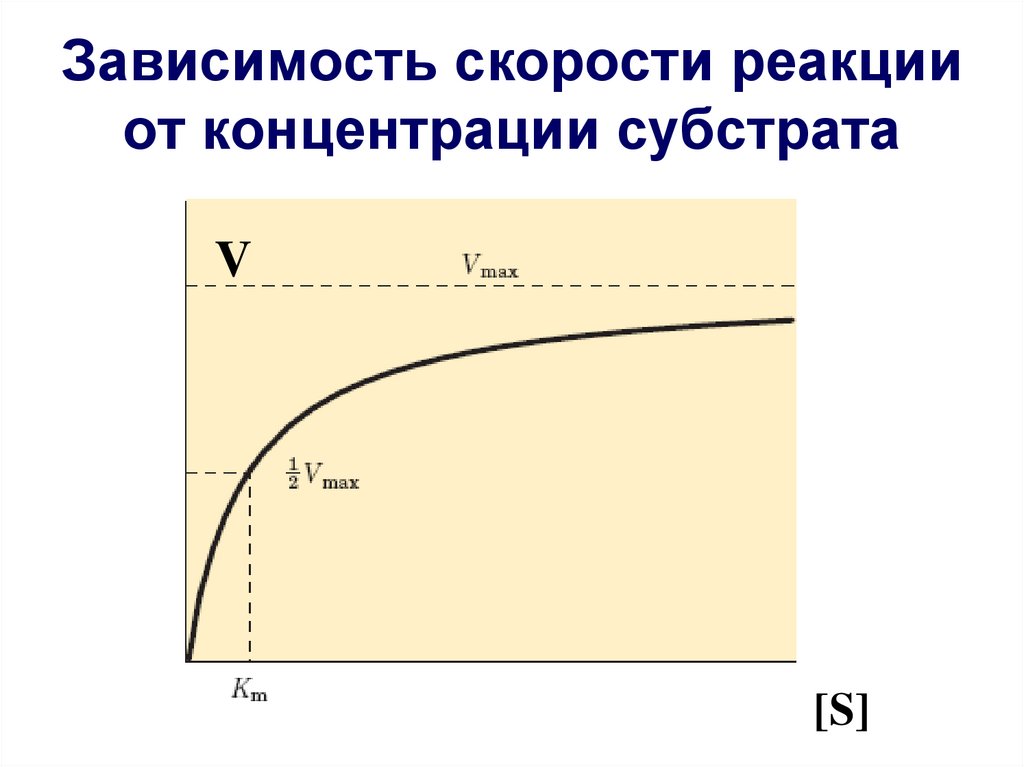
Зависимость скорости реакции от концентрациисубстрата
8. Кинетика ферментативных реакций
Уравнение Михаэлиса – МентенV0 =
Vmax [S]
Km + [S]
9.
Л. МихаэлисМ. Ментен
10.
V0 = k2[ES][Et] – общий уровень фермента, участвующего в
реакции на данный момент.
[Et] - [ES] - концентрация свободного фермента.
11.
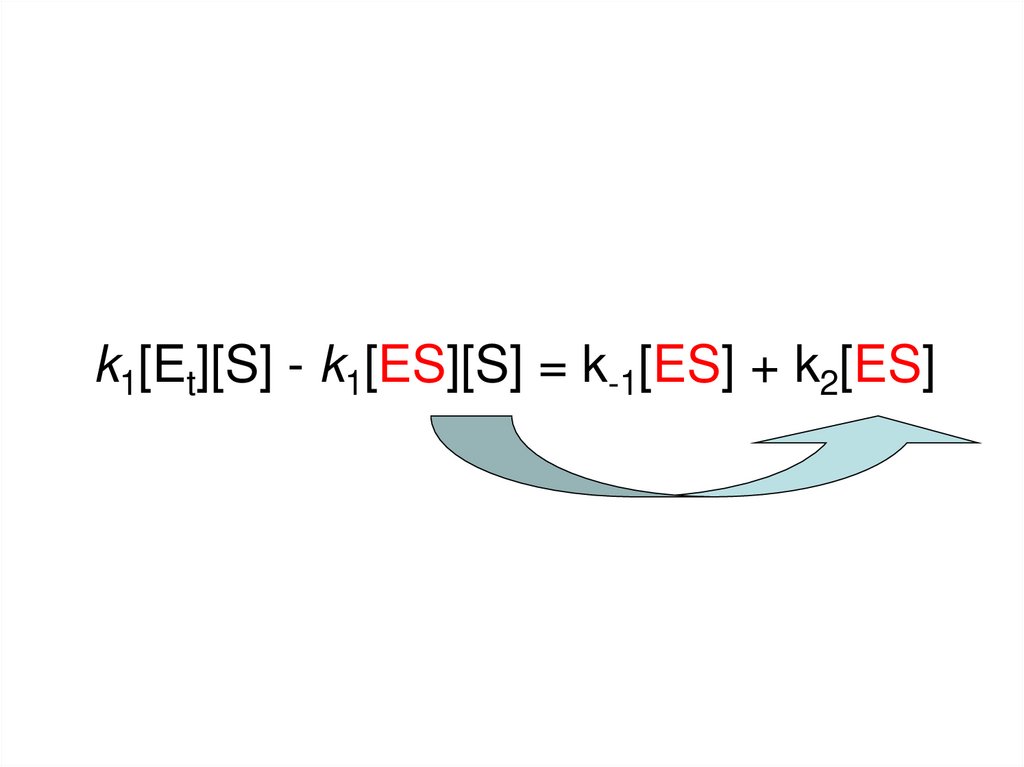
(Образование) ES = k1([Et] - [ES])[S](Распад)
ES = k-1[ES] + k2[ES]
12.
(Образование)ES = k1([Et] - [ES])[S]
(Распад)
ES = k-1[ES] + k2[ES]
k1([Et] - [ES])[S]
13.
k1([Et] - [ES])[S] =14.
k1([Et] - [ES])[S] = k-1[ES] + k2[ES]15.
k1[Et][S] - k1[ES][S] = k-1[ES] + k2[ES]16.
k1[Et][S] - k1[ES][S] = k-1[ES] + k2[ES]17.
k1[Et][S] = (k1[S] + k-1 + k2)[ES]18.
Решаем уравнение относительно [ES]:k1[Et][S] = (k1[S] + k-1 + k2)[ES]
19.
/K120.
Соотношение суммы констант скорости распадак константе скорости синтеза
(k2 + k-1)
______________________
k1
получило название
константа Михаэлиса -
Km
21.
22.
V0 = k2[ES]23.
Максимальная скорость - Vmaxвозможна при условии полного насыщения фермента
субстратом, т.е. когда
[ES] = [Et]
В этом случае Vmax может быть представлена как
Vmax = k2[Et].
Подставив это в уравнение
получаем
уравнение Михаэлиса-Ментен:
24.
25. Зависимость скорости реакции от концентрации субстрата
V[S]
26.
При условииV0 = ½ Vmax
подставляем в уравнение
27.
разделив обе половины уравнения на Vmax получаем:решая его относительно Km получаем:
Km + [S] = 2[S]
или
Km = [S]
28.
Km = [S]Константа Михаэлиса
- это концентрация субстрата при которой скорость
ферментативной реакции ровна половине максимальной.
Km характеризует сродство субстрата к ферменту
29.
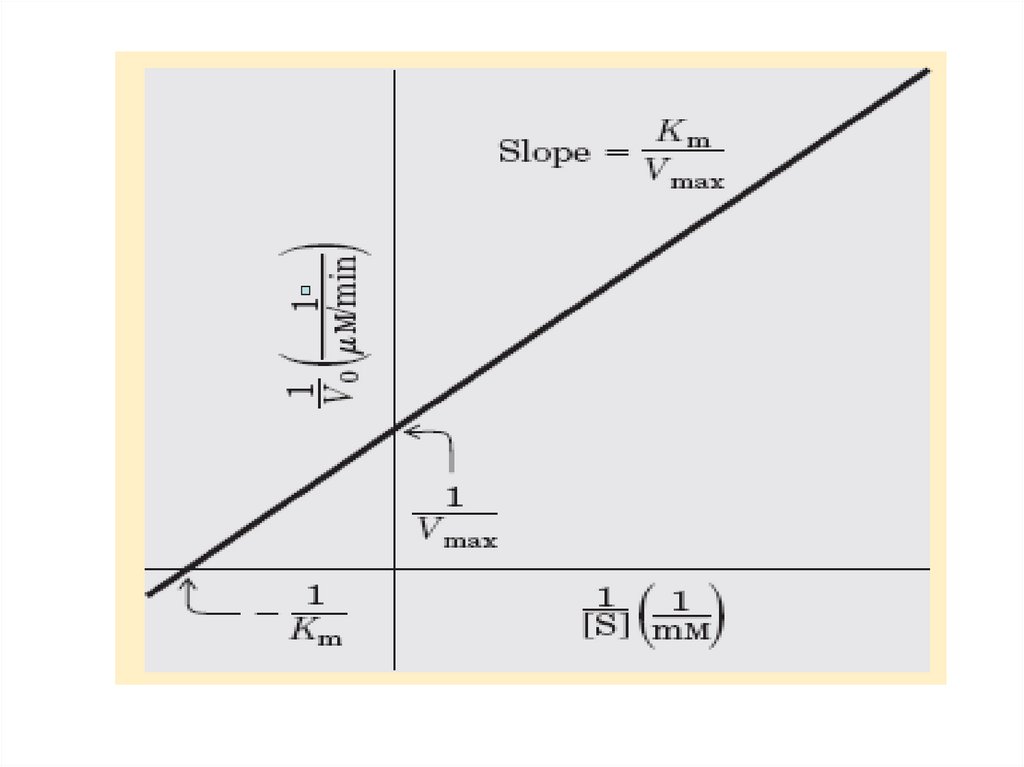
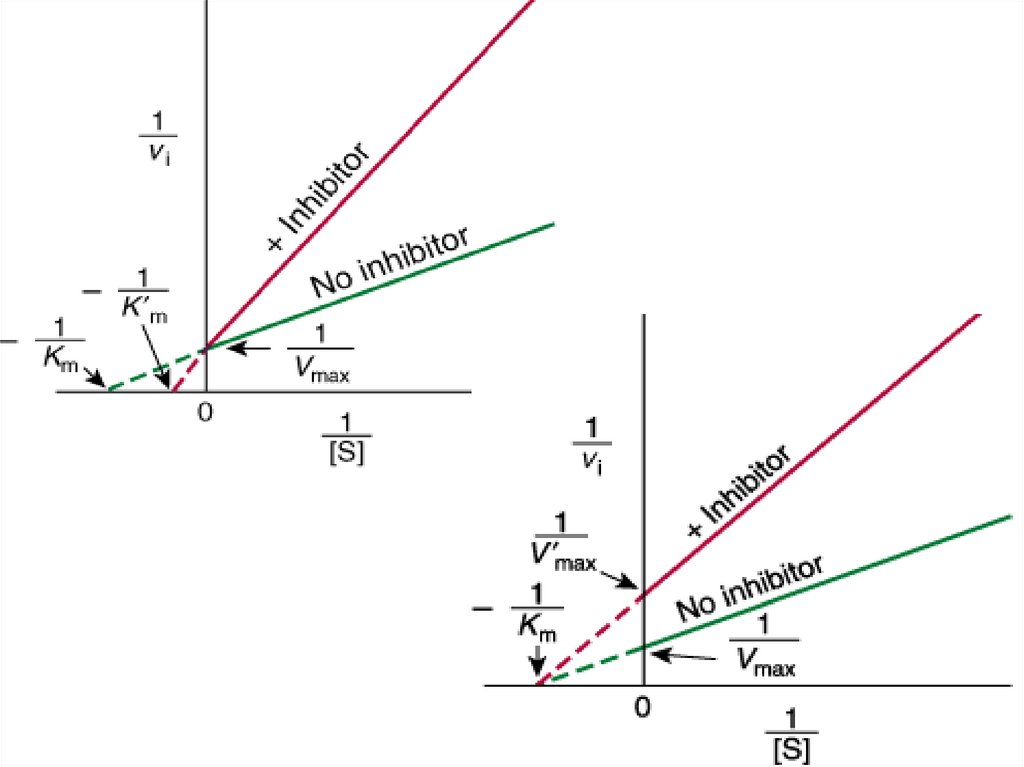
Уравнение Лайнвивер-Бэрка(Lineweaver-Burk).
30. Уравнение и график Лайнуивера -Берка
31.
32. Активаторы ферментов
Повышают ферментативную активность;
Формируют конформацию активного центра
фермента;
Облегчают образование ферменткомплекса;
субстратного
Стабилизируют нативную структуру фермента;
Защищают функциональные группы активного
центра.
33. Ингибиторы ферментов
НЕСПЕЦИФИЧЕСКИЕ.
СПЕЦИФИЧЕСКИЕ:
А) НЕОБРАТИМЫЕ
Б) ОБРАТИМЫЕ:
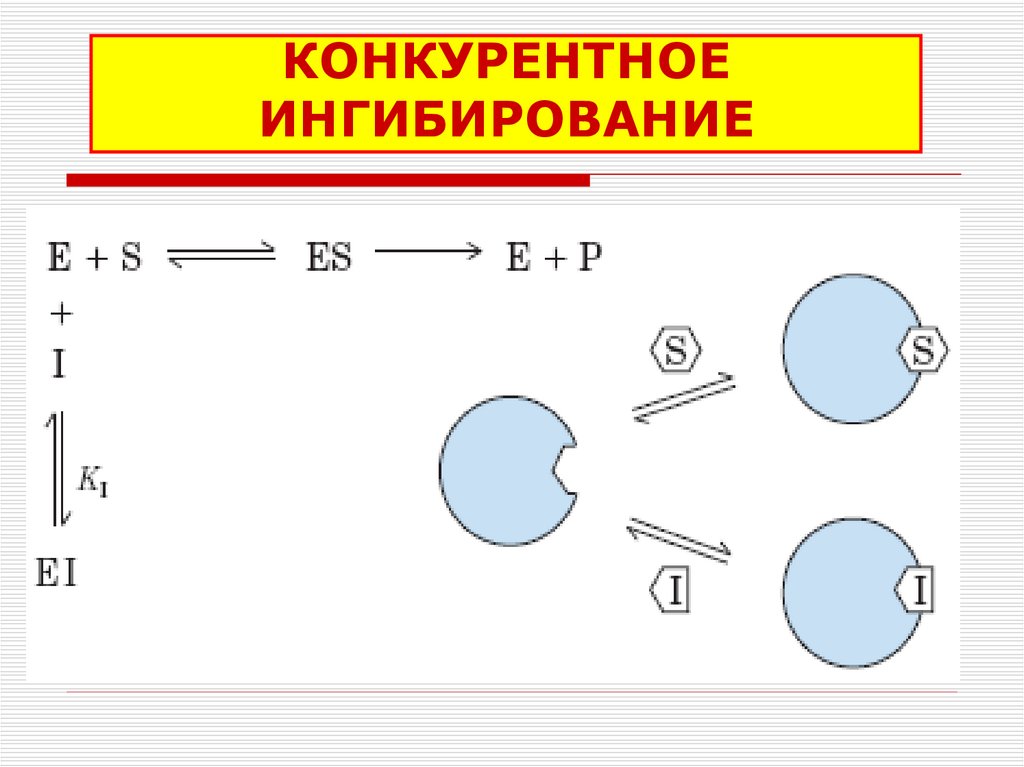
- КОНКУРЕНТНЫЕ
- НЕКОНКУРЕНТНЫЕ.
34. НЕСПЕЦИФИЧЕСКИЕ ИНГИБИТОРЫ
Вызывают денатурацию молекулыфермента –
• кислоты,
• щелочи,
• соли тяжелых металлов.
35. НЕОБРАТИМЫЕ ИНГИБИТОРЫ
Необратимое ингибирование наблюдается при образованииковалентных связей между
ингибитором и активным центром
фермента. Фермент не может
выполнять каталитическую
функцию.
36. ОБРАТИМЫЕ ИНГИБИТОРЫ
Связываются с активным центромфермента слабыми нековалентными
связями и легко отделяются от фермента.
Обратимые ингибиторы бывают:
конкурентными
неконкурентными.
37. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
38. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
39.
40. Регуляция активности ферментов
1) Активация ферментов при присоединениирегуляторных белков –
аденилатциклаза
2) Изменение активности ферментов путем
ассоциации / диссоциации протомеров протеинкиназа А
41. 3) Химическая модификация фермента
• Регуляция активности ферментов путемфосфорилирования/дефосфорилирования
фосфорилаза
• Регуляция активности ферментов
частичным протеолизом
пепсиноген – пепсин

















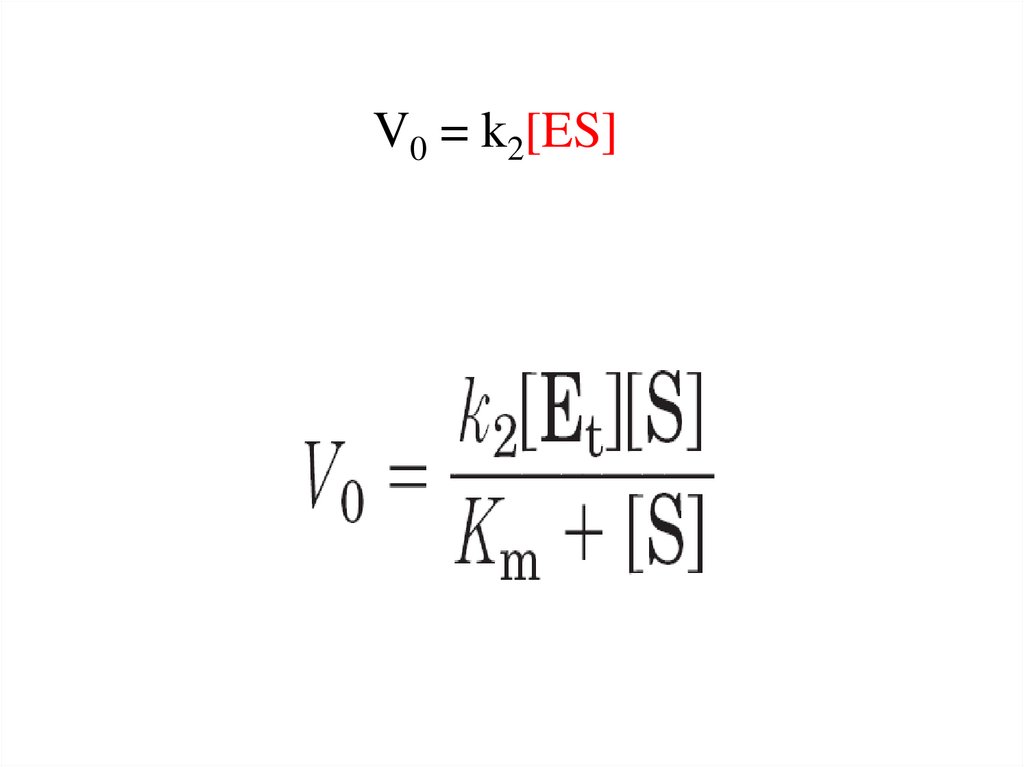

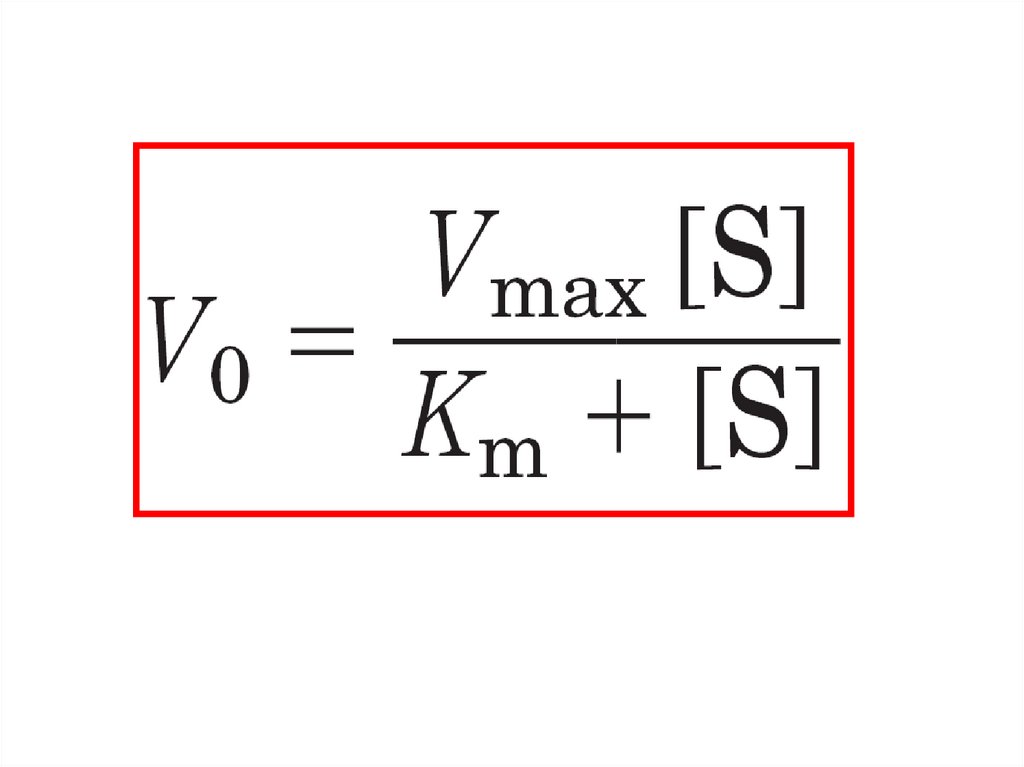














 Биология
Биология








