Похожие презентации:
Иммуноферментный анализ
1. Иммуноферментный анализ (ИФА) - относится к современным методам ИА и используется для качественного и количественного определения антиген
Иммуноферментный анализ (ИФА) - относится ксовременным
ИА и используется
для антигена
ИФА
- основанметодам
на специфическом
связывании
качественного
и количественного
определения
(АГ)
с соответствующими
антителами(АТ)
с антигенов/
антител в биологических
использованием
ферментаобразцах.
в качестве метки для
регистрации сигнала.
ИФА
Главный принцип ИФА – «узнавание» анализируемого
соединения специфическим к нему антителом.
2.
ELISE (enzyme-linked immunosorbent assay) –разновидность ИФА - твердофазный ИФА,
Е. Энгвалл и Р. Пэлман (Швеция), 1971 г.
3.
Антиген (Аг) в ИФА - любой патоген (бактерия) или егофрагмент, а также любое соединение (аналит) к которому можно
подобрать моноклональное антитело (Ат).
Эпитоп (антигенная детерминанта) – участок Аг, который
узнается и связывается Ат.
Антитела:
1. Поликлональные (for example кроличьи антитела против
всех Ig человека);
2. Моноклональные (к определенному классу Ig)
Основные характеристики антител:
Аффинность – степень специфического сродства активного
центра АТ к АГ-детерминанте. При низкой афинности антител
распад комплекса Аг-Ат приводит к удалению связанного Аг из
системы.
Авидность – степень прочности связывания АТ с АГ.
Чем выше аффинность (степень сродства), тем лучше
авидность (прочность связывания)
4.
Области применения ИФАДиагностика инфекционных и вирусных заболеваний (все инфекции, ВИЧ, гепатиты) выявление АГ и/или специфических АТ к ним;
Кардиомаркеры (hs СРБ, тропонин, миоглобин, NTproBNP);
Определение уровня гормонов (щитовидной железы, надпочечников, половые и т.д.);
Выявление и определение уровня ксенобиотиков (лекарственных препаратов, токсикантов,
наркотических веществ);
Определение уровня иммуноглобулинов (Ig A, М,G, Е, подклассы IgG 1-4);
Определение уровня цитокинов (все IL,интерфероны, ФНО, КСФ и т.д.);
Выявление иммунных комплексов;
Определение уровня опухолевых маркеров (ОМ);
Определение уровня специфических белков крови (ферритин, TRF, фибронектин ,
эритропоэтин и др.);
Определение концентрации ферментов (СОД, глутатионпероксидаза, каталаза и т.д.);
Скрининг моноклональных антител;
Определение компонентов костного метаболизма (маркеров остеосинтеза и резорбции –
(ДПД, С-концевые телопептиды, остеокальцин и т.д.)
Определение факторов свертывания крови (Д-димер)
5. Области применения ИФА
Иммунология;Инфекционные и вирусные заболевания;
Кардиология;
Патология гемостаза;
Онкология;
Фертильность и репродукция;
Гормоны;
Ветеринария
6.
Варианты ИФА1. По условиям в которых проводится реакция ИФА:
Гомогенный – нет стадии разделения
иммунохимических комплексов, образовавшихся в
процессе реакции от компонентов не вступивших в
реакцию. Т.е. все реакции протекают в растворе;
Гетерогенный - реакция проводится с реагентами,
фиксированными на поверхности (твердой фазе) с
иммобилизованными на нее АТ (или АГ).
7.
2. По количеству этапов в постановке реакций ИФА:прямой;
непрямой
3. По количеству реагентов на первом этапе:
конкурентный
неконкурентный
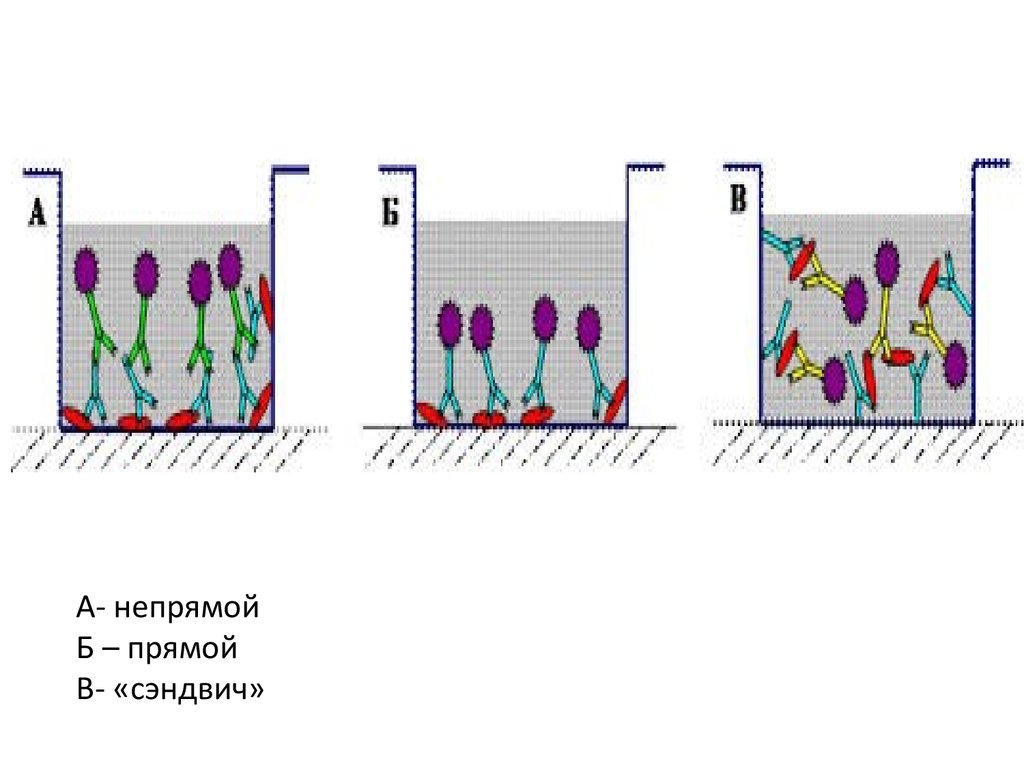
8.
А- непрямойБ – прямой
В- «сэндвич»
9. ИФА типа «сэндвич»
21
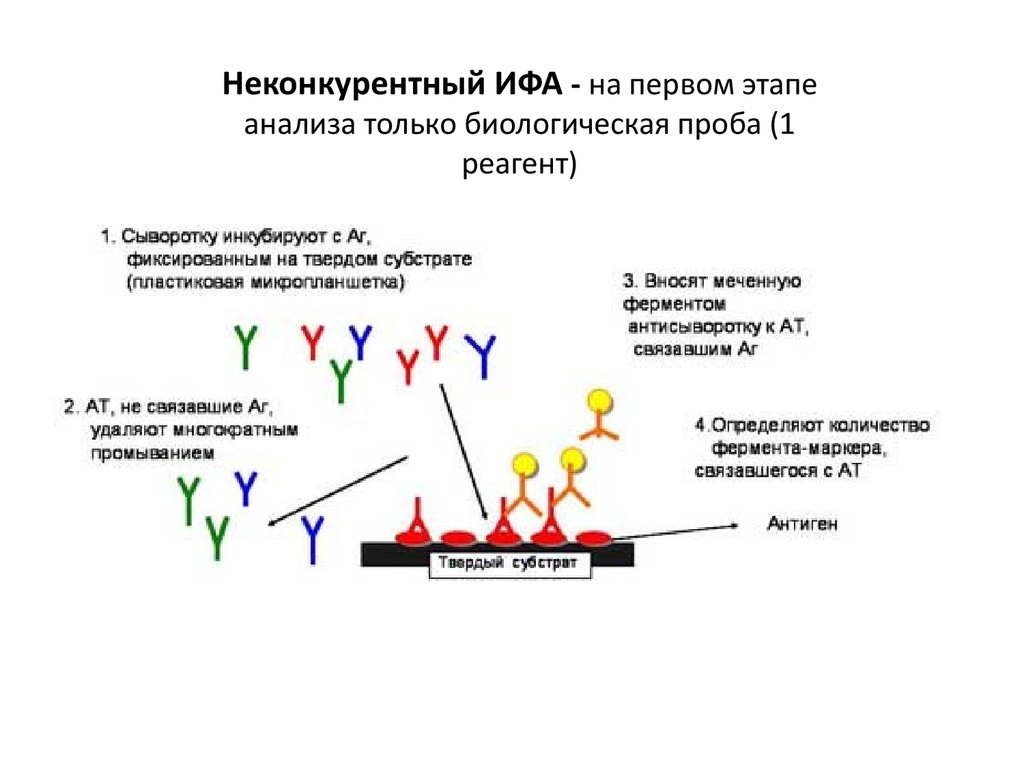
10.
Неконкурентный ИФА - на первом этапеанализа только биологическая проба (1
реагент)
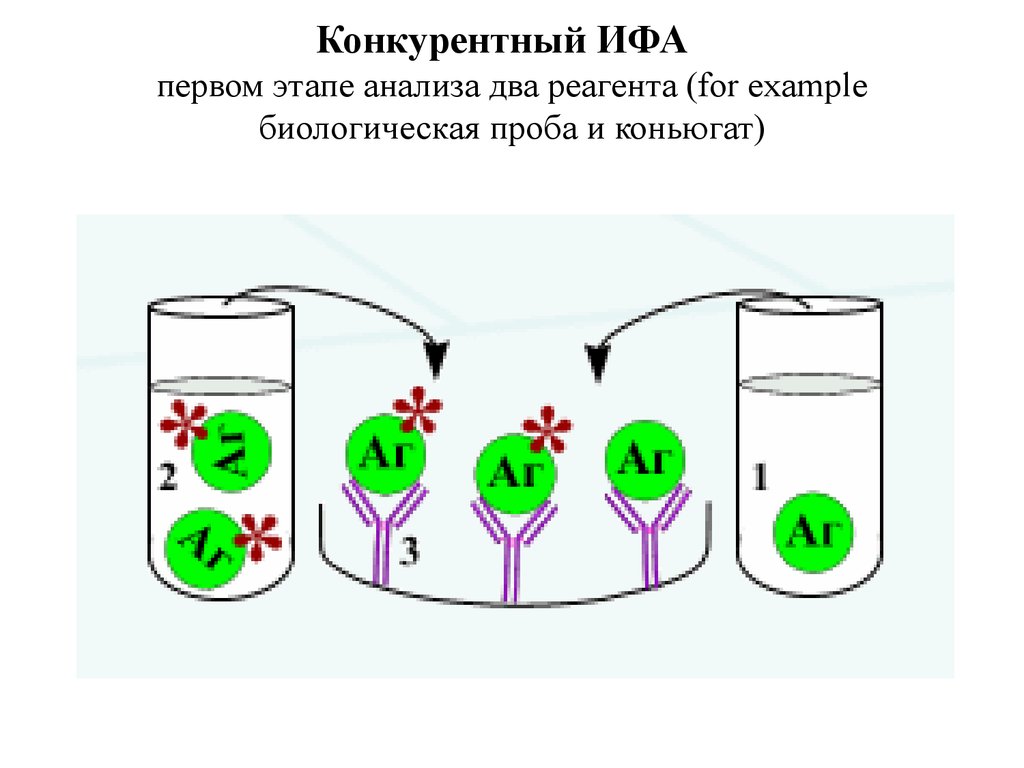
11. Конкурентный ИФА первом этапе анализа два реагента (for example биологическая проба и коньюгат)
12. АНАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ИФА
Чувствительность (нижний предел обнаружения) –минимальная достоверно определяемая концентрация
исследуемого вещества в сыворотке (плазме) крови;
Измеряется в единицах концентрации.
Зависит от концентрации, активности и специфичности
используемых Ат.
Специфичность – характеристика избирательности тестсистемы.
Она показывает насколько вероятно, что реакция будет
протекать с искомым веществом, а не с другими
компонентами исследуемого образца.
Измеряется в %.
Чувствительность и специфичность ИФА повышается
при применении моноклональных Ат.
13. ПРОТОКОЛ ИФА
1.Внесение биологического образца (сыворотка, плазма и др.) в
лунки планшета на дне которого сорбированы Ат к искомому
аналиту (Аг);
2. Инкубация при определенных условиях
происходит узнавание тестируемого соединения специфическим к
нему Ат/Аг, что ведет к образованию иммунного комплекса;
3. Промывка лунок - удаление несвязавшихся компонентов
реакции;
4. Внесение коньюгата – Ат/Аг меченые ферментом;
5. Инкубация
формируется связь коньюгата с ранее сформировавшимся
иммунным комплексом;
Коньюгат - фермент-Аг (или фермент- Ат)
6. Промывка лунок - удаление несвязавшихся компонентов
реакции;
14.
7. Внесениесубстрат-хромогенной смеси;
8. Инкубация (в темноте);
«ферментная метка превращается в
регистрируемый сигнал
9. Внесение стоп-раствора;
10. Учет результатов с помощью спектрофотометра или
ИФА-ридера.
15.
Учет результатов:При количественном варианте ИФА параллельно с
анализируемыми образцами исследуют стандартные образцы
(калибровочные пробы),
каждый из которых содержит
исследуемый аналит в
определенной концентрации
По ОП стандартов строится
калибровочная кривая, на
которую затем накладываются
ОП растворов в лунках и определяется концентрация аналита
в биологических образцах и контрольной сыворотке.
О правильности полученных результатов судят по результатам
тестирования контрольных образцов (средняя, SD).
16.
ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О ГЕМОСТАЗЕГемостаз - биологическая система, функция которой заключается в
сохранении жидкого состояния крови, остановке кровотечений
при повреждениях стенок сосудов и растворении тромбов,
выполнивших свою функцию в процессе свертывания крови.
Свертывание крови – сложная цепь реакций, в которых участвуют
сосудистая стенка, тромбоциты и факторы свертывания.
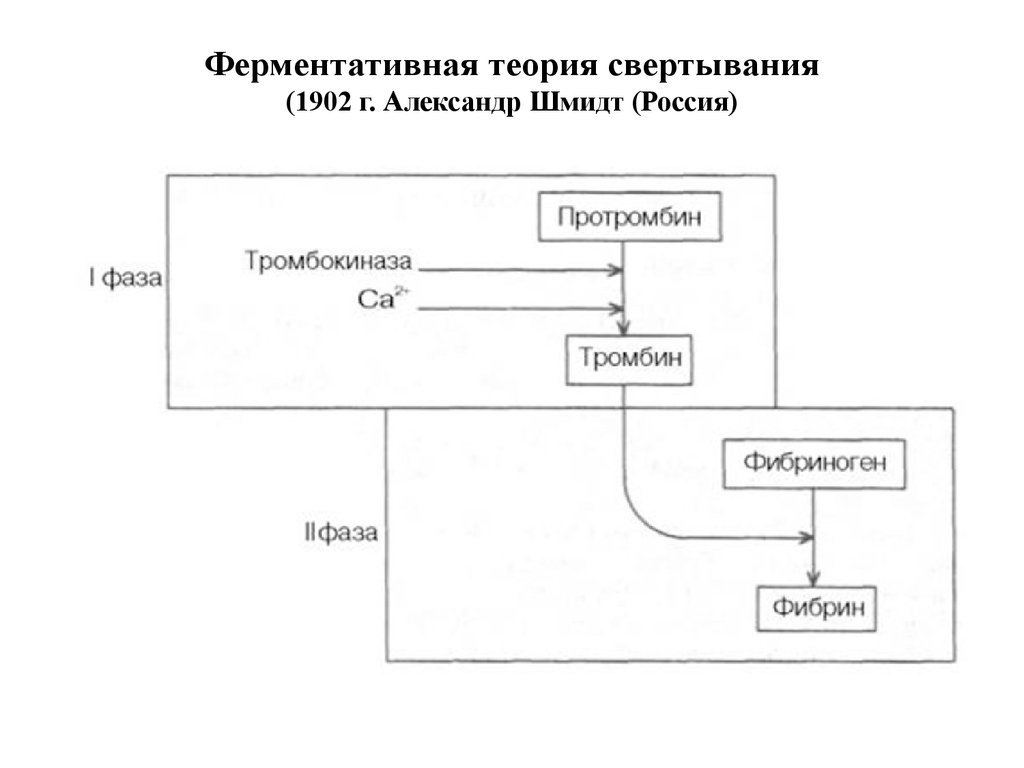
17. Ферментативная теория свертывания (1902 г. Александр Шмидт (Россия)
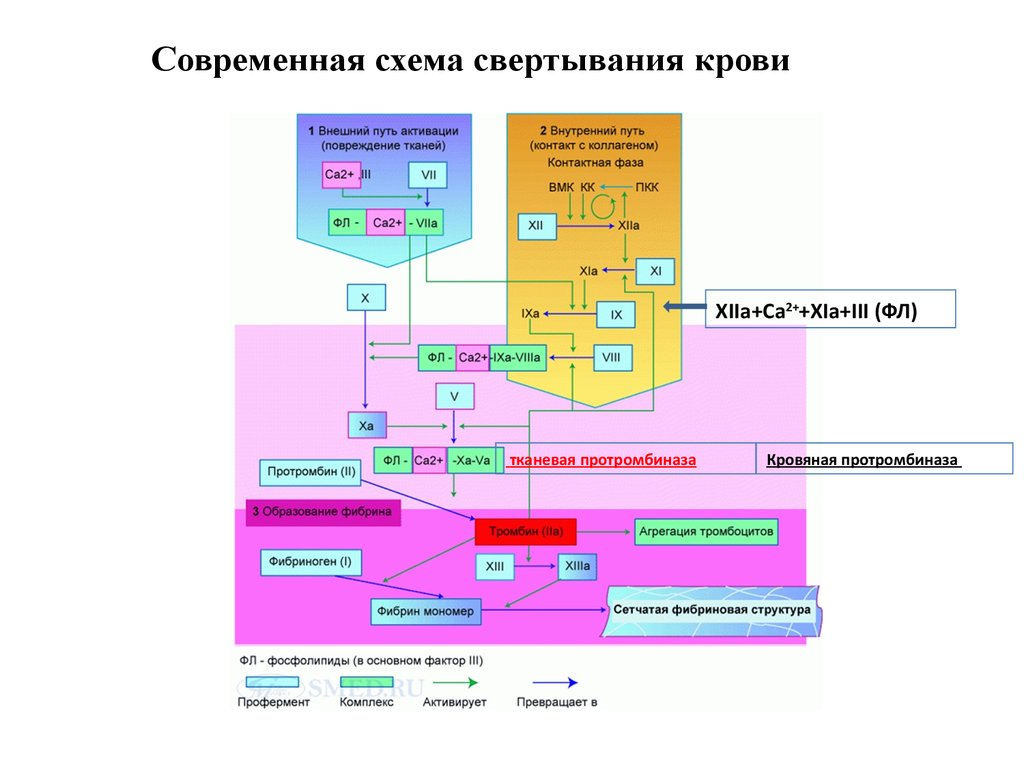
18. Современная схема свертывания крови (5 фаз) – 5-6 мин
1. Образование протромбиназ (тканевой + кровяной) - 3-4 мин;2. Образование тромбина;
3. Образование фибрина;
4. Полимеризация фибрина и организация сгустка;
5. Фибринолиз - лизис фибринового сгустка, который приводит к
растворению тромба после репарации поврежденной стенки
сосуда.
.
19.
Современная схема свертывания кровиXIIa+Ca2++XIa+III (ФЛ)
тканевая протромбиназа
Кровяная протромбиназа
20.
Протромбиназа (комплекс факторов)Тромбопластин (III) – Ca2+ (IV) - Xa – Va
III – тромбопластин (тканевой, кровяной, эритроцитарный,
тромбоцитарный;
IV – Ca2+
Xa – активированный ф. Стьюард-Прауэр – основной компонент
протромбиназы;
Va – активированный проакцелерин – ускоритель
ферментативных реакций свертывания
21. Факторы свертывания крови
Факторы свёртывания крови — группа веществ, содержащихся в плазме крови итромбоцитах, обеспечивающих свёртывание крови:
Плазменные (17 ф.) - I - XIII;
Тромбоцитарные (14-22 ф.);
Тканевые факторы;
Клеточные (эритроциты, лейкоциты)
Плазменные факторы свертывания преимущественно синтезируются в печени. Ф.
VIII – в клетках эндотелия
Большинство факторов свёртывания — белки (ферменты, кофакторы ферментов,
ингибиторы ферментов). Ca 2+ и др. низкомолекулярные органические вещества.
В норме белковые факторы свёртывания крови находятся в плазме в неактивном
состоянии. В процессе свертывания крови предшественники факторов свертывания
превращаются в их активные формы.
22. Классификация факторов свертывания I:
Субстраты (фибриноген (I);Ферменты – большинство
Кофакторы ферментов (тканевой фактор, факторы V VIII,
фактор Фицджеральда);
II:
Группа ф/г (I, V, VIII, XIII);
Группа протромбина (II, VII, IX, X);
Контактные факторы (XI, XII, прекалликреин, кининоген)
23.
I ЭТАП СВЕРТЫВАНИЯ КРОВИСосудисто-тромбоцитарный гемостаз - спазм сосудов и их
механическая закупорка агрегатами тромбоцитов.
Механизм: адгезия, активация и агрегация тромбоцитов на
обнажившихся в результате повреждения коллагеновых волокнах
сосудистой стенки.
В результате образуется
преобладанием тромбоцитов.
«белый тромб» (тромб с
24.
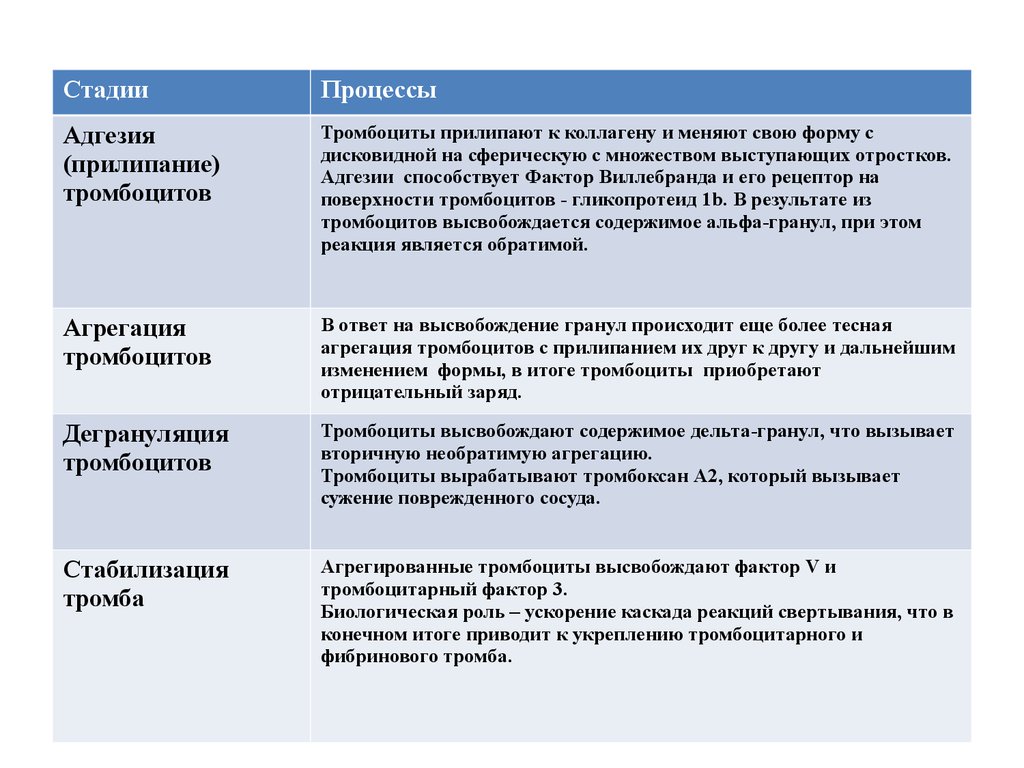
СтадииПроцессы
Адгезия
(прилипание)
тромбоцитов
Тромбоциты прилипают к коллагену и меняют свою форму с
дисковидной на сферическую с множеством выступающих отростков.
Адгезии способствует Фактор Виллебранда и его рецептор на
поверхности тромбоцитов - гликопротеид 1b. В результате из
тромбоцитов высвобождается содержимое альфа-гранул, при этом
реакция является обратимой.
Агрегация
тромбоцитов
В ответ на высвобождение гранул происходит еще более тесная
агрегация тромбоцитов с прилипанием их друг к другу и дальнейшим
изменением формы, в итоге тромбоциты приобретают
отрицательный заряд.
Дегрануляция
тромбоцитов
Тромбоциты высвобождают содержимое дельта-гранул, что вызывает
вторичную необратимую агрегацию.
Тромбоциты вырабатывают тромбоксан А2, который вызывает
сужение поврежденного сосуда.
Стабилизация
тромба
Агрегированные тромбоциты высвобождают фактор V и
тромбоцитарный фактор 3.
Биологическая роль – ускорение каскада реакций свертывания, что в
конечном итоге приводит к укреплению тромбоцитарного и
фибринового тромба.
25.
АКТИВАЦИЯ ТРОМБОЦИТОВ В ПРОЦЕССЕ СВЕРТЫВАНИЯКРОВИ
1. Фактор Виллебрандта связывает обнажившийся коллаген сосудов и
тромбоцитарный рецептор гликопротеид Ib;
2. Активация тромбоцитов;
3. А. тромбоциты выделяют факторы (АДФ, тромбоксан), которые активируют
другие тромбоциты;
4. А. тромбоциты выделяют ф. V (акцелератор плазменного каскада)
26. Роль сосудов в остановке кровотечения
Вазоконстрикция (сужение просвета сосуда) осуществляется подвлиянием БАВ тромбоцитов (серотонин, тромбоксан)
приводит к:
- сокращению кровотока через поврежденный участок;
- стимуляции агрегации тромбоцитов;
- контактной активации свертывания с дальнейшим запуском
ферментативных реакций вторичного гемостаза (плазменного)
27.
28.
Лабораторные методы для оценки состоянияпервичного гемостаза
Время кровотечения (по Дюке);
Определение количества, размеров и степени зрелости
тромбоцитов (ОАК);
Определение агрегационной функции тромбоцитов;
Определение ф. Виллебранда;
Определение ретракции кровяного сгустка.
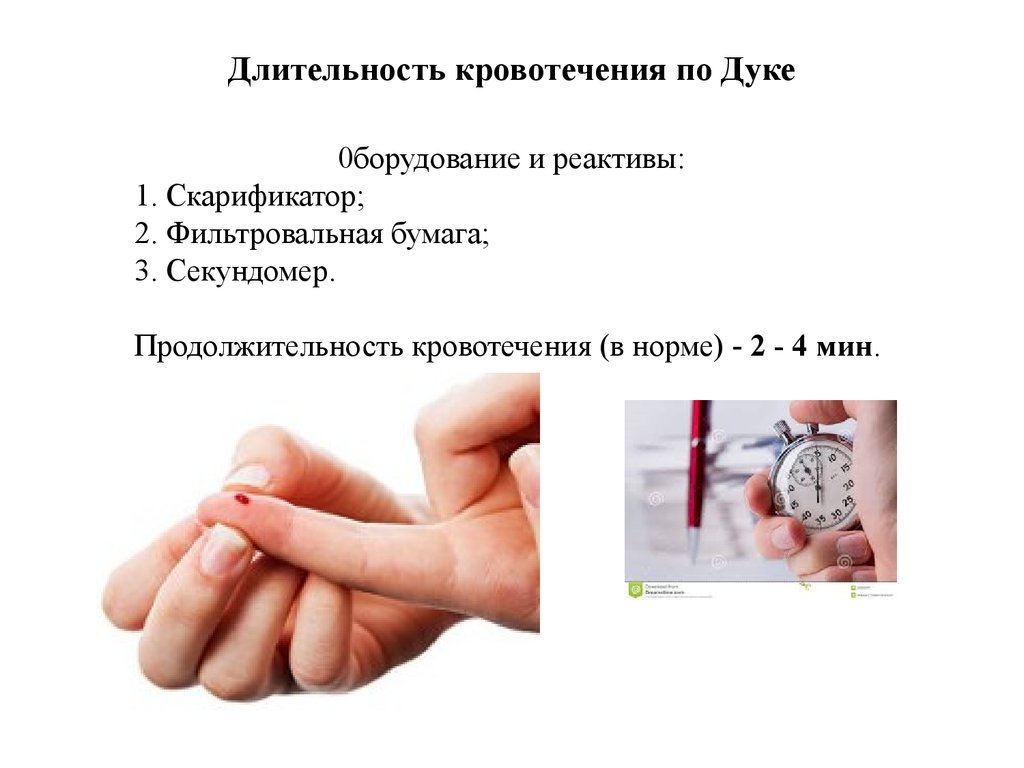
29. Длительность кровотечения по Дуке
0борудование и реактивы:1. Скарификатор;
2. Фильтровальная бумага;
3. Секундомер.
Продолжительность кровотечения (в норме) - 2 - 4 мин.
30.
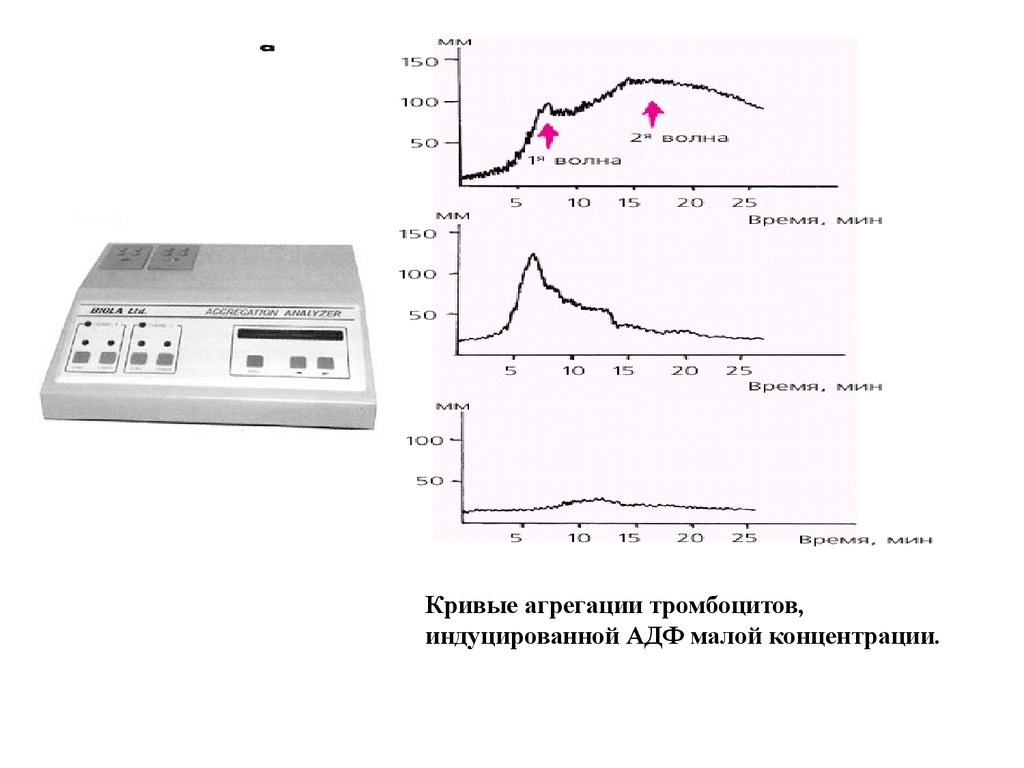
Кривые агрегации тромбоцитов,индуцированной АДФ малой концентрации.
31.
Протромбиназа (комплекс факторов)Тромбопластин (III) – Ca2+ (IV) - Xa – Va
III – тромбопластин (тканевой, кровяной, эритроцитарный,
тромбоцитарный;
IV – Ca2+
Xa – активированный ф. Стьюард-Прауэр – основной компонент
протромбиназы;
Va – активированный проакцелерин – ускоритель
ферментативных реакций свертывания
32.
Современная схема свертывания кровиXIIa+Ca2++XIa+III (ФЛ)
тканевая протромбиназа
Кровяная протромбиназа
33. СВЕРТЫВАНИЕ КРОВИ IN VITRO - МЕТОДЫ ИЗУЧЕНИЯ ПОКАЗАТЕЛЕЙ ГЕМОСТАЗА
СВЕРТЫВАНИЕ КРОВИ IN VITRO МЕТОДЫ ИЗУЧЕНИЯ ПОКАЗАТЕЛЕЙ ГЕМОСТАЗА• Протромбиновое время (ПВ)
• Активированное парциальное (частичное) тромбопластиновое
время (АЧТВ)
• Тромбиновое время
• Фибриноген
• Продукты деградации фибрина (ПДФ)
• Д-димер
34. Протромбиновое время (ПВ), А. Квик, 1935г.
1) ПВ в норме 12-17 сек;2) Протромбиновое отношение (ПО)
ПО = ПВ пациента/ПВ контрольной плазмы
(в норме 0,9-1,3);
3) Протромбин (по Квику) – определяется по калибровочному
графику, построенному на нормальной плазме;
4) Международное нормализированное отношение (МНО) = (ПВ
пациента/ПВ контроля x МИЧ*
Референсное значение 0,9-1,3
*МИЧ – международный индекс чувствительности
35. ПВ оценивает внешний механизм свертывания
укорачивается при активации внешнего механизмасвертывания (травмы, хирургические вмешательства,
атеросклероз, инфекции);
удлиняется:
– дефицит или аномалия факторов протромбинового
комплекса (VII, X, V, II);
- прием непрямых антикоагулянтов (варфарин);
- болезни печени;
- дефицит витамина К;
- ДВС в фазе гипокоагуляции
36. АЧТВ – оценивает внутренний механизм свертывания
Норма АЧТВ от 28 до 38 секУкорочение АЧТВ:
- при активации внутреннего механизма свертывания (тромбозы)
- ДВС (фаза гиперкоагуляции).
Удлинение:
– дефицит факторов внутреннего пути свертывания (VIII, IX, XI, XII) если
результаты ПВ являются нормальными;
-дефицит II, V, X при гипокоагуляции по результатам ПВ;
-дефицит фактора Виллебранда;
-ДВС (фаза гипокоагуляции)
-заболевания печени
-дефицит витамина К
37. D-димер - продукт деградации фибрина при воздействии на него плазмина. Концентрация D-димера пропорциональна активности фибринолиза (колич
D-димер- продукт деградации фибрина
при воздействии на него плазмина.
Концентрация D-димера пропорциональна активности
фибринолиза (количеству лизируемого фибрина).
Методы определения:
Одностадийный ИФА.
Специфичность анализа обеспечивается использованием
моноклональных антител, обладающих высокой специфичностью к Dдимеру.
Нормальная концентрация D-димера в крови 0 - 250 нг/мл.
38. Программа по профилактике и лечению лиц ГПР по ЖДА (из рекомендаций ценрта по Контролю заболеваемости США, 1998)
Дети грудного (0-12 мес.) и младшего (1-5 лет) возраста:Грудное вскармливание или питательные смеси обогащенные Fe;
прикорм в виде фруктов, овощей и соков по достижению 6-месячного
возраста;
Обследование для выявление анемии каждые 6 месяцев.
Дети младшего школьного возраста (5-12 лет) и мальчики-подростки (1218 лет):
Обследование детей с ЖДА или недостаточным потреблением Fe в
анамнезе;
Девочки-подростки (12-18 лет) и женщины детородного возраста вне
периода беременности:
Потребление богатой Fe пищи и продуктов, усиливающих его всасывание;
Обследование каждые 5-10 лет на протяжении всего детородного периода;
39.
Период беременности:Назначение пероральных препаратов Fe при первом посещении женской
консультации;
Обследование на анемию при первом посещении женской консультации;
При уровне Hg < 90 г/л обеспечить последующее наблюдение;
Послеродовой период:
Факторы риска включают длительную анемию, большую кровопотерю и
многоплодную беременность;
Мужчины старше 18 лет и женщины в постменопаузе:
Плановое обследование не показано.
40. Группы особого риска по ЖДА
o беременных и кормящих грудью - до 70-80%;o дети в возрасте до 1 года - до 45%.
41. Fe -содержащие белки и их функции в организме
o транспорт O2 и СО2- (гемоглобин, миоглобин);o окислительно-восстановительные реакции (цитохромы,
пероксидаза, каталаза);
o транспорт и депонирование железа (трансферрин,
ферритин, гемосидерин)
42.
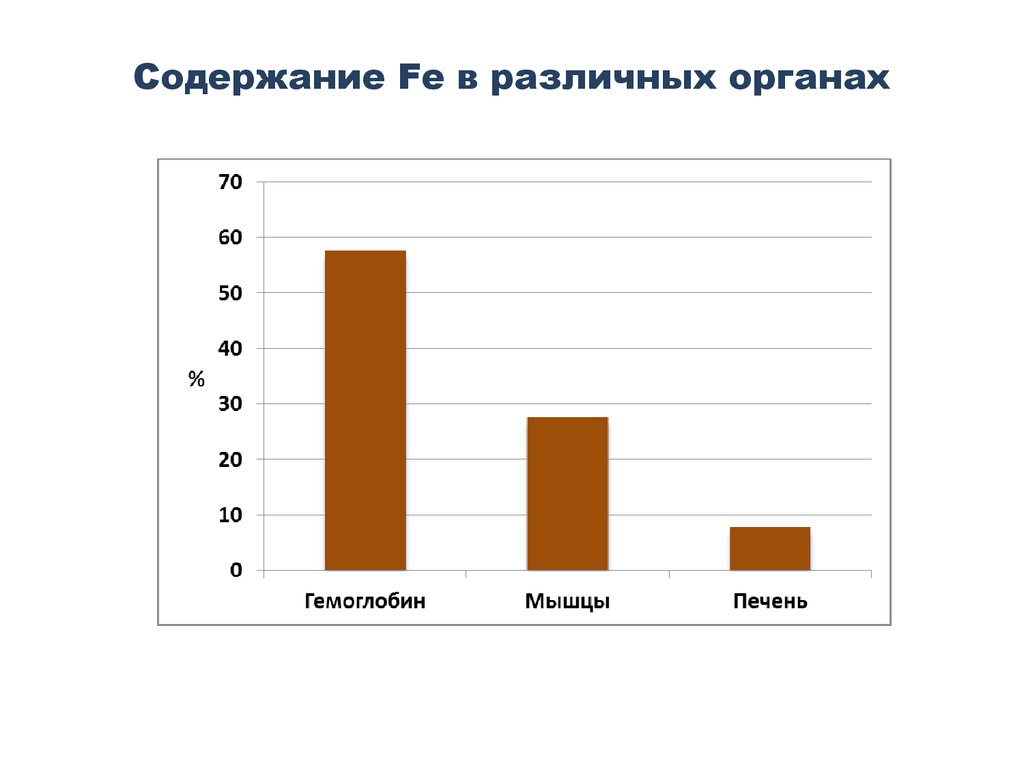
Содержание Fe в белках организма28-31 мг/кг – в составе Hg;
4-5 мг/кг – в составе миоглобина;
12 мг/кг – ферритина и гемосидерина;
Остальное – в составе гемсодержащих и др. ферментов.
43. Содержание Fe в различных органах
44.
o Трансферрин – транспортный белок (88 кДа), синтезируется впечени, молекула содержит два центра связывания (2 атома Fe2+).
Биологическая роль – связывает и переносит Fe в эритрокариоциты
костного мозга или в органы-депо Fe (печень и т.д.)
o Ферритин – высокомолекулярный водорастворимый белок (500 кДа),
содержит 20% Fe3+. Содержится практически во всех клетках
организма, в большей степени - в селезенке, печени, костном мозге.
Биологическая роль – депо Fe.
o Гемосидерин - небелковый комплекс нерастворимым в H2O и очень
богатый Fe (37%). Содержится главным образом в макрофагах РЭС
печени и селезенки.
Биологическая роль – изучена недостаточно.
45. БАЛАНС Fe в организме определяется:
1) Поступлением железа в организм с продуктамипитания;
2) Всасыванием железа в органах ЖКТ;
3) Эритропоэзом;
4) Депонированием железа;
5) Потерями железа.
46. Выделение (потери) Fe из организма
• из ЖКТ (кал, желчь, слущивающийся эпителий кишки) 0,6-0,7 мг/сутки;• через почки - до 0,1 мг/сутки;
• менструации у женщин - от 0,6-1,2 мг до 2,5 мг
железа /сутки. Всего за цикл 2 - 79 мг;
• выделение через кожу (пот) - 0,2-0,3 мг/сутки
Нерегулярные потери - беременность и лактация.
47. Лабораторные показатели, характеризующие обмен Fe
o Сывороточное Fe;o ОЖСС (общая Fe-связывающая способность сыворотки)
- максимальное количество Fe, которое может
присоединить трансферрин (TRF);
o коэффициент насыщения TRF = сыв. Fe/ ОЖСС;
o Концентрация ферритина;
o Концентрация трансферрина.
48. Снижение уровня сывороточного Fe
При железодефицитной анемии (ЖДА);при анемиях, связанных с воспалением, острыми
инфекциями;
при заболеваниях органов ЖКТ;
• Опухолях;
• Инфаркте миокарда
49. Критерии ВОЗ для диагностики анемии
Эритроциты <4,0 x109/л,Hg <130,0 г/л,
гематокрит <39%.
Эритроциты <3,8 x109/л,
Hg <120,0 г/л,
гематокрит <36%.
50. Железодефицитная анемия (ЖДА)
– это анемии, обусловленные нарушением синтеза Hb исоответственно снижением его количества в единице
объема крови.
Непосредственной причиной является дефицит Fe в
организме.
51. Причины железодефицитной анемии
Кровопотери (различного происхождения)Врожденный дефицит белка трансферрина;
Анемия у детей
Донорство
Нарушение всасывания железа (хронический энтерит,
резекция 12-перстной кишки и желудка)
52. Группы особого риска по ЖДА
o беременных и кормящих грудью - до 70-80%;o дети в возрасте до 1 года - до 45%.
53. Стадии формирования ЖДА
I. стадия - скрытый (латентный) дефицитжелеза;
II. стадия проявлений ЖДА (синдром
анемии).
54. I стадия ЖДА. Лабораторные показатели на стадии латентного дефицита Fe 1.Общий анализ крови (ОАК)
I стадия ЖДА. Лабораторные показатели на стадиилатентного дефицита Fe
Hb>120 г/л
1.Общий анализ крови (ОАК)
RBC, MCV, MCH, MCHC, RDW – НОРМА
2. Обмен железа:
СЫВОРОТОЧНОЕ ЖЕЛЕЗО - НОРМА ИЛИ СНИЖЕНО,
ТРАНСФЕРРИН - НОРМА
ФЕРРИТИН – СНИЖЕН
55. II стадия ЖДА. Лабораторные показатели на стадии клинических проявлений ЖДА
ОАК:Hb (гемоглобин) - < 120 г/л
RBC (эритроциты) - норма или снижены;
MCV (средний объем эритроцитов) - менее 80 fl;
MCH - менее 26 пг;
MCHC - менее 320 г/л;
RDW - > нормы. Норма 11,5-14,5%.
56. Диагностика ЖДА по эритроцитарным индексам
RDWMCV- средний объем эритроцита;
MCH - cреднее содержание Hg в отдельном эритроците (концентрация
гемоглобина / число эритроцитов);
MCHC – средняя концентрация гемоглобина в эритроците
(концентрация гемоглобина/гематокрит);
RDW - колебания объема клеток (коэффициент вариации среднего
объема эритроцитов).
57. ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА (БИОХИМИЧЕСКИЕ)
o Уровень сывороточного Fe - снижен;o Уровень ферритина – резко снижен;
o ОЖСС - повышена;
o Коэффициент насыщения трансферрина - снижен
















































 Медицина
Медицина Биология
Биология