Похожие презентации:
Азотсодержащие органические соединения
1. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
амины,аминоспирты,
амиды
2. Амины
- органические соединения, содержащиев своём составе аминогруппу –NH2 или
замещённую аминогруппу (-NHR или
NR2)
- производные аммиака, в котором один
или несколько атомов водорода
замещены углеводородными
радикалами
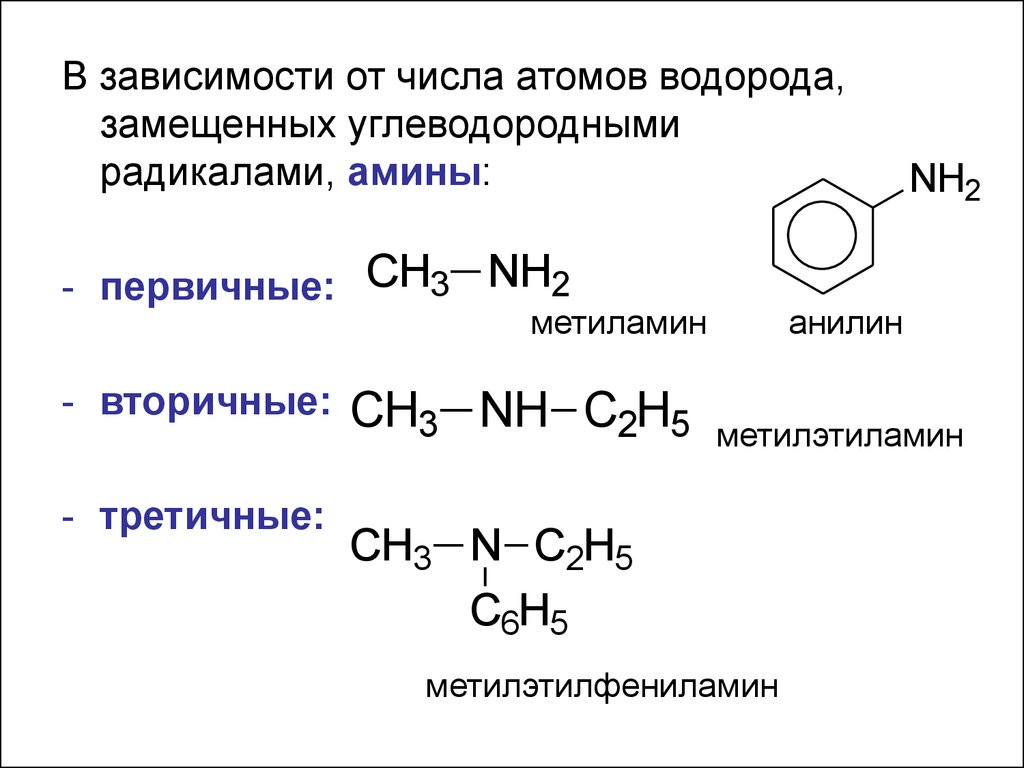
3.
В зависимости от числа атомов водорода,замещенных углеводородными
радикалами, амины:
- первичные: CH3 NH2
метиламин
- вторичные:
- третичные:
CH3 NH C2H5
NH2
анилин
метилэтиламин
CH3 N C2H5
C6H5
метилэтилфениламин
4.
CH3 CH CH3NH2
2-аминопропан
CH3 CH CH CH3
NH2 NH2
2,3-диаминобутан
изомерия:
- углеродного скелета
- положения аминогруппы
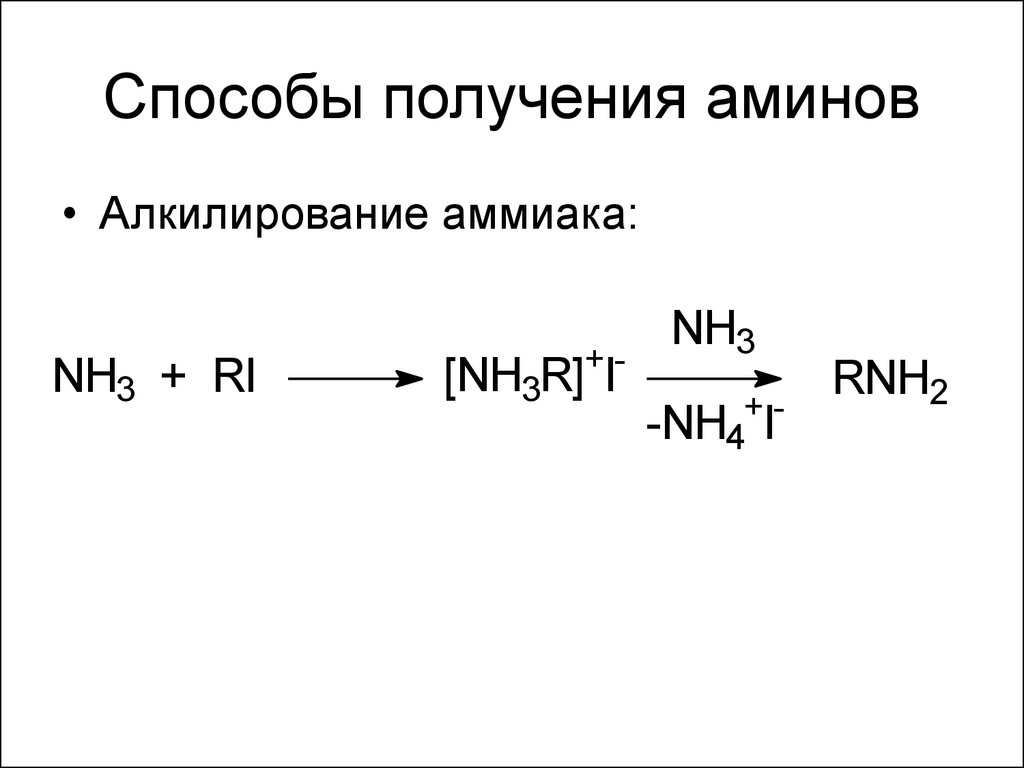
5. Способы получения аминов
• Алкилирование аммиака:NH3 + RI
[NH3R]+I-
NH3
+-NH4 I
RNH2
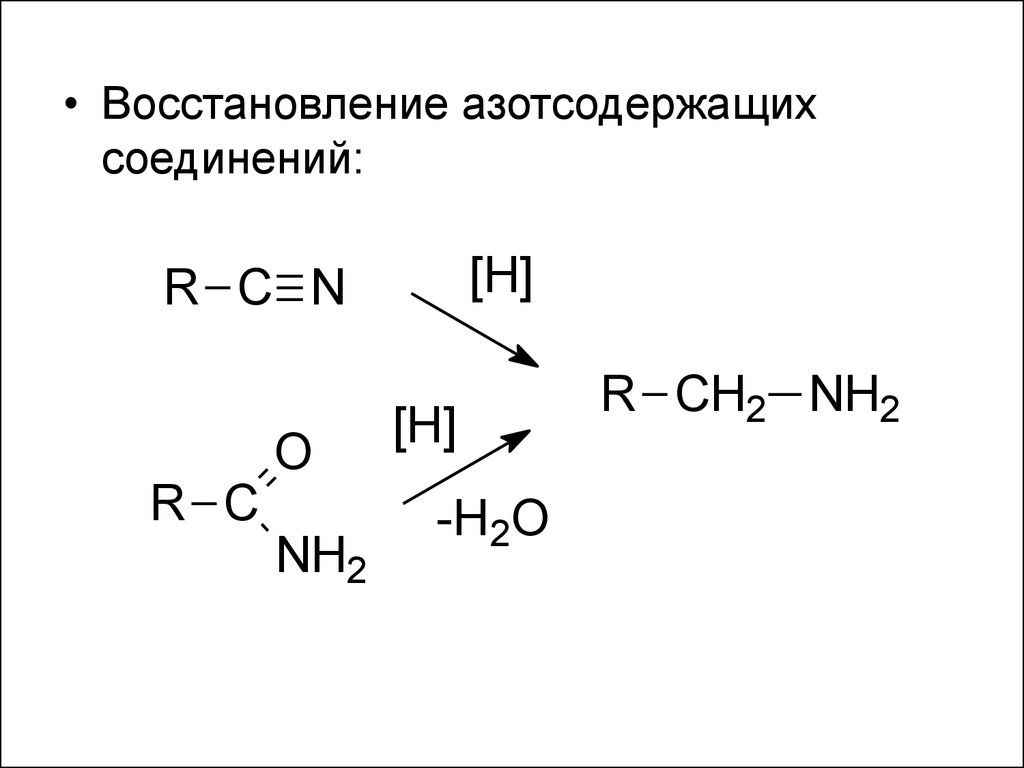
6.
• Восстановление азотсодержащихсоединений:
[H]
R C N
O
R C
NH2
[H]
-H2O
R CH2 NH2
7.
• Расщепление амидов кислотгипобромитами:
O
R C
+ NaOBr
RNH2 + CO2 + NaBr
NH2
• Биогенные амины образуются путём
декарбоксилирования -аминокислот
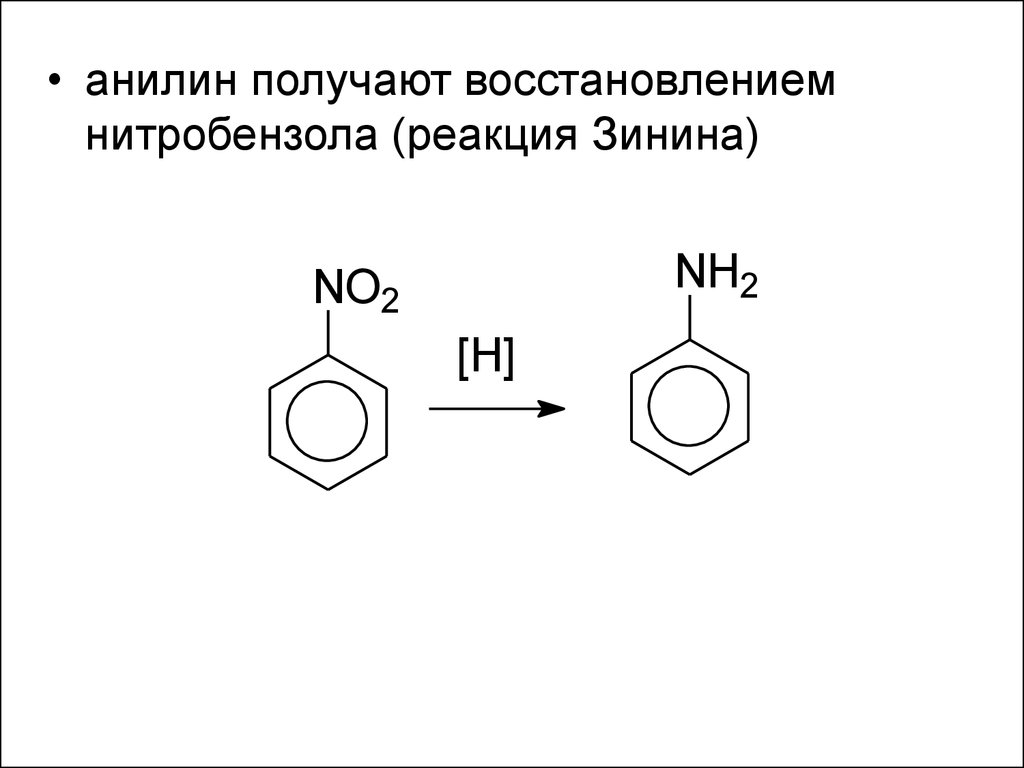
8.
• анилин получают восстановлениемнитробензола (реакция Зинина)
NH2
NO2
[H]
9.
(CH3)3NNH2
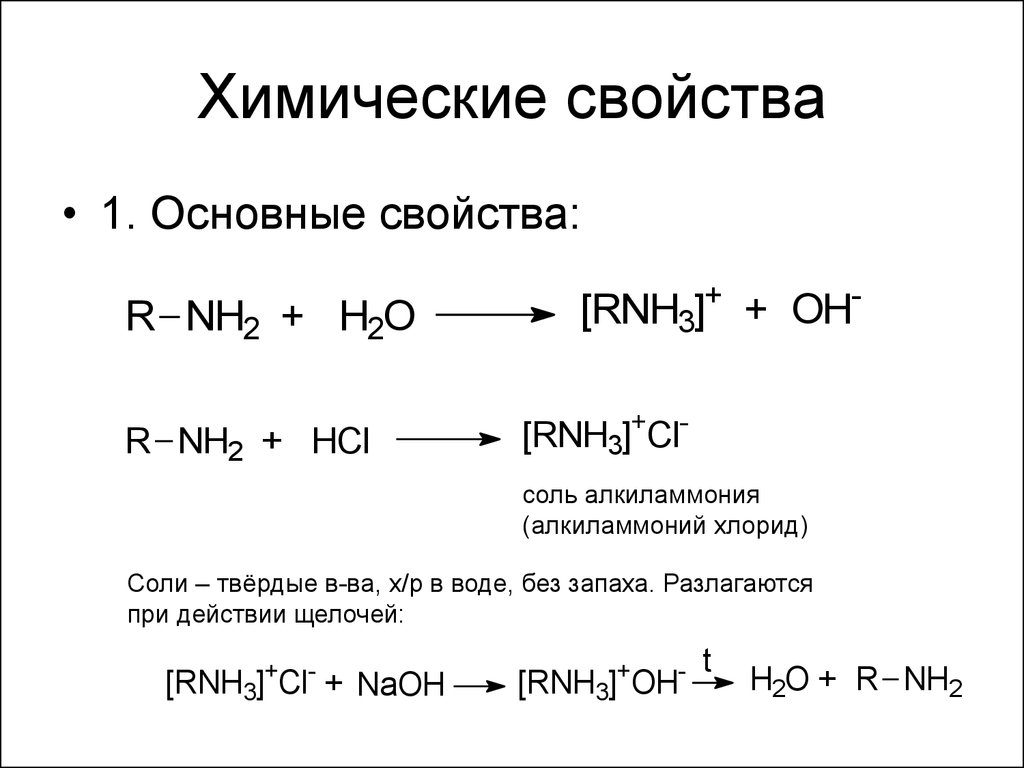
10. Химические свойства
• 1. Основные свойства:R NH2 + H2O
R NH2 + HCl
[RNH3]+ + OH[RNH3]+Clсоль алкиламмония
(алкиламмоний хлорид)
Соли – твёрдые в-ва, х/р в воде, без запаха. Разлагаются
при действии щелочей:
[RNH3]+Cl- + NaOH
[RNH3]+OH-
t
H2O + R NH2
11.
• Амины жирного ряда обладают болеевыраженными основными свойствами,
чем аммиак.
• У аминов ароматического ряда
основные свойства слабые.
Наличие основных свойств
доказывается реакцией образования
солей при взаимодействии с кислотами:
C6H5NH2 + HCl
[C6H5NH3]+Clсолянокислый анилин
12.
• 2. Взаимодействие с азотистойкислотой
проходит с образованием различных
продуктов для аминов разного строения.
Это качественная реакция, позволяющая
различить первичный, вторичный,
третичный амины.
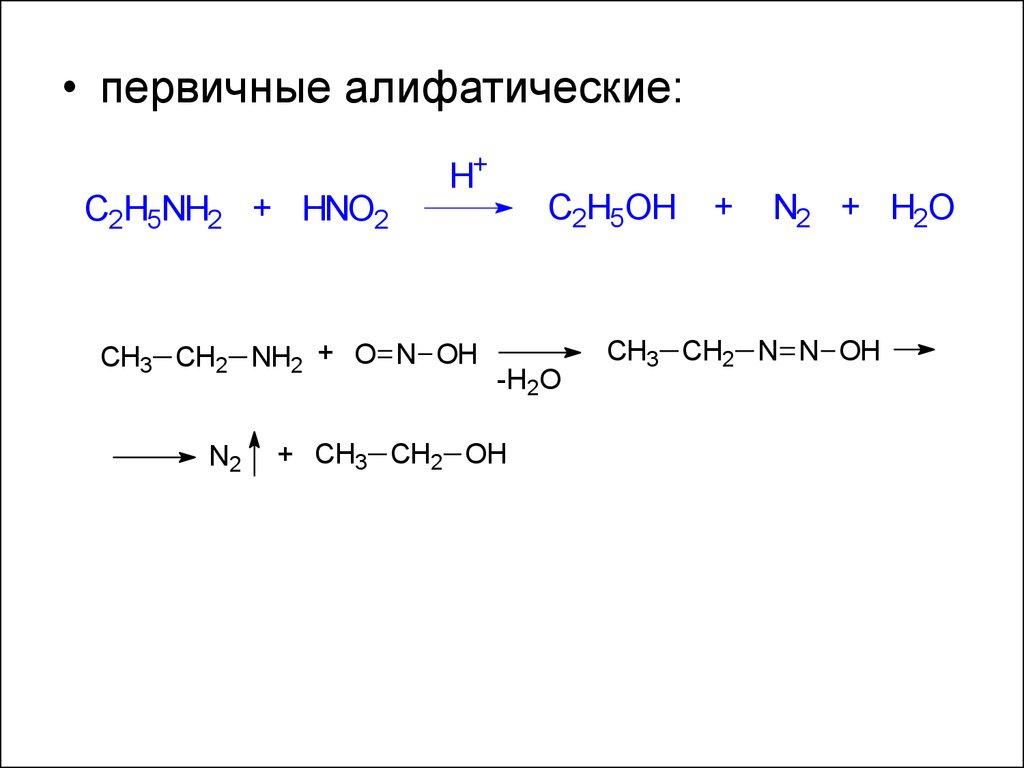
13.
• первичные алифатические:C2H5NH2 + HNO2
H+
CH3 CH2 NH2 + O N OH
N2
C2H5OH
-H2O
+ CH3 CH2 OH
+
N2 + H2O
CH3 CH2 N N OH
14.
• вторичные алифатические:CH3 NH CH3 +
HONO
-H2O
CH3 N CH3
N O
нитрозосоединение
15.
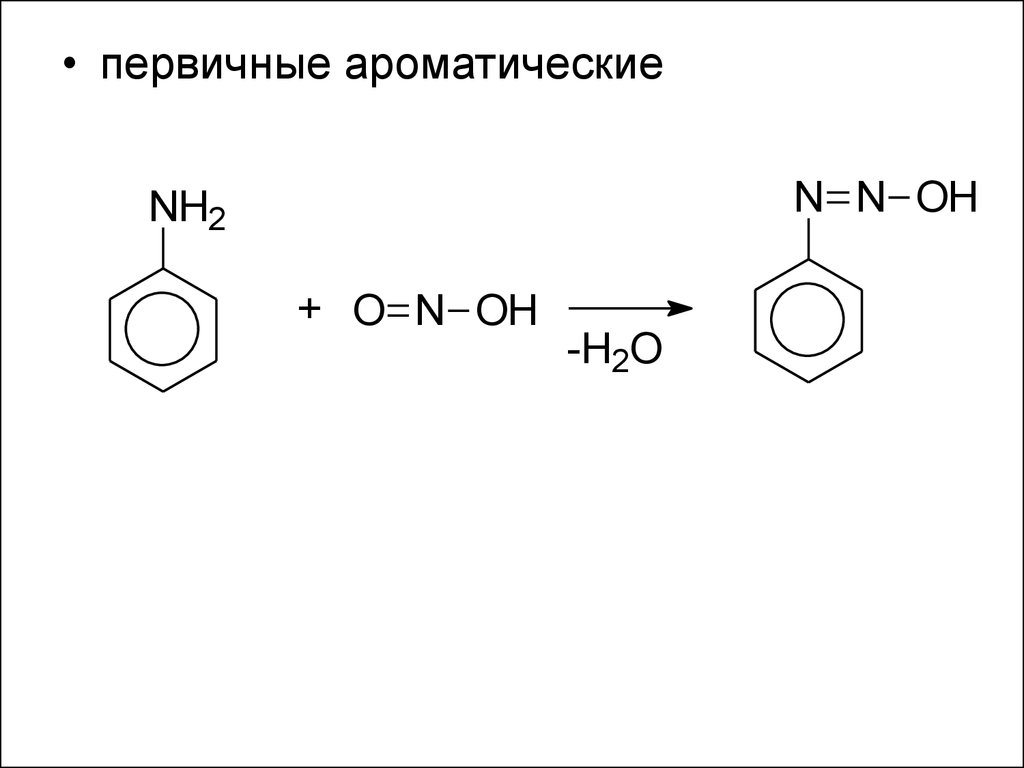
• первичные ароматическиеN N OH
NH2
+ O N OH
-H2O
16.
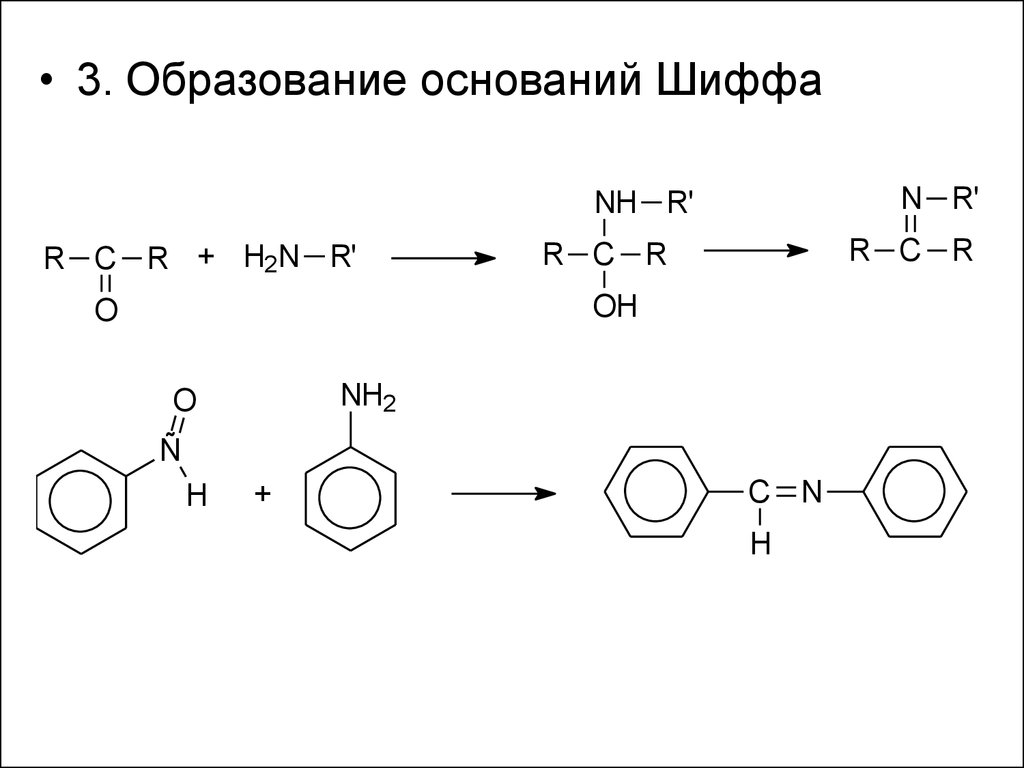
• 3. Образование оснований ШиффаN R'
NH R'
R C R + H2N R'
R C R
R C R
OH
O
NH2
O
Ñ
H
+
C N
H
17.
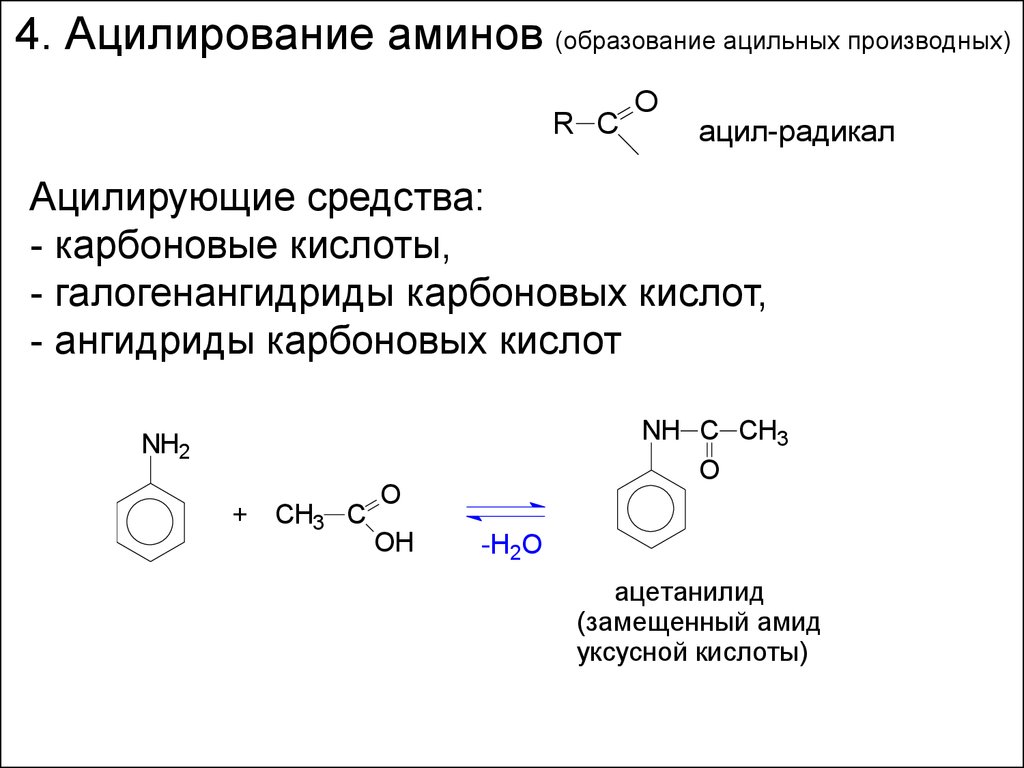
4. Ацилирование аминов (образование ацильных производных)R C
O
ацил-радикал
Ацилирующие средства:
- карбоновые кислоты,
- галогенангидриды карбоновых кислот,
- ангидриды карбоновых кислот
NH C CH3
O
NH2
+ CH3 C
O
OH
-H2O
ацетанилид
(замещенный амид
уксусной кислоты)
18.
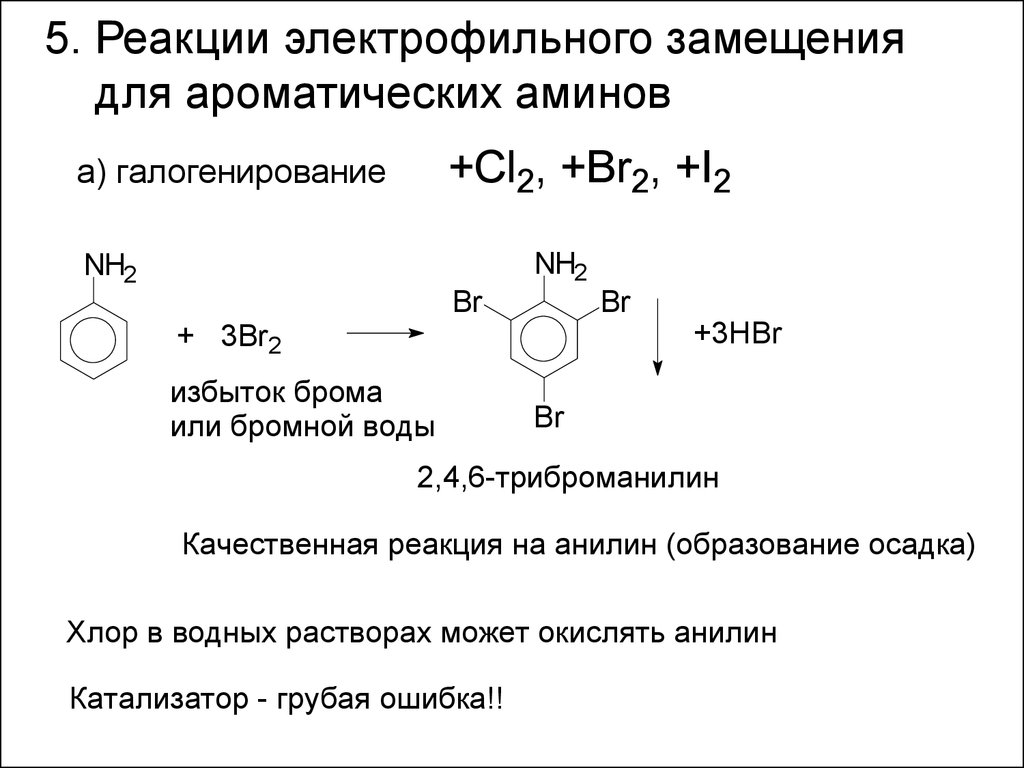
5. Реакции электрофильного замещениядля ароматических аминов
+Cl2, +Br2, +I2
а) галогенирование
NH2
Br
NH2
+ 3Br2
избыток брома
или бромной воды
Br
+3HBr
Br
2,4,6-триброманилин
Качественная реакция на анилин (образование осадка)
Хлор в водных растворах может окислять анилин
Катализатор - грубая ошибка!!
19.
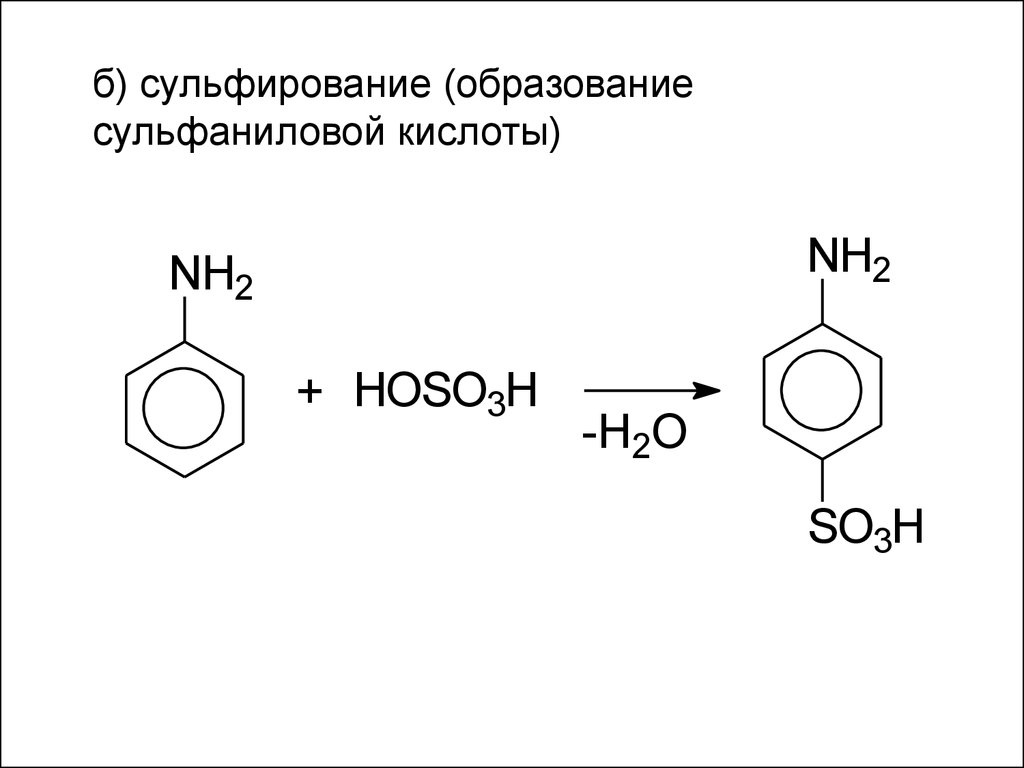
б) сульфирование (образованиесульфаниловой кислоты)
NH2
NH2
+ HOSO3H
-H2O
SO3H
20.
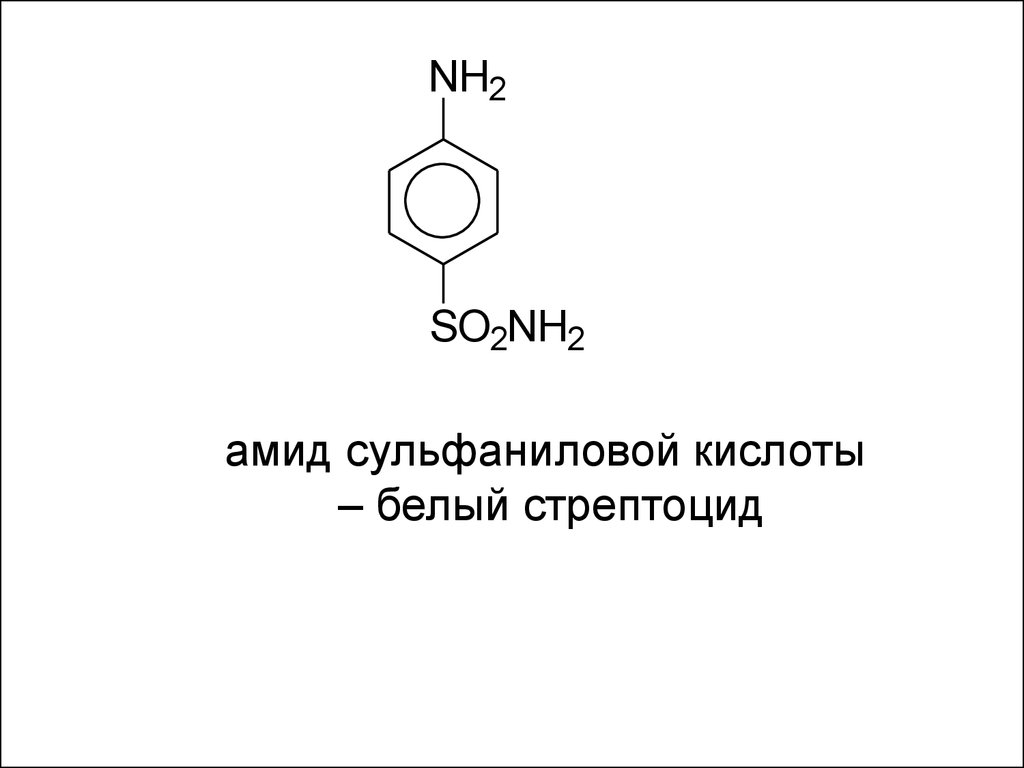
NH2SO2NH2
амид сульфаниловой кислоты
– белый стрептоцид
21.
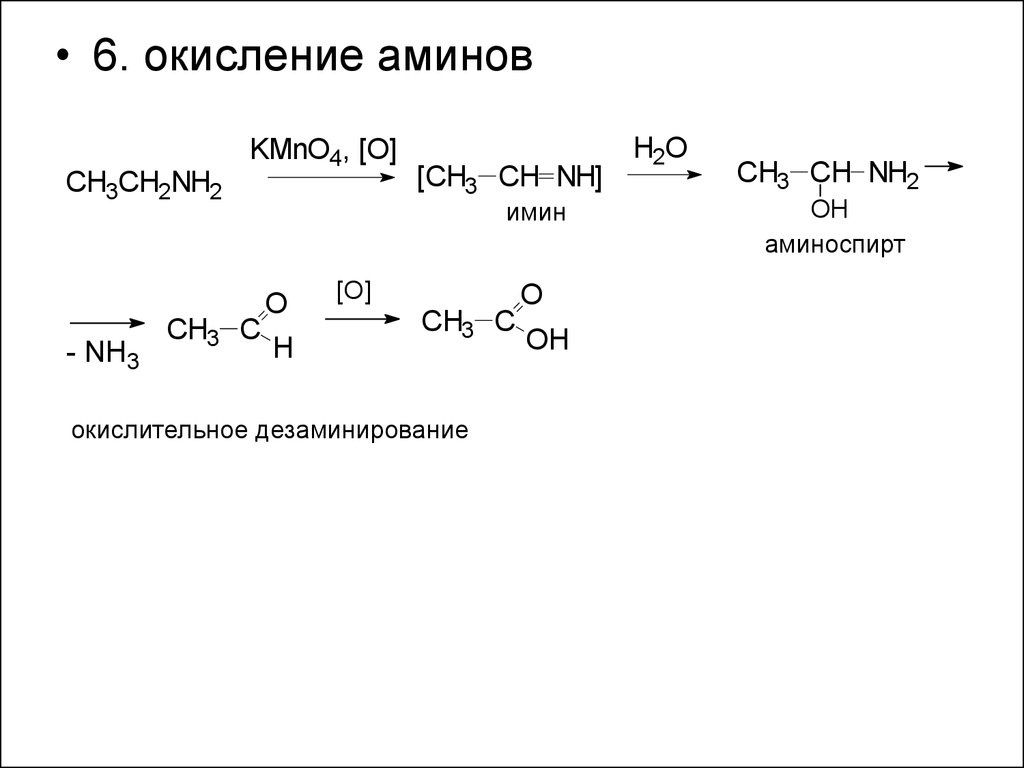
• 6. окисление аминовCH3CH2NH2
- NH3
KMnO4, [O]
CH3 C
[CH3 CH NH]
имин
O
H
[O]
CH3 C
окислительное дезаминирование
O
OH
H2O
CH3 CH NH2
OH
аминоспирт
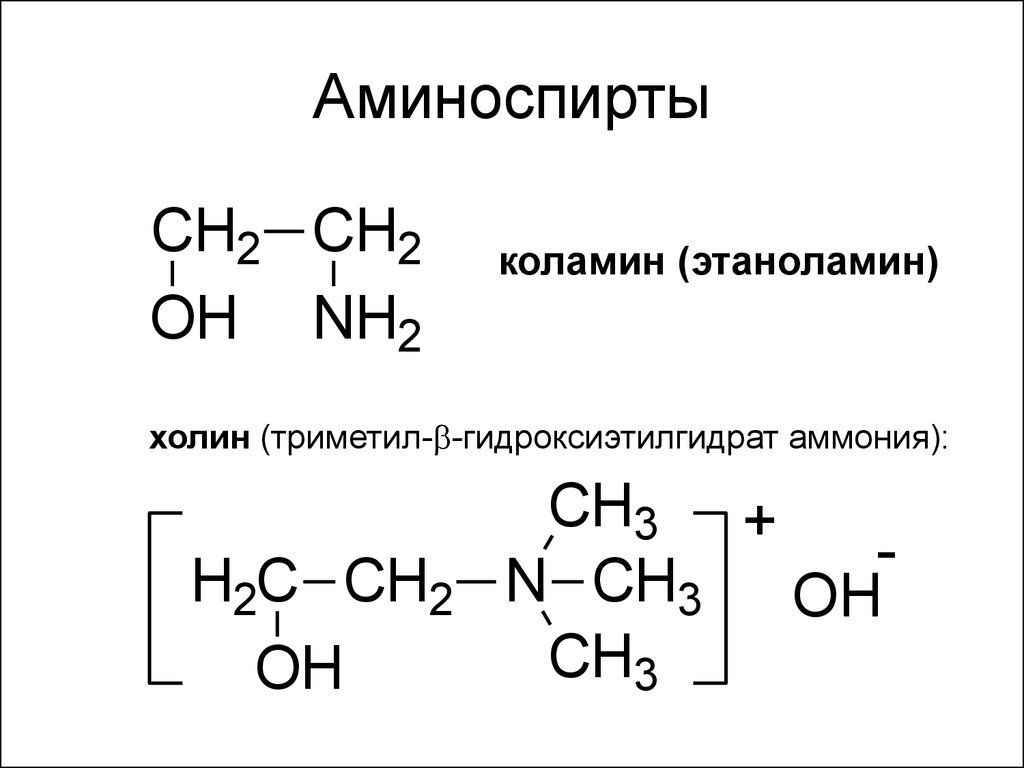
22. Аминоспирты
CH2 CH2OH NH2
коламин (этаноламин)
холин (триметил- -гидроксиэтилгидрат аммония):
H2C CH2
OH
CH3 +
N CH3 OH
CH3
23. Амиды кислот
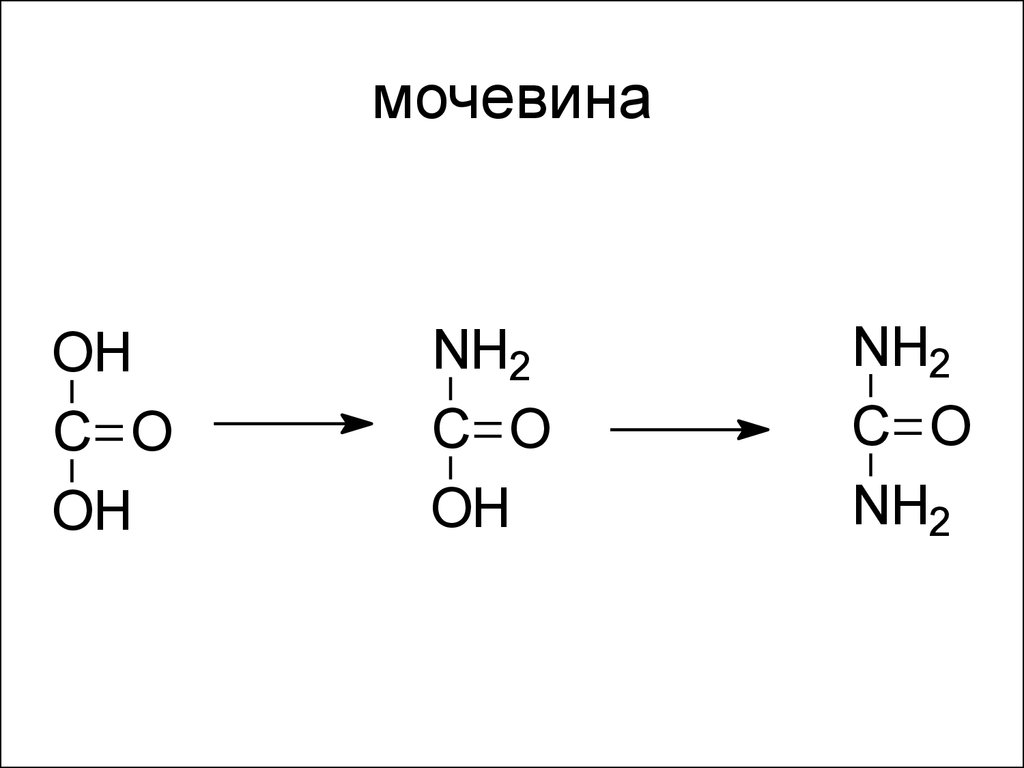
• См. лекцию по карбоновым кислотам24. мочевина
OHC O
OH
NH2
C O
OH
NH2
C O
NH2
25.
NH2C O
NH2
HCl
NH3Cl
C O
NH3Cl
26.
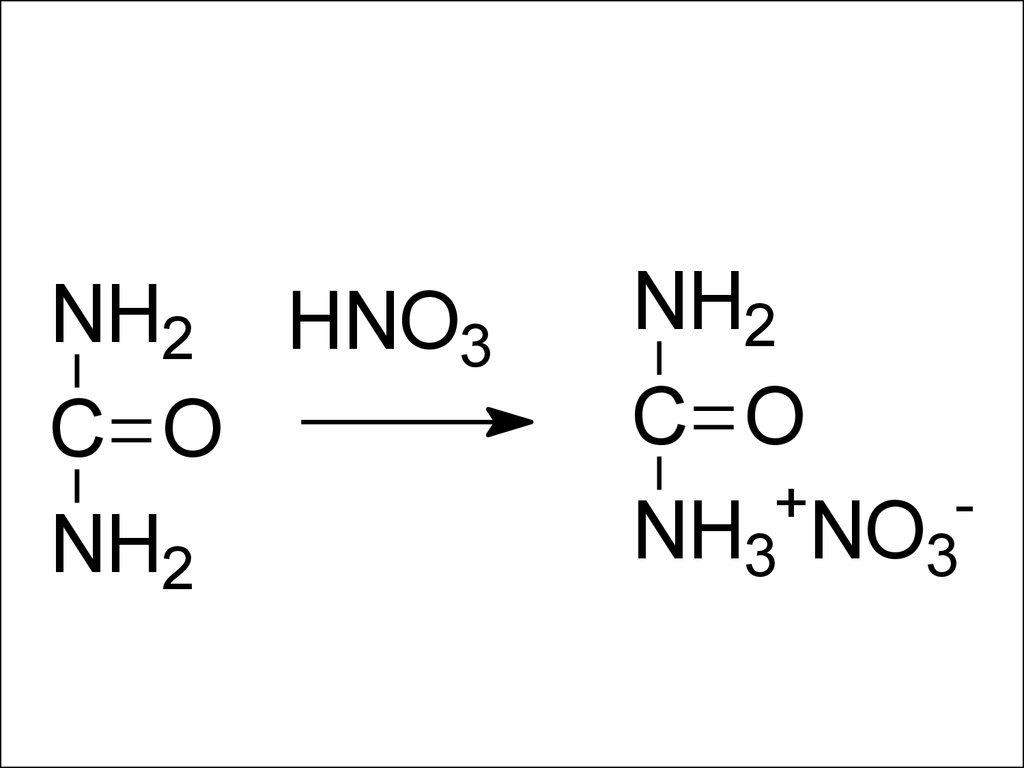
NH2 HNO3C O
NH2
NH2
C O
+
NH3 NO3
27.
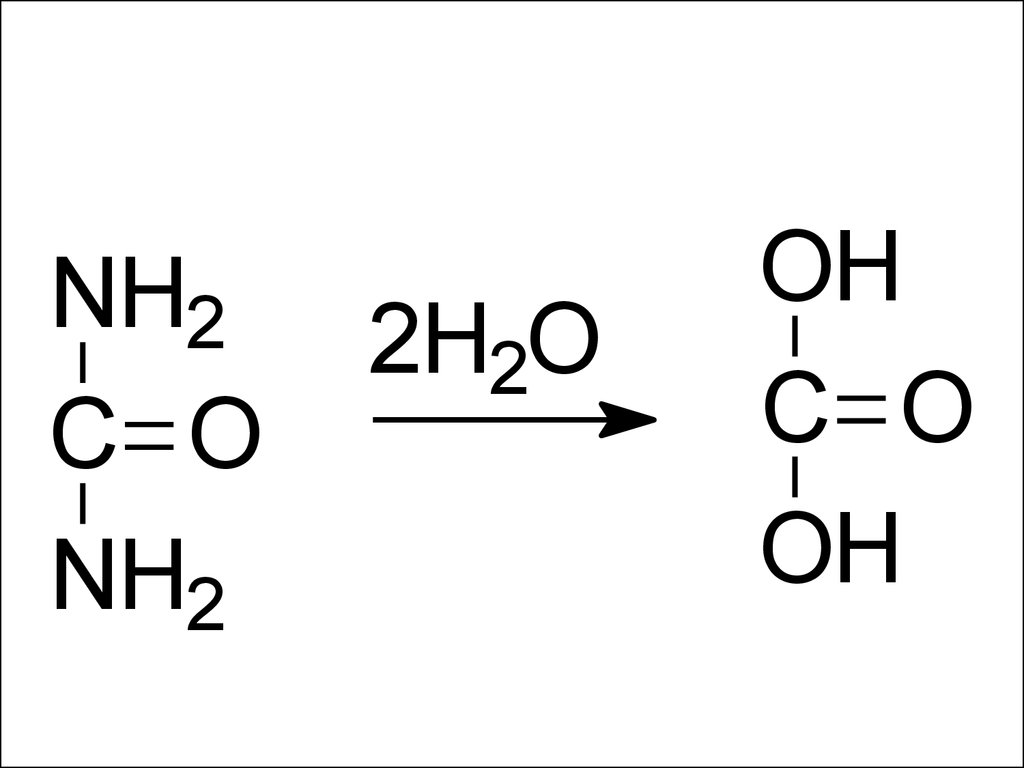
NH2C O
NH2
2H2O
OH
C O
OH
28.
NH2 2HNO2
C O
NH2
N N OH
C O
N N OH
NH2 3NaOBr
C O
NH2
OH
2N2 + C O + CO2
OH
3NaBr + CO2 + H2O + N2
29.
NH2 CH COOH3
C O
NH2
NH CH2 COOH
C O
NH2
30.
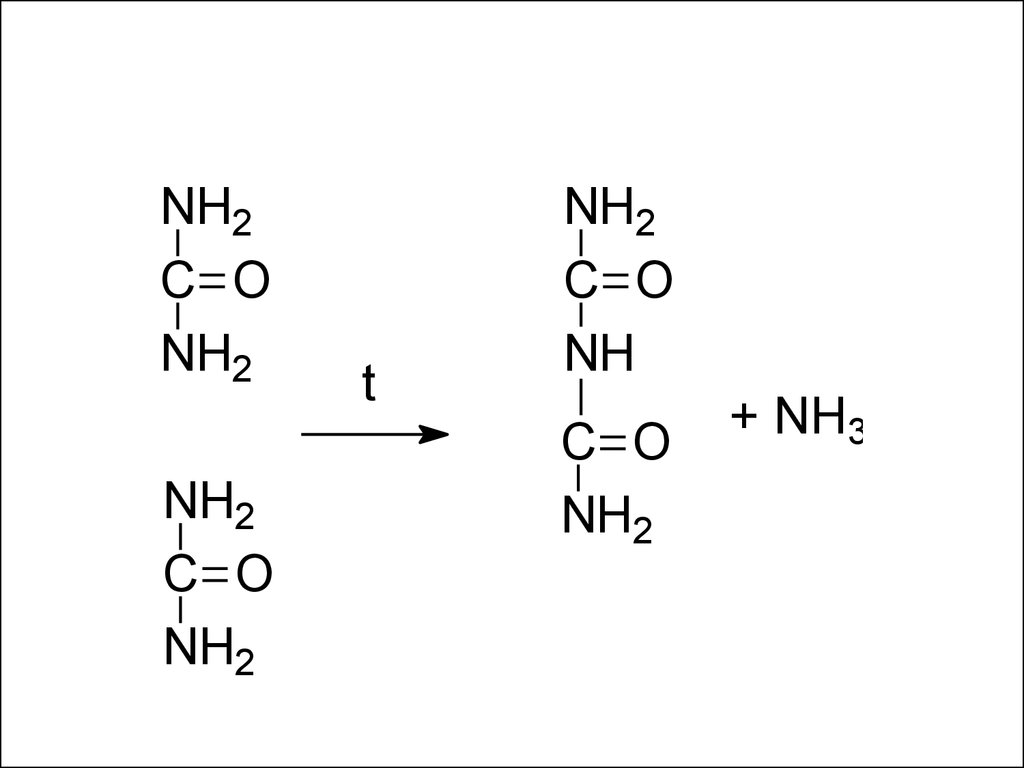
NH2C O
NH2
NH2
C O
NH2
t
NH2
C O
NH
C O
NH2
+ NH3
31. Гетероциклические соединения.
Гетероциклическими называютциклические органические соединения,
в состав цикла которых, помимо атомов
углерода, входят один или несколько
атомов других элементов
(гетероатомов).
32. Классификационные признаки:
природа гетероатома
число гетероатомов
размер цикла
степень насыщенности
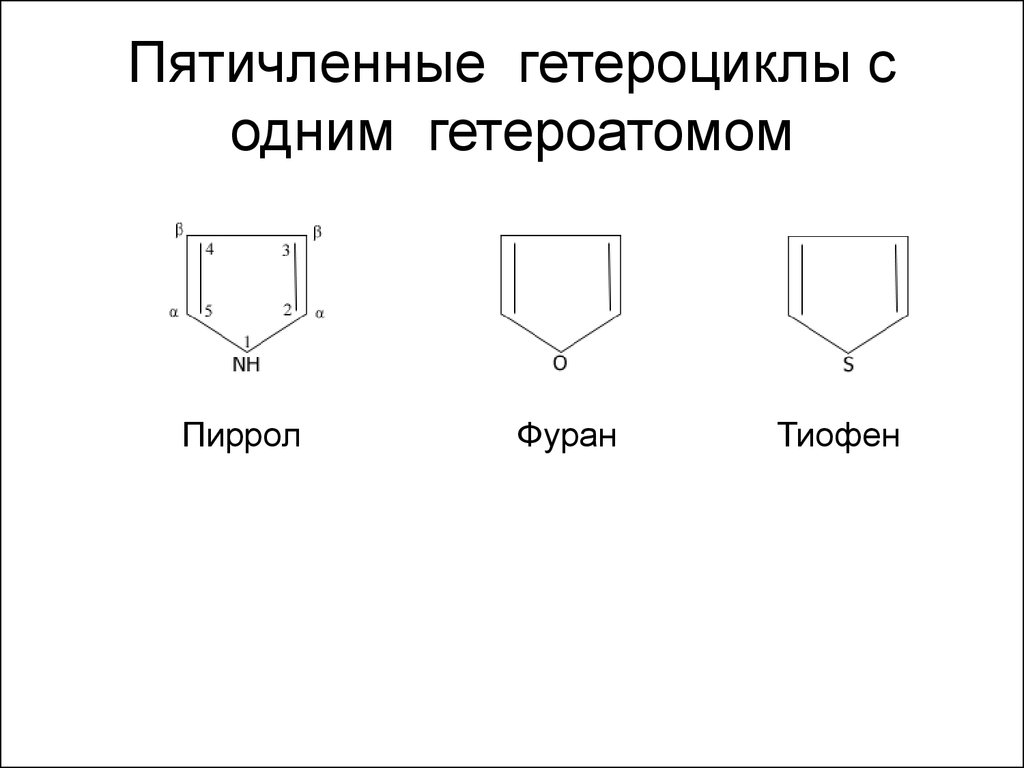
33. Пятичленные гетероциклы с одним гетероатомом
ПирролФуран
Тиофен
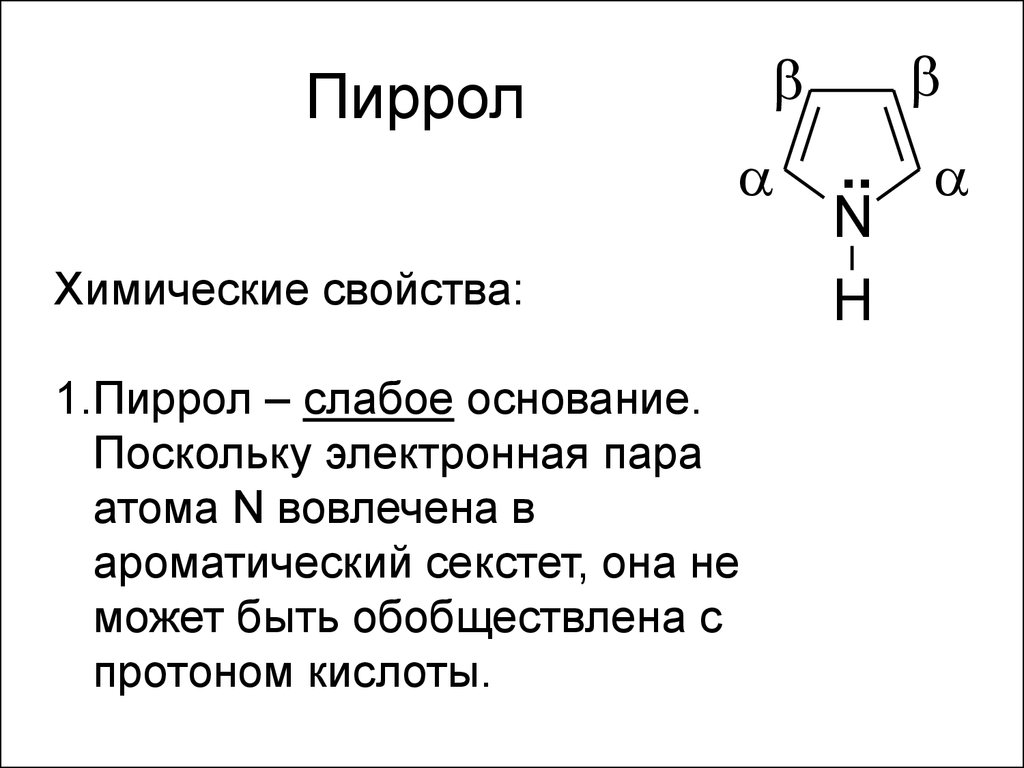
34. Пиррол
Химические свойства:1.Пиррол – слабое основание.
Поскольку электронная пара
атома N вовлечена в
ароматический секстет, она не
может быть обобществлена с
протоном кислоты.
..
N
H
35.
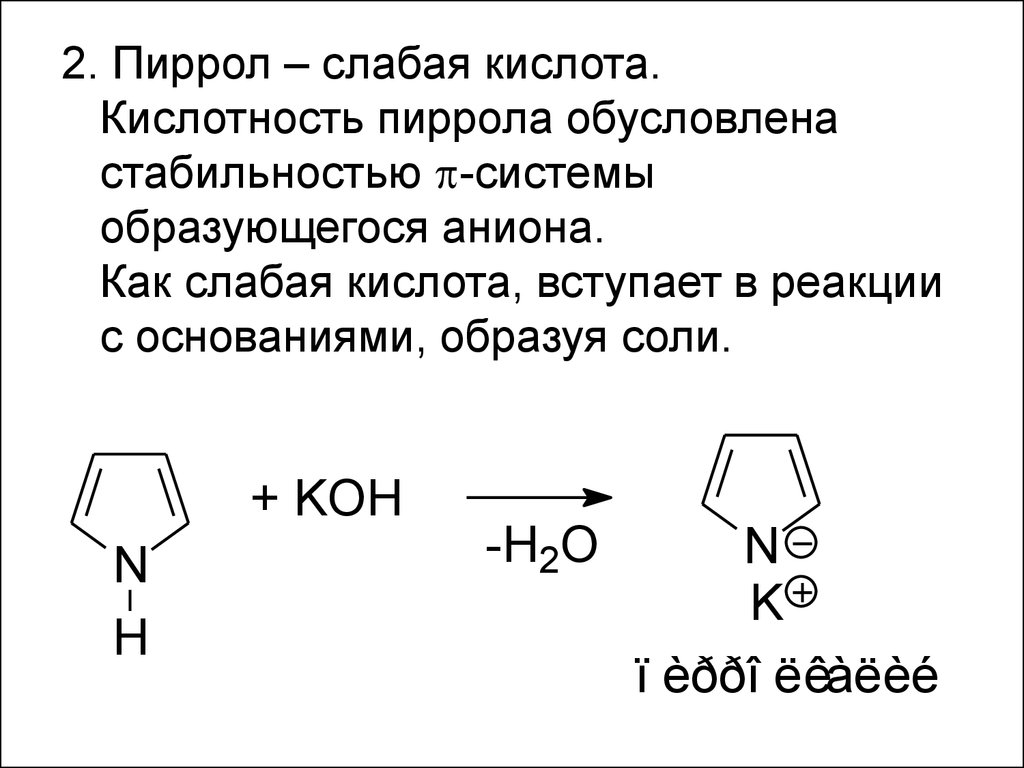
2. Пиррол – слабая кислота.Кислотность пиррола обусловлена
стабильностью -системы
образующегося аниона.
Как слабая кислота, вступает в реакции
с основаниями, образуя соли.
+ KOH
N
H
-H2O
N
K
ï èððî ëêàëèé
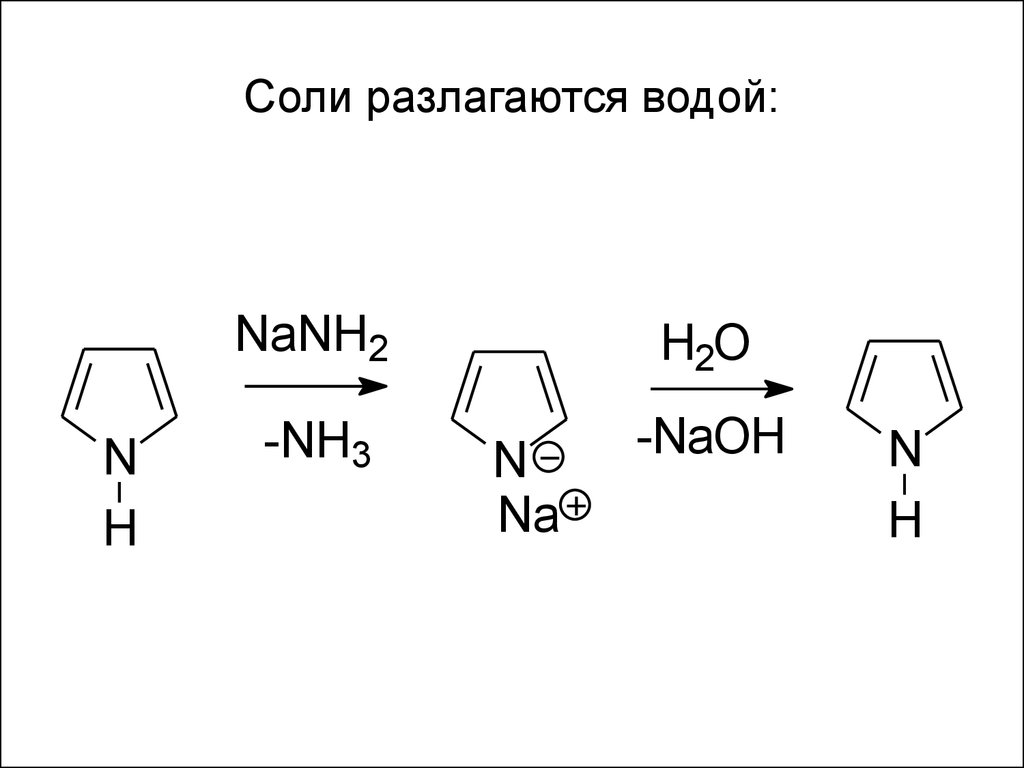
36. Соли разлагаются водой:
NH
NaNH2
H2O
-NH3
-NaOH
N
Na
N
H
37.
3. Пиррол является ацидофобнымсоединением (не выдерживает
присутствия кислот).
В присутствии кислот осмоляется:
+
H
n
N
H
+
N
H
H
n
38.
4. Пиррол, являясь типично ароматическимсоединением, вступает в реакции
электрофильного замещения. Причём
обладает высокой реакционной
способностью.
Наиболее реакционно способно -положение (гетероатом ЭД-заместитель).
39.
ì ÿãêèé í èòðóþ ù èé àãåí òN
H
(àöåòèëí èòðàò)
N
H
NO2
-í èòðî ï èððî ë
Py.SO3
N
H
ï èðèäèí ñóëüô î òðèî êñèä
N
H
SO3H
-ï èððî ëñóëüô î êèñëî òà
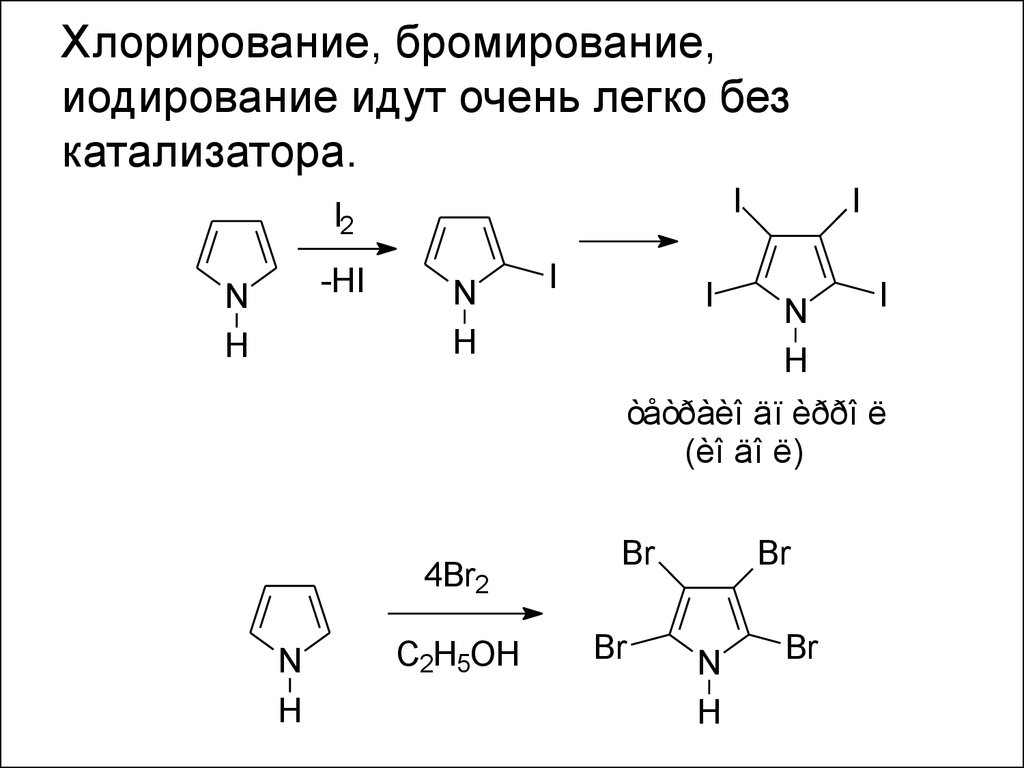
40. Хлорирование, бромирование, иодирование идут очень легко без катализатора.
II2
-HI
N
H
N
H
I
I
I
N
H
I
òåòðàèî äï èððî ë
(èî äî ë)
4Br2
N
H
C2H5OH
Br
Br
Br
N
H
Br
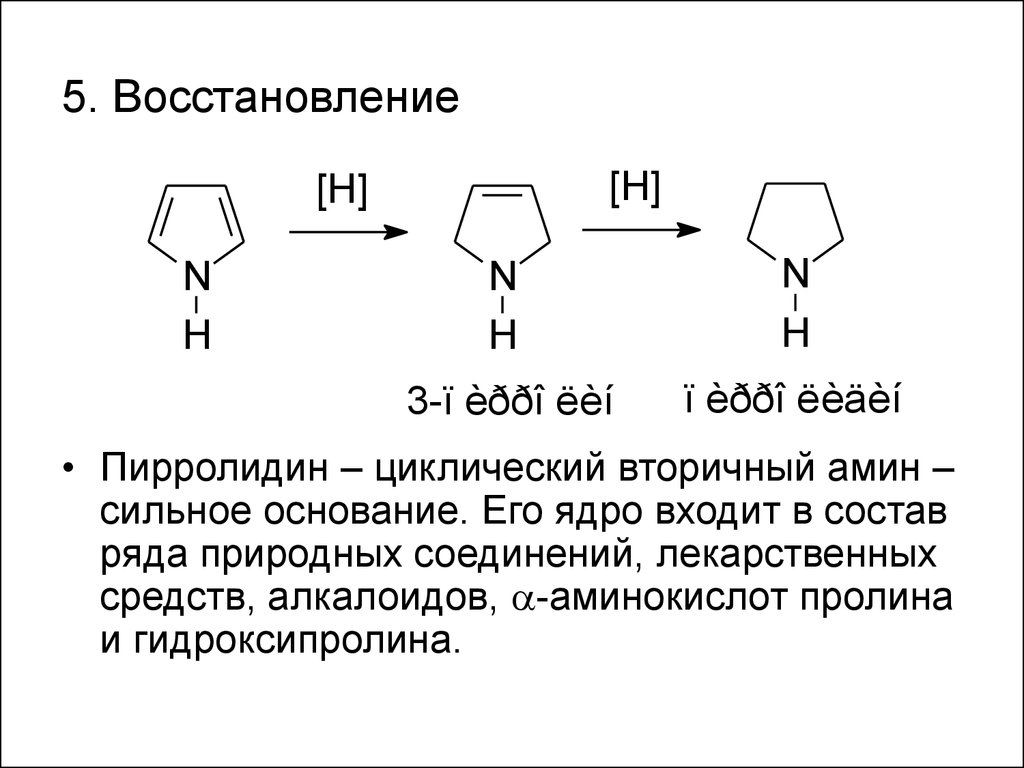
41. 5. Восстановление
[H][H]
N
H
N
H
N
H
3-ï èððî ëèí
ï èððî ëèäèí
• Пирролидин – циклический вторичный амин –
сильное основание. Его ядро входит в состав
ряда природных соединений, лекарственных
средств, алкалоидов, -аминокислот пролина
и гидроксипролина.
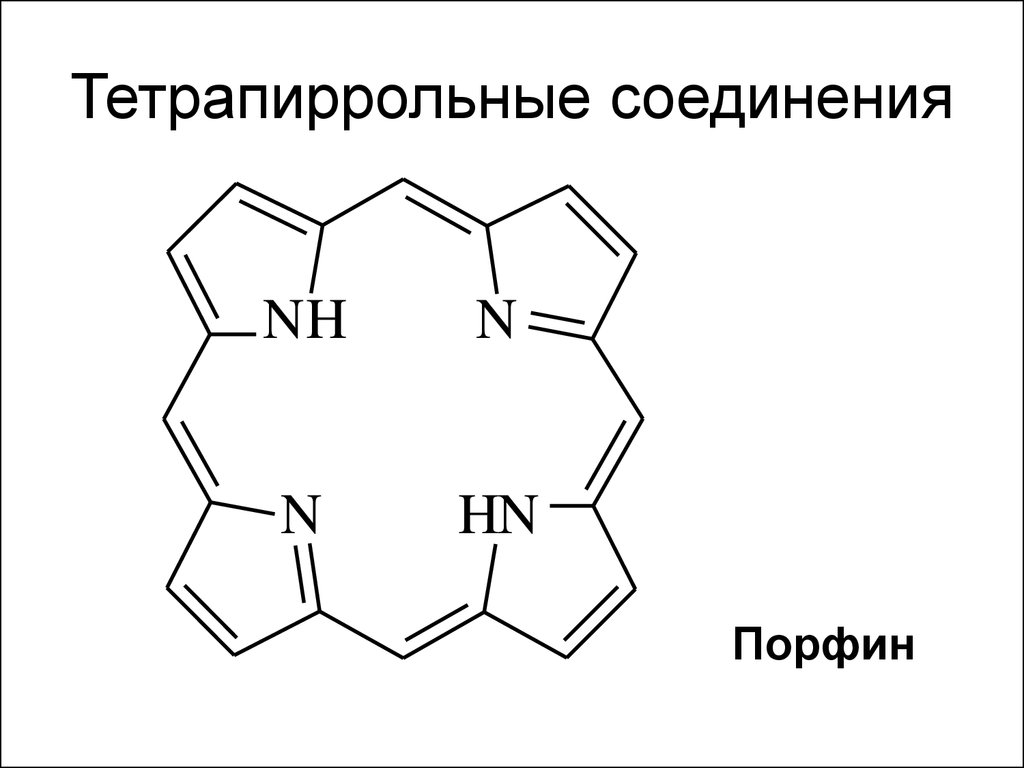
42. Тетрапиррольные соединения
NHN
N
HN
Порфин
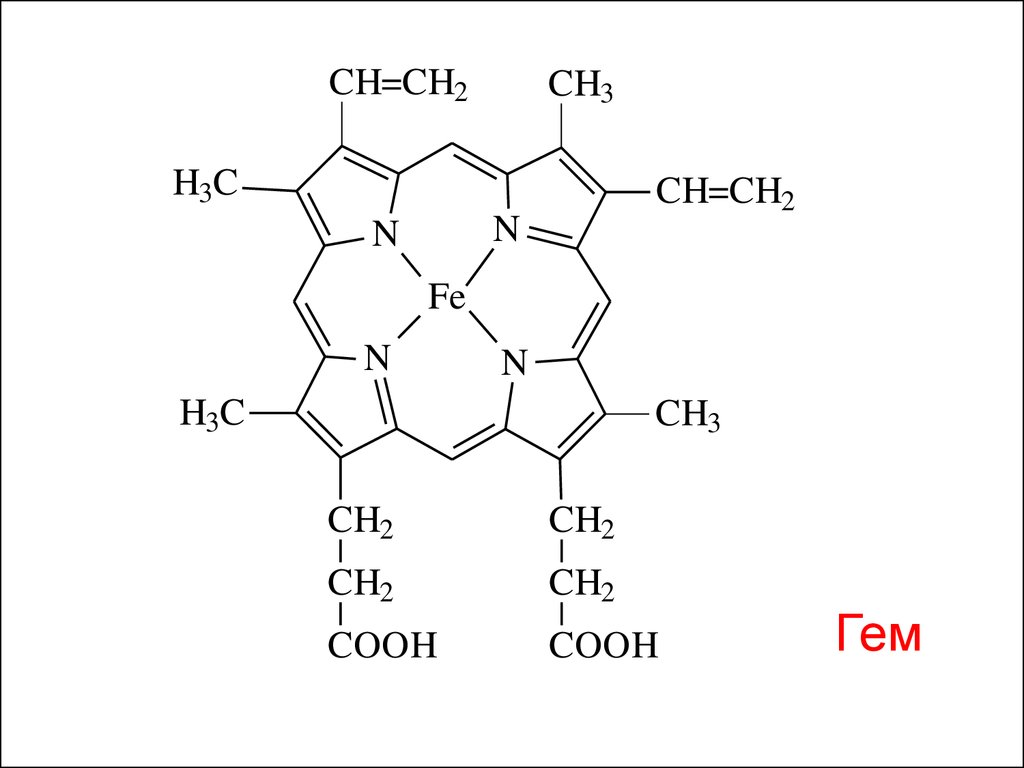
43.
CH=CH2CH3
H3C
CH=CH2
N
N
Fe
N
N
H3C
CH3
CH2
CH2
CH2
CH2
COOH
COOH
Гем
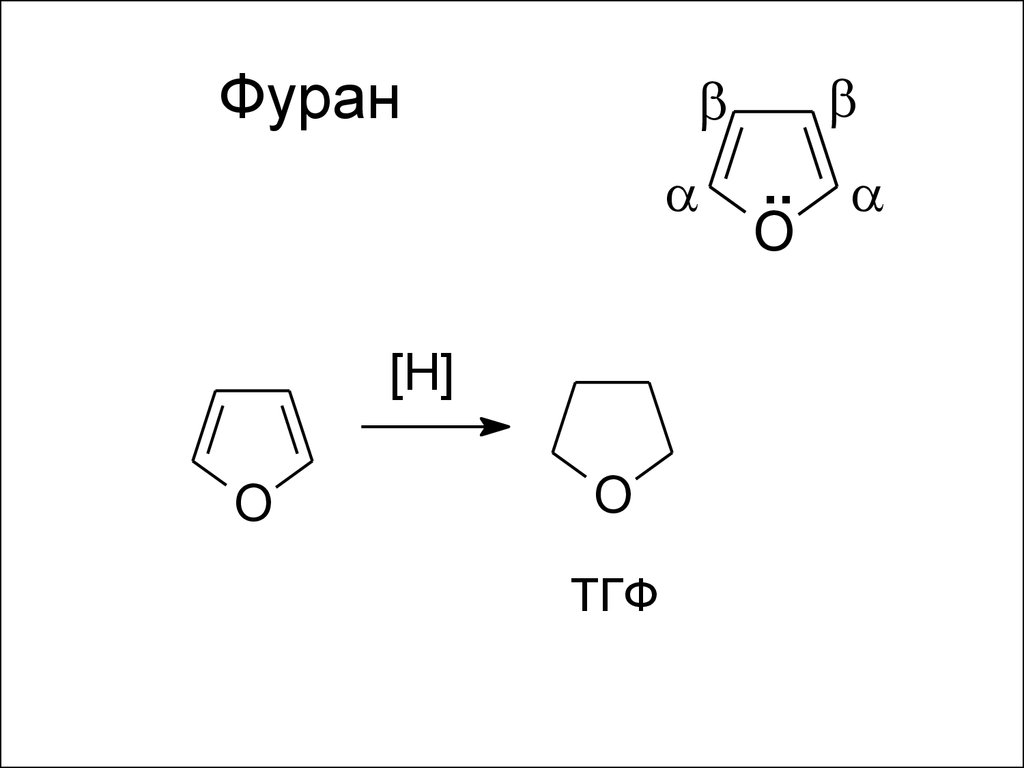
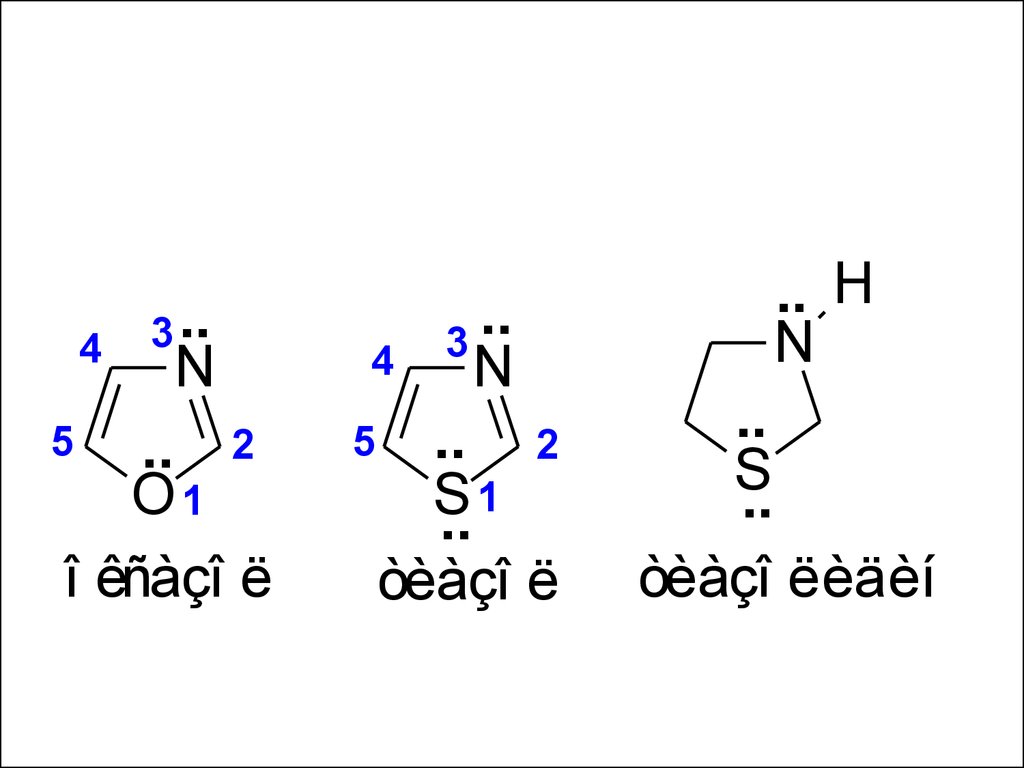
44. Фуран
[H]O
O
ТГФ
..
O
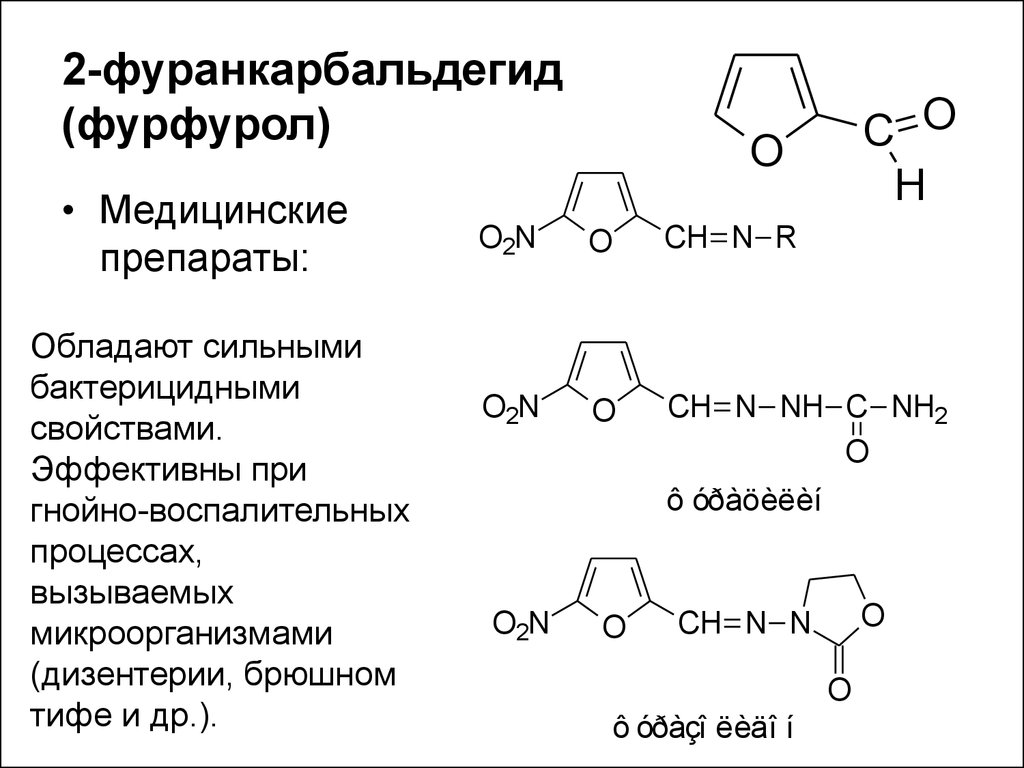
45. 2-фуранкарбальдегид (фурфурол)
• Медицинскиепрепараты:
Обладают сильными
бактерицидными
свойствами.
Эффективны при
гнойно-воспалительных
процессах,
вызываемых
микроорганизмами
(дизентерии, брюшном
тифе и др.).
C O
H
O
O2N
O
CH N R
O2N
O
CH N NH C NH2
O
ô óðàöèëèí
O2N
O
O
CH N N
O
ô óðàçî ëèäî í
46.
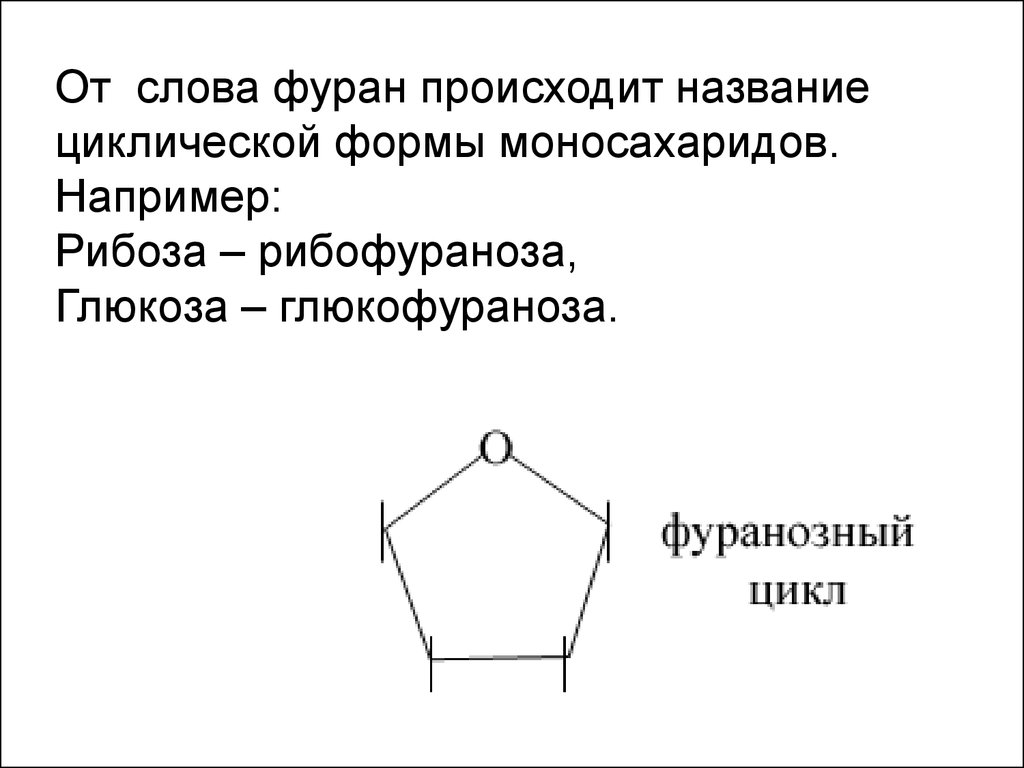
От слова фуран происходит названиециклической формы моносахаридов.
Например:
Рибоза – рибофураноза,
Глюкоза – глюкофураноза.
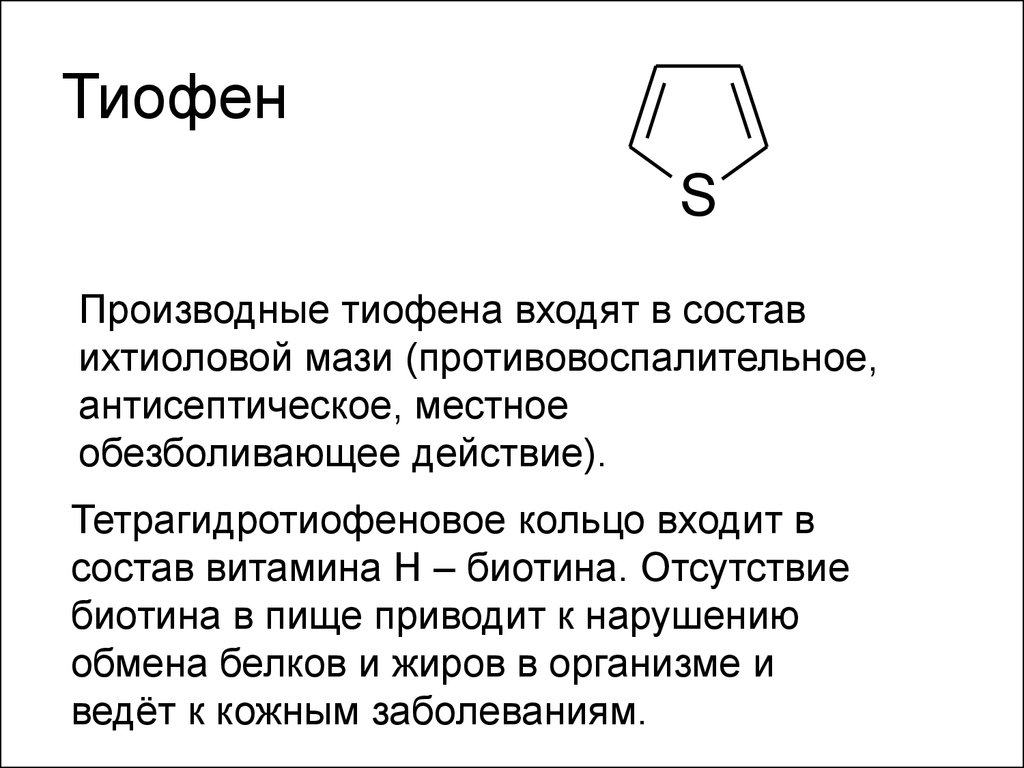
47. Тиофен
SПроизводные тиофена входят в состав
ихтиоловой мази (противовоспалительное,
антисептическое, местное
обезболивающее действие).
Тетрагидротиофеновое кольцо входит в
состав витамина Н – биотина. Отсутствие
биотина в пище приводит к нарушению
обмена белков и жиров в организме и
ведёт к кожным заболеваниям.
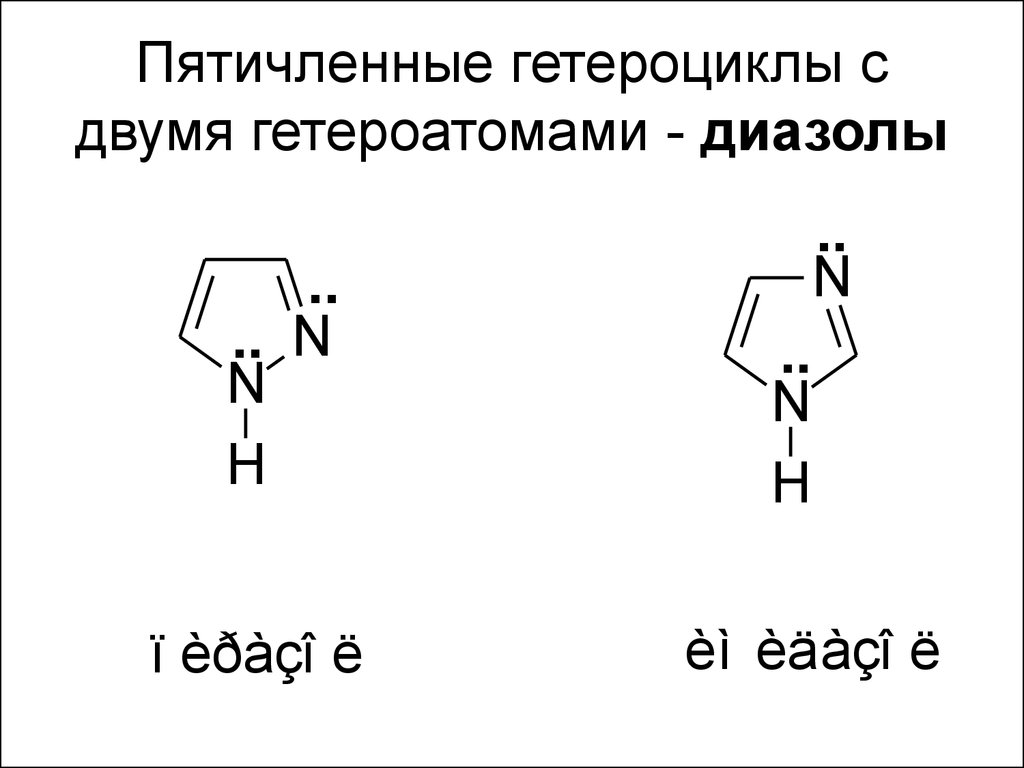
48. Пятичленные гетероциклы с двумя гетероатомами - диазолы
.... N
N
H
ï èðàçî ë
..
N
..
N
H
èì èäàçî ë
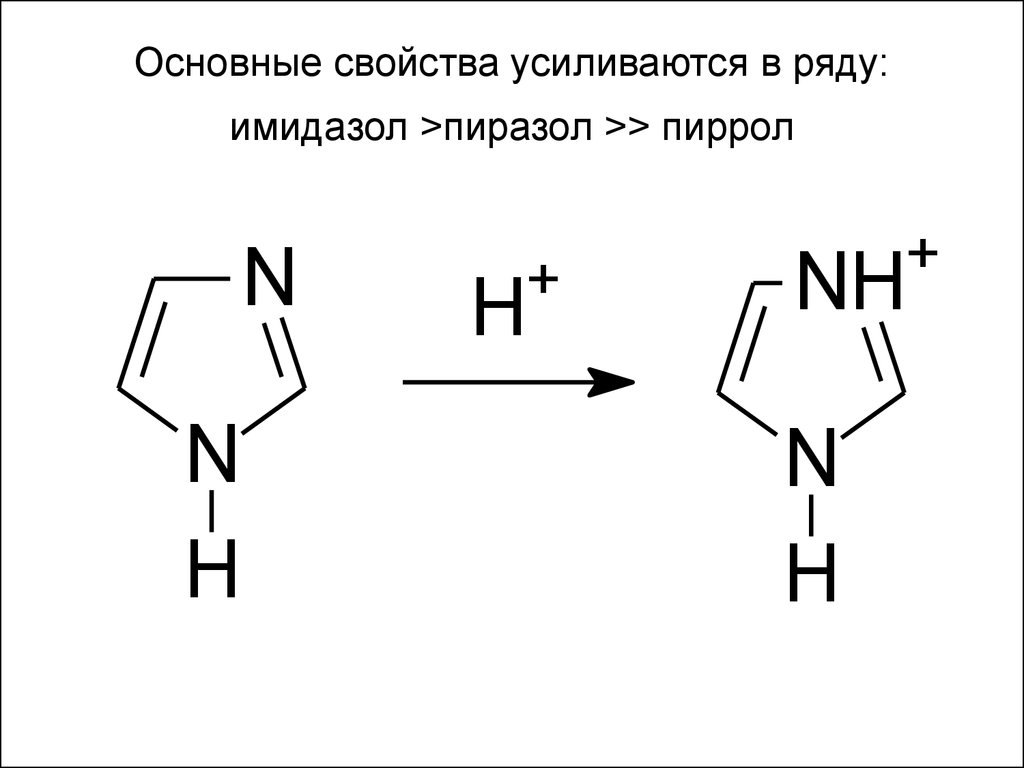
49. Основные свойства усиливаются в ряду: имидазол >пиразол >> пиррол
Основные свойства усиливаются в ряду:имидазол >пиразол >> пиррол
N
N
H
+
H
+
NH
N
H
50.
[H][H]
N
H
N
N
H
N
ï èðàçî ëèí
N
H
N H
ï èðàçî ëèäèí
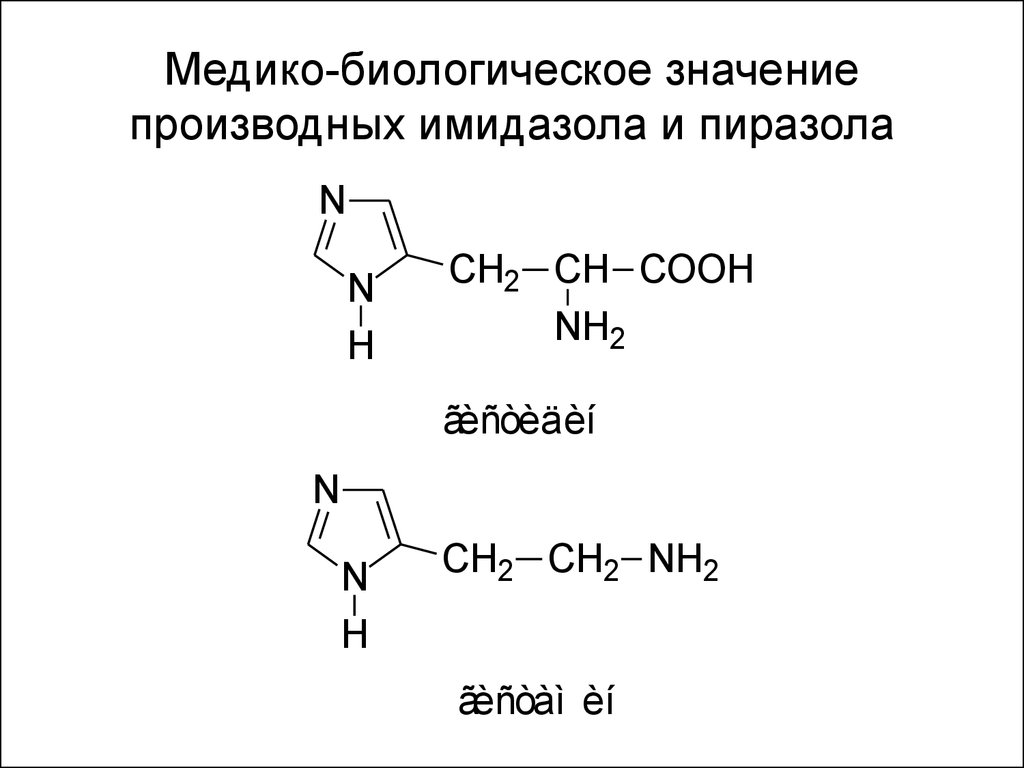
51. Медико-биологическое значение производных имидазола и пиразола
NN
H
CH2 CH COOH
NH2
ãèñòèäèí
N
N
H
CH2 CH2 NH2
ãèñòàì èí
52.
ON H
N
H
ï èðàçî ëî í
CH3
O
(CH3)2N
N CH
3
N
C6H5
O
CH3
N CH
3
N
C6H5
àì èäî ï èðèí
àí òèï èðèí
CH2SO3Na
H3C N
CH3
O
N CH
3
N
C6H5
àí àëüãèí
53.
45
3 ..
N
.. 2
O1
î êñàçî ë
..
4 3N
5 ..
2
1
S
..
òèàçî ë
.. H
N
..
S
..
òèàçî ëèäèí
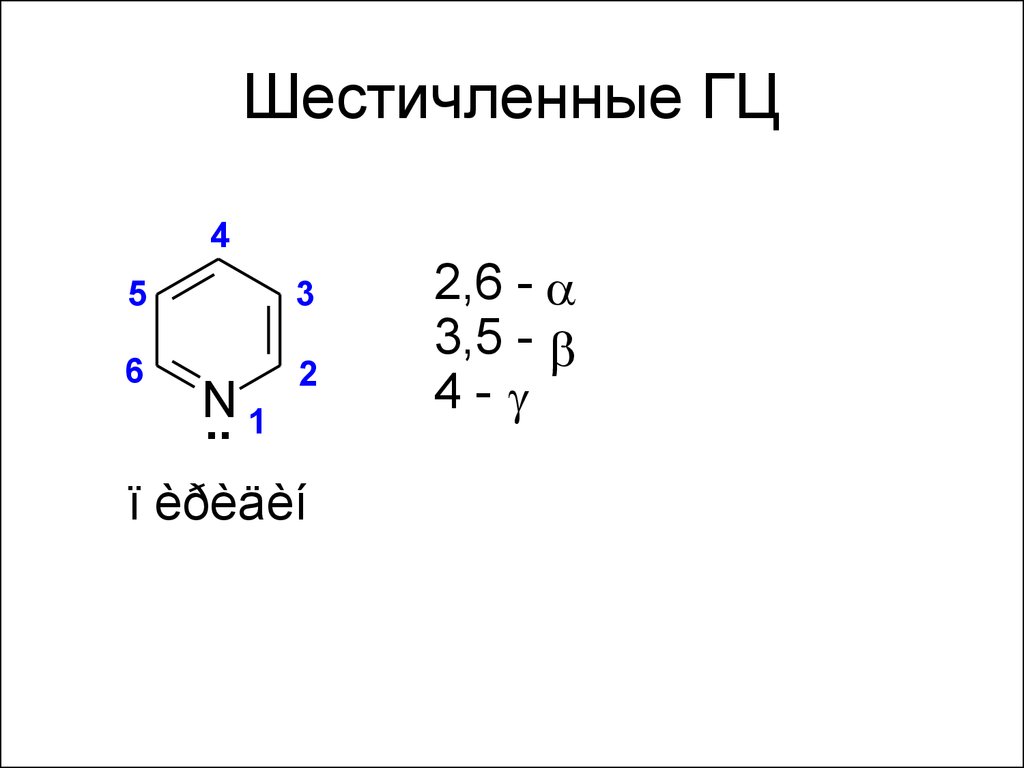
54. Шестичленные ГЦ
45
3
6
2
N
.. 1
ï èðèäèí
2,6 -
3,5 -
4-
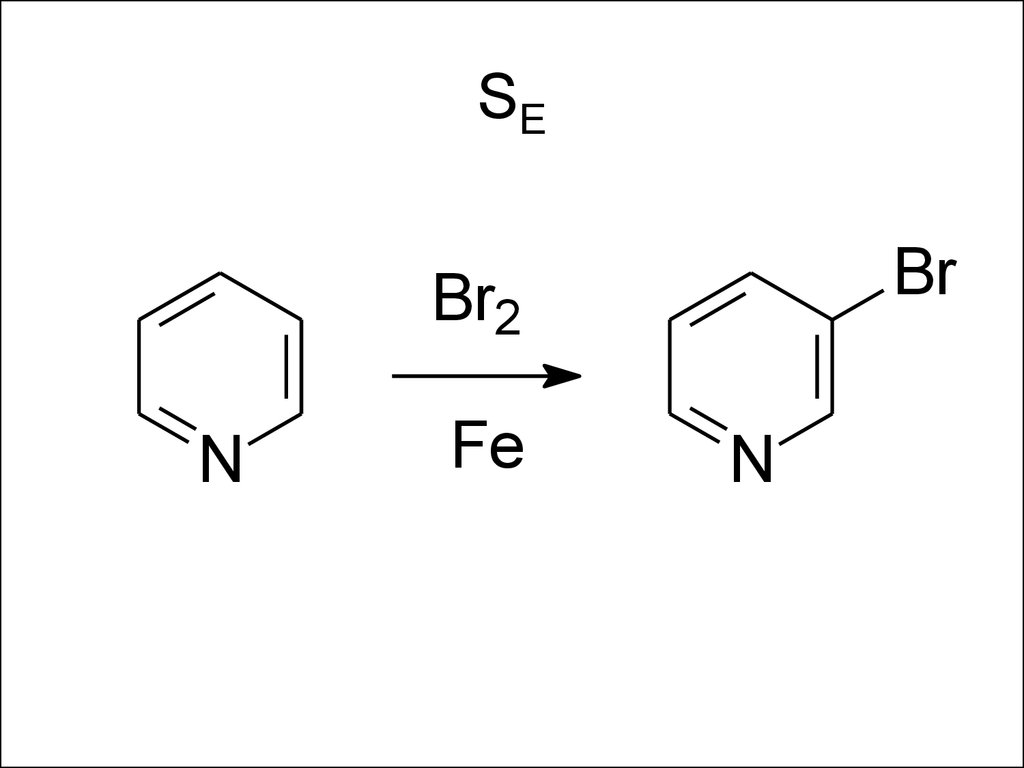
55. SE
BrBr2
N
Fe
N
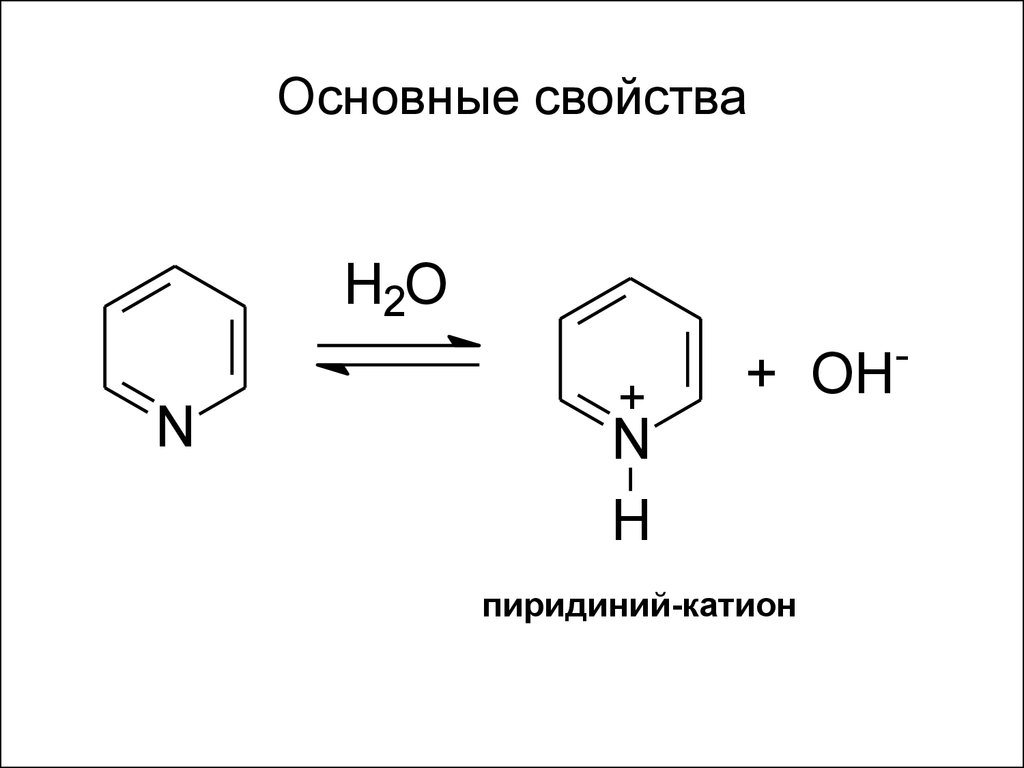
56. Основные свойства
H2O-
N
+
+ OH
N
H
пиридиний-катион
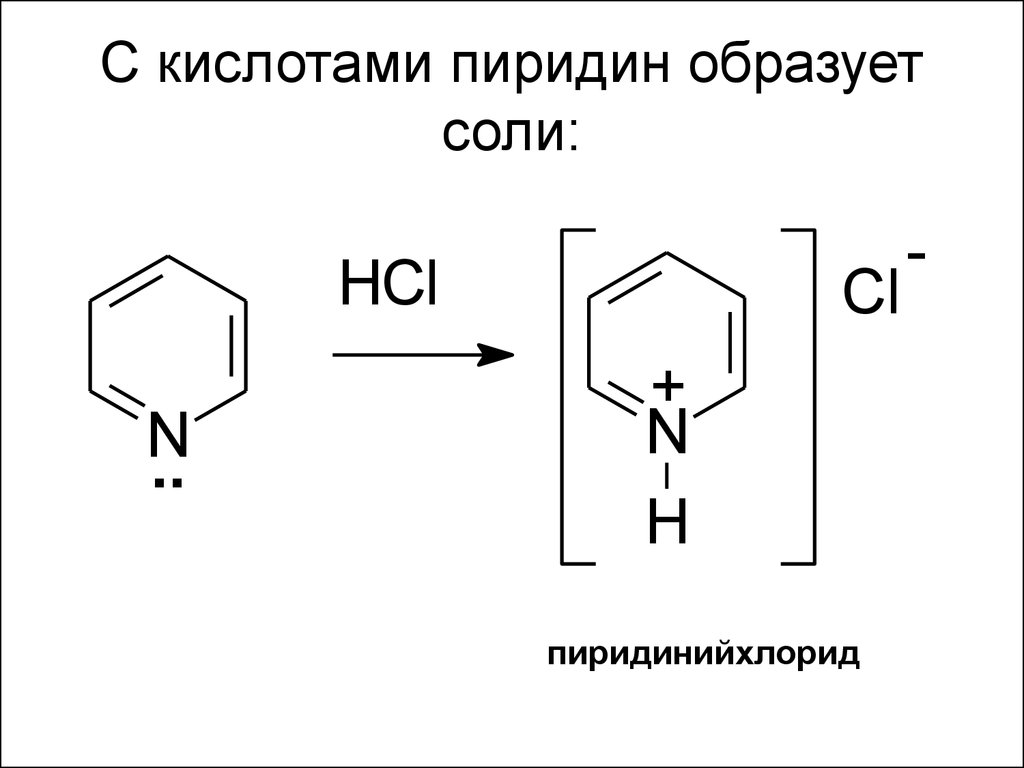
57. С кислотами пиридин образует соли:
HClN
..
Cl
+
N
H
пиридинийхлорид
-
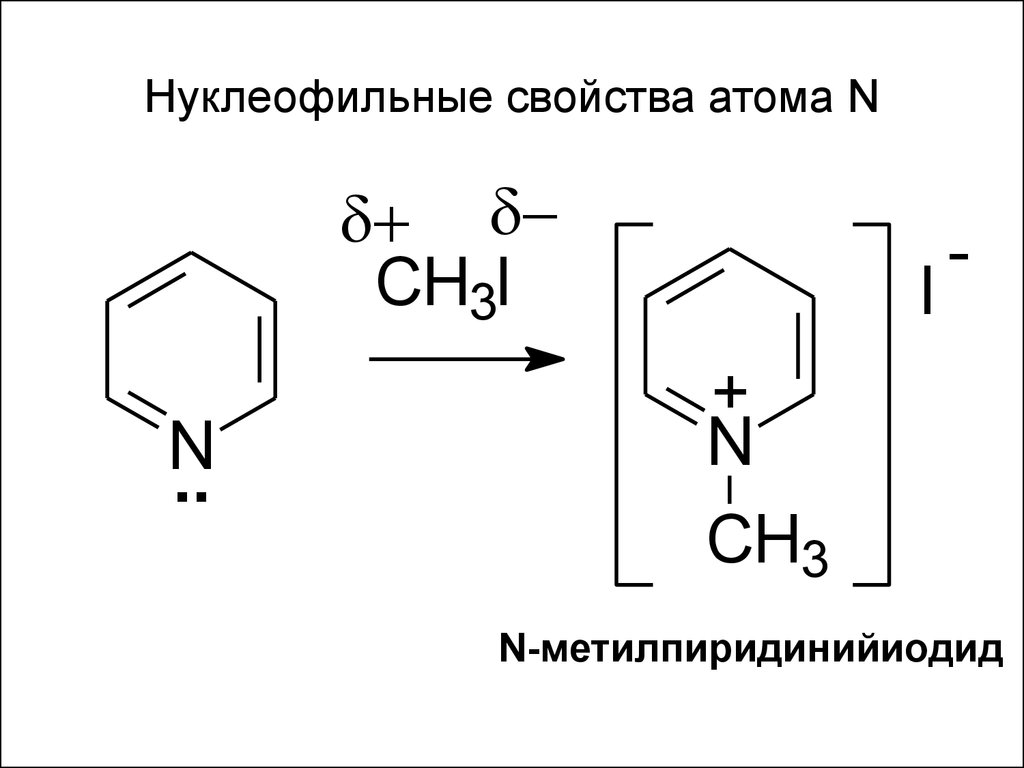
58. Нуклеофильные свойства атома N
CH3IN
..
I
-
+
N
CH3
N-метилпиридинийиодид
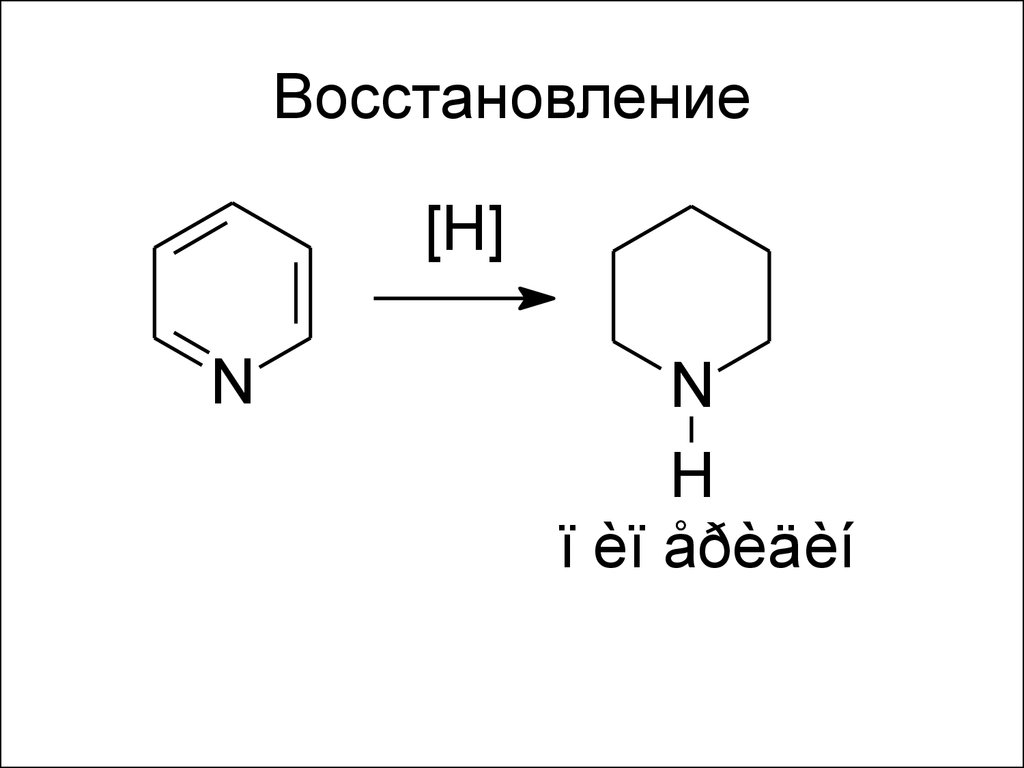
59. Восстановление
[H]N
N
H
ï èï åðèäèí
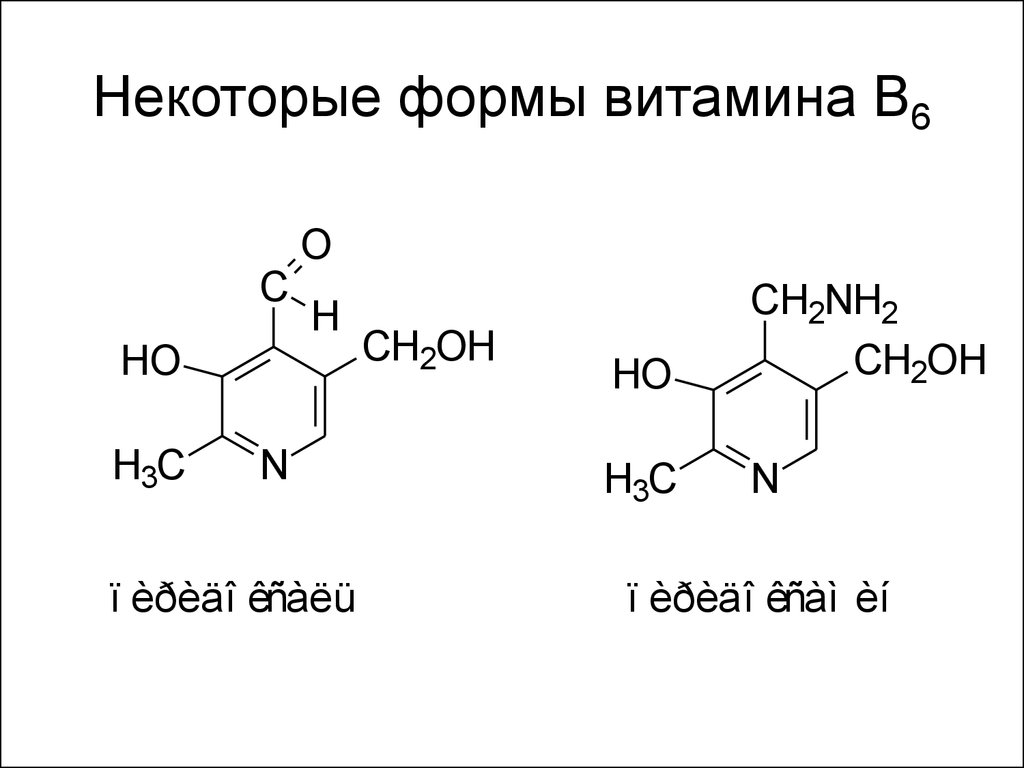
60. Некоторые формы витамина В6
OC
H
HO
H3C
N
ï èðèäî êñàëü
CH2OH
HO
CH2NH2
CH2OH
H3C
N
ï èðèäî êñàì èí
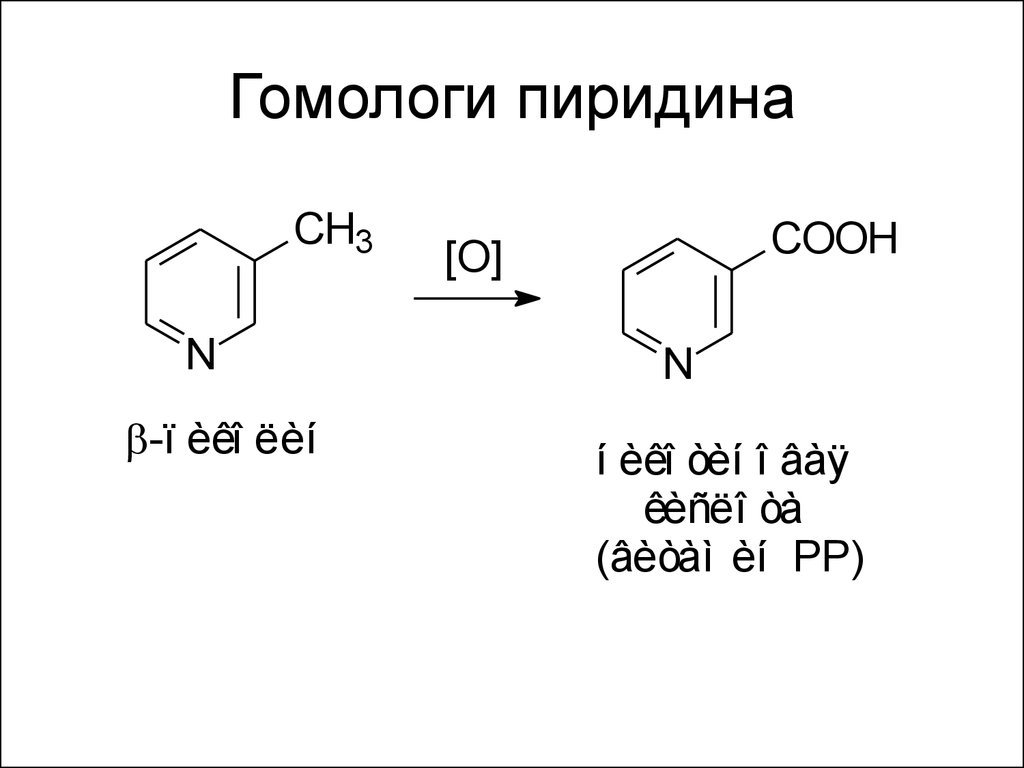
61. Гомологи пиридина
CH3N
-ï èêî ëèí
COOH
[O]
N
í èêî òèí î âàÿ
êèñëî òà
(âèòàì èí PP)
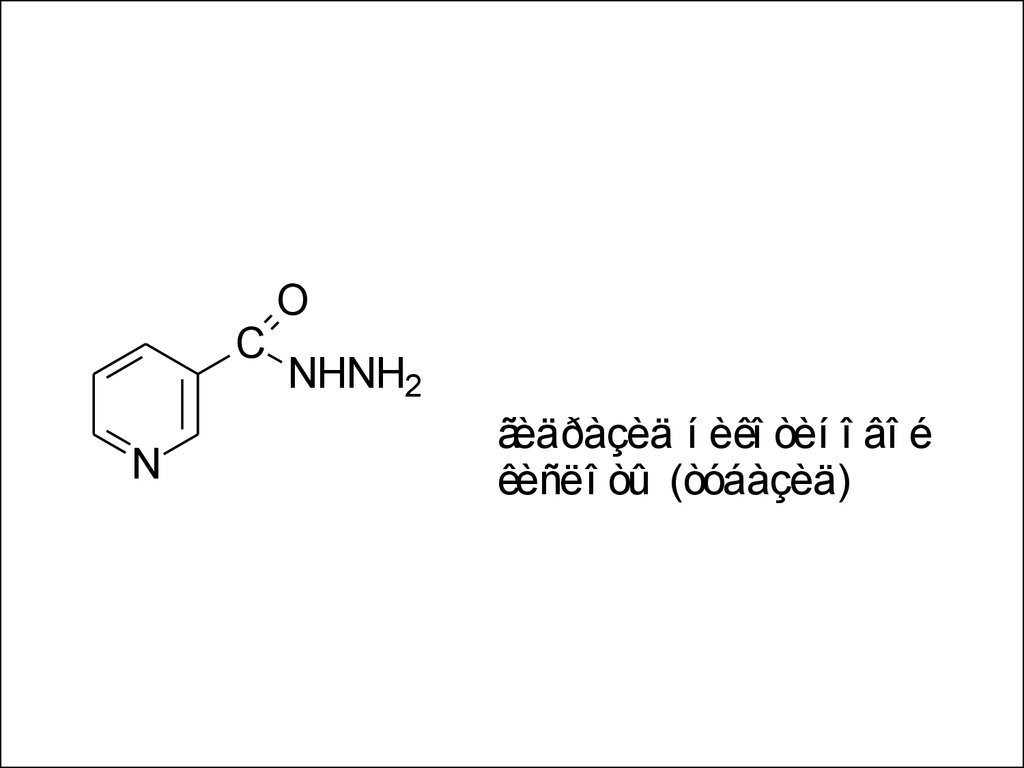
62.
OC
N
NHNH2
ãèäðàçèä í èêî òèí î âî é
êèñëî òû (òóáàçèä)
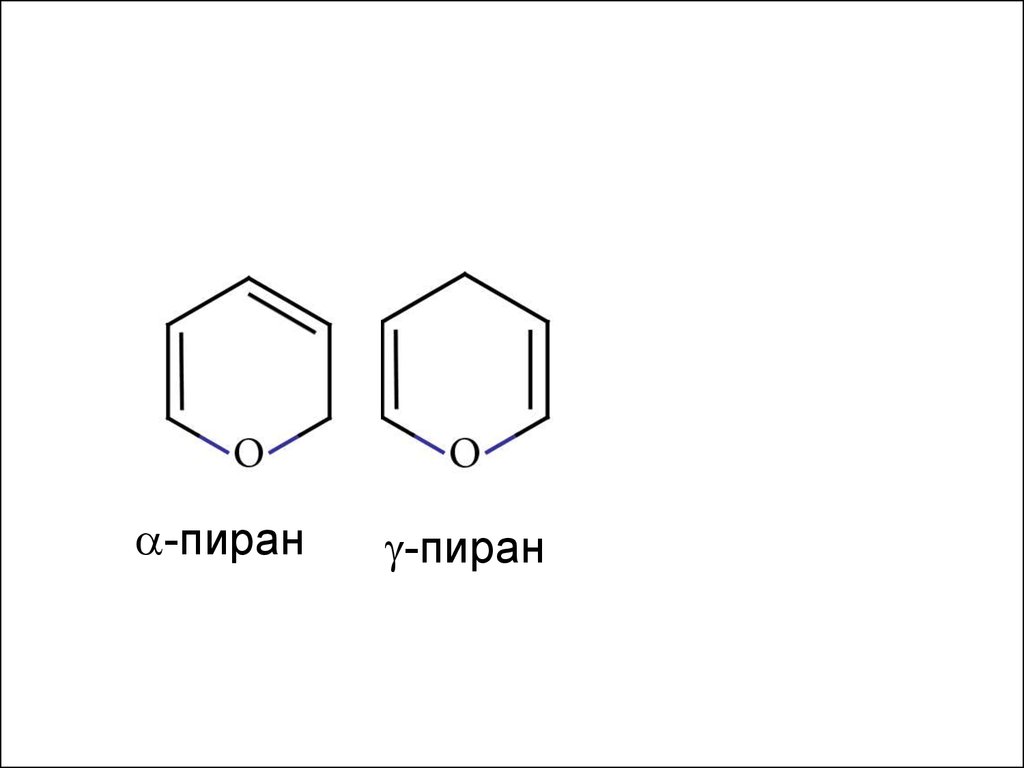
63.
-пиран-пиран
64.
Из строения молекулы видно,что пиран не обладает
ароматическим характером.
Пирановое кольцо лежит в
основе циклических форм
моносахаридов,
олигосахаридов, полисахаридов
и гетеросахаридов.
Так, циклическая форма
глюкозы называется
глюкопираноза; галактоза –
галактопираноза.
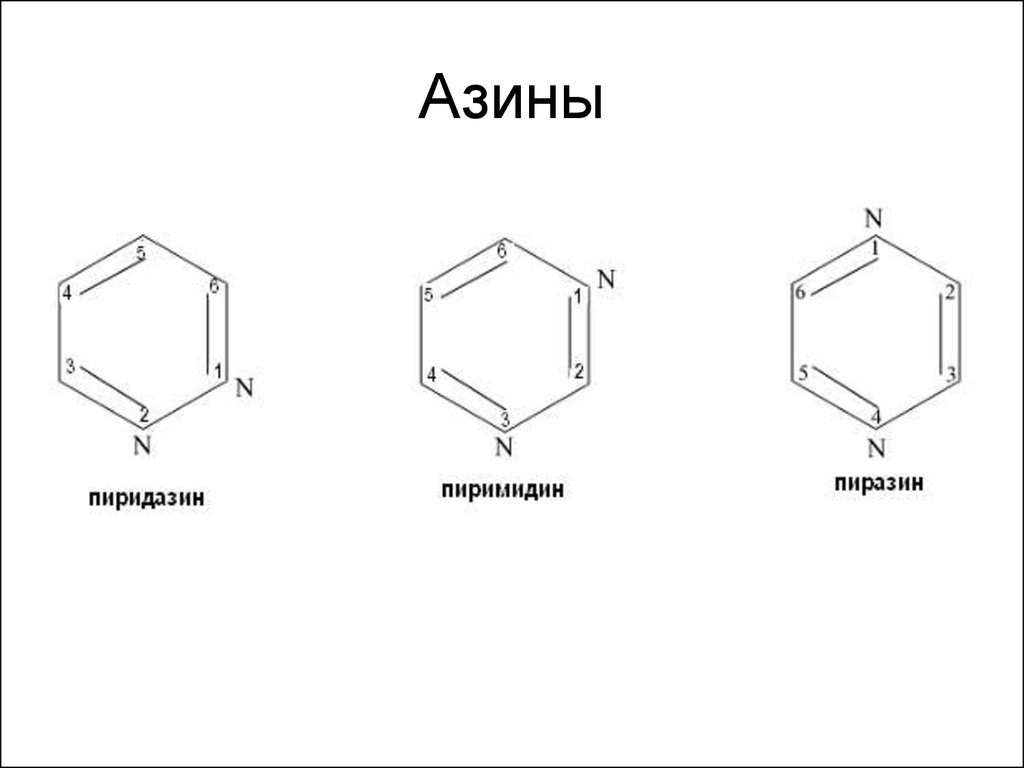
65. Азины
66.
67.
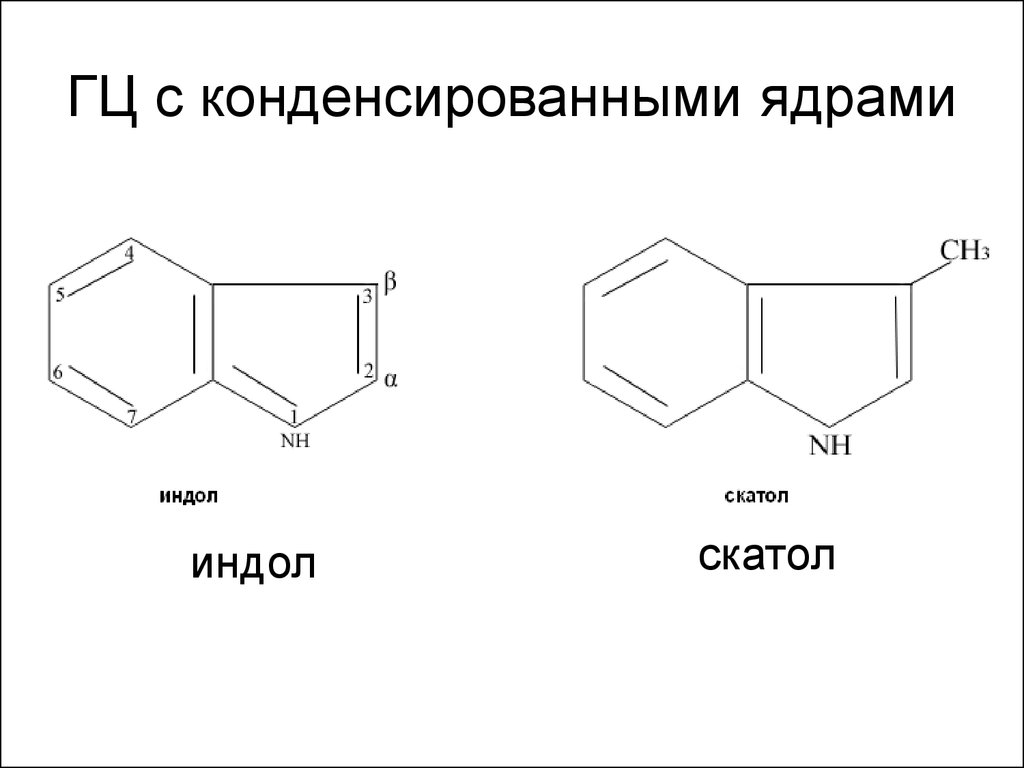
Барбитуровая к-та68. ГЦ с конденсированными ядрами
индолскатол
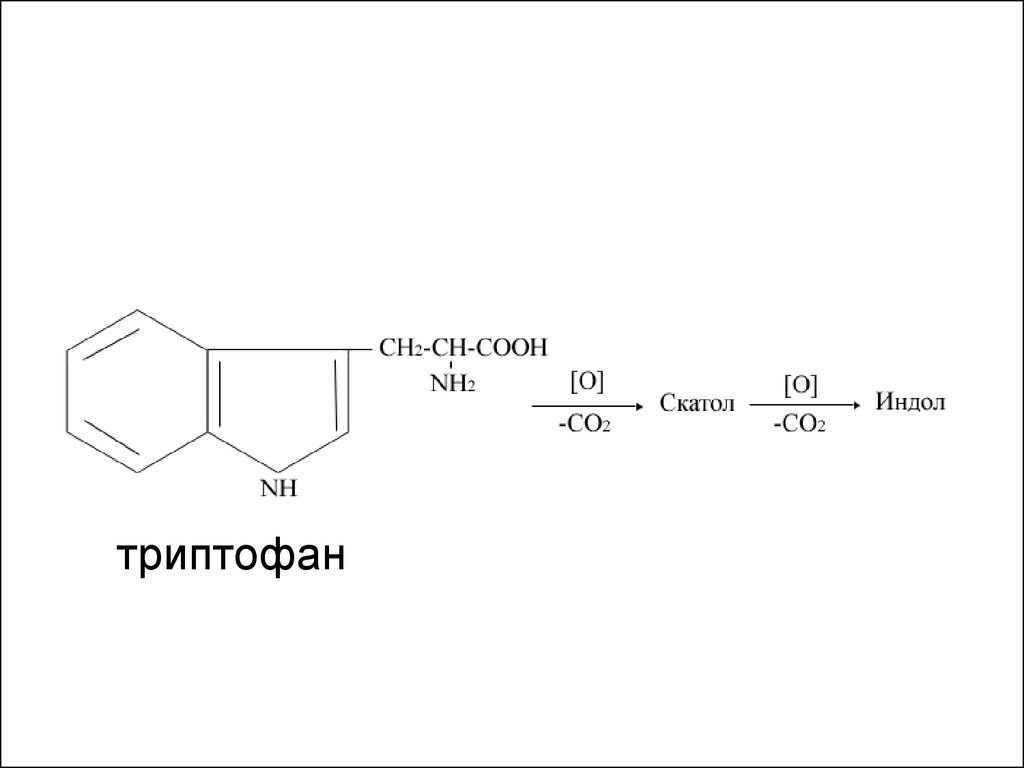
69.
триптофан70.
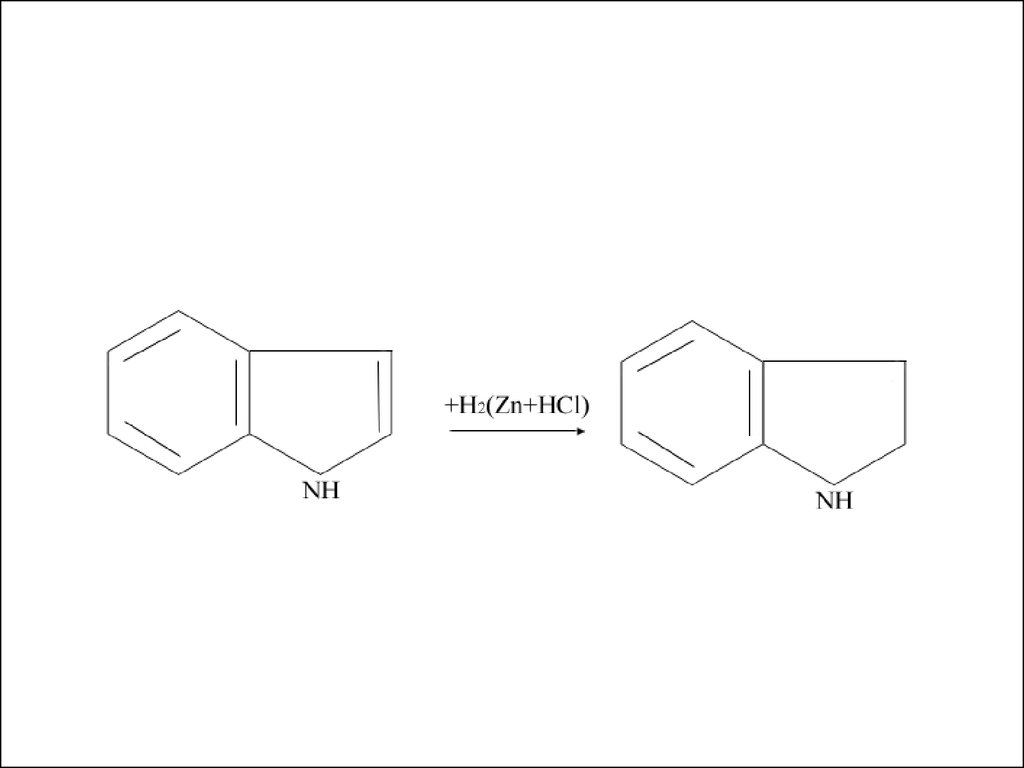
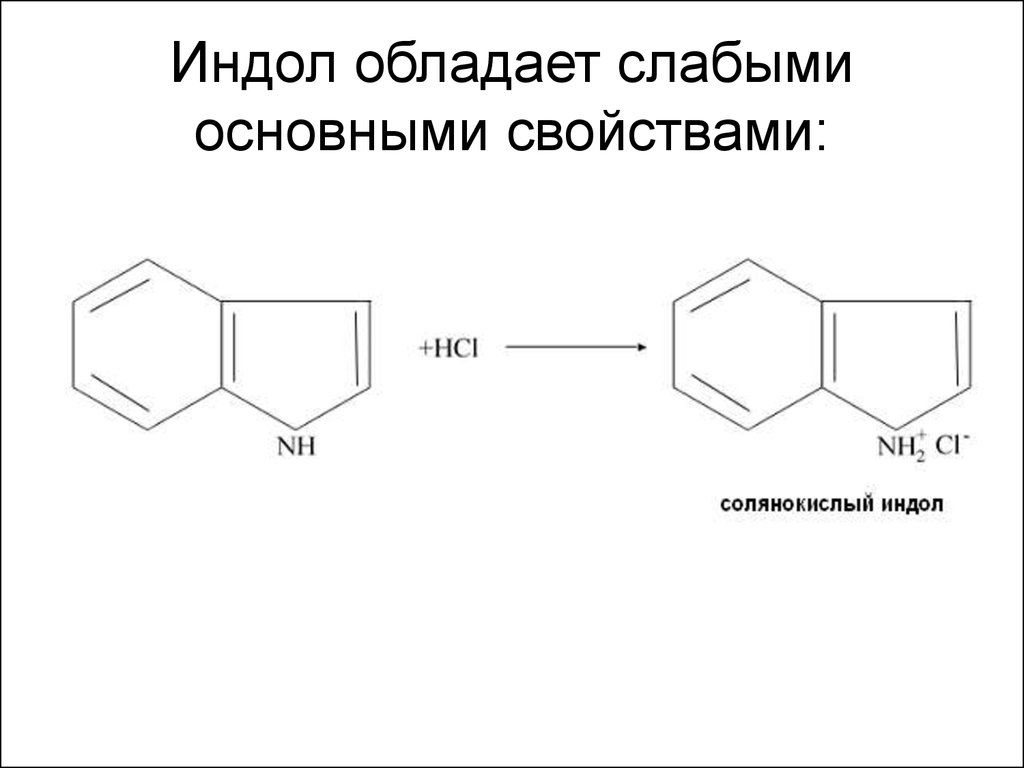
71. Индол обладает слабыми основными свойствами:
72.
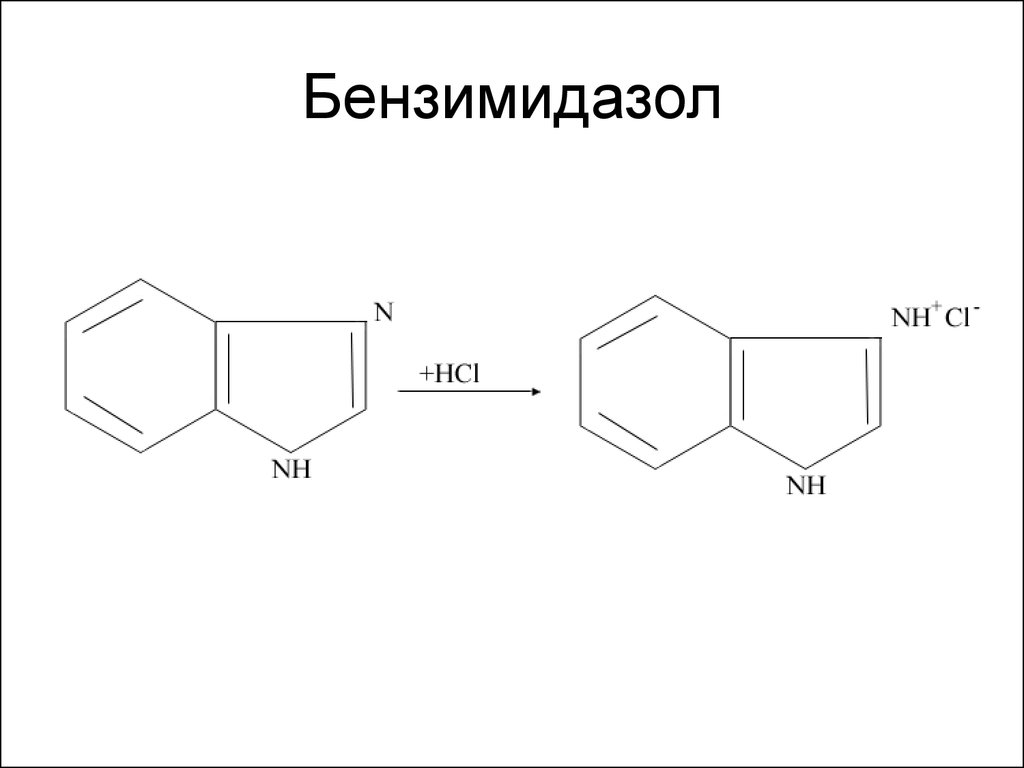
73. Бензимидазол
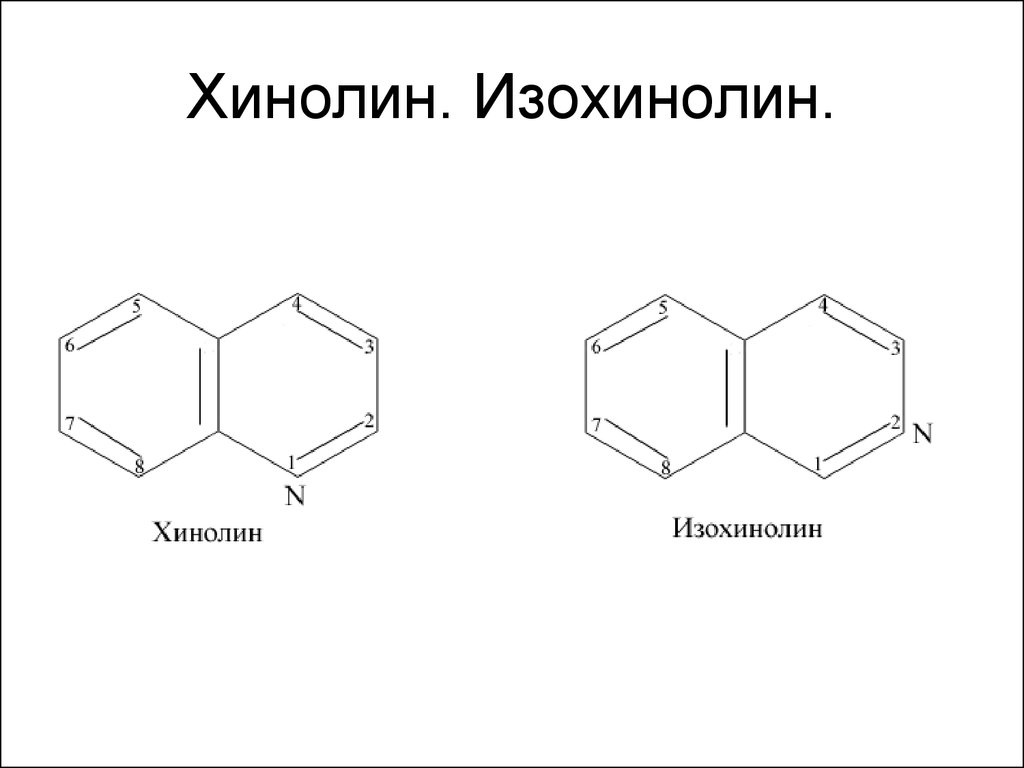
74. Хинолин. Изохинолин.
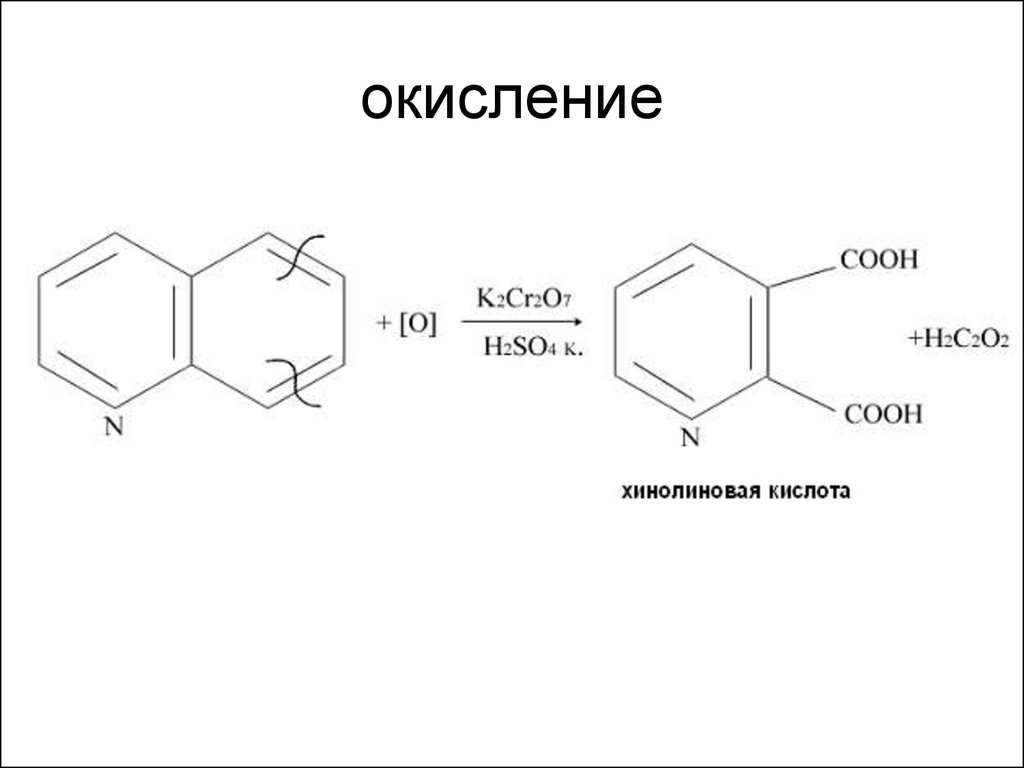
75. окисление
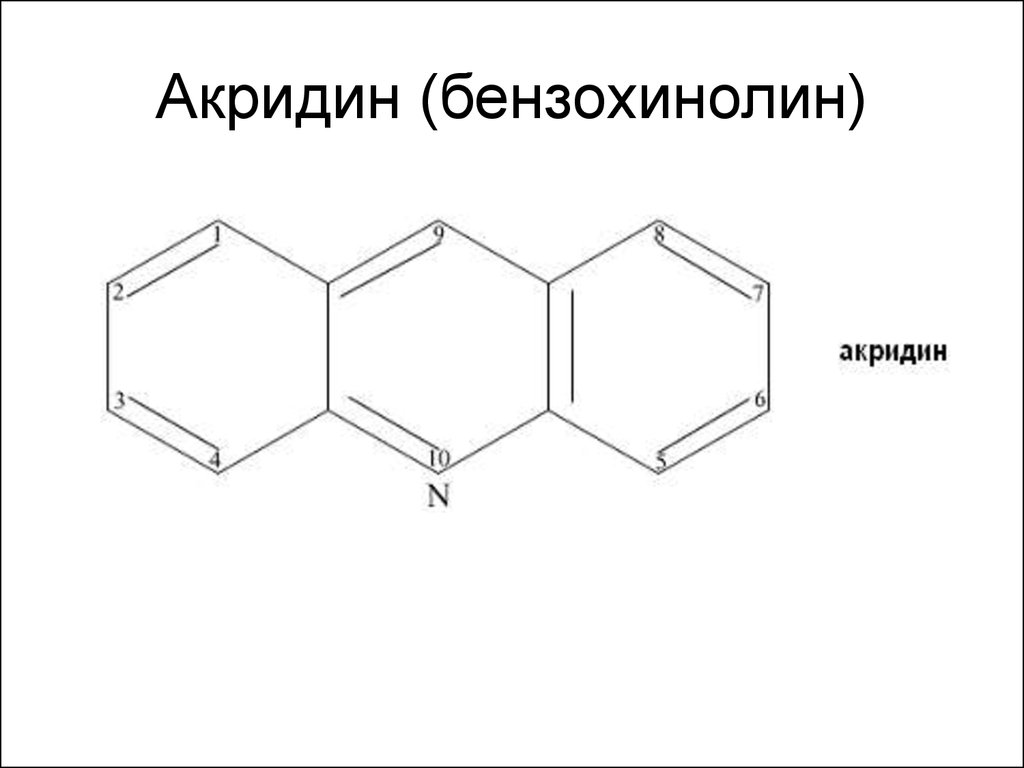
76. Акридин (бензохинолин)
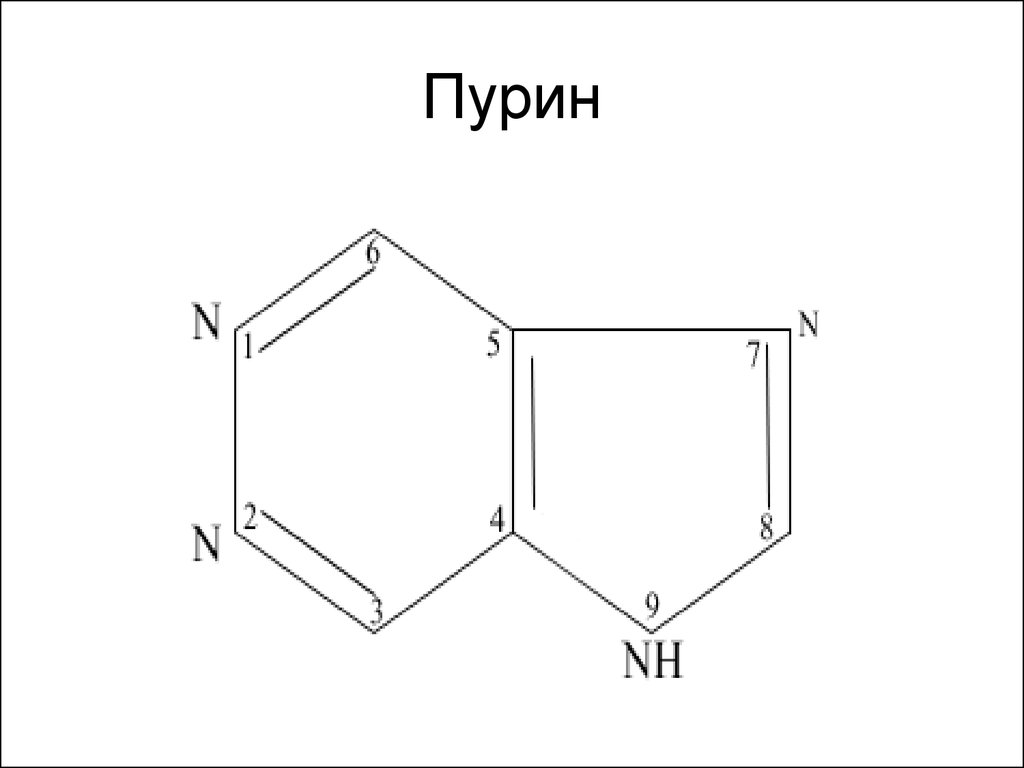
77. Пурин
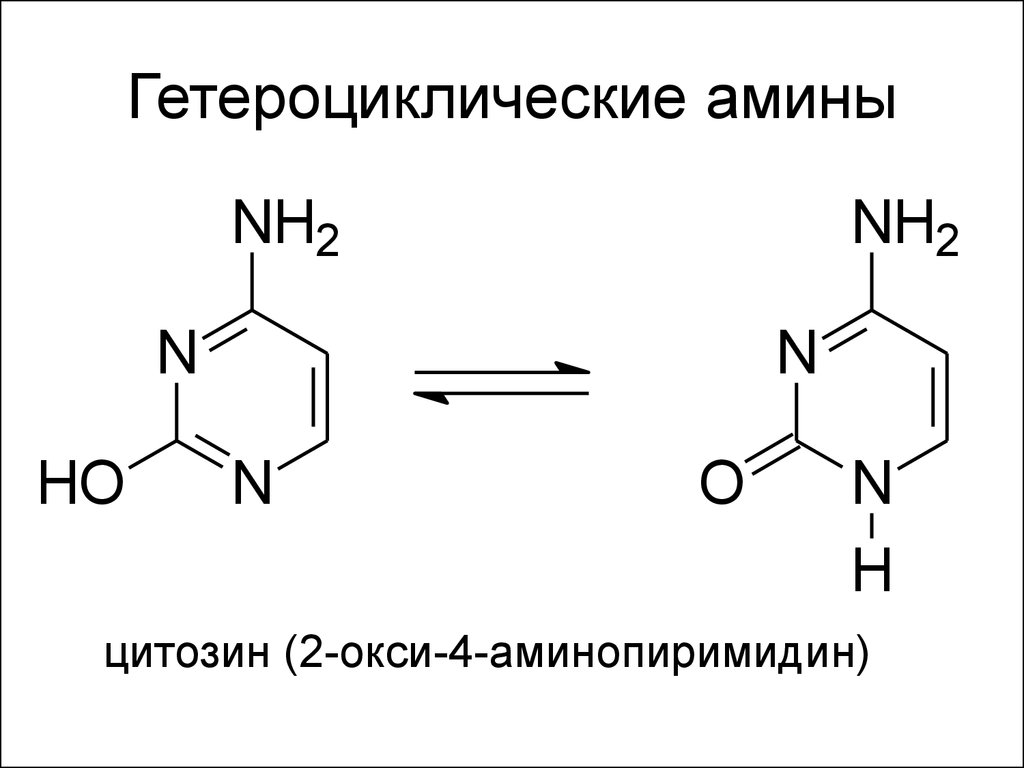
78. Гетероциклические амины
NH2NH2
N
HO
N
N
O
N
H
цитозин (2-окси-4-аминопиримидин)
79.
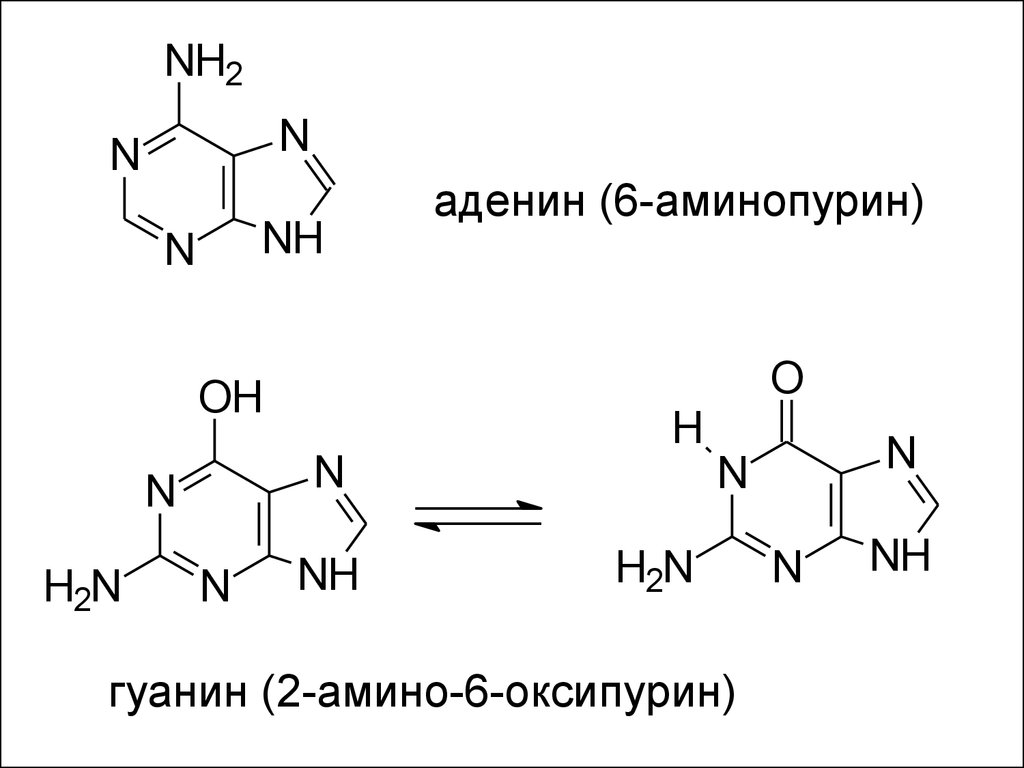
NH2N
N
NH
N
O
OH
H
N
N
H2N
аденин (6-аминопурин)
N
NH
N
N
H2N
гуанин (2-амино-6-оксипурин)
N
NH
80.
NH2OH
HNO2
N
N
NH
N
N
N
+ N2 + H2O
N NH
гипоксантин
OH
OH
N
N
H2N
N
NH
HNO2
N
N
HO
+ N2 + H2O
N
NH
ксантин
























 Химия
Химия








