Похожие презентации:
Строение соединений d-элементов
1. Строение соединений d-элементов
Лекцию подготовил: Шлапаков Никита,студент 6 курса Химического факультета МГУ.
Вороново, 2019
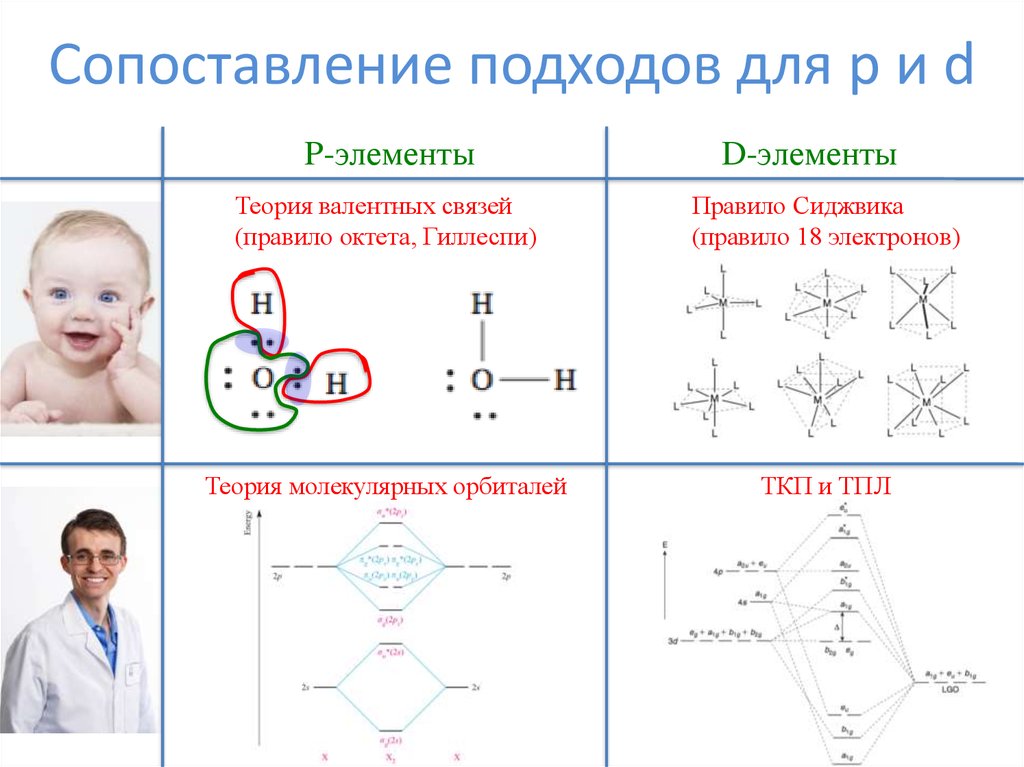
2. Сопоставление подходов для p и d
P-элементыD-элементы
Теория валентных связей
(правило октета, Гиллеспи)
Правило Сиджвика
(правило 18 электронов)
Теория молекулярных орбиталей
ТКП и ТПЛ
3. Правило Сиджвика
Комплексные соединения d-элементов вмалых или отрицательных степенях
окисления предпочитают лигандное
окружение, обеспечивающее 18-электронное
заполнение внешней оболочки.
!!! Очень плохо работает для степеней
окисления выше 2+ и с лигандами сильного
поля. Эти соединения описываются другими
приближениями.
4. Основные принципы
Типы электронов в комплексных соединениях:1) Собственные электроны центральных атомов (d-металлов), не
задействованные в связях (N)
2) Пары электронов от присоединённых лигандов (L)
3) Обобществлённые электроны от кластерных связей М-М (K)
Количество кластерных связей зависит от значений N и L.
Обычно, всегда образуется столько связей, чтобы N+L+K=18
Предсказания реакционной способности:
1) Для каждого атома соблюдается N+L+K=18 – соединение
стабильно
2) Есть атомы металла, для которых N+L+K<18 – соединение
является окислителем
3) Есть атомы металла, для которых N+L+K>18 – соединение
является восстановителем
5. Характеристики лигандов
1) Дентантность – количество пар электронов, предоставляемое лигандом2-электронные лиганды – CO, N2, NO+, H–, PR3, алкены и прочее
4-электронные лиганды – циклобутадиен, бутадиен, аллил
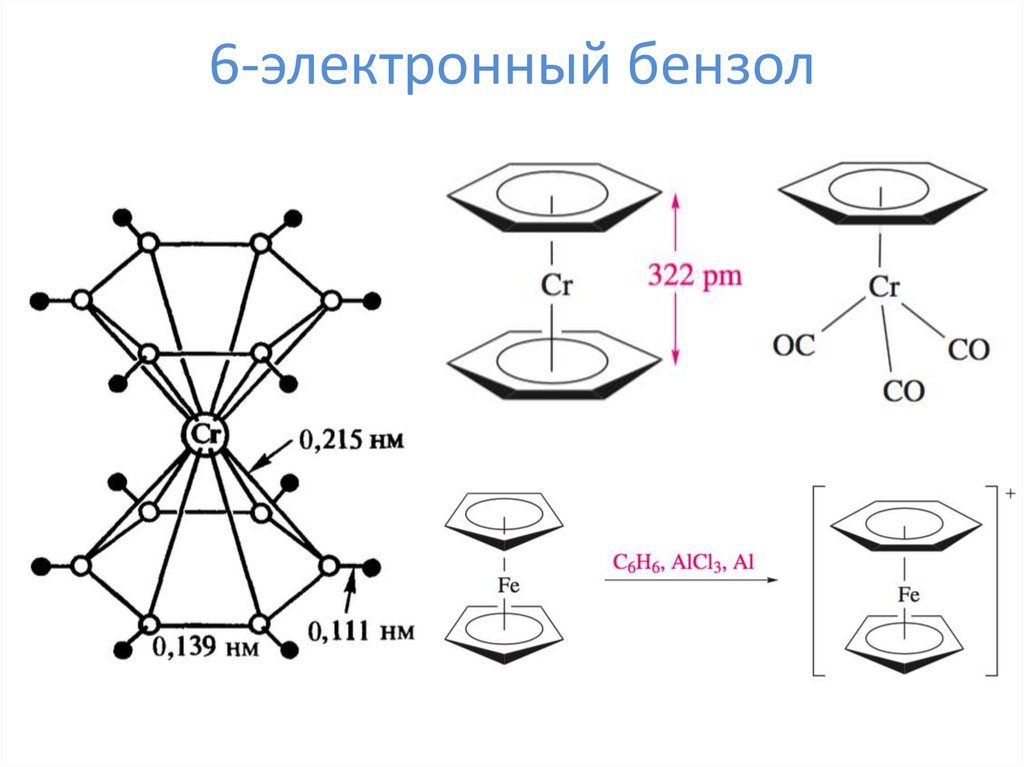
6-электронные лиганды – ципендадиенид, бензол, тропилий
8-электронные лиганды - циклооктатетраен
2) Гаптность – количество атомов лиганда, участвующих в связывании с металлом (η)
η1 – все привычные лиганды
η2 – алкен
η3 – аллил
η4 – бутадиен, циклобутадиен
η5 – циклопентадиенид
3) Формальный заряд – заряд лиганда в свободном состоянии
–1 – циклопентадиенид, аллил, галогенид
0 – все основные лиганды
+1 – нитрозил, тропилий
4) Мостиковость – количество атомов металла, с которыми связан лиганд (μ)
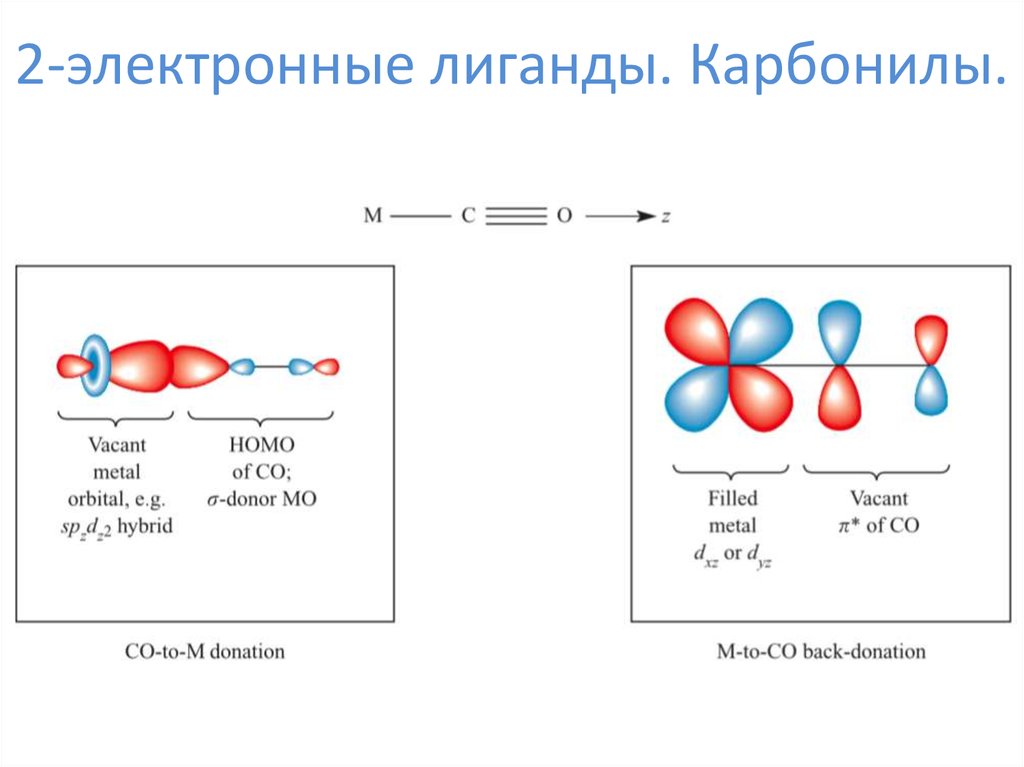
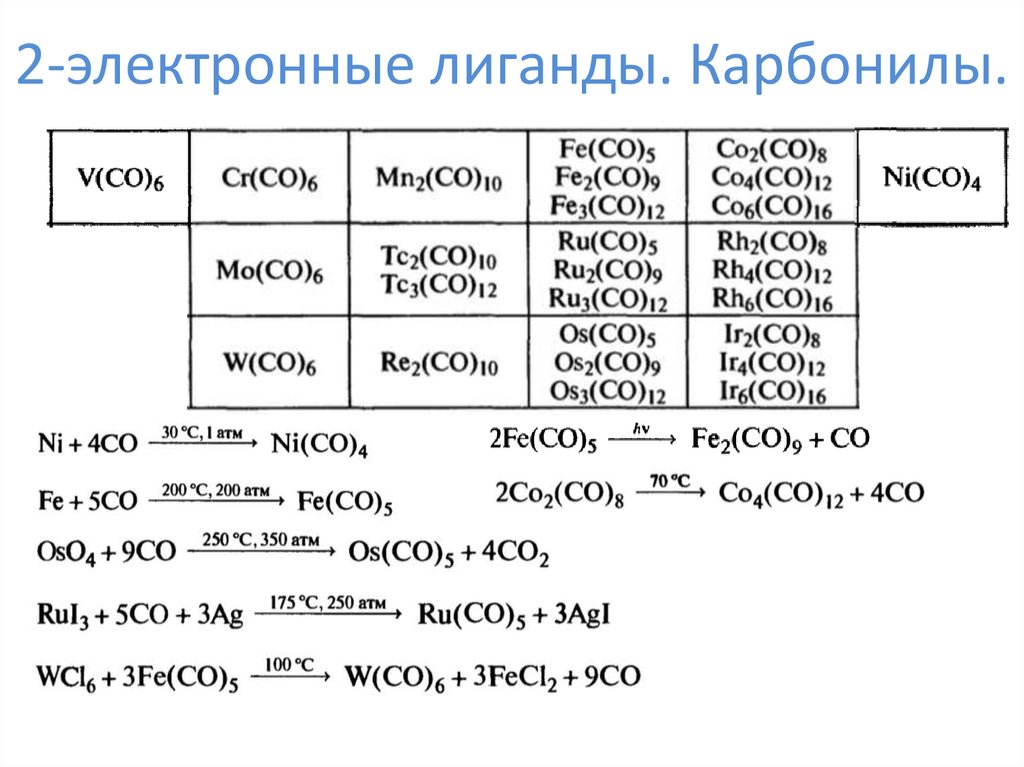
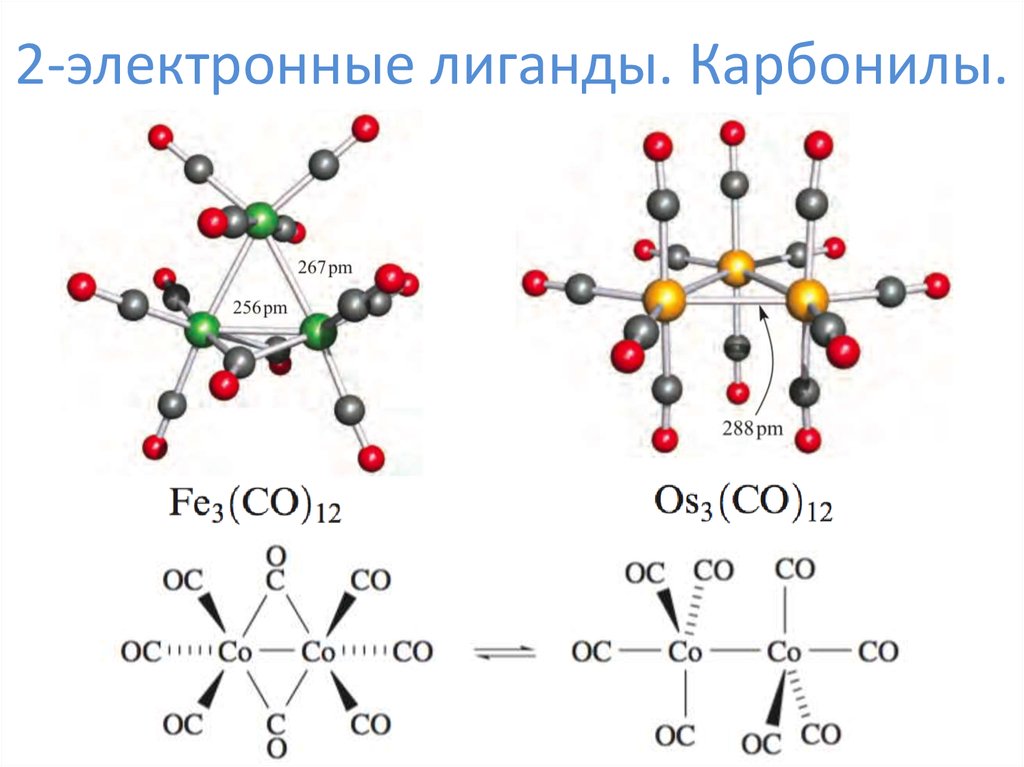
6. 2-электронные лиганды. Карбонилы.
7. 2-электронные лиганды. Карбонилы.
8. 2-электронные лиганды. Карбонилы.
Mm(CO)nL = 2*n
K = 18*m – L – N
9. 2-электронные лиганды. Карбонилы.
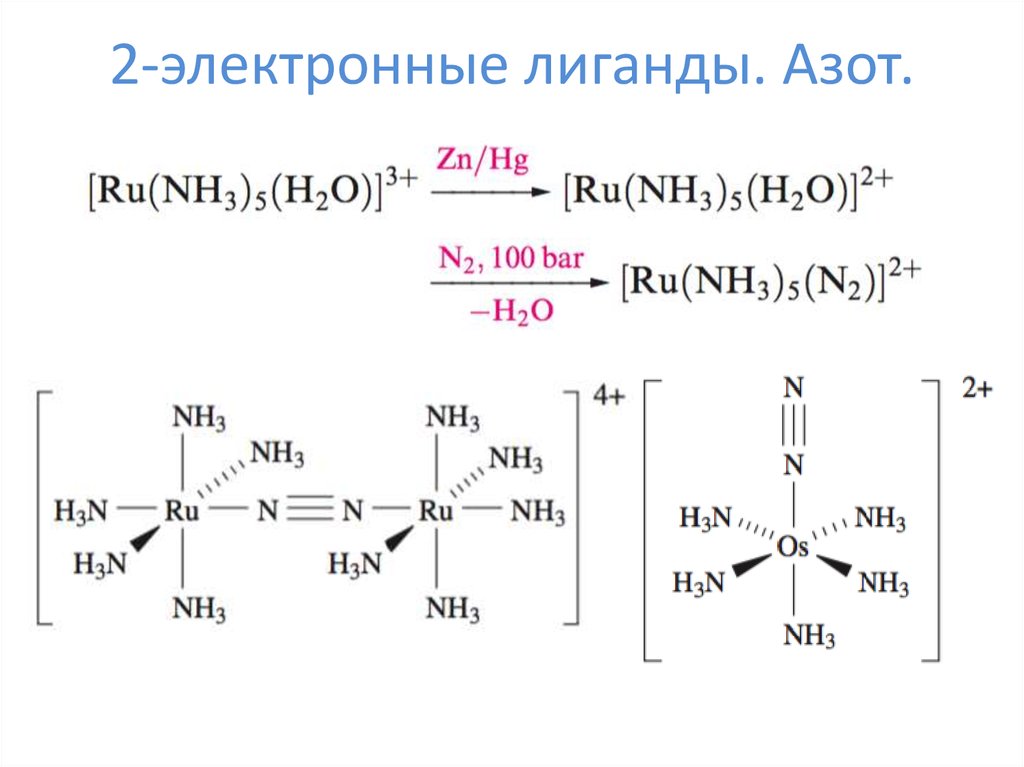
10. 2-электронные лиганды. Азот.
11. 2-электронные лиганды. Гидриды.
12. 2-электронные лиганды. Гидриды.
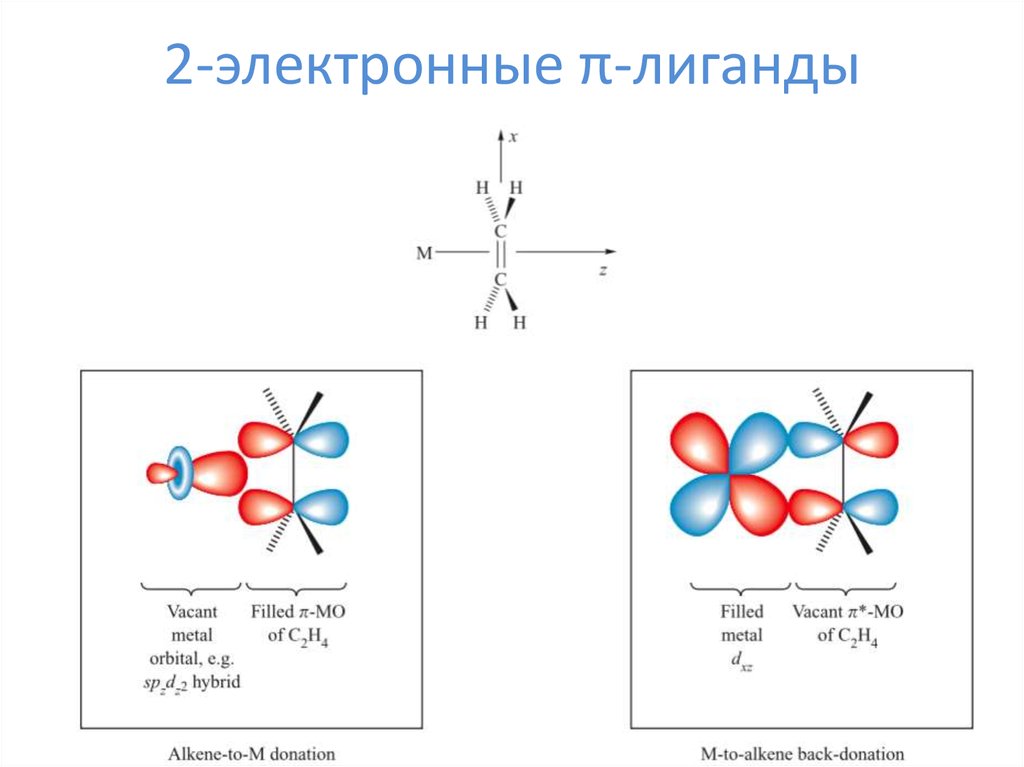
13. 2-электронные π-лиганды
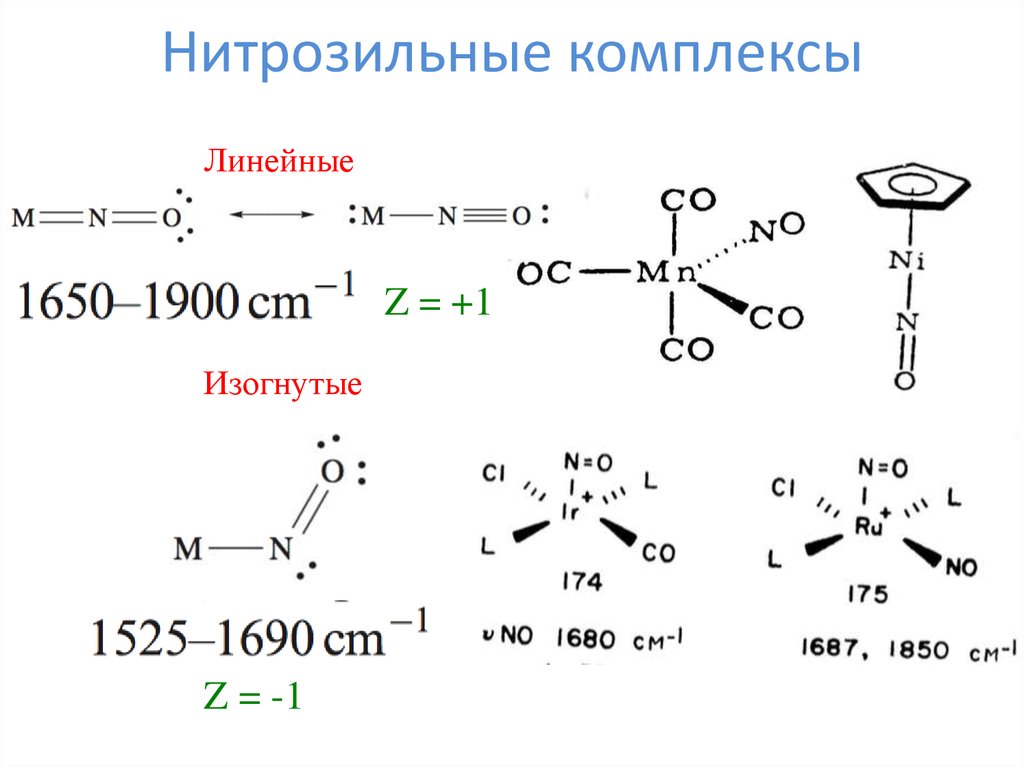
14. Нитрозильные комплексы
ЛинейныеZ = +1
Изогнутые
Z = -1
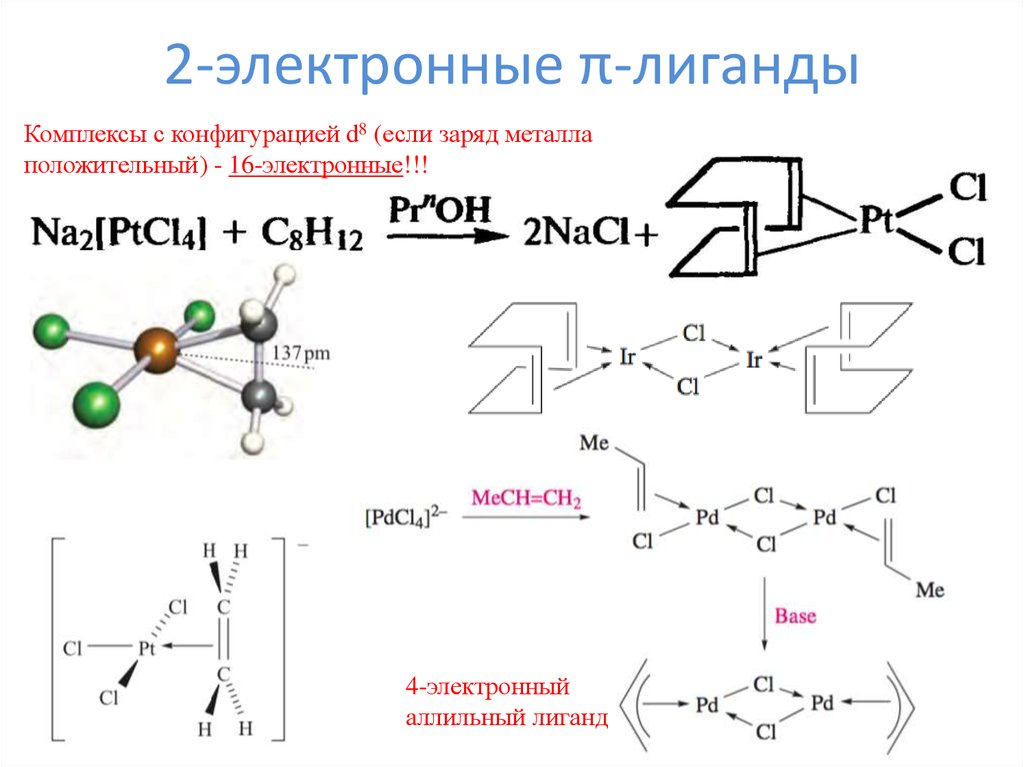
15. 2-электронные π-лиганды
Комплексы с конфигурацией d8 (если заряд металлаположительный) - 16-электронные!!!
4-электронный
аллильный лиганд
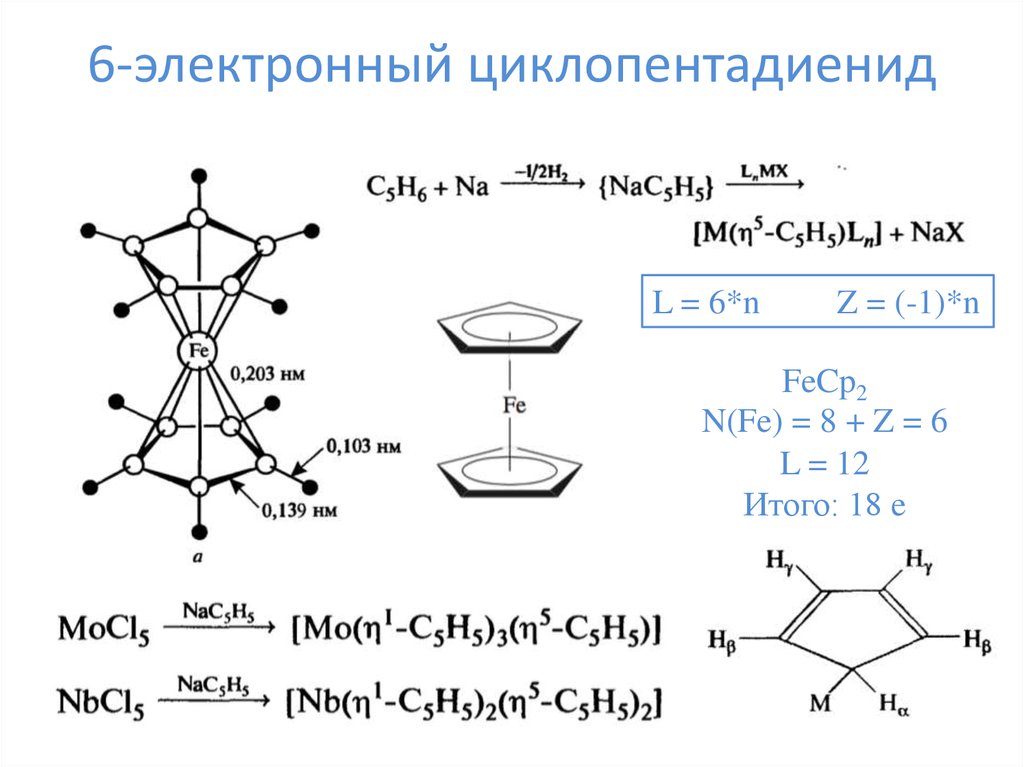
16. 6-электронный циклопентадиенид
L = 6*nZ = (-1)*n
FeCp2
N(Fe) = 8 + Z = 6
L = 12
Итого: 18 e
17. 6-электронный циклопентадиенид
18. 6-электронный бензол
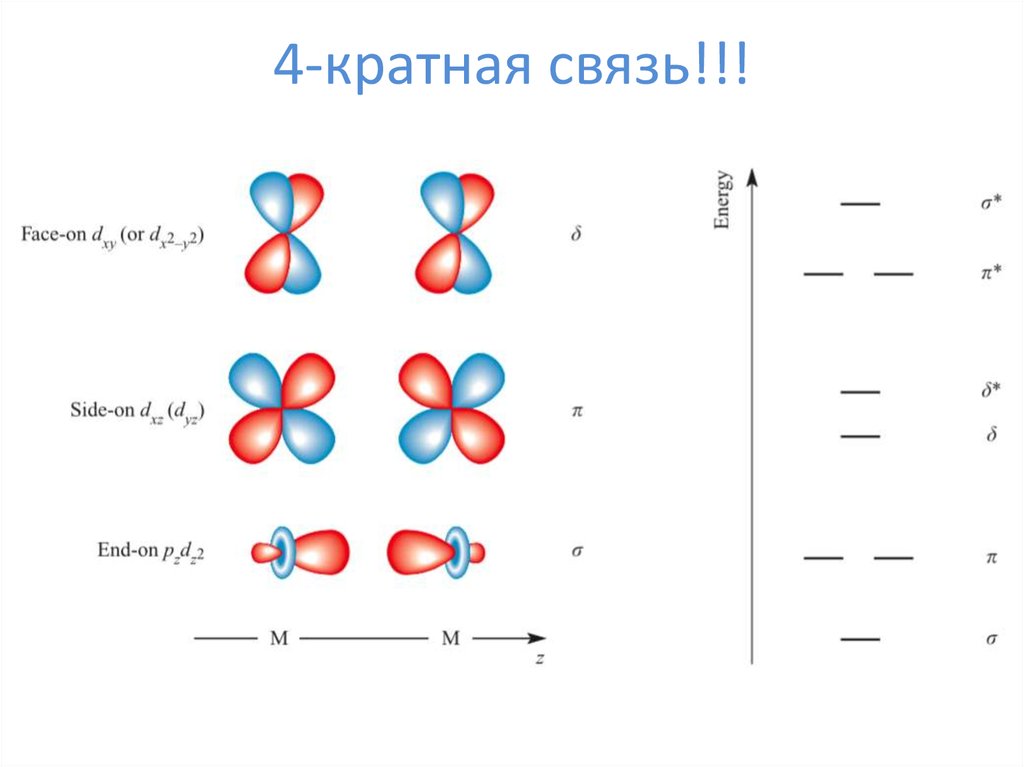
19. 4-кратная связь!!!
20. 4-кратная связь!!!
21. Давайте посчитаем
HRe3(CO)14[HCr2(CO)10]-
Mn2(CO)7(NO)3
MoCp2H2
[VCp(CO)4]
[Fe(CN)5(NO)]2-
[H2Re4(CO)12]2-
[Co3(CO)10]-
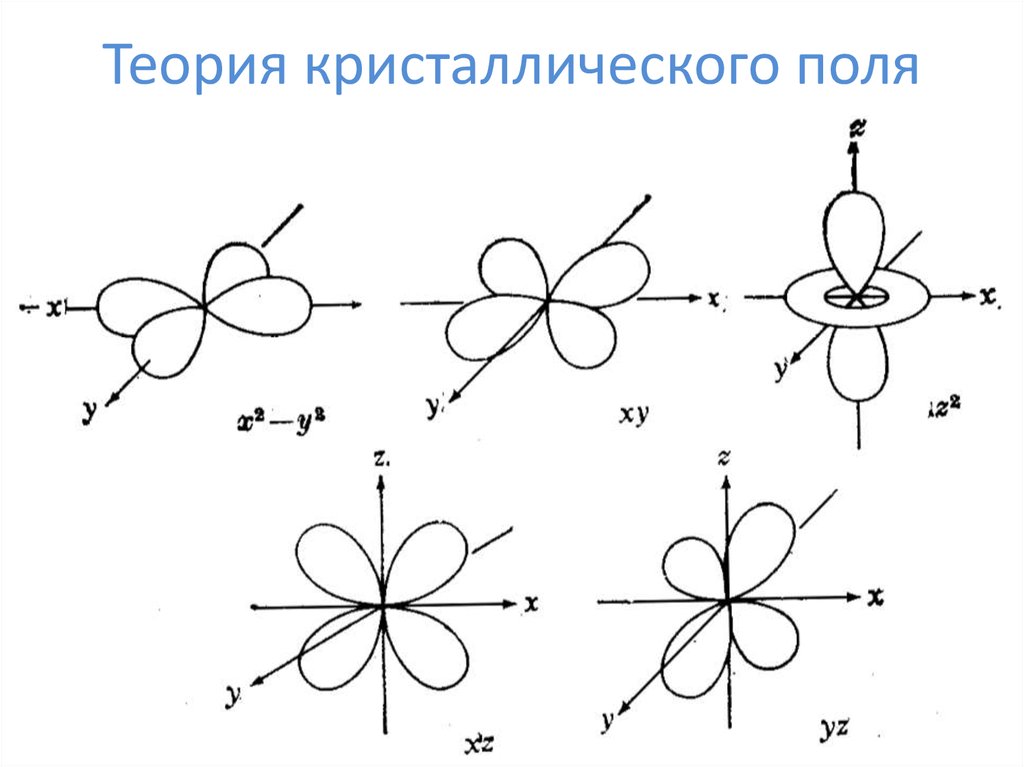
22. Теория кристаллического поля
• Позволяет предсказать магнитные свойства(число неспаренных электронов)
• Позволяет оценить устойчивость комплекса
и его реакционноспособность
• Позволяет сравнить устойчивость
октаэдрического и тетраэдрического
окружения
• Позволяет предсказать искажение формы
комплекса по определённой оси
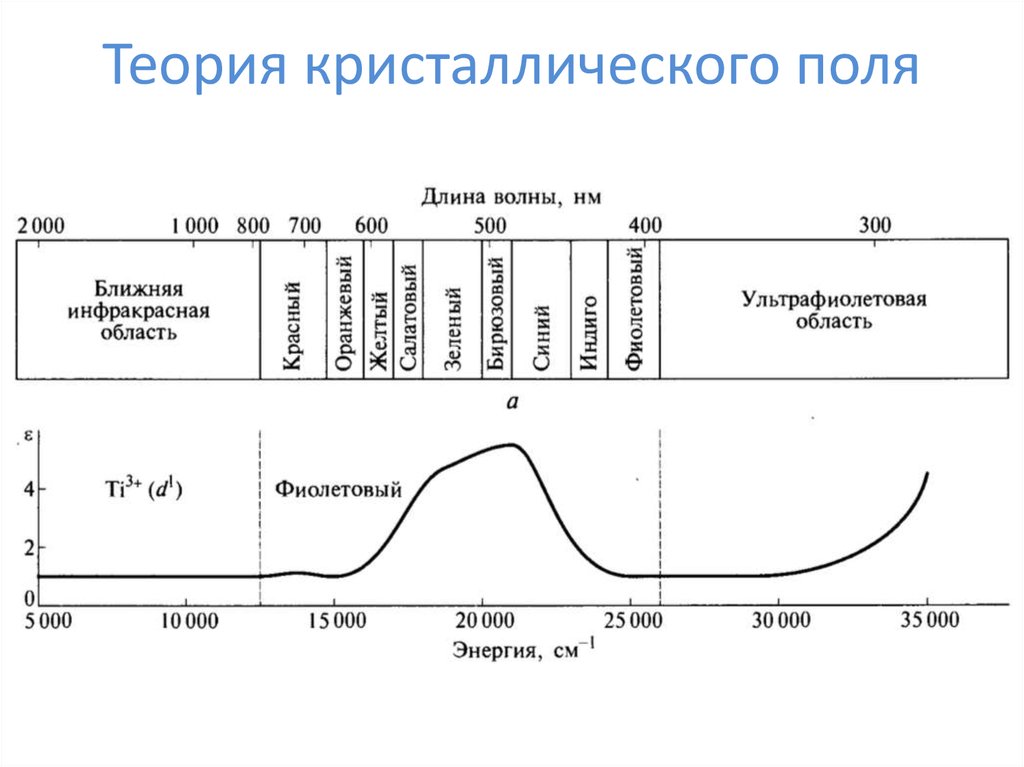
23. Теория кристаллического поля
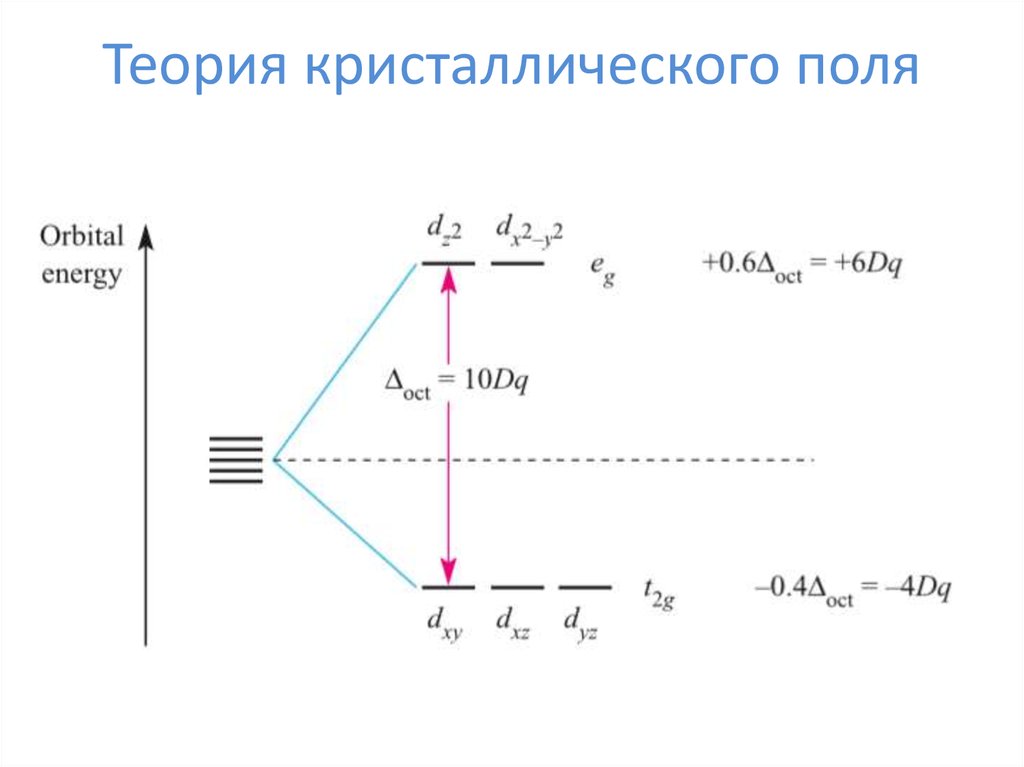
24. Теория кристаллического поля
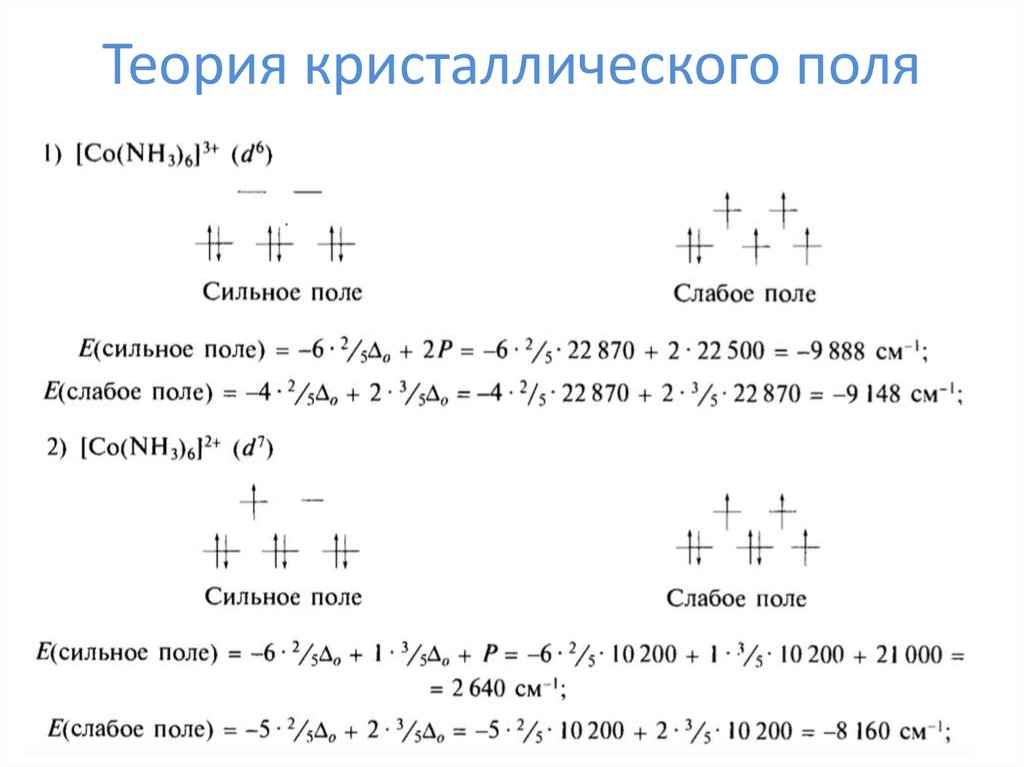
ΔоЭнергия стабилизации
кристаллическим полем
ЭСКП = n*⅖Δо – m*⅗Δо – kP
n – число электронов на t2g
m – число электронов на eg
k – число спариваний
P – энергия спарисания
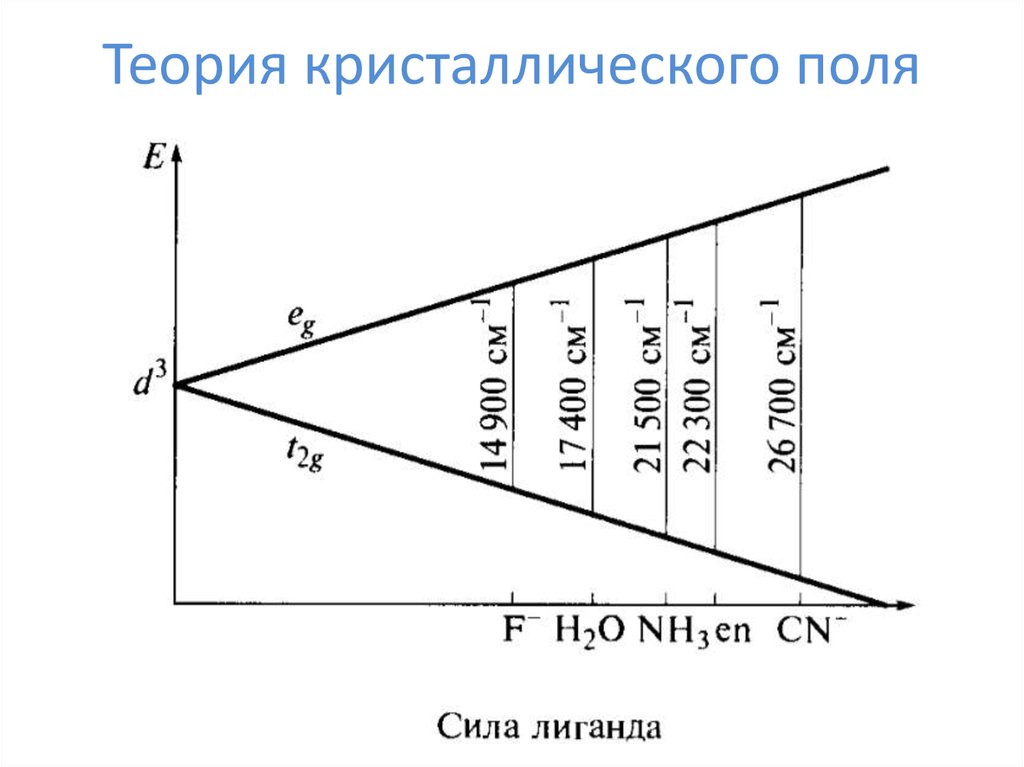
25. Теория кристаллического поля
26. Теория кристаллического поля
27. Теория кристаллического поля
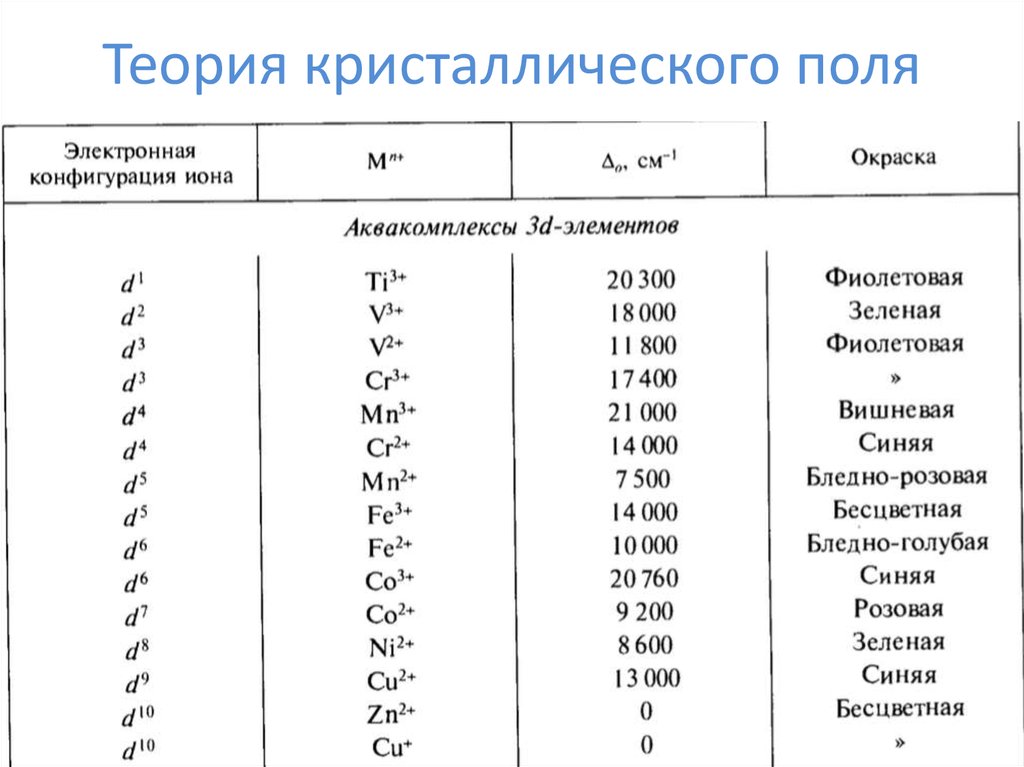
28. Теория кристаллического поля
29. Теория кристаллического поля
30. Теория кристаллического поля
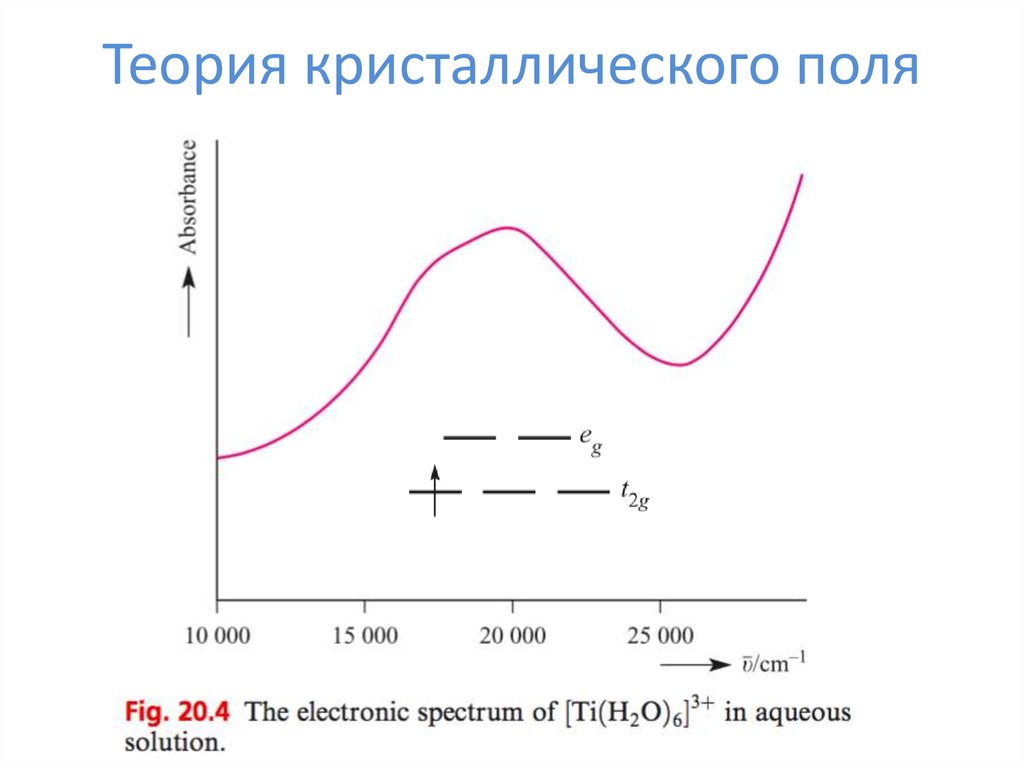
31. Теория кристаллического поля
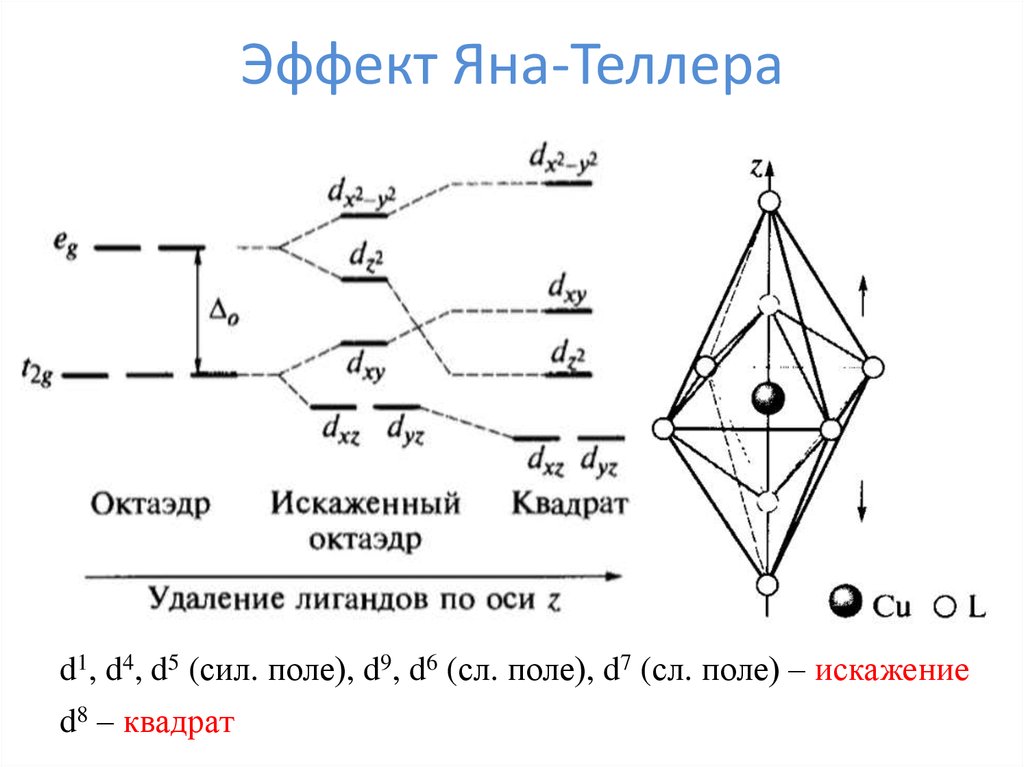
32. Эффект Яна-Теллера
d1, d4, d5 (сил. поле), d9, d6 (сл. поле), d7 (сл. поле) – искажениеd8 – квадрат
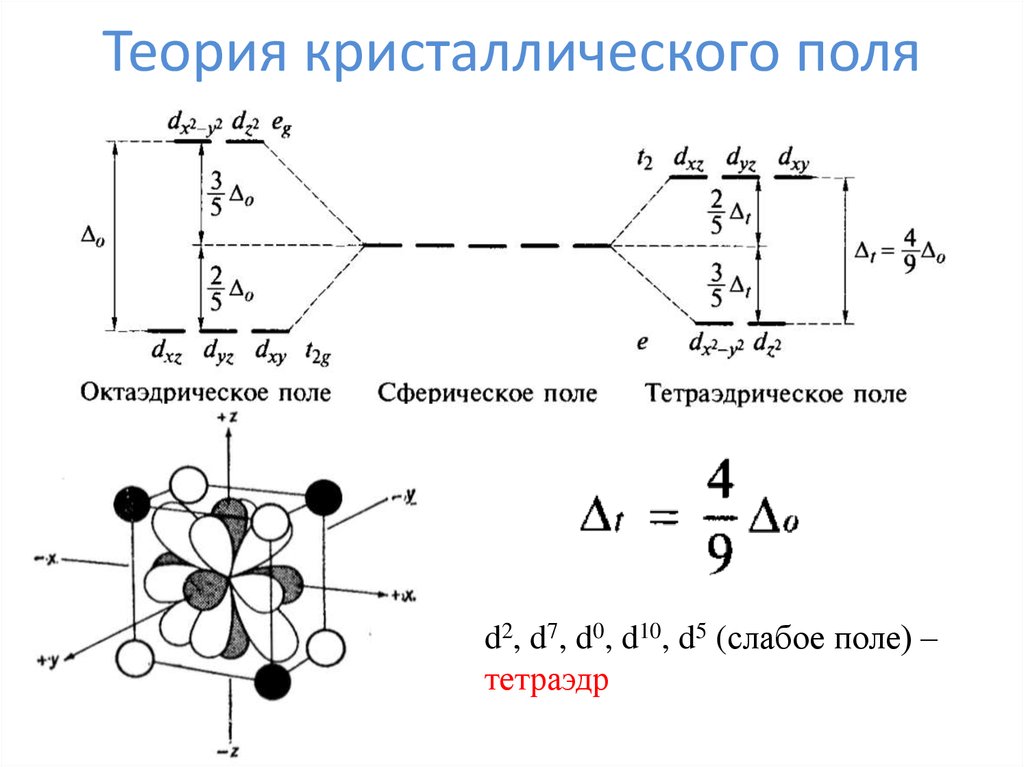
33. Теория кристаллического поля
d2, d7, d0, d10, d5 (слабое поле) –тетраэдр
34. Личные контакты
• Страница VK: Никита Шлапаков• Электронная почта: shlapakovns@gmail.com
• Консультации, советы по подготовке
химическая литература














 Химия
Химия








