Похожие презентации:
Контрольная работа. Разбор. 9 класс
1.
Урок 9 класса.Разбор контрольная работа
2.
К/Р1. Cu2S + O2 -> Cu2O + SO2
2. Cu2S + O2 -> CuO + SO2
3. Cu2S + O2 -> CuO + S
3.
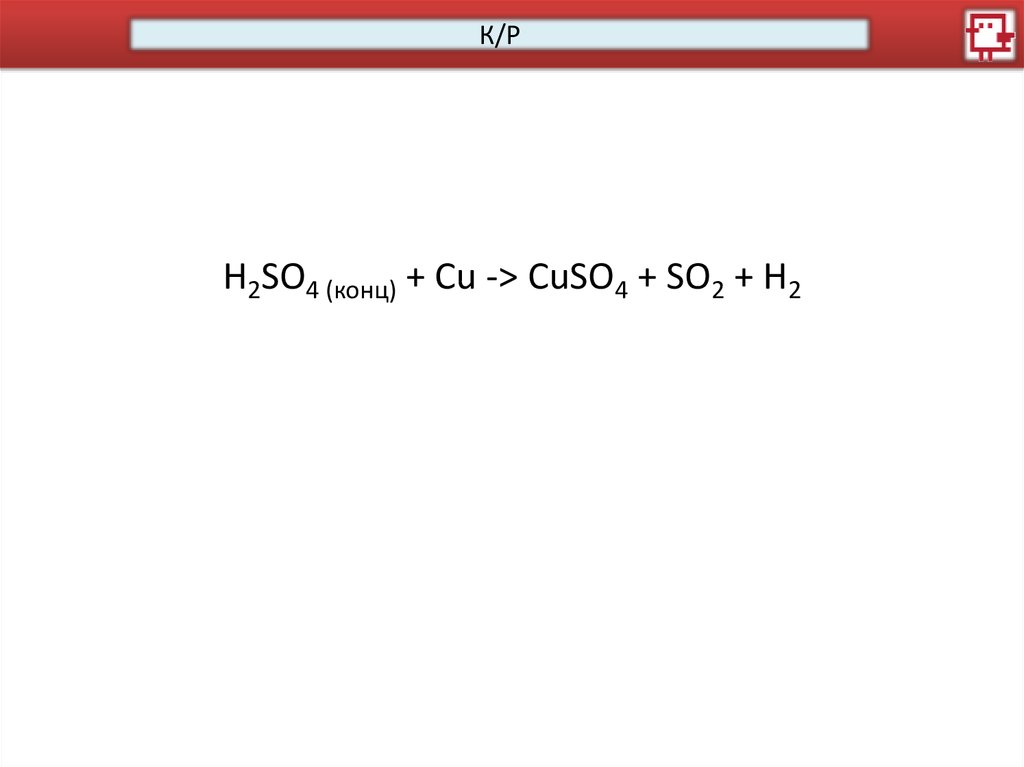
К/РH2SO4 (конц) + Cu -> CuSO4 + SO2 + H2
4.
К/РH2SO4 (конц) + C -> H2O + CO2 + SO2
5.
К/РSCl2O + Br2 + H2O -> H2SO4 + HCl + HBr
Тионилхлорид/
оксидихлорид серы
6.
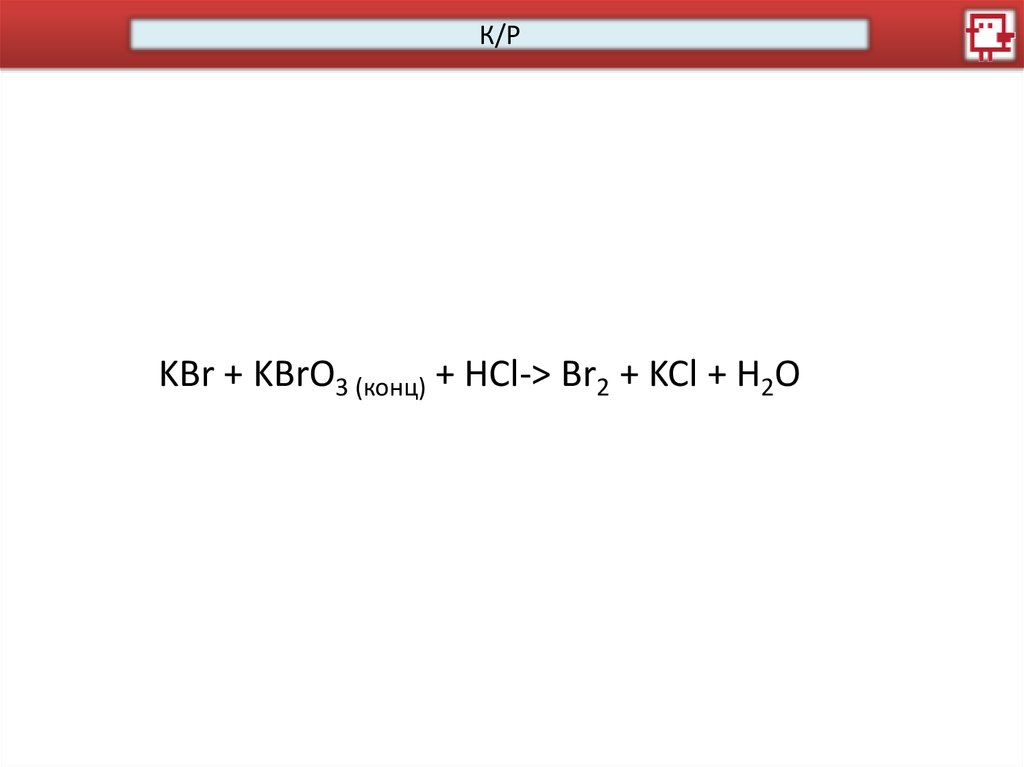
К/РKBr + KBrO3 (конц) + HCl-> Br2 + KCl + H2O
7.
К/РKBr + KMnO4 + H2SO4 -> Br2 + MnSO4 + H2O + K2SO4
8.
К/РCe(SO4)2 + H2O2 -> Ce(SO4)3 + O2 + H2SO4
9.
К/РKMnO4 + KHSO3 -> K2SO4 + KHSO4 + MnO2 + H2O
10.
6я группа элементов28.11.2016
3е занятие 2го триместра
11.
Распространенность6я группа главная подгруппа содержит элементы:
О
S
Se
Te
На долю кислорода приходится около 50% массы земной коры и
90% массы мирового океана.
Сера встречается в природных условиях в виде залежей
самородной серы и входит в состав сульфидных руд. Земная кора
содержит около 0,03%; морская вода 0.1%
12.
Химические свойства кислородаО – второй по электроотрицательности элемент.
С большинством металлов О реагирует при комнатной
температуре, образую основные оксиды.
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
C неметаллами (за исключением инертных газов) О реагирует при
нагревании.
Р + О2 (60оС) -> Р2О5
S + O2 (250оС) -> SO2
C + O2 (700оС) -> CO2
Реагирует со сложными веществами:
2H2S + O2 -> 2S + 2H2O
2H2S + O2 -> 2SО2 + 2H2O
13.
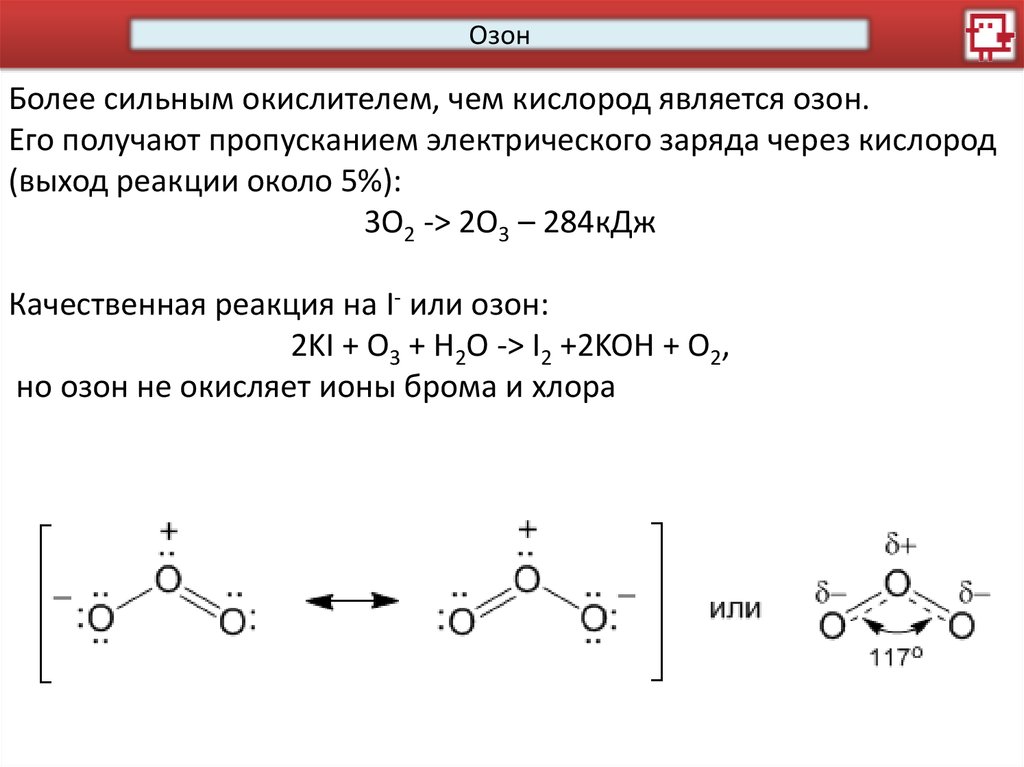
ОзонБолее сильным окислителем, чем кислород является озон.
Его получают пропусканием электрического заряда через кислород
(выход реакции около 5%):
3O2 -> 2O3 – 284кДж
Качественная реакция на I- или озон:
2KI + O3 + H2O -> I2 +2KOH + O2,
но озон не окисляет ионы брома и хлора
14.
ПолучениеВ промышленности получают:
1) Фракционной перегонкой жидкого воздуха (разность
температур конденсации)
2) Электролизом воды
В лаборатории:
2KMnO4 -> K2MnO4 + MnO2 + O2
4K2Cr2O7 -> 4K2CrO4 + 2Cr2O3 + 3O2
2H2O ->2H2O + O2 (самый простой способ)
15.
СераПри комнатной температуре сера реагирует со фтором, хлором и
концентрированными кислотами-окислителями (HNO3, H2SO4):
S + 3F2 -> SF6
S + Cl2 = SCl2
S + 6HNO3 (конц) = H2SO4 + 6 NO2 + 2H2O
S + 2H2SO4 (конц) = 3SO2 + 2H2O
Также при комнатной температуре протекает реакция со ртутью:
Hg + S = HgS
При нагревании:
2P + 3S -> P2S3
H2 + S <-> H2S + 20.6 кДж
Fe + S -> FeS
C щелочами:
2S + 6KOH -> K2SO4 + 2K2S + 3H2O
16.
СероводородСероводород – бесцветный и очень токсичный газ с запахом тухлых
яиц.
Получение в лаборатории:
FeS + 2HCl -> FeCl2 + H2S
Al2S3 + 6H2O -> 2Al(OH)3 + 3H2S
H2S – типичный восстановитель:
H2S + Br2 -> S + 2HBr
А так же, слабая кислота
Pb(OH)2 + H2S -> PbS + 2H2O
17.
Сернистый газ. Сернистая кислотаSO2 + H2O <-> H2SO3
Сернистый газ можно получить при взаимодействии:
Me + 2H2SO4 (конц) -> CuSO4 + SO2 + 2H2O
H2S + O2 -> SO2 + H2O
Характерные реакции:
• Реакции, протекающие без изменения степени окисления:
Ca(OH)2 + SO2 -> CaSO3 + H2O
• Реакции с повышением степени окисления до +6
Na2SO3 + Cl2 + H2O -> Na2SO4 + 2HCl
• Реакции протекающие с понижением степени окисления
2H2S + H2SO3 -> 3S + 3H2O
• Реакции самооксиления-самовосстановления
• NaSO3 + S -> Na2S2O3
18.
Ангидрид серной кислоты. Серная кислота.Получение ангидрида серной кислоты (SO3) при катализаторе Pt
или V2O5
2SO2 + O2 -> 2SO3 + Q
SO3 + H2O = H2SO4
Олеум – раствор SO3 в 100%-ной серной кислоте.
Разбавленная серная кислота окисляет только металлы, стоящие в
ряду напряжений до водорода:
Zn + H2SO4 (разб) = ZnSO4 + H2
При прокаливании:
ZnSO4 = ZnO + SO3
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Ag2SO4 = 2Ag + SО2 + O2
Концентрированная кислота реагирует:
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
Пассируются: алюминий, хром и железо.















 Химия
Химия








