Похожие презентации:
Физика для химиков. День первый - термодинамика
1. Физика для химиков
ФИЗИКА ДЛЯ ХИМИКОВДЕНЬ ПЕРВЫЙ - ТЕРМОДИНАМИКА
2. Химические реакции и теплота
ХИМИЧЕСКИЕ РЕАКЦИИ И ТЕПЛОТАCH4 + 2O2 = CO2 + 2H2O + 2783 кДж/моль
NaOH + HCl = NaOH + H2O + 55,9 кДж/моль
C2H4Cl2 = CH2CH2Cl + HCl – 73 кДж/моль
3. Внутренняя энергия
ВНУТРЕННЯЯ ЭНЕРГИЯПоступательное движение
Вращение
Колебания
Электростатическое и магнитное
взаимодействие
5) Все-все-все!
1)
2)
3)
4)
Точное значение неизвестно. Измеряется
изменение.
4. Энергия не может взяться из ниоткуда и исчезнуть в никуда (это важно)
ЭНЕРГИЯ НЕ МОЖЕТ ВЗЯТЬСЯ ИЗ НИОТКУДА ИИСЧЕЗНУТЬ В НИКУДА (ЭТО ВАЖНО)
5. Первое начало термодинамики
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИQ = ΔU + W
Работа только
по расширению газа
Q = ΔU + p ΔV
Q = ΔH - V Δp
(H = U+pV)
H - Энтальпия
6. Внутренняя энергия и энтальпия
ВНУТРЕННЯЯ ЭНЕРГИЯ И ЭНТАЛЬПИЯQ = ΔH - V Δp
Q = ΔU + p ΔV
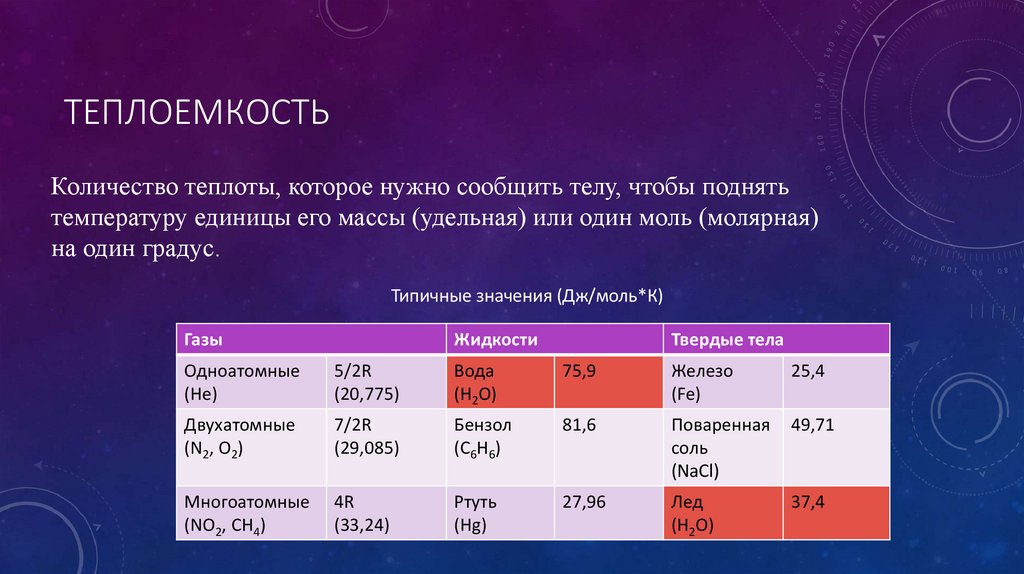
Метод измерения
Результат измерения
P = const
ΔH
V = const
ΔU
Имеет значение только для процессов с участием газов (хим. реакции,
Термическое расширение)
7. Тепловой эффект реакции
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИQ – функция состояния
(это важно)
aA+bB = dD+eE ± Q
CH4 + 2O2 = CO2 + 2H2O + 2783 кДж/моль
NaOH + HCl = NaOH + H2O + 55,9 кДж/моль
∆H = ∆H1 + ∆H2
C2H4Cl2 = CH2CH2Cl + HCl – 73 кДж/моль
∆H > 0 − энергия поглощается
∆H < 0 − энергия выделяется
8. Реакции можно и нужно складывать и вычитать
РЕАКЦИИ МОЖНО И НУЖНО СКЛАДЫВАТЬ ИВЫЧИТАТЬ
CH4 + Cl2 = CH3Cl + HCl
CH3Cl + Cl2 = CH2Cl2 + HCl
S+O2 = SO2
2SO2+O2 = 2SO3
2
CH4 + Cl2 + CH3Cl + Cl2 = CH3Cl + HCl + CH2Cl2 + HCl
CH4 + 2Cl2 = CH2Cl2 + 2 HCl
∆H = ∆H1 + ∆H2
2S+2O2 + 2SO2+O2 = 2SO3 + 2SO2
2S + 3O2 = 2SO3
∆H = 2∆H1 + ∆H2
9. Задание: какое количество теплоты выделится или поглотится при газификации угля
ЗАДАНИЕ: КАКОЕ КОЛИЧЕСТВО ТЕПЛОТЫ ВЫДЕЛИТСЯИЛИ ПОГЛОТИТСЯ ПРИ ГАЗИФИКАЦИИ УГЛЯ
С + 2H2 = CH4
∆H = ?
СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
С(тв) + O2(г) = СO2(г) + 394 кДж
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
10. Стандартная теплота образования
СТАНДАРТНАЯ ТЕПЛОТА ОБРАЗОВАНИЯC + 1/2O2 = CO
∆















 Физика
Физика Химия
Химия








