Похожие презентации:
Основы генной инженерии и биотехнологии. Лекция 4
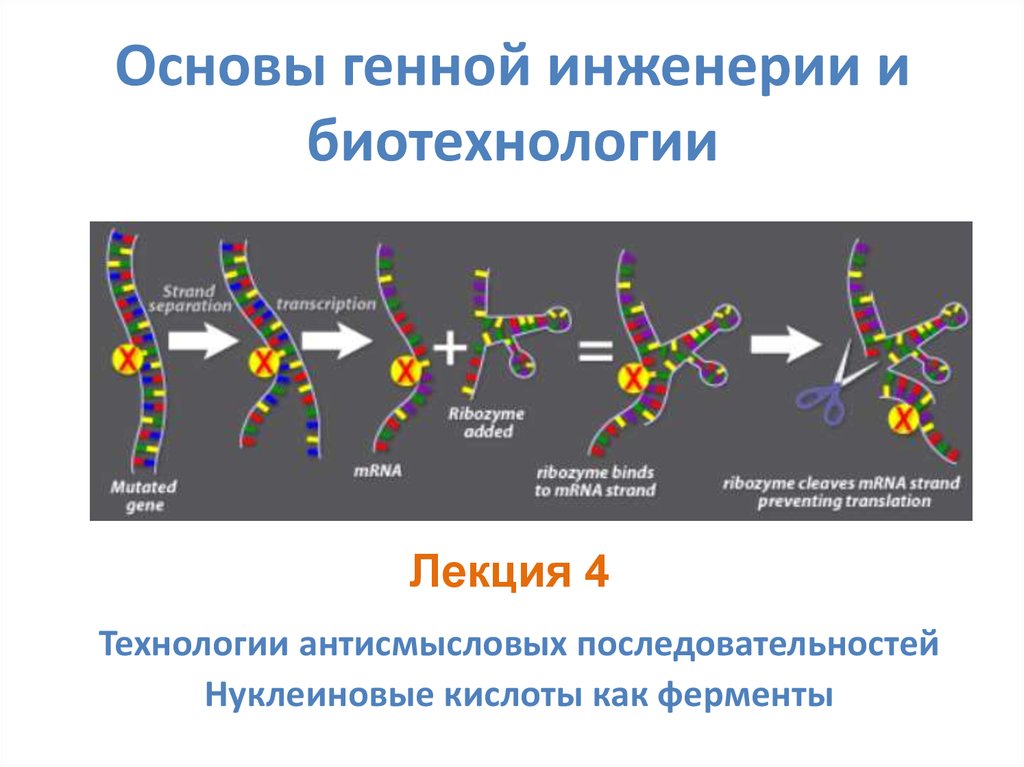
1. Основы генной инженерии и биотехнологии
Лекция 4Технологии антисмысловых последовательностей
Нуклеиновые кислоты как ферменты
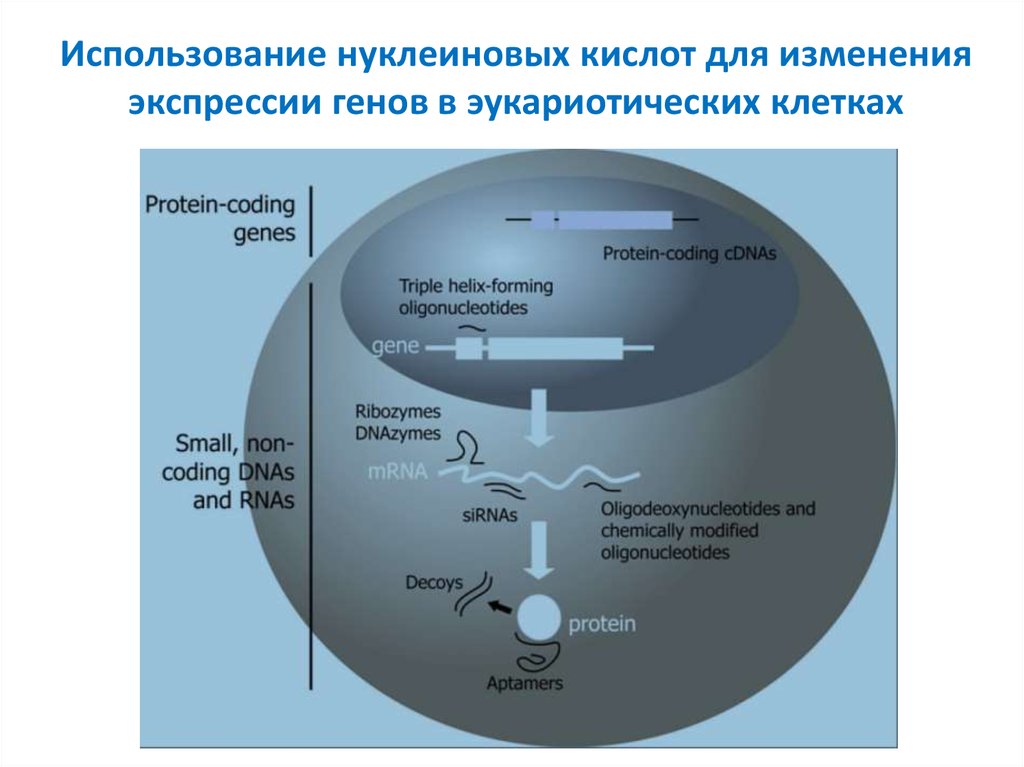
2. Использование нуклеиновых кислот для изменения экспрессии генов в эукариотических клетках
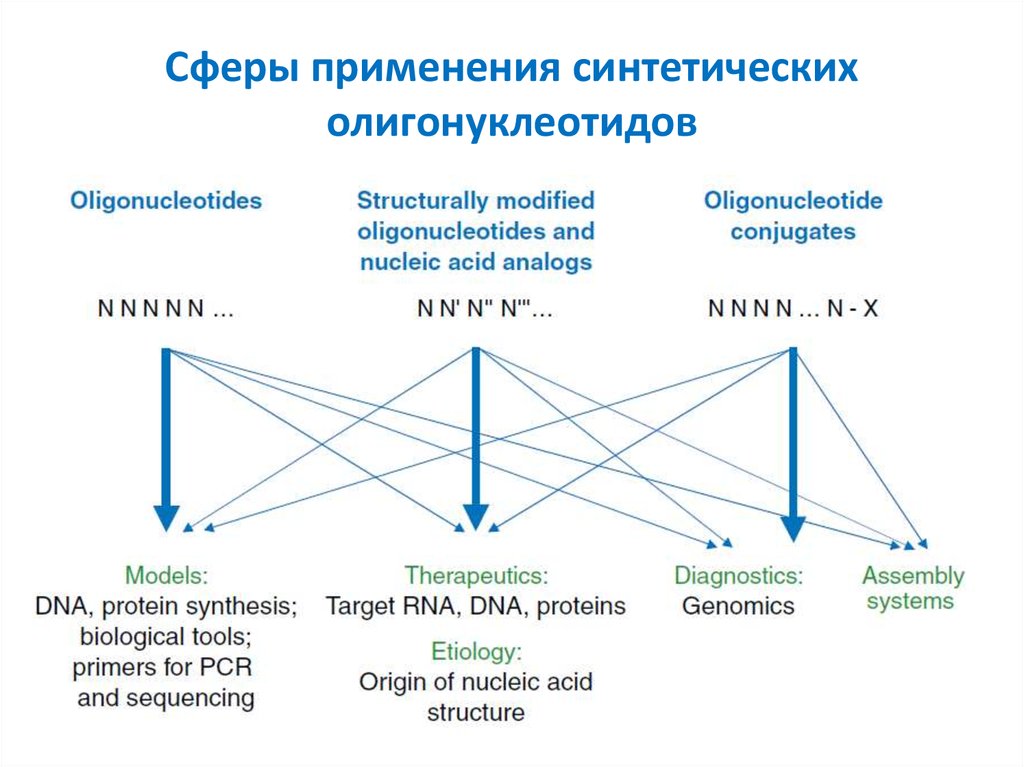
3. Сферы применения синтетических олигонуклеотидов
4. Механизмы подавления трансляции антисмысловыми олигодезоксирибонуклеотидами (ODN)
Трансляция внорме
ODN
Разрушение
РНК РНКазой H
Блок инициации
Блок элонгации
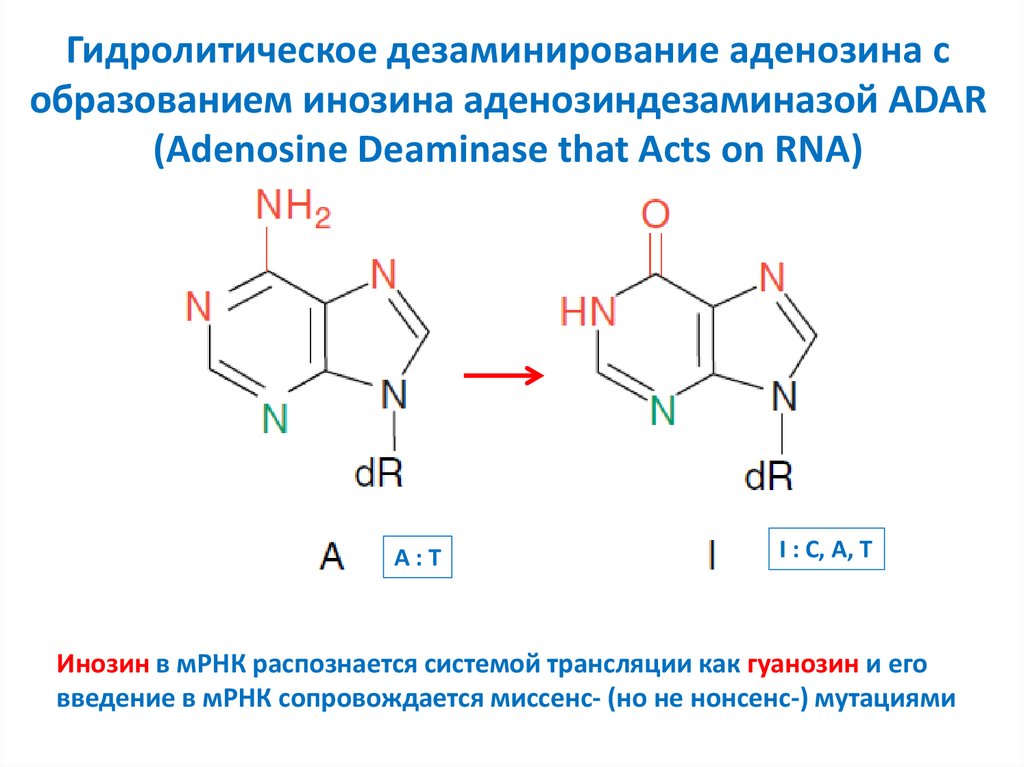
5. Гидролитическое дезаминирование аденозина с образованием инозина аденозиндезаминазой ADAR (Adenosine Deaminase that Acts on
RNA)A:T
I : C, A, T
Инозин в мРНК распознается системой трансляции как гуанозин и его
введение в мРНК сопровождается миссенс- (но не нонсенс-) мутациями
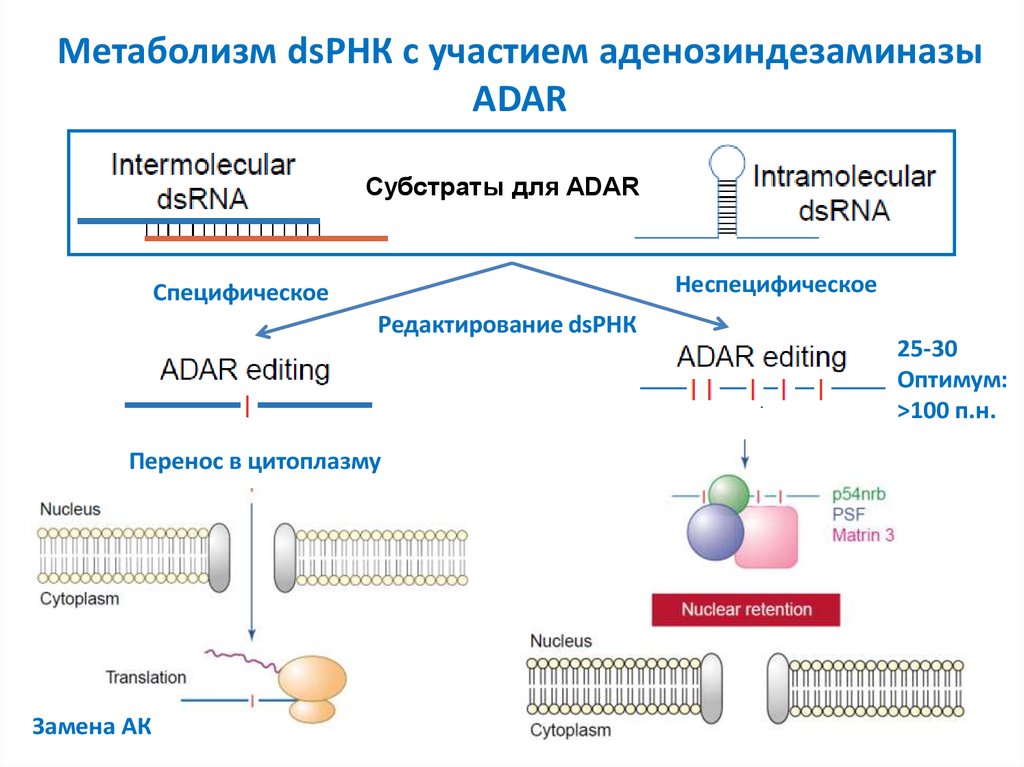
6. Метаболизм dsРНК с участием аденозиндезаминазы ADAR
Субстраты для ADARНеспецифическое
Специфическое
Редактирование dsРНК
Перенос в цитоплазму
Замена АК
25-30
Оптимум:
>100 п.н.
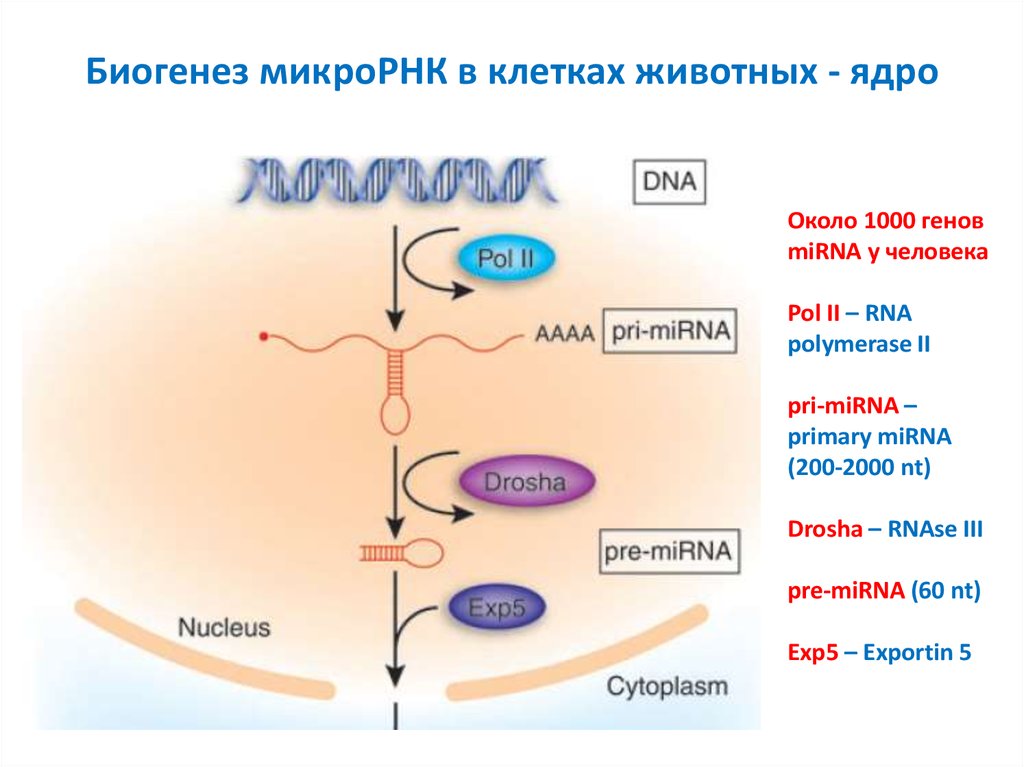
7. Биогенез микроРНК в клетках животных - ядро
Около 1000 геновmiRNA у человека
Pol II – RNA
polymerase II
pri-miRNA –
primary miRNA
(200-2000 nt)
Drosha – RNAse III
pre-miRNA (60 nt)
Exp5 – Exportin 5
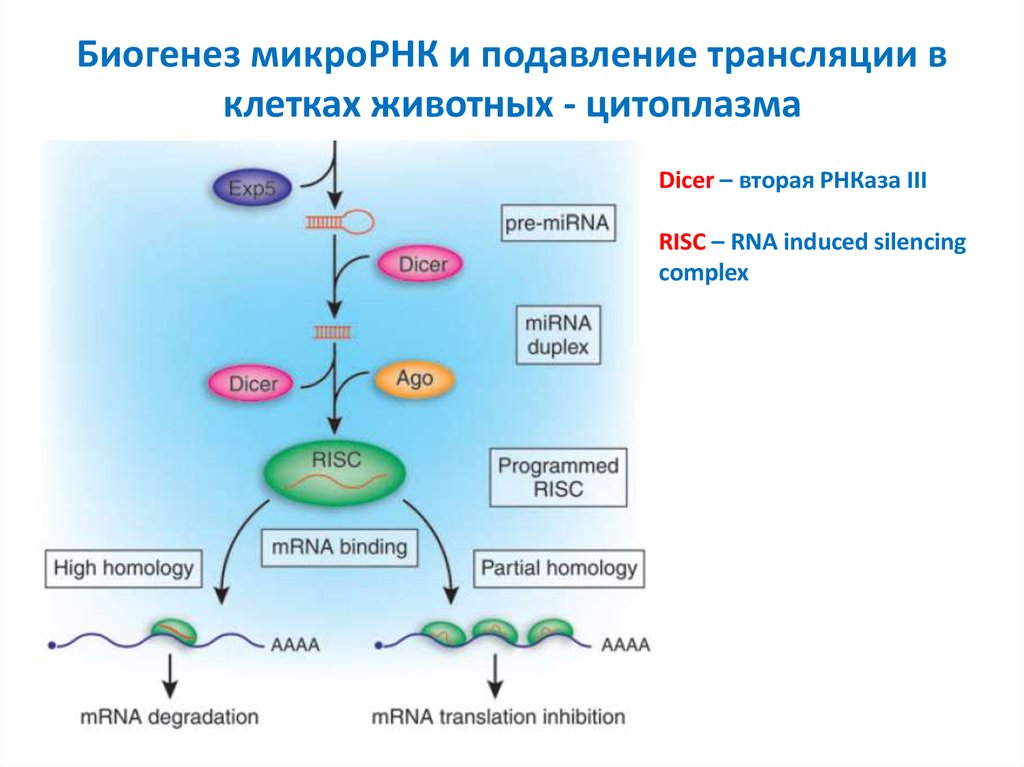
8. Биогенез микроРНК и подавление трансляции в клетках животных - цитоплазма
Dicer – вторая РНКаза IIIRISC – RNA induced silencing
complex
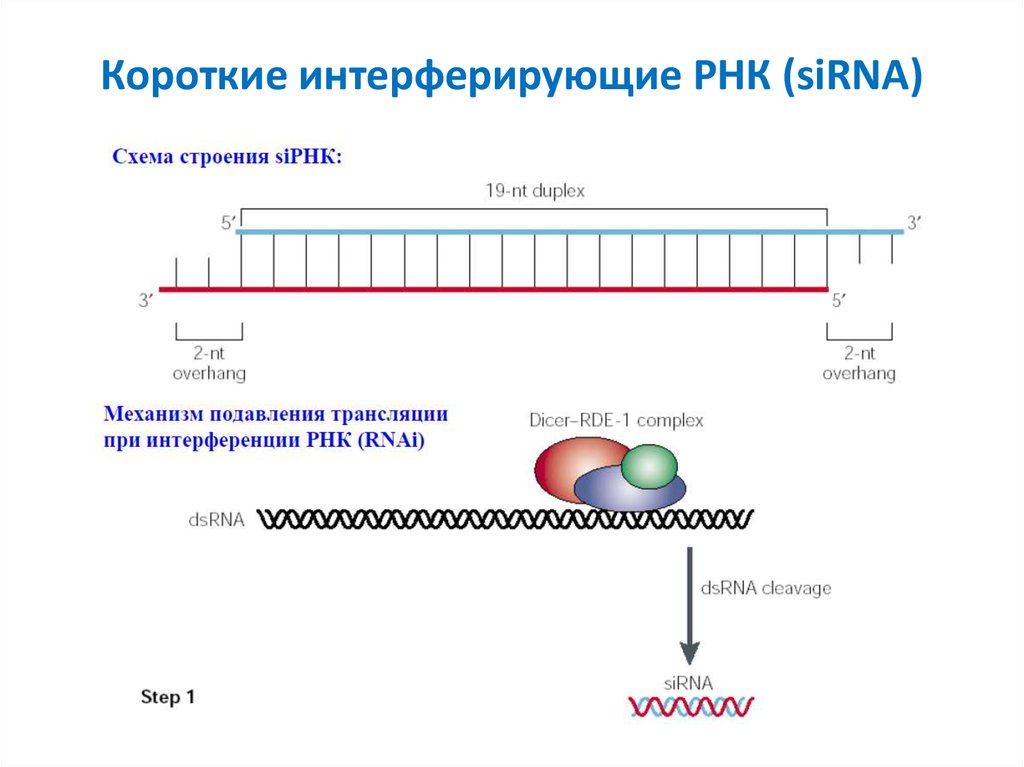
9. Короткие интерферирующие РНК (siRNA)
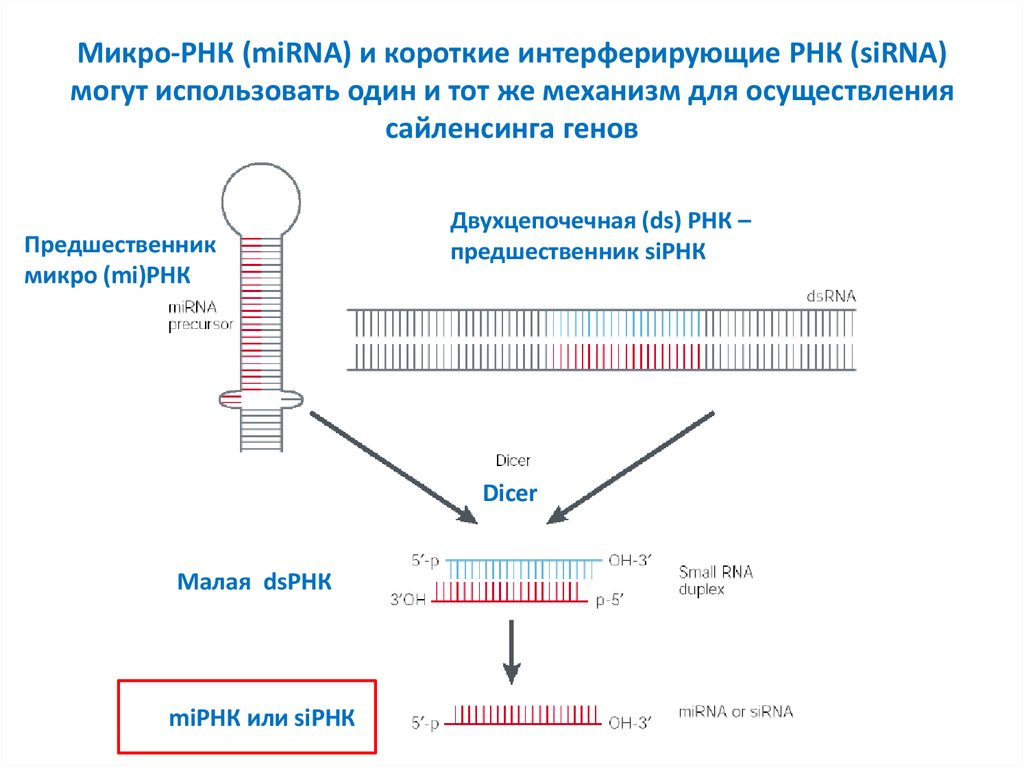
10. Микро-РНК (miRNA) и короткие интерферирующие РНК (siRNA) могут использовать один и тот же механизм для осуществления
сайленсинга геновПредшественник
микро (mi)РНК
Двухцепочечная (ds) РНК –
предшественник siРНК
Dicer
Малая dsРНК
miРНК или siРНК
11. Некоторые свойства антисмысловых олигодезоксирибонуклеотидов (ODN)
Механизм проникновения в клетку напоминаетэндоцитоз, опосредованный рецепторами
Высокие действующие концентрации
Низкая внутриклеточная стабильность (время
полужизни в ооцитах ~20 мин.
гапмеры (gapmer) – ODN, построенные из аналогов
нуклеотидов
Отсутствие иммунного ответа
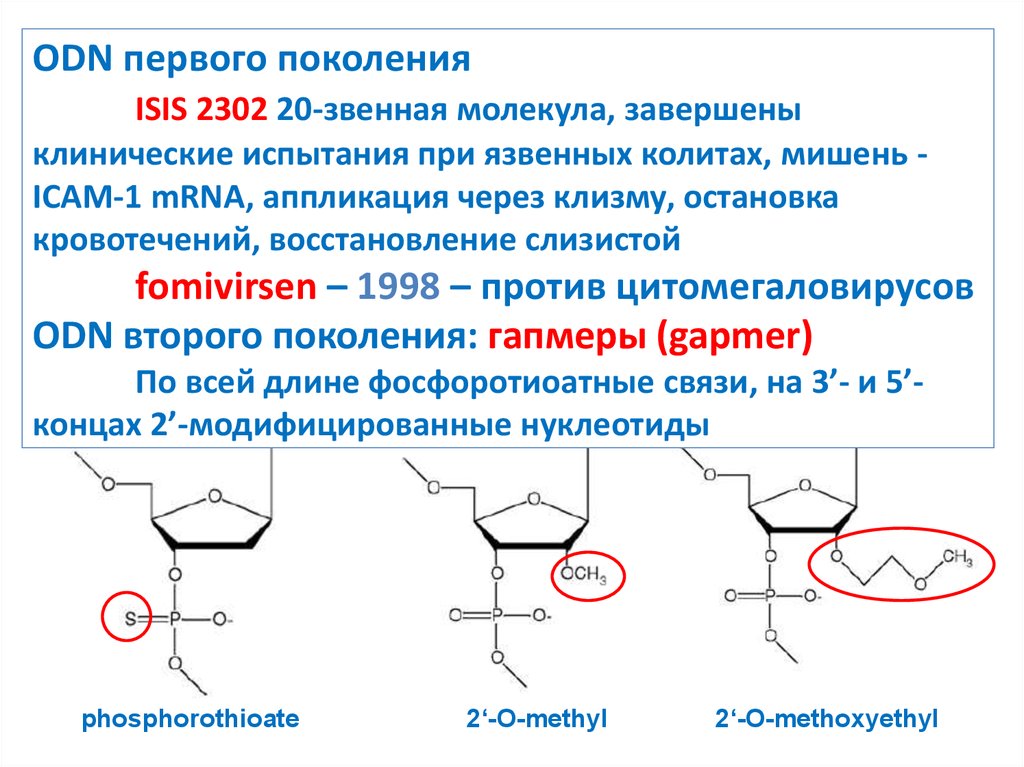
12. ODN первого поколения ISIS 2302 20-звенная молекула, завершены клинические испытания при язвенных колитах, мишень - ICAM-1
ODN первого поколенияISIS 2302 20-звенная молекула, завершены
клинические испытания при язвенных колитах, мишень ICAM-1 mRNA, аппликация через клизму, остановка
кровотечений, восстановление слизистой
fomivirsen – 1998 – против цитомегаловирусов
ODN второго поколения: гапмеры (gapmer)
По всей длине фосфоротиоатные связи, на 3’- и 5’концах 2’-модифицированные нуклеотиды
phosphorothioate
2‘-O-methyl
2‘-O-methoxyethyl
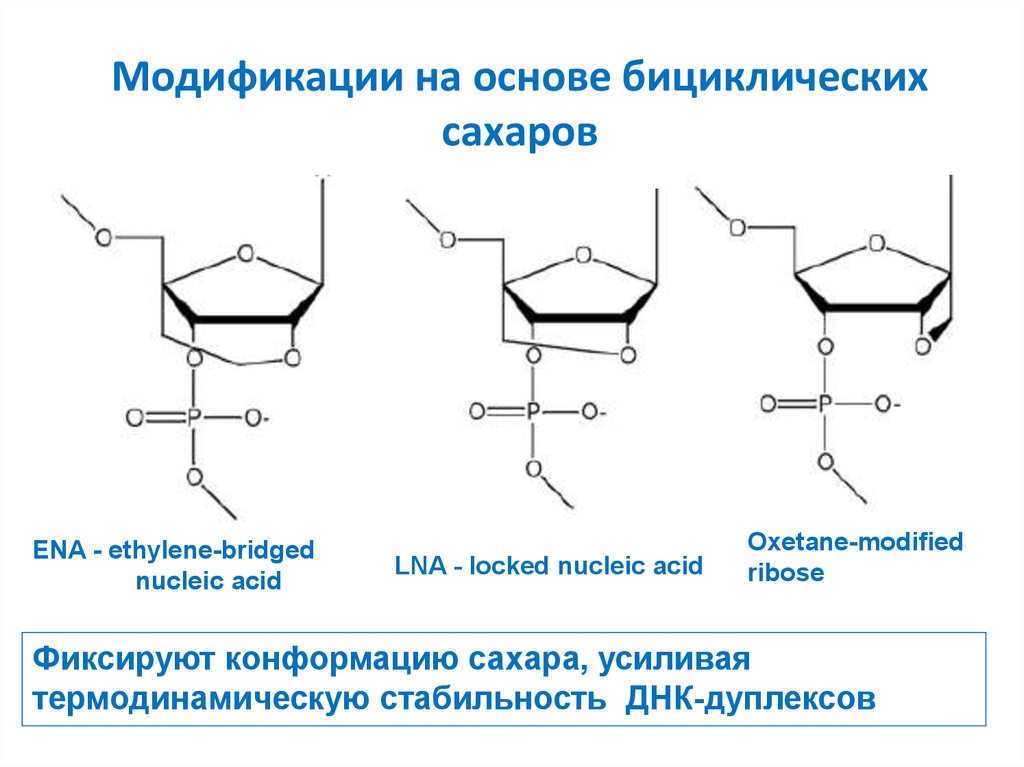
13. Модификации на основе бициклических сахаров
ENA - ethylene-bridgednucleic acid
LNA - locked nucleic acid
Oxetane-modified
ribose
Фиксируют конформацию сахара, усиливая
термодинамическую стабильность ДНК-дуплексов
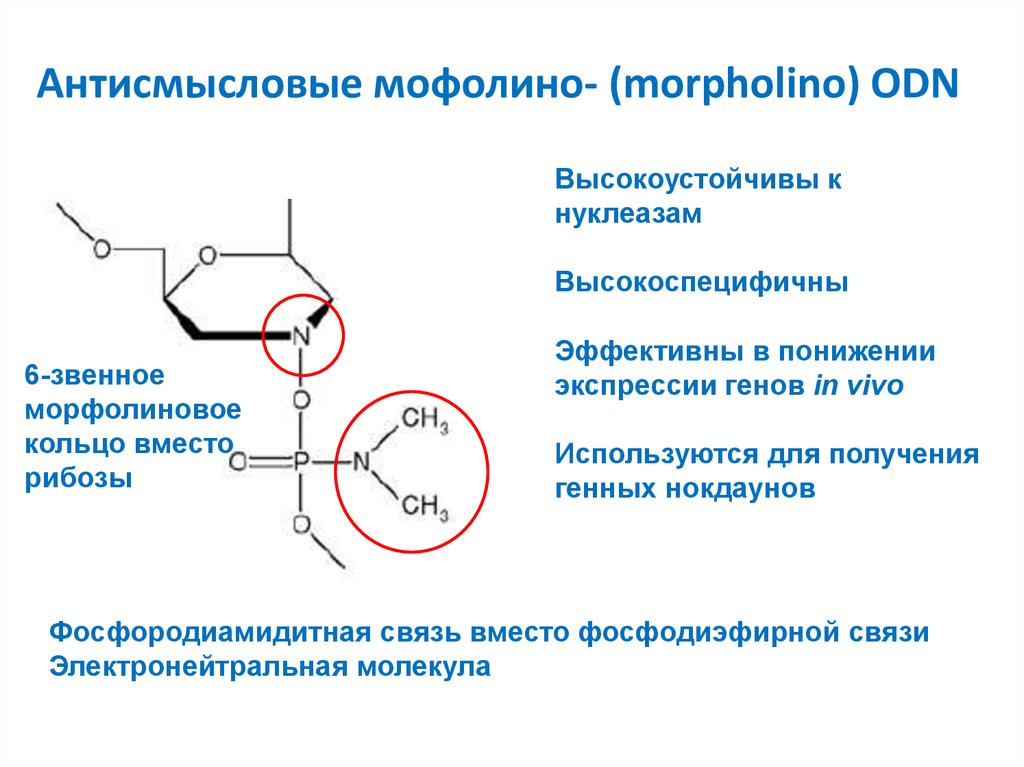
14. Антисмысловые мофолино- (morpholino) ODN
Высокоустойчивы кнуклеазам
Высокоспецифичны
6-звенное
морфолиновое
кольцо вместо
рибозы
Эффективны в понижении
экспрессии генов in vivo
Используются для получения
генных нокдаунов
Фосфородиамидитная связь вместо фосфодиэфирной связи
Электронейтральная молекула
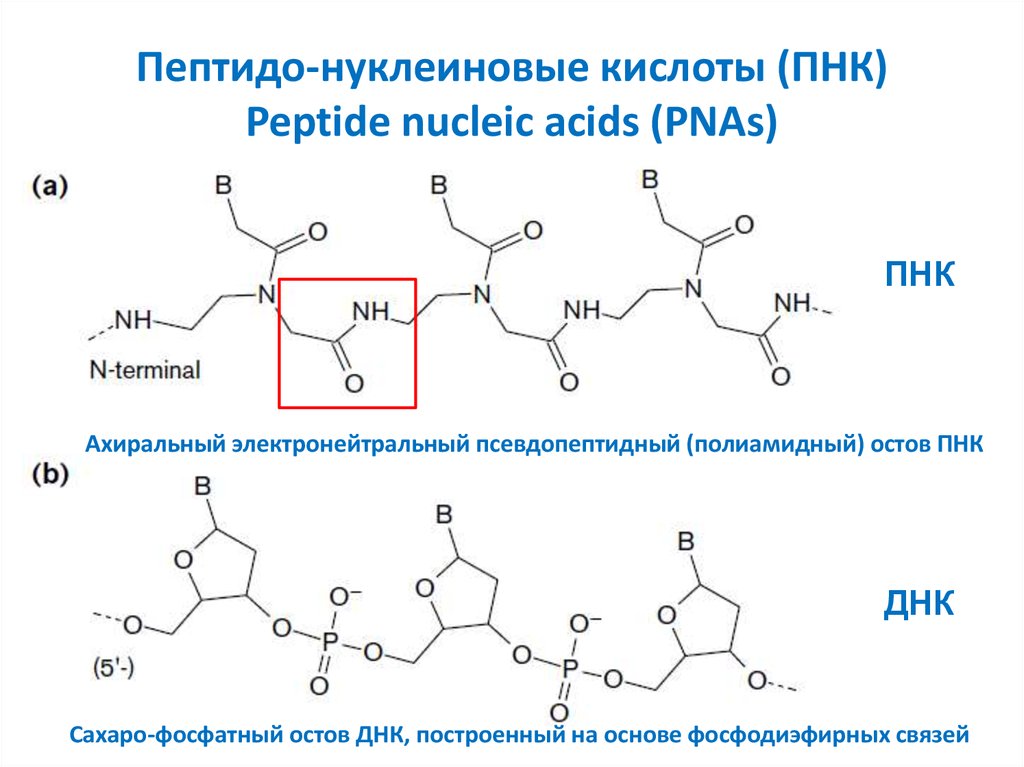
15. Пептидо-нуклеиновые кислоты (ПНК) Peptide nucleic acids (PNAs)
ПНКАхиральный электронейтральный псевдопептидный (полиамидный) остов ПНК
ДНК
Сахаро-фосфатный остов ДНК, построенный на основе фосфодиэфирных связей
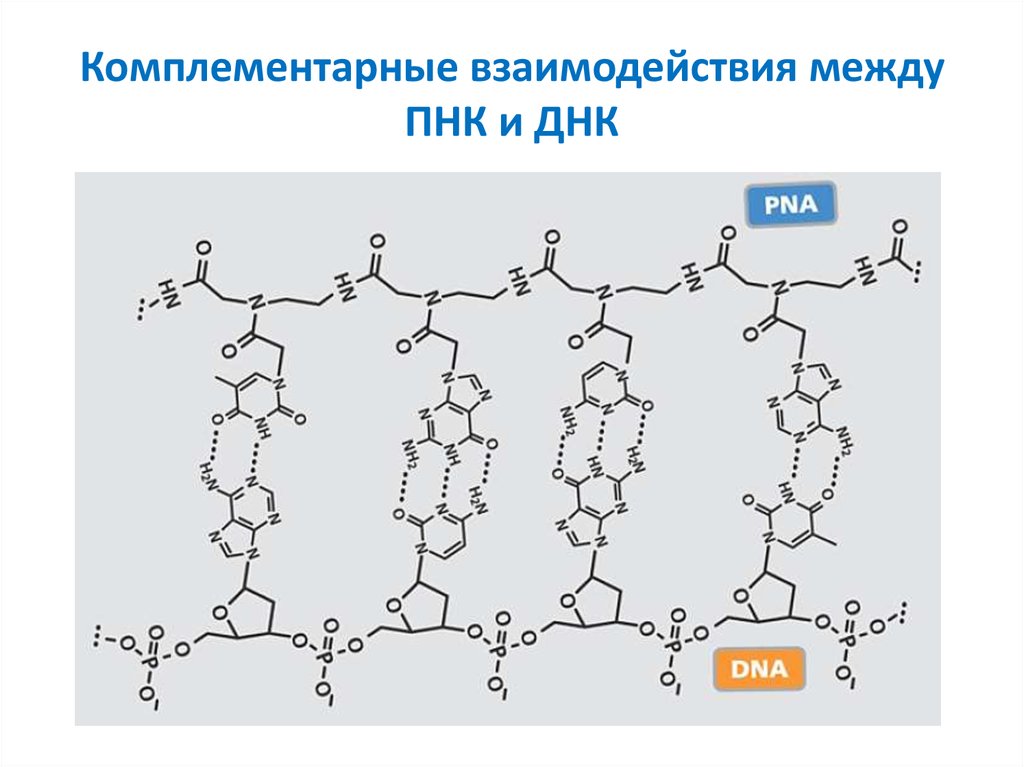
16. Комплементарные взаимодействия между ПНК и ДНК
17. Применение пептидо-нуклеиновых кислот
Антисмысловые и анти-генные стратегиимишени – мРНК (AUG-кодоны) и dsДНК (триплексы),
антимикробные агенты (мишень – 23S РНК)
Доставка лекарств и радиоизотопов к генам
Гибридизация с нуклеиновыми кислотами
Не могут быть праймерами в ПЦР, флуоресцентно-меченые зонды
для гибридизации in situ, MALDI-TOF масс-спектрометрия, биочипы
на основе ПНК
Аффинное выделение нуклеиновых кислот
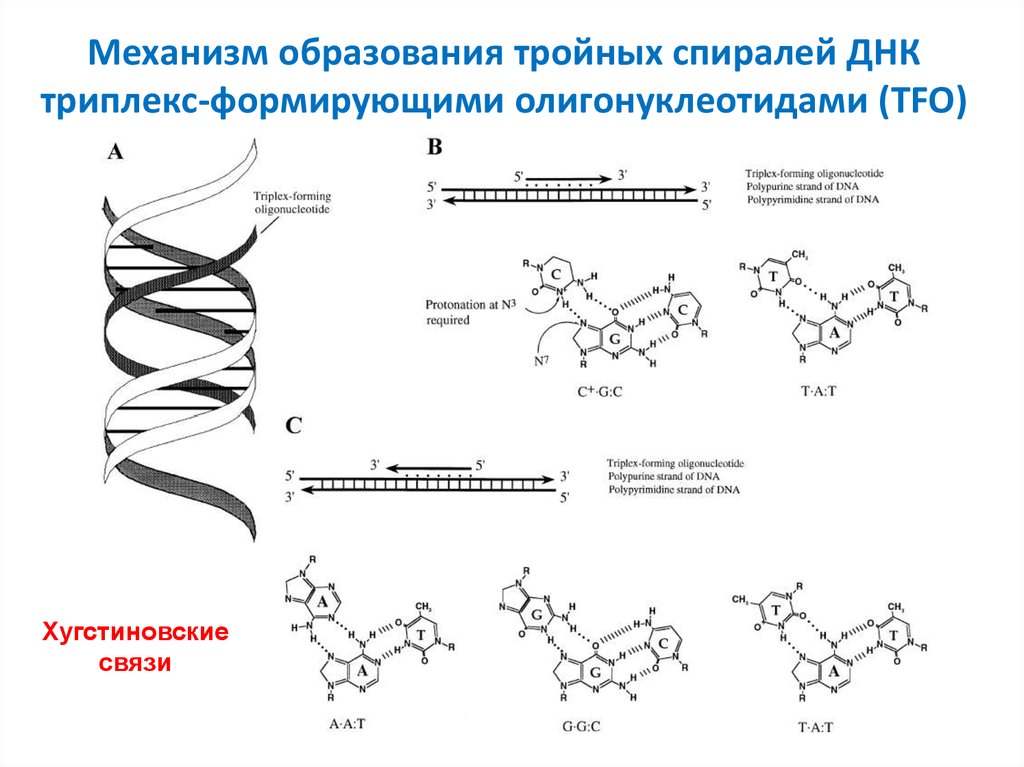
18. Механизм образования тройных спиралей ДНК триплекс-формирующими олигонуклеотидами (TFO)
Хугстиновскиесвязи
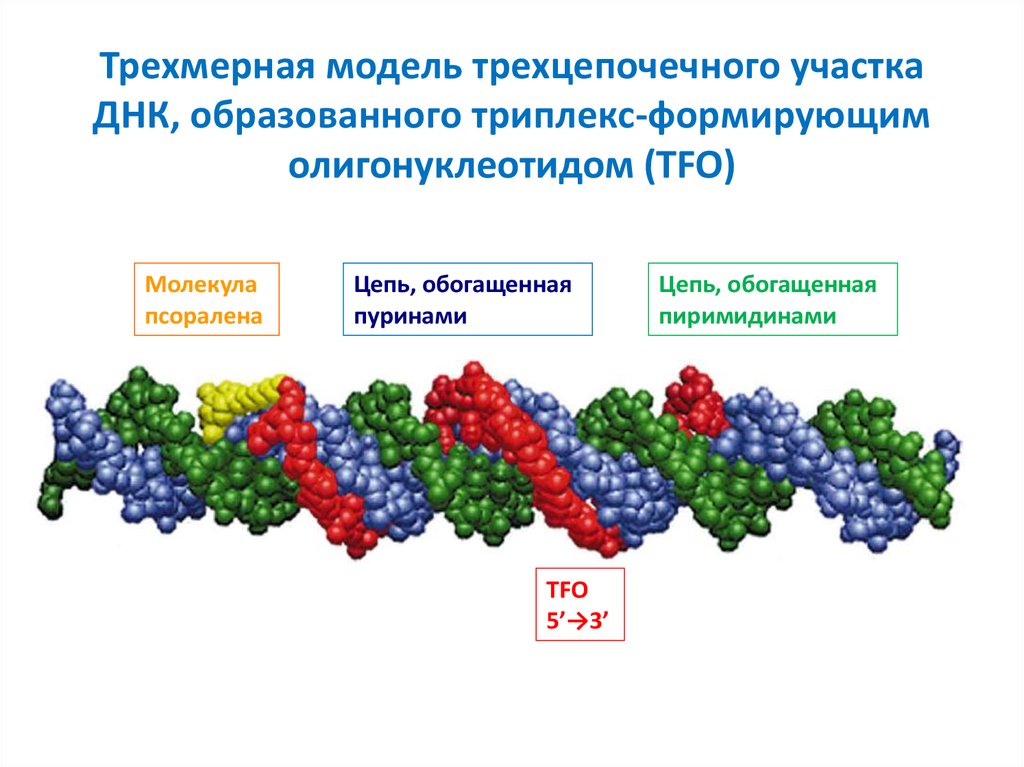
19. Трехмерная модель трехцепочечного участка ДНК, образованного триплекс-формирующим олигонуклеотидом (TFO)
Молекулапсоралена
Цепь, обогащенная
пуринами
TFO
5’→3’
Цепь, обогащенная
пиримидинами
20. Условия образования и свойства TFO
Взаимодействуют с гомопуриновой цепью ДНК по большойбороздке
Могут содержать в себе как пуриновый, так и пиримидиновый
мотивы
У пиримидиновых TFO (T·A:T) в парах C·G:C остаток C должен быть
протонирован по N3 (что происходит только при низких значениях pH)
Пуриновые TFO, а именно: A·A:T и G·G:C образуются независимо от
pH окружающей среды
Для TFO характерна высокая специфичность: 16-звенный TFO
взаимодействует с одним уникальным сайтом на 109 т.о.
TFO стабилизируются ионами Mg2+, Ca2+ и полиаминами
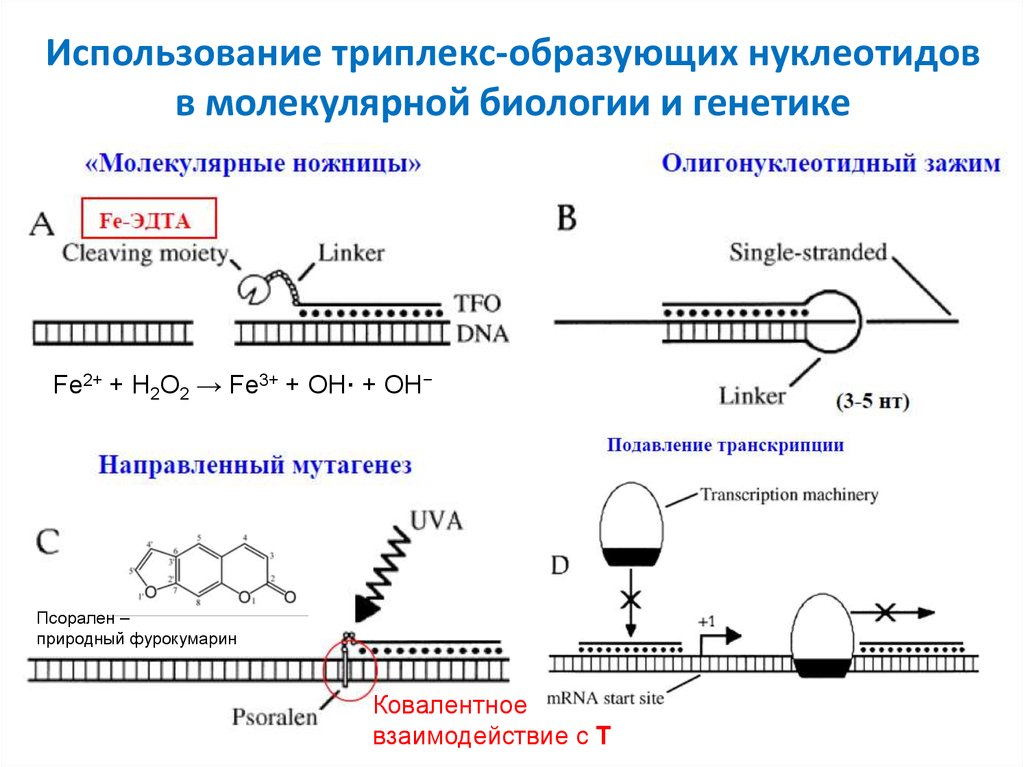
21. Использование триплекс-образующих нуклеотидов в молекулярной биологии и генетике
Fe2+ + H2O2 → Fe3+ + OH· + OH−Псорален –
природный фурокумарин
Ковалентное
взаимодействие c T
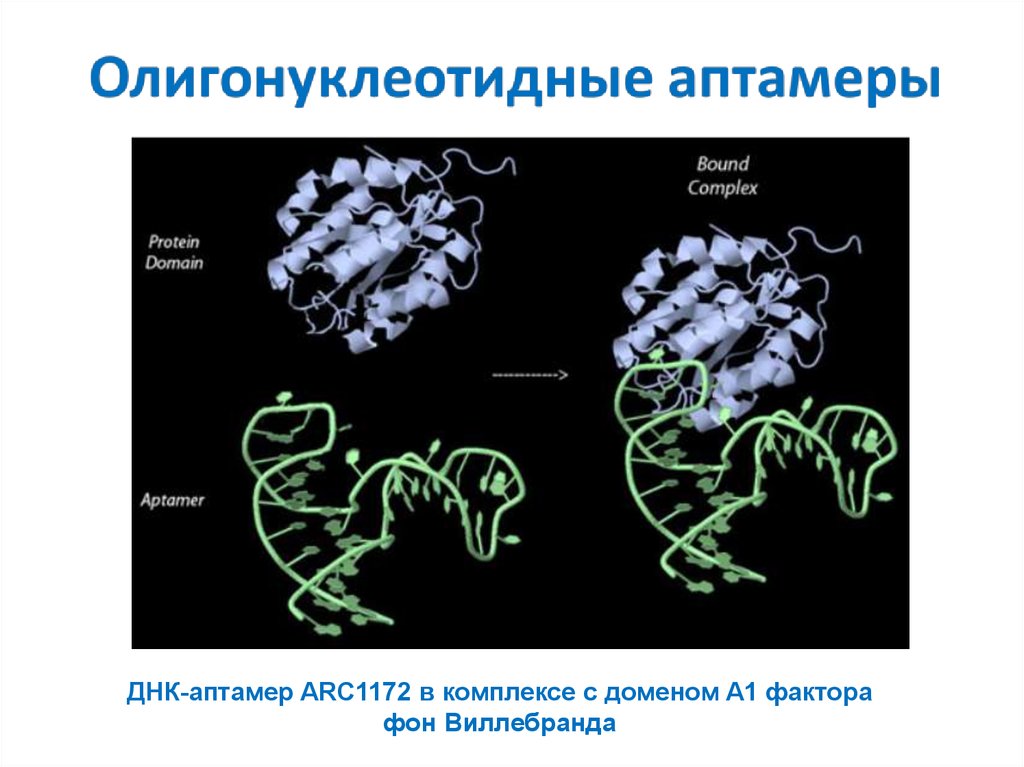
22.
ДНК-аптамер ARC1172 в комплексе с доменом A1 факторафон Виллебранда
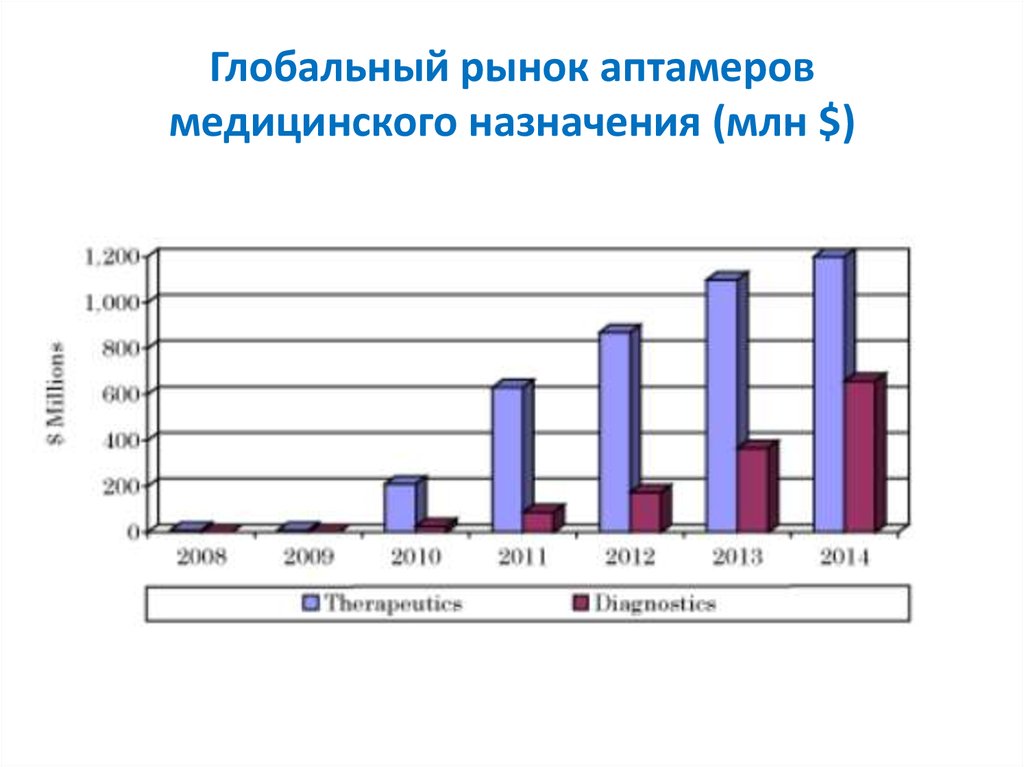
23. Глобальный рынок аптамеров медицинского назначения (млн $)
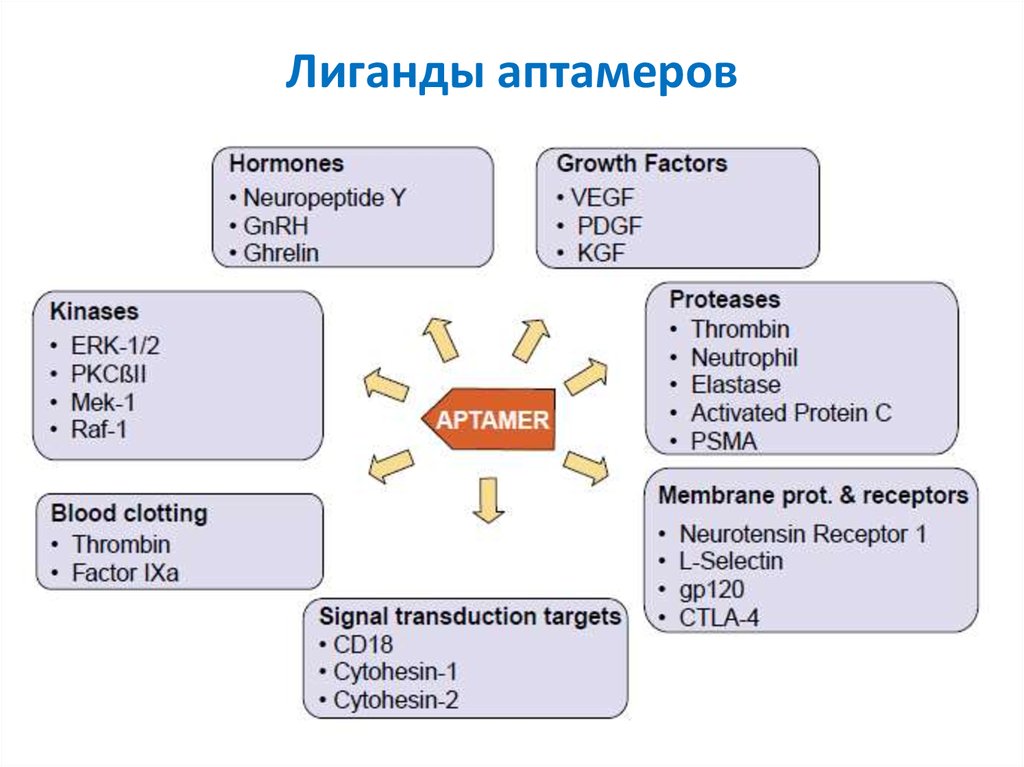
24. Лиганды аптамеров
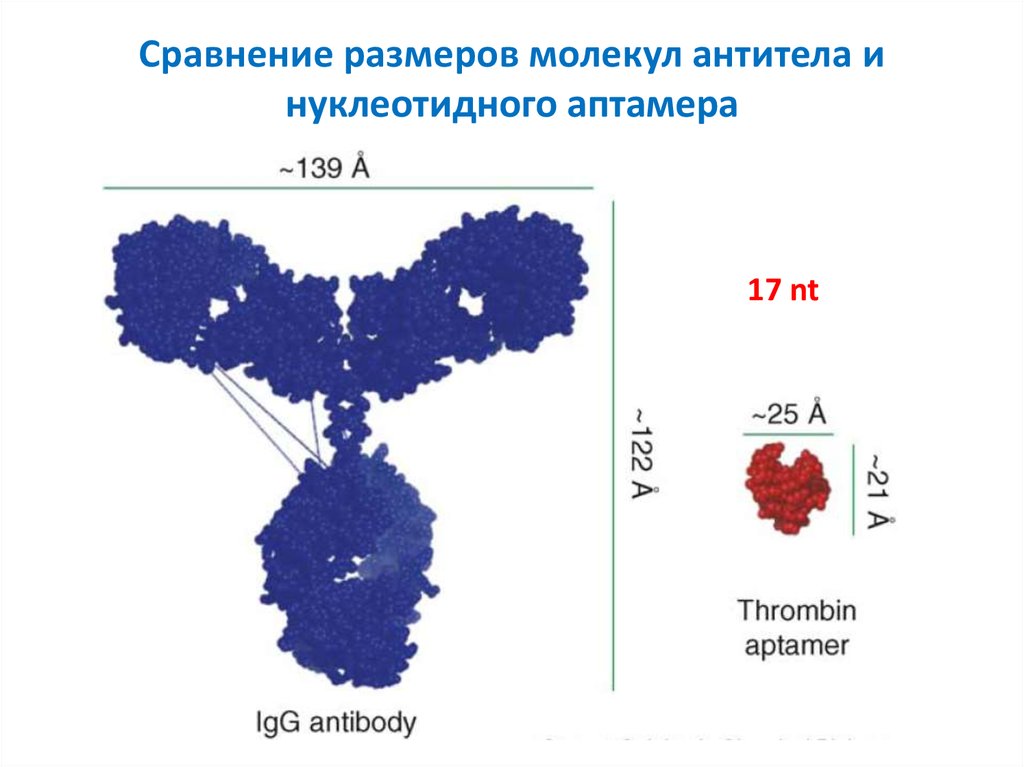
25. Сравнение размеров молекул антитела и нуклеотидного аптамера
17 nt26. Области современного применения аптамеров
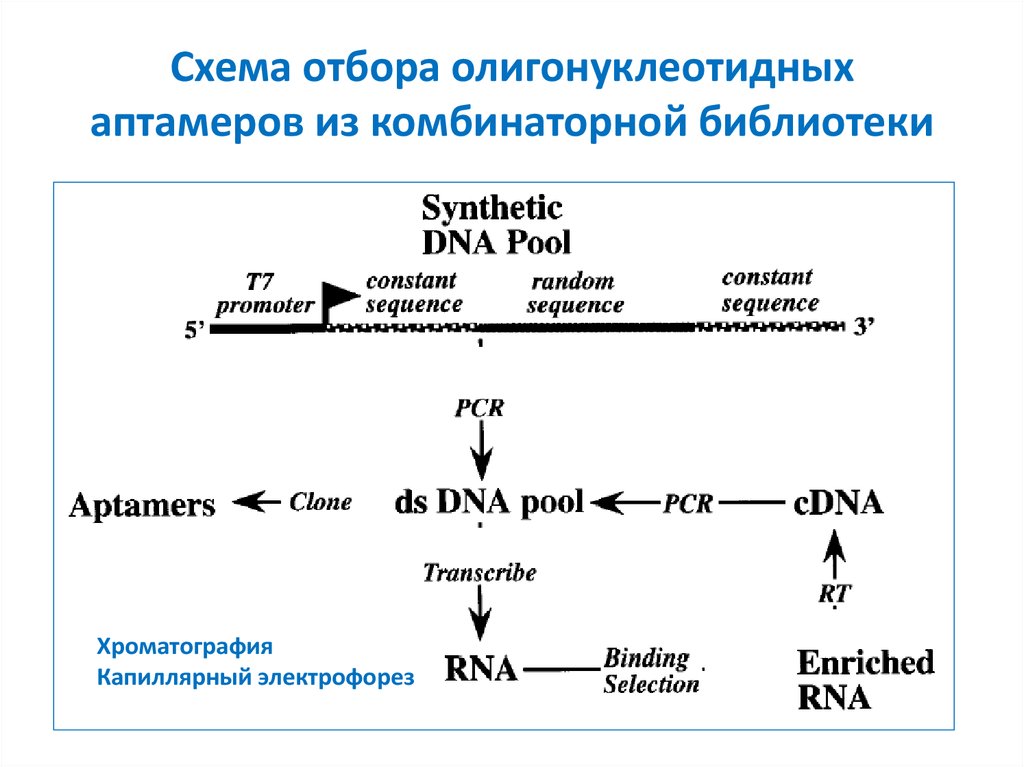
27. Схема отбора олигонуклеотидных аптамеров из комбинаторной библиотеки
ХроматографияКапиллярный электрофорез
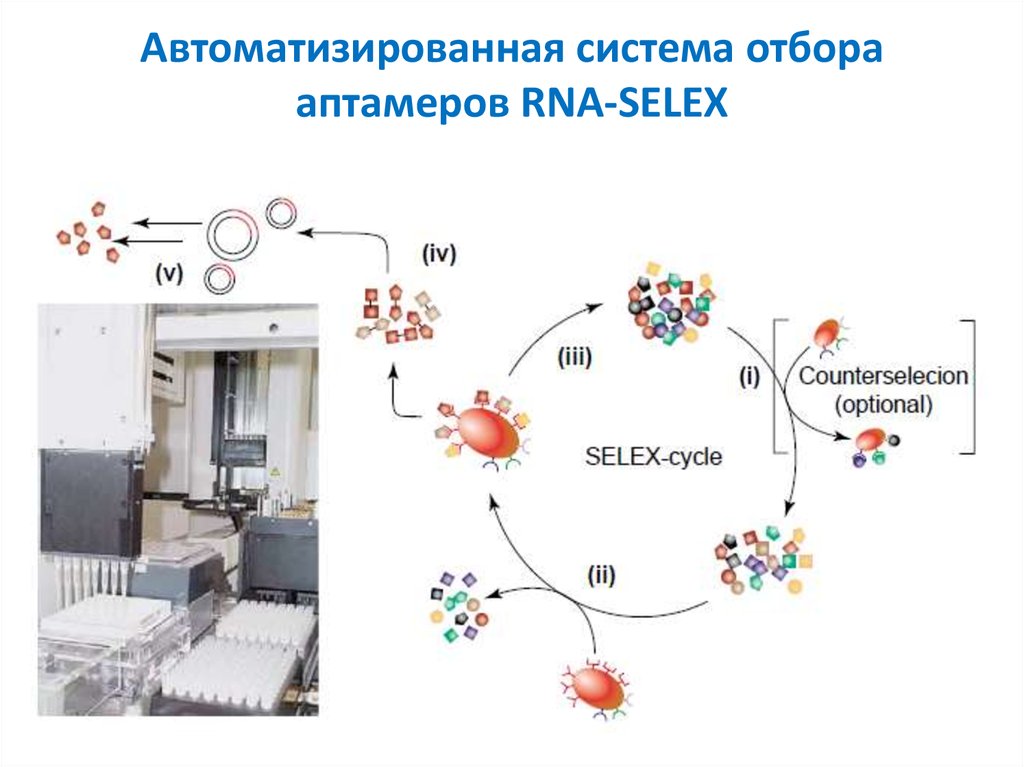
28. Автоматизированная система отбора аптамеров RNA-SELEX
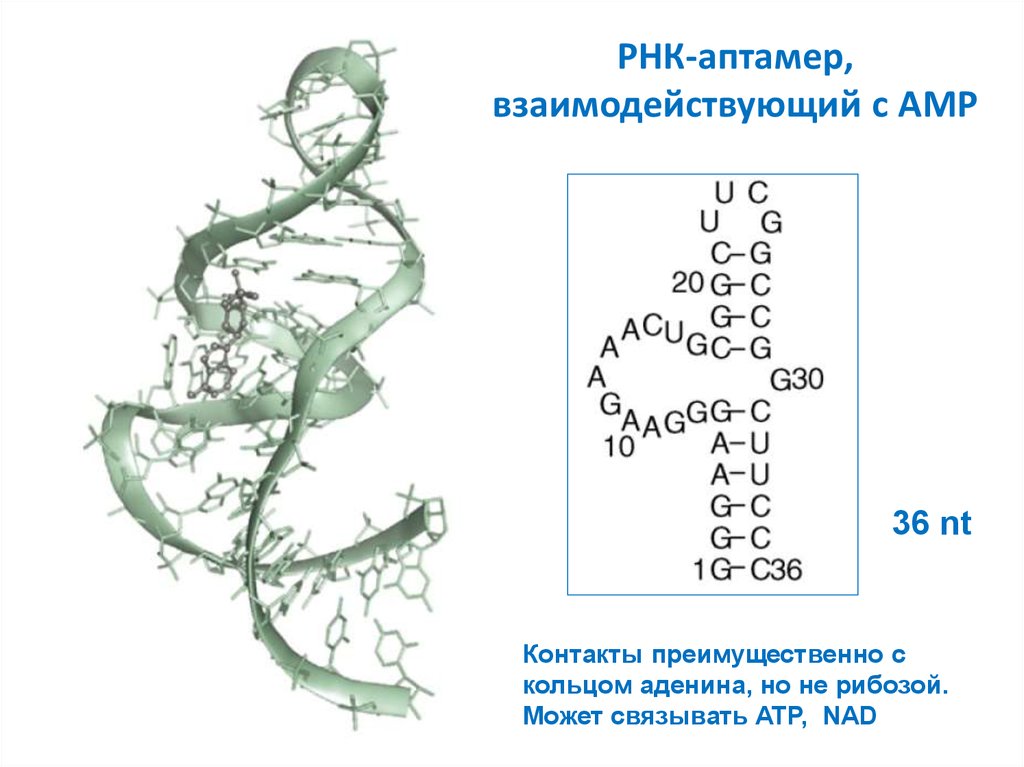
29. РНК-аптамер, взаимодействующий с AMP
36 ntКонтакты преимущественно с
кольцом аденина, но не рибозой.
Может связывать ATP, NAD
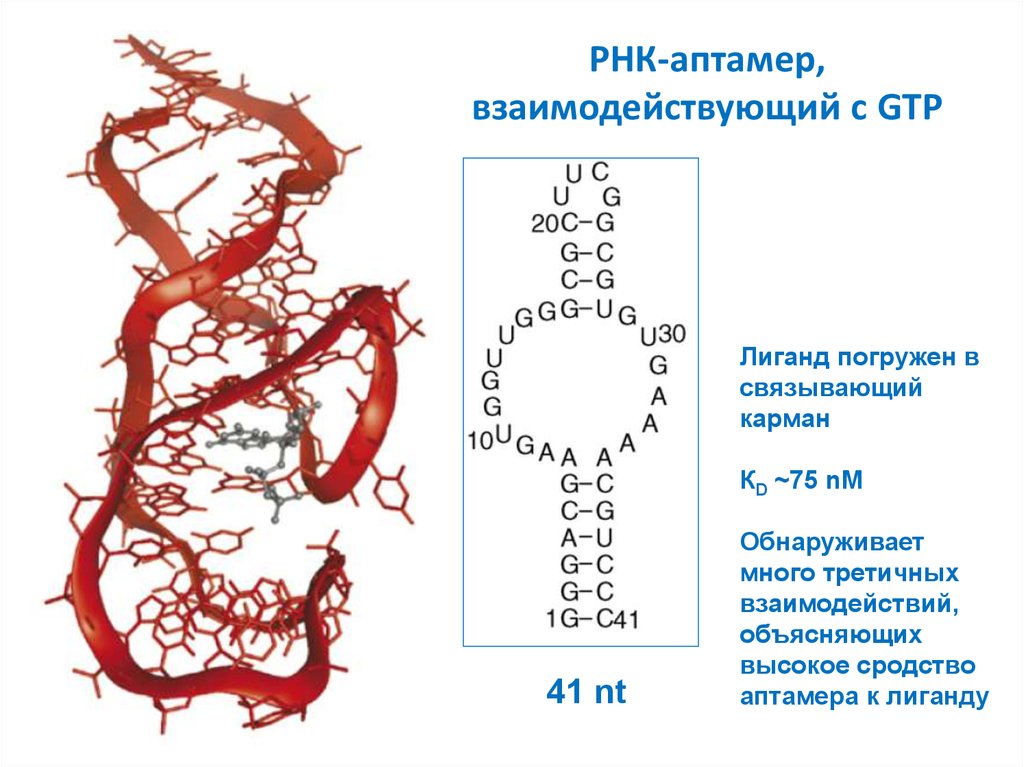
30. РНК-аптамер, взаимодействующий с GTP
Лиганд погружен всвязывающий
карман
КD ~75 nM
41 nt
Обнаруживает
много третичных
взаимодействий,
объясняющих
высокое сродство
аптамера к лиганду
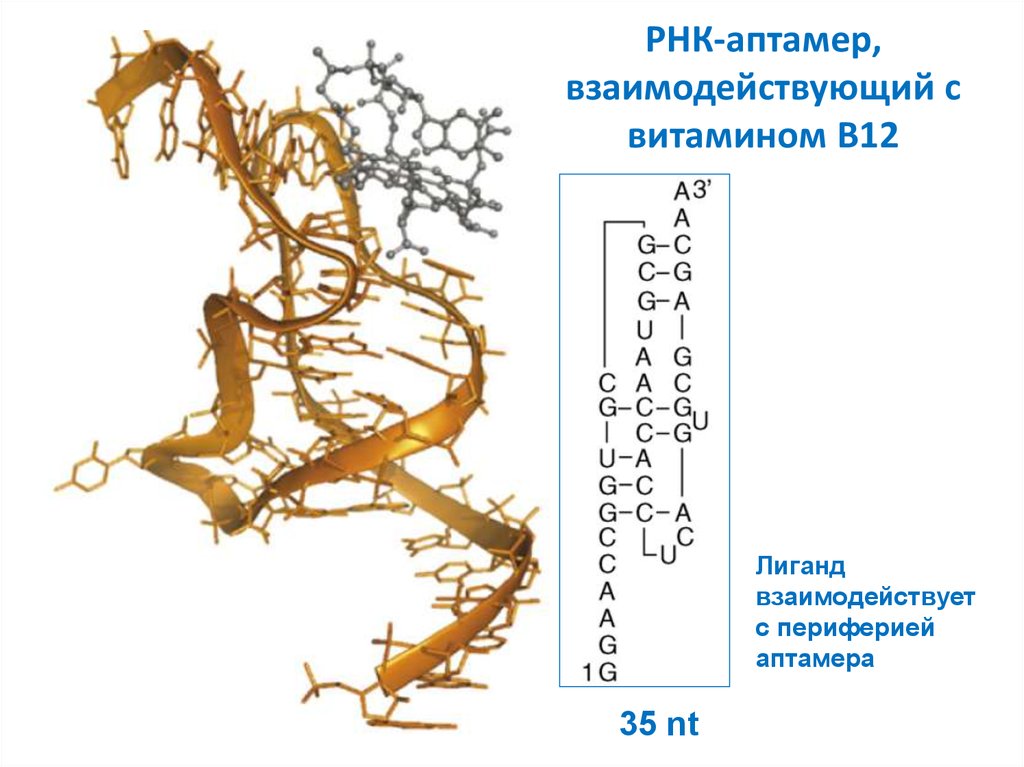
31. РНК-аптамер, взаимодействующий с витамином B12
Лигандвзаимодействует
с периферией
аптамера
35 nt
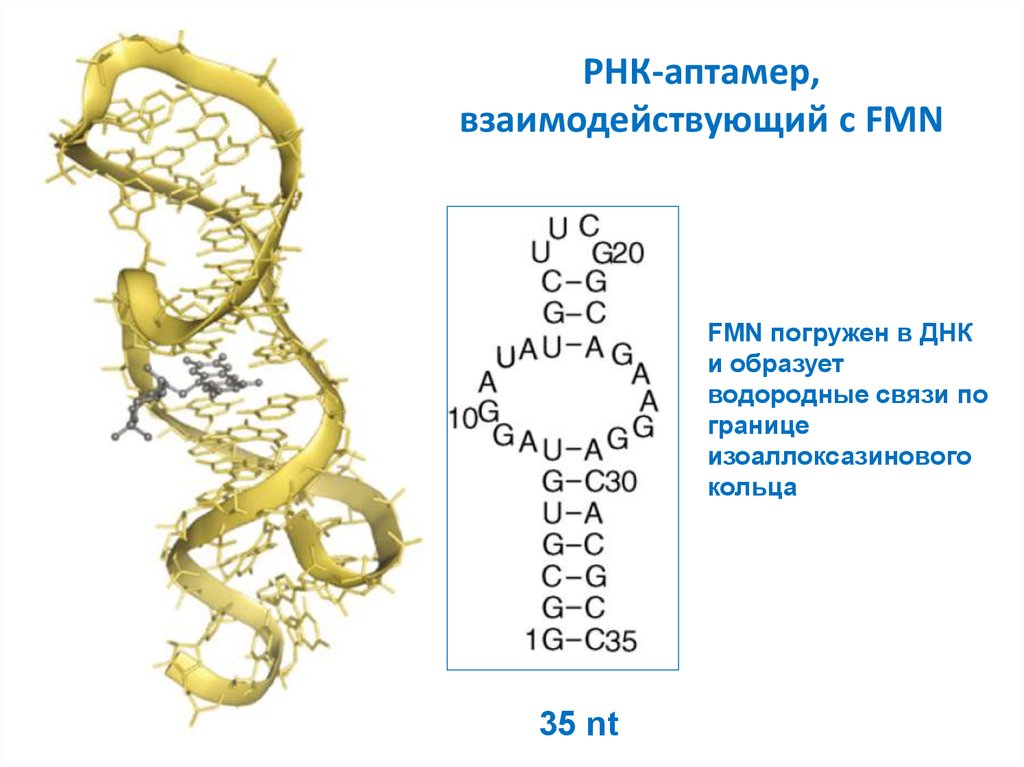
32. РНК-аптамер, взаимодействующий с FMN
FMN погружен в ДНКи образует
водородные связи по
границе
изоаллоксазинового
кольца
35 nt
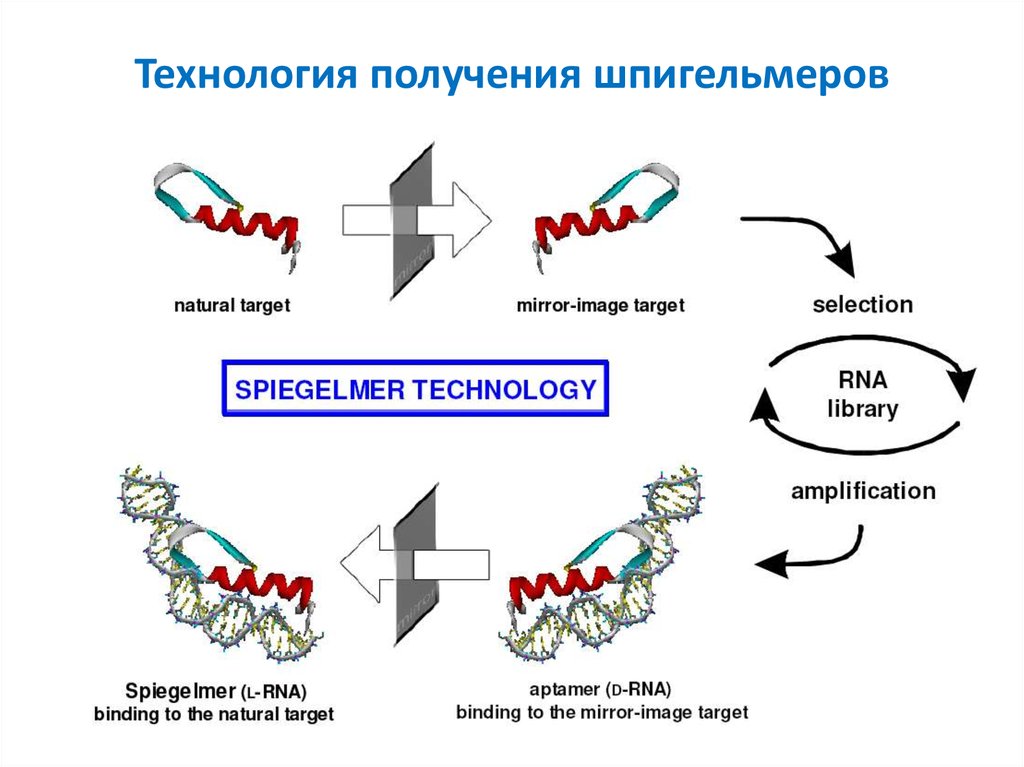
33. Зеркальные аптамеры- шпигельмеры (Spiegelmer)
L-Рибоза или L-2’-дезоксирибоза в сахаро-фосфатном остовеПолучение:
1) Обычный отбор среди обычных нуклеиновых кислот с Dсахарами. Лиганды – полипептиды, построенные из
неприродных D-изомеров аминокислотных остатков.
2) После определения первичной структуры – химический
синтез из аналогов нуклеотидов, содержащих L-сахара.
Синтезированные шпигельмеры взаимодействуют с
природными белками
Преимущество перед обычными аптамерами:
Устойчивость к нуклеазам
34. Технология получения шпигельмеров
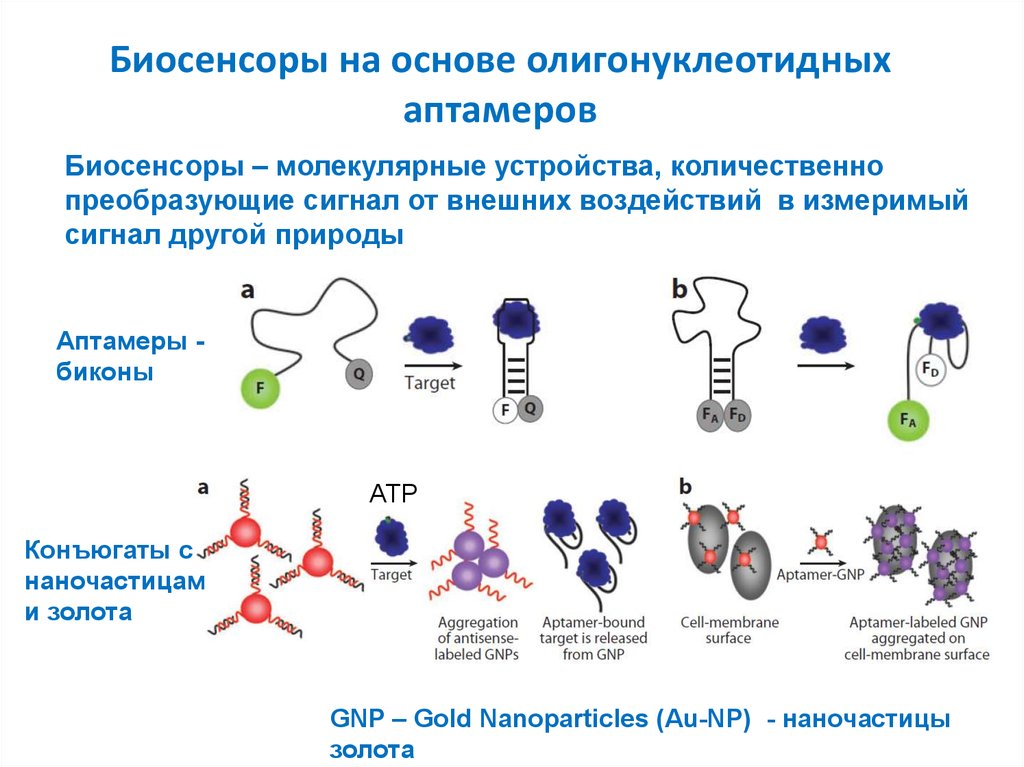
35. Биосенсоры на основе олигонуклеотидных аптамеров
Биосенсоры – молекулярные устройства, количественнопреобразующие сигнал от внешних воздействий в измеримый
сигнал другой природы
Аптамеры биконы
ATP
Конъюгаты с
наночастицам
и золота
GNP – Gold Nanoparticles (Au-NP) - наночастицы
золота
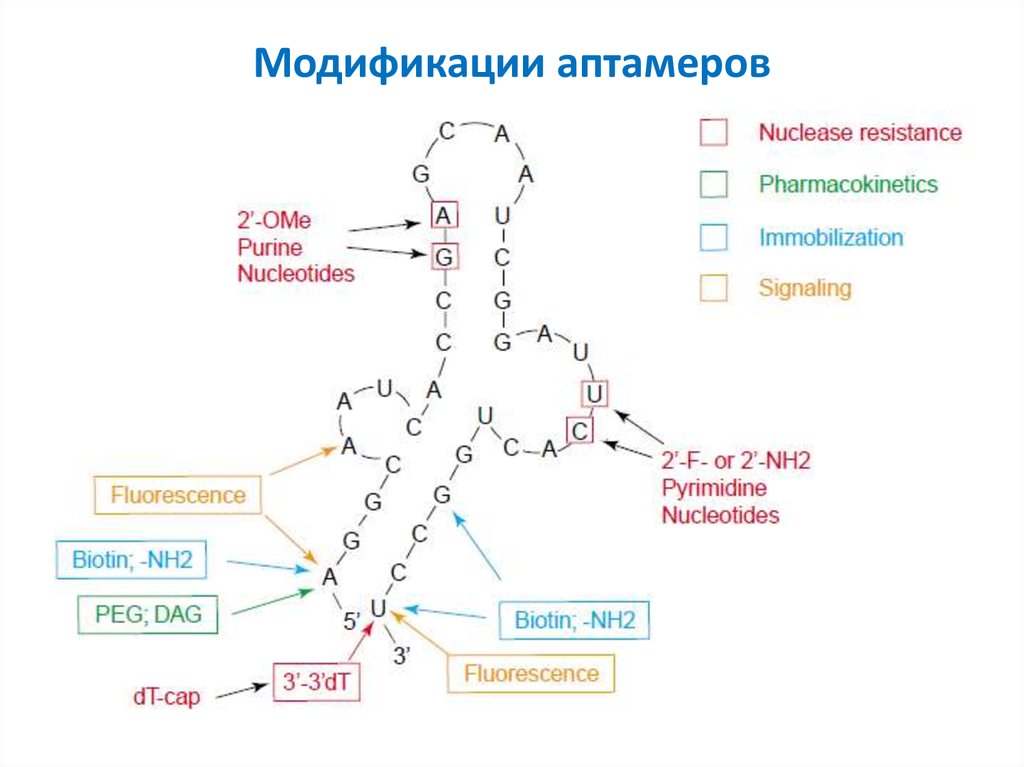
36. Модификации аптамеров
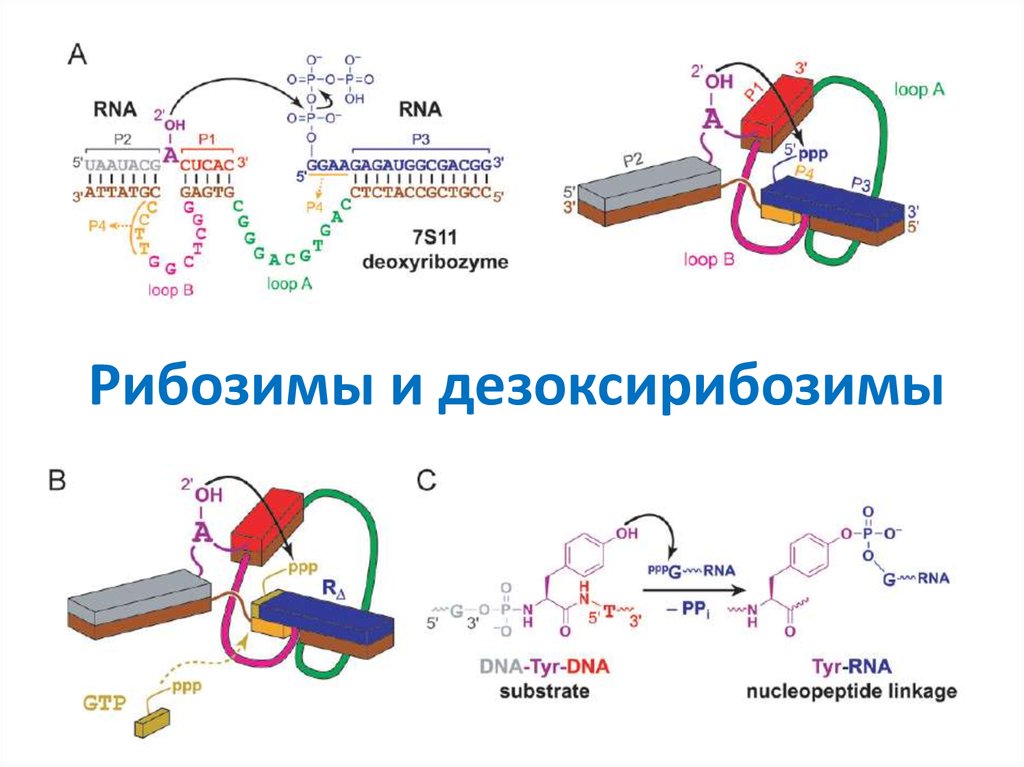
37. Рибозимы и дезоксирибозимы
38. Thomas Cech – первооткрыватель рибозимов
1982 г. Аутосплайсинг интронарибосомной 35S-РНК жгутикового
простейшего Tetrahymena
Нобелевская премия по химии 1989 г.
совместно с Sidney Altman
39.
40. Сидни Олтман (Sidney Altman) получает Нобелевскую премию за РНКазу P
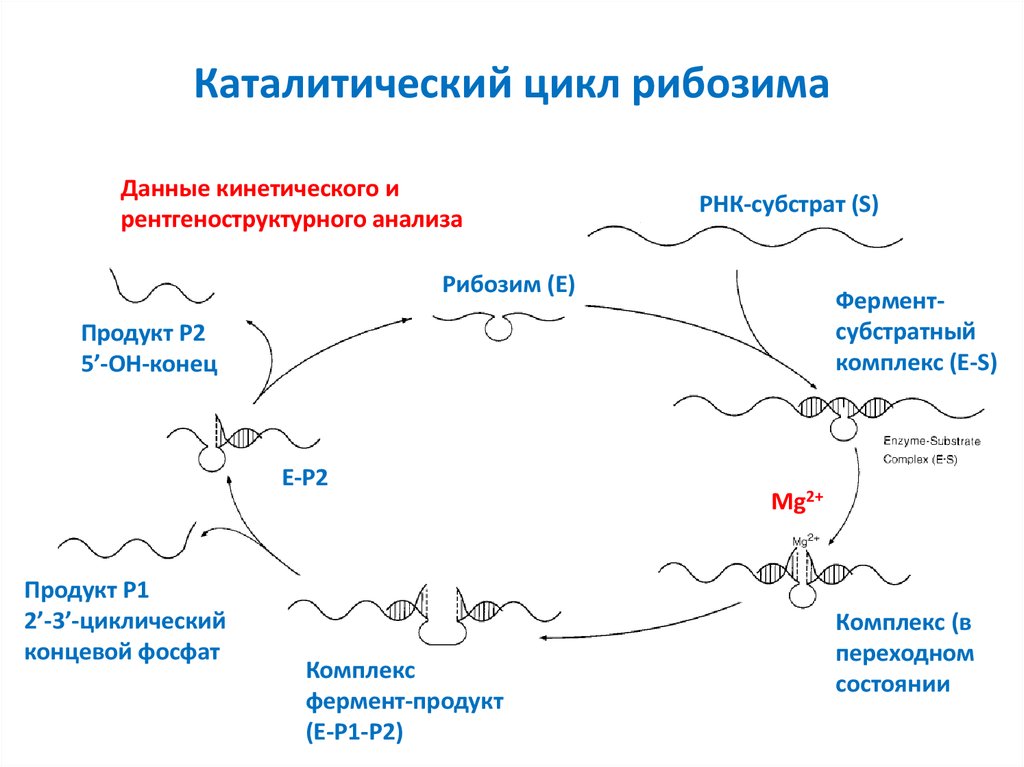
41. Каталитический цикл рибозима
Данные кинетического ирентгеноструктурного анализа
РНК-субстрат (S)
Рибозим (E)
Ферментсубстратный
комплекс (E-S)
Продукт P2
5’-OH-конец
E-P2
Продукт P1
2’-3’-циклический
концевой фосфат
Комплекс
фермент-продукт
(E-P1-P2)
Mg2+
Комплекс (в
переходном
состоянии
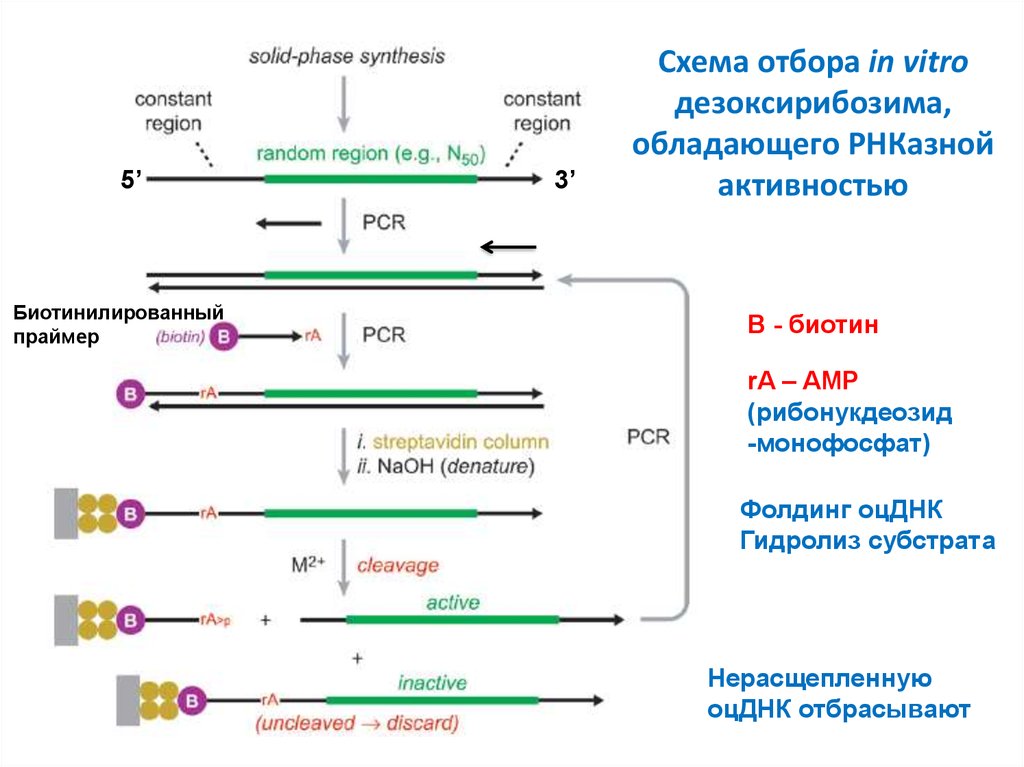
42. Схема отбора in vitro дезоксирибозима, обладающего РНКазной активностью
5’Биотинилированный
праймер
3’
Схема отбора in vitro
дезоксирибозима,
обладающего РНКазной
активностью
B - биотин
rA – AMP
(рибонукдеозид
-монофосфат)
Фолдинг оцДНК
Гидролиз субстрата
Нерасщепленную
оцДНК отбрасывают
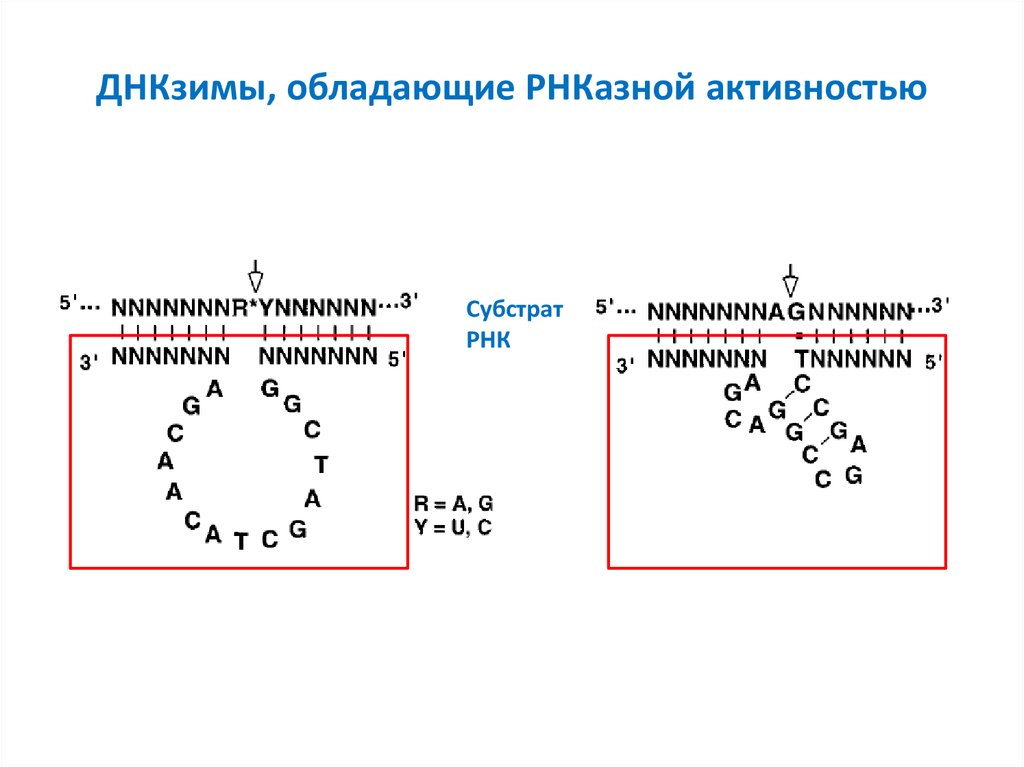
43. ДНКзимы, обладающие РНКазной активностью
СубстратРНК
44. Подтипы рибозимов, сконструированных на основе рибозима типа «головки молотка»
РНК (субстрат)Рибозим типа
«головки молотка»
Минизим
Максизим
ДНКзим
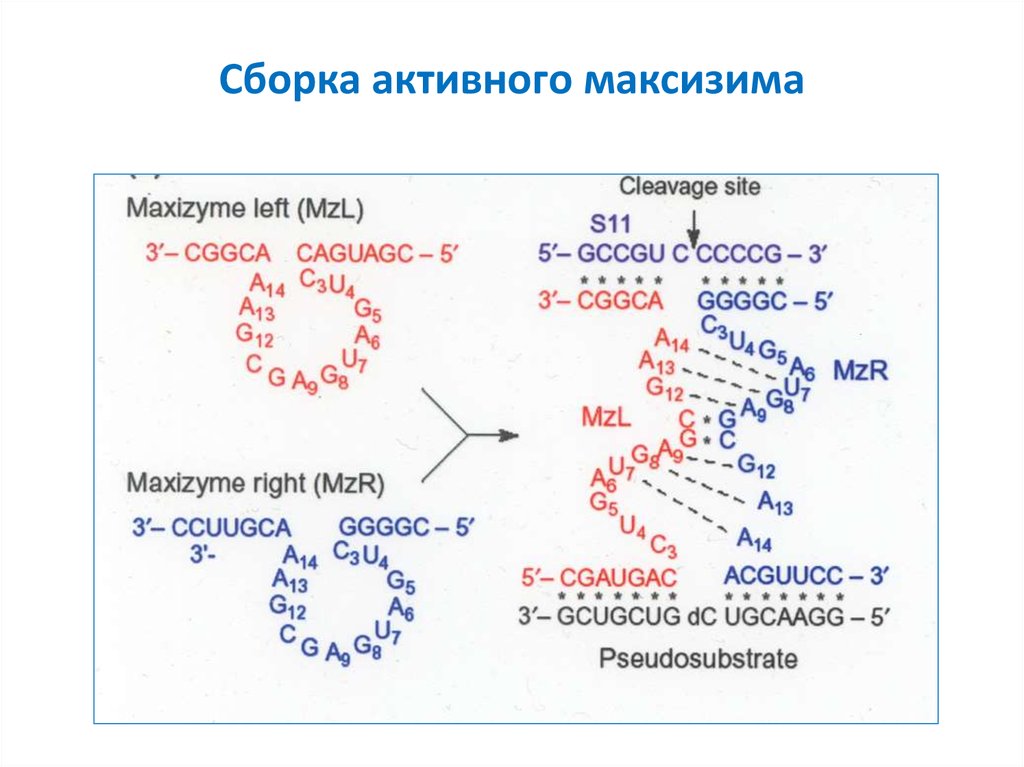
45. Сборка активного максизима
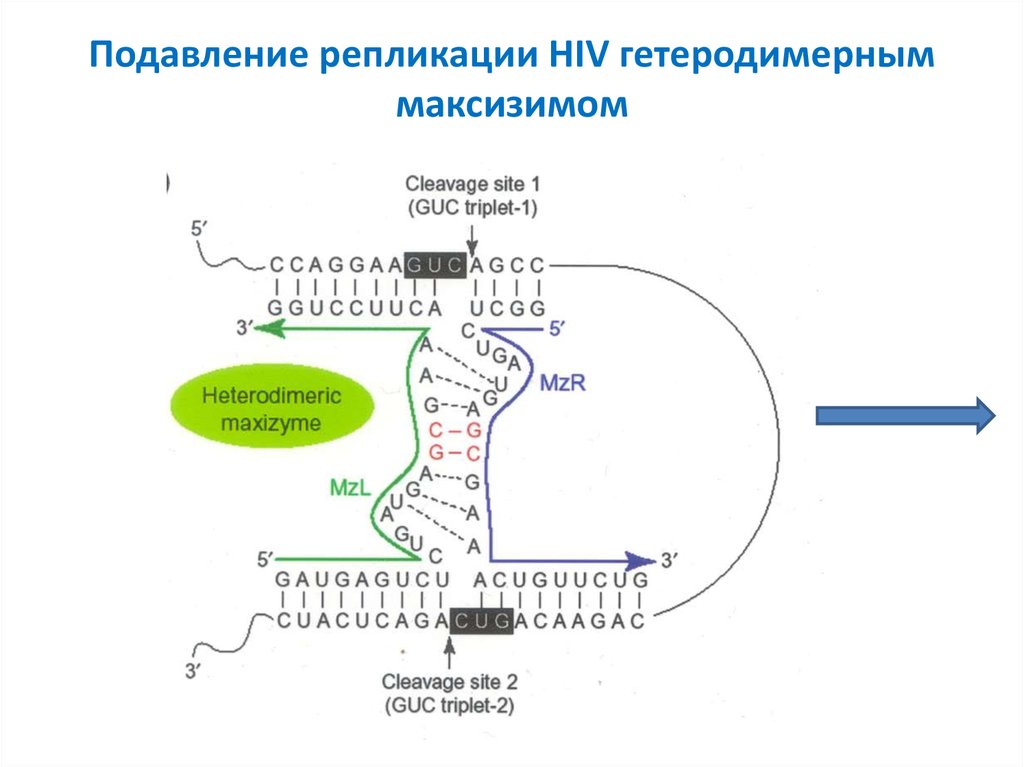
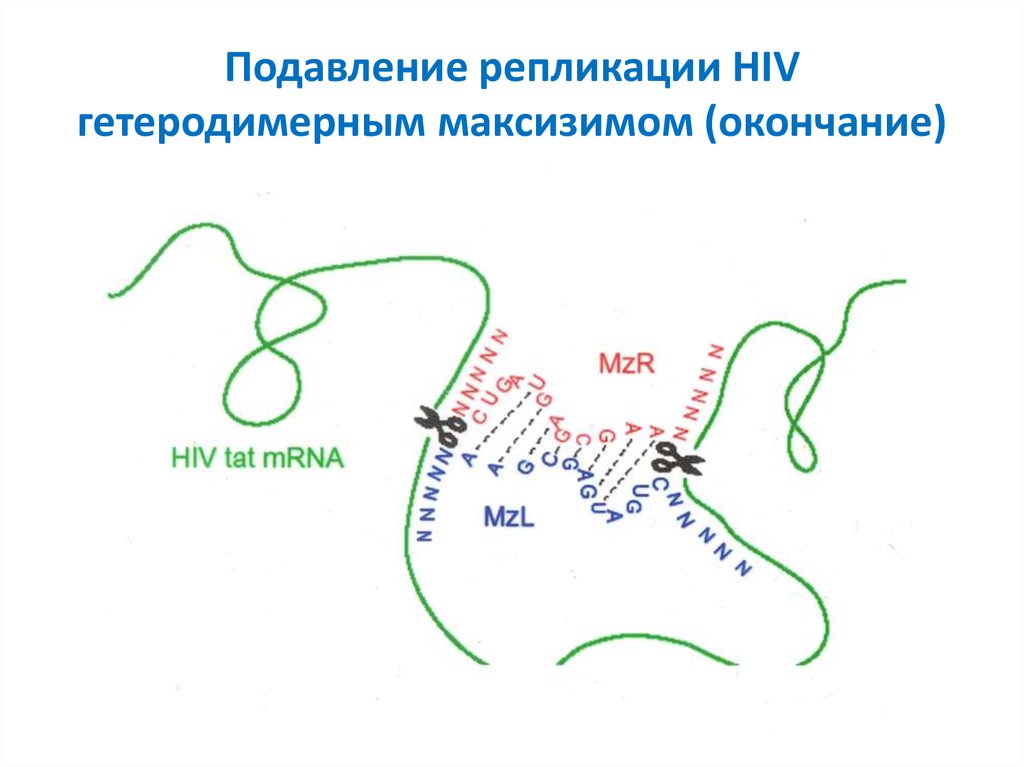
46. Подавление репликации HIV гетеродимерным максизимом
47. Подавление репликации HIV гетеродимерным максизимом (окончание)
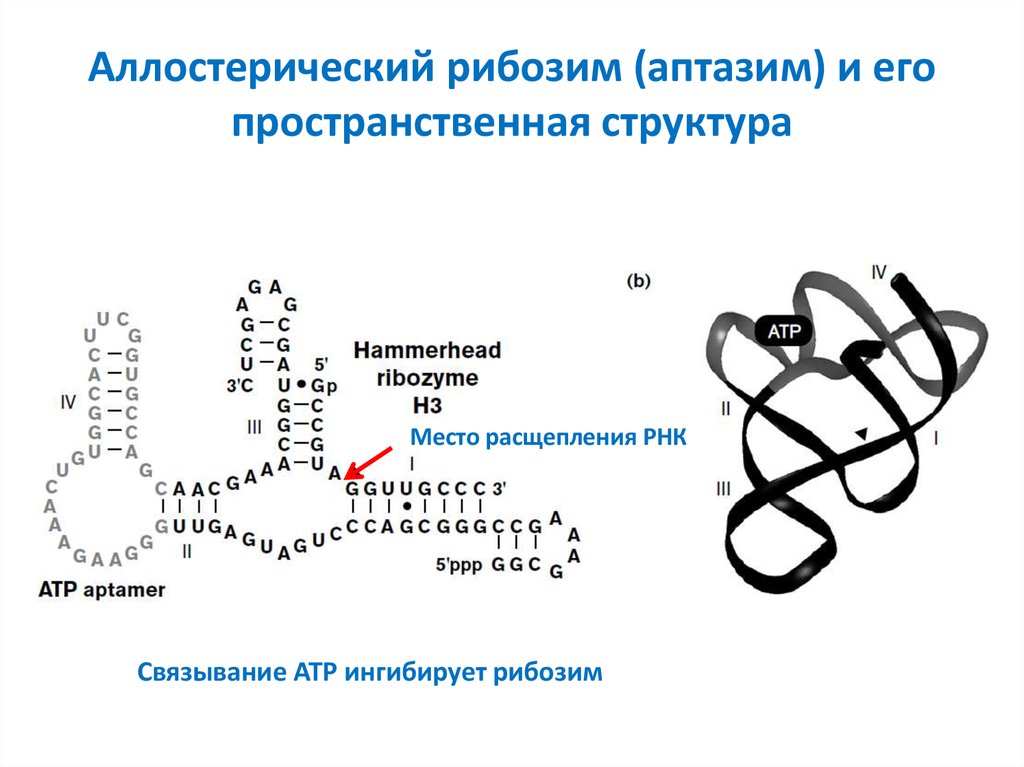
48. Аллостерический рибозим (аптазим) и его пространственная структура
Место расщепления РНКСвязывание ATP ингибирует рибозим
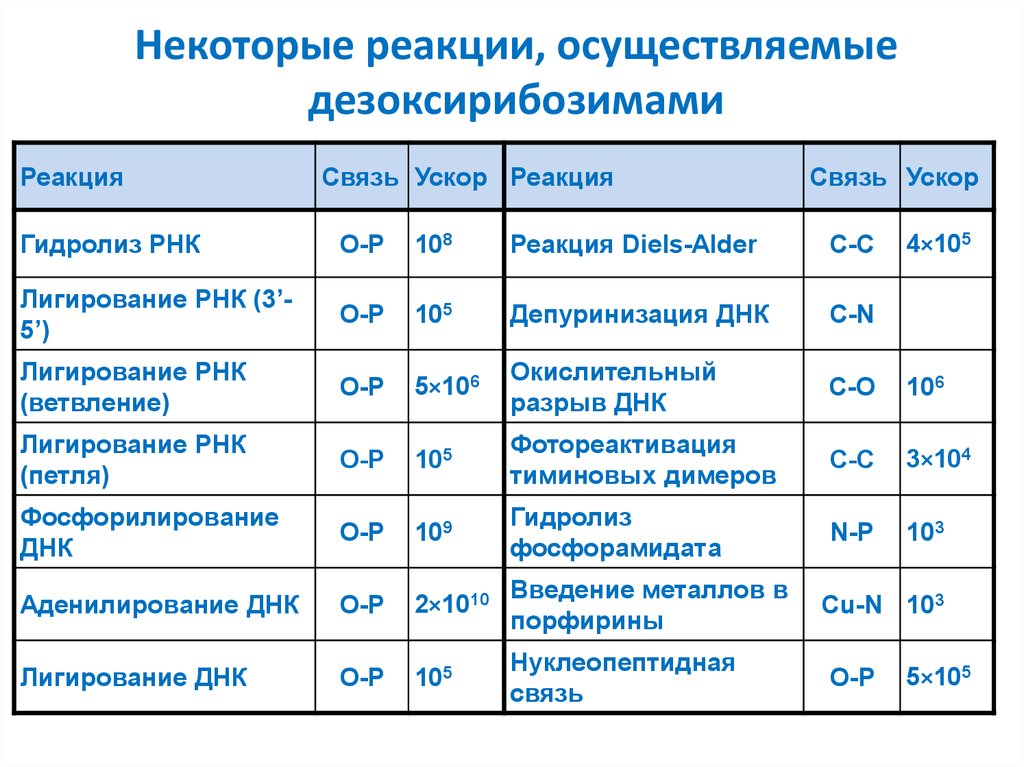
49. Некоторые реакции, осуществляемые дезоксирибозимами
РеакцияСвязь Ускор Реакция
Связь Ускор
Гидролиз РНК
O-P
108
Реакция Diels-Alder
С-С
Лигирование РНК (3’5’)
O-P
105
Депуринизация ДНК
С-N
Лигирование РНК
(ветвление)
O-P
5×106
Окислительный
разрыв ДНК
C-O
106
Лигирование РНК
(петля)
O-P
105
Фотореактивация
тиминовых димеров
С-С
3×104
Фосфорилирование
ДНК
O-P
109
Гидролиз
фосфорамидата
N-P
103
Аденилирование ДНК
O-P
2×1010
Введение металлов в
порфирины
Лигирование ДНК
O-P
105
Нуклеопептидная
связь
4×105
Cu-N 103
O-P
5×105
50. ДНК в наноконструкторе
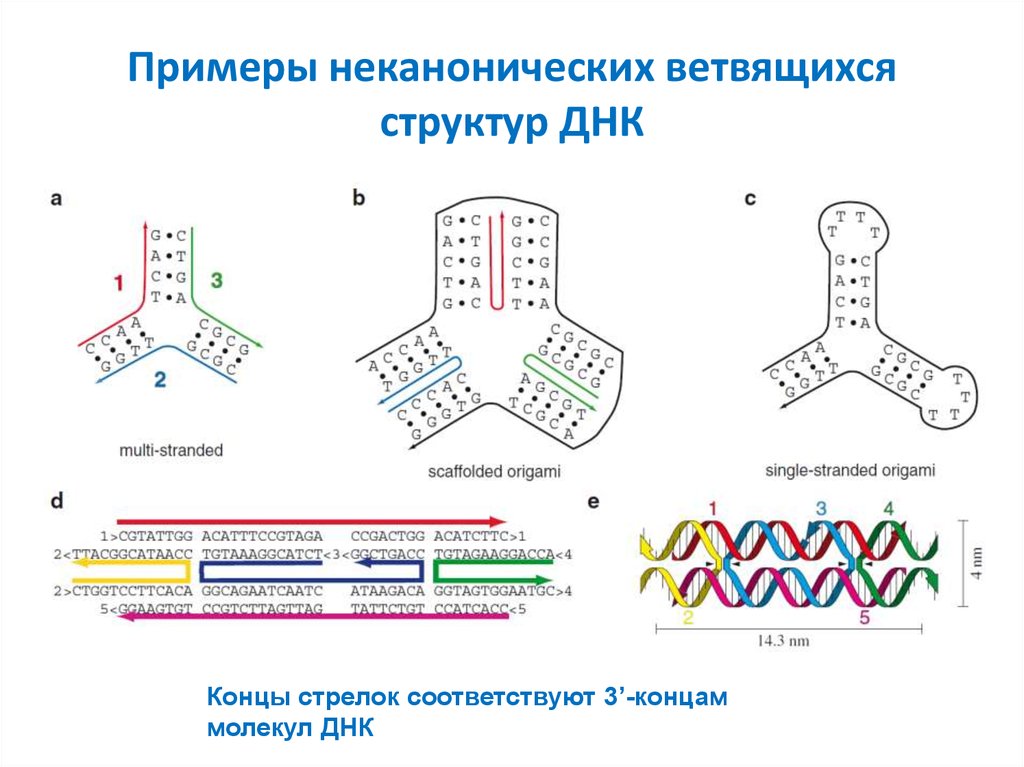
51. Примеры неканонических ветвящихся структур ДНК
Концы стрелок соответствуют 3’-концаммолекул ДНК
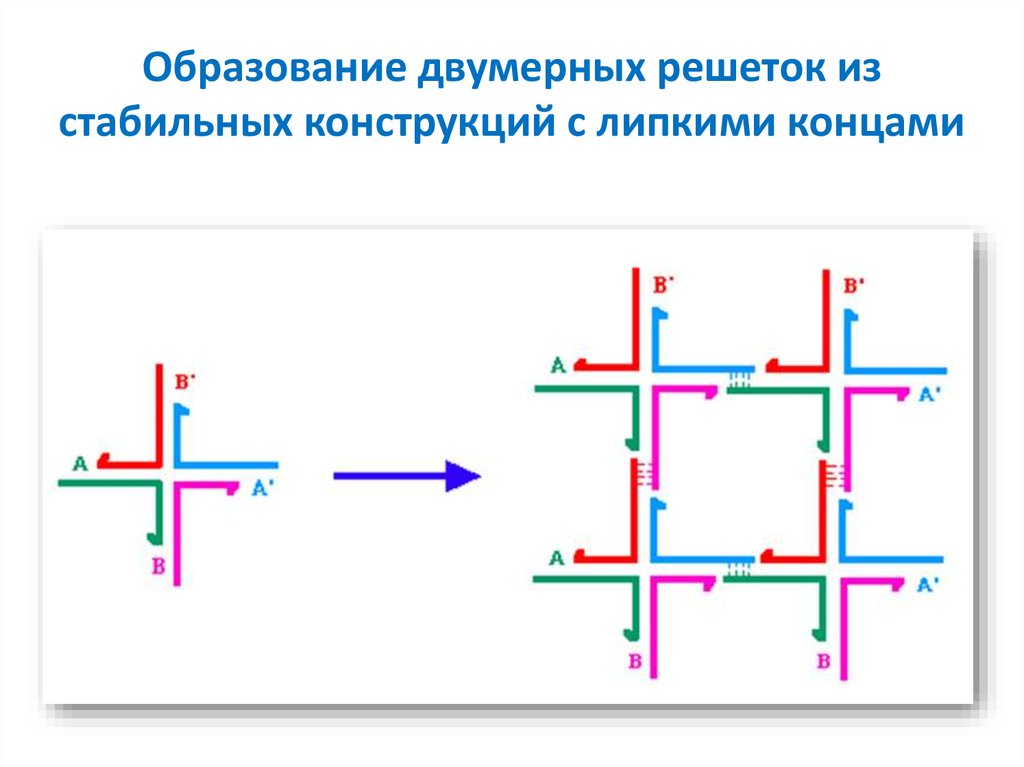
52. Образование двумерных решеток из стабильных конструкций с липкими концами
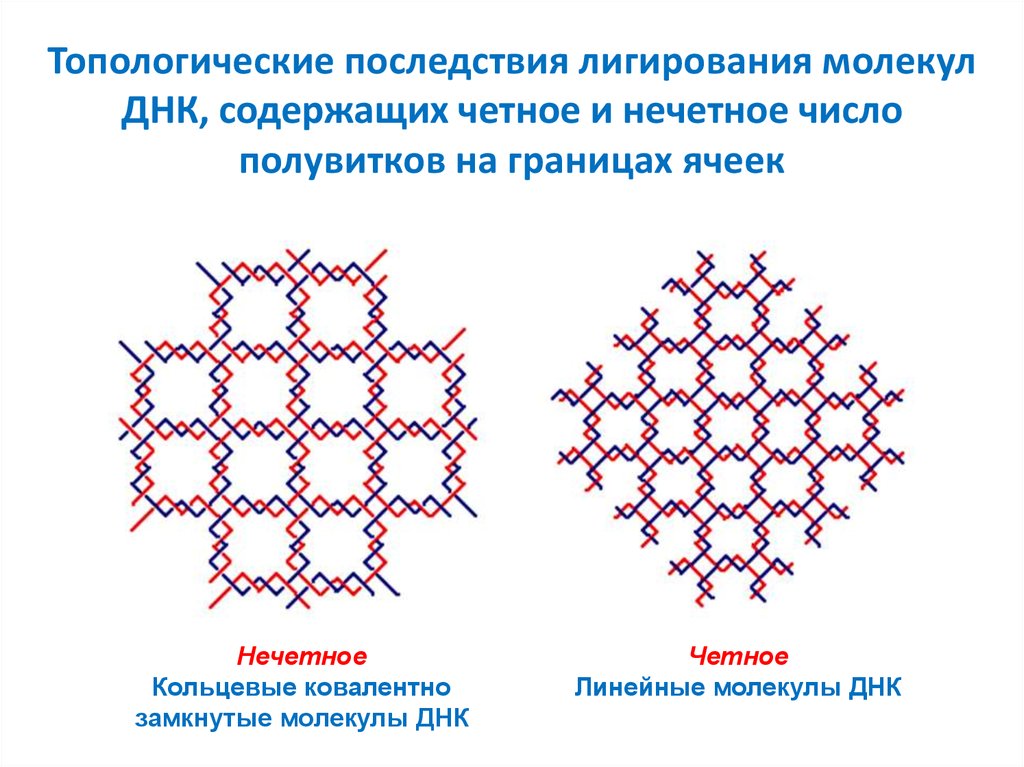
53. Топологические последствия лигирования молекул ДНК, содержащих четное и нечетное число полувитков на границах ячеек
НечетноеКольцевые ковалентно
замкнутые молекулы ДНК
Четное
Линейные молекулы ДНК
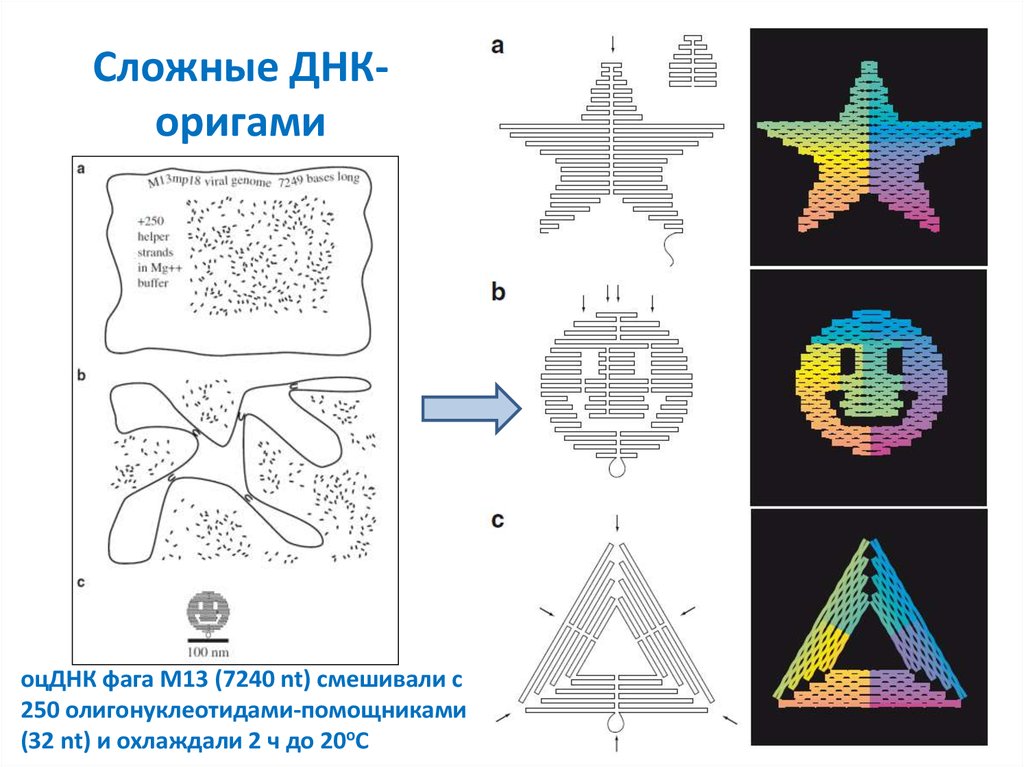
54. Сложные ДНК-оригами
Сложные ДНКоригамиоцДНК фага M13 (7240 nt) смешивали с
250 олигонуклеотидами-помощниками
(32 nt) и охлаждали 2 ч до 20оС
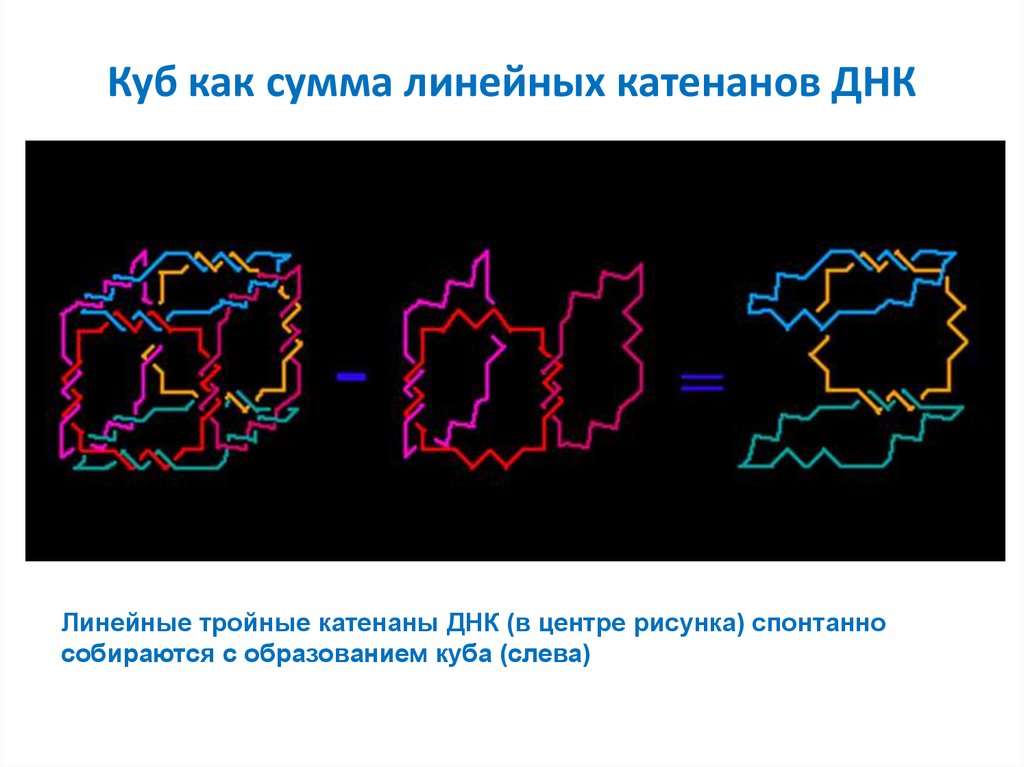
55. Куб как сумма линейных катенанов ДНК
Линейные тройные катенаны ДНК (в центре рисунка) спонтаннособираются с образованием куба (слева)
56. Усеченный октаэдр, построенный из ДНК
Фигура построена из 14 кольцевых молекул оцДНК. Цветные точки –сахаро-фосфатный остов ДНК, белые точки – азотистые основания. Вид сверху.











 Биология
Биология








