Похожие презентации:
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
1. СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
ФГБОУ ВПО «Марийский государственный университет»Факультет биолого-химический
Кафедра химии
Шевченко Алексей Игоревич
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ
В СИСТЕМЕ Со(II)-ЭДТА-H2O2
Йошкар-Ола, 2014
2.
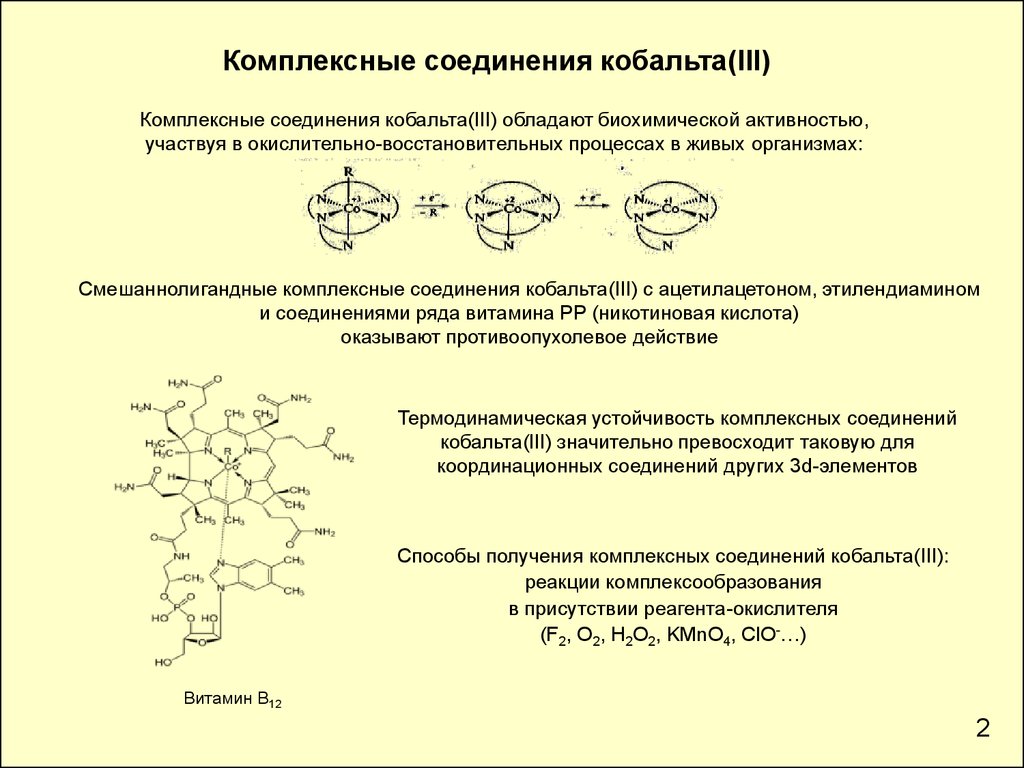
Комплексные соединения кобальта(III)Комплексные соединения кобальта(III) обладают биохимической активностью,
участвуя в окислительно-восстановительных процессах в живых организмах:
Смешаннолигандные комплексные соединения кобальта(III) с ацетилацетоном, этилендиамином
и соединениями ряда витамина РР (никотиновая кислота)
оказывают противоопухолевое действие
Термодинамическая устойчивость комплексных соединений
кобальта(III) значительно превосходит таковую для
координационных соединений других 3d-элементов
Способы получения комплексных соединений кобальта(III):
реакции комплексообразования
в присутствии реагента-окислителя
(F2, O2, H2O2, KMnO4, ClO-…)
Витамин В12
2
3.
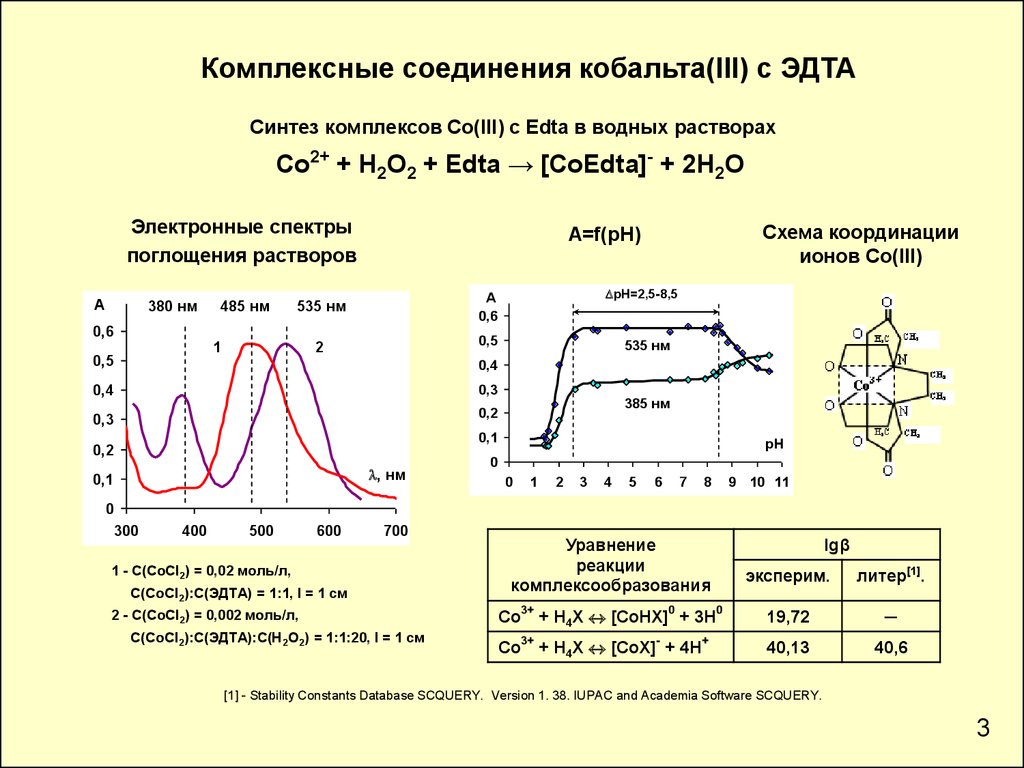
Комплексные соединения кобальта(III) с ЭДТАСинтез комплексов Со(III) с Edta в водных растворах
Co2+ + H2O2 + Edta → [CoEdta]- + 2H2O
Электронные спектры
поглощения растворов
А
380 нм
0,6
485 нм
535 нм
А
0,6
2
0,5
1
0,5
Схема координации
ионов Co(III)
А=f(рН)
DрН=2,5-8,5
535 нм
0,4
0,3
0,4
385 нм
0,2
0,3
0,1
0,2
l, нм
0,1
0
300
400
500
600
700
1 - С(СoCl2) = 0,02 моль/л,
С(СоCl2):С(ЭДТА) = 1:1, l = 1 см
2 - С(СoCl2) = 0,002 моль/л,
С(СоCl2):С(ЭДТА):С(Н2О2) = 1:1:20, l = 1 см
рН
0
0
1
2
3
4
5
6
7
8
Уравнение
реакции
комплексообразования
9 10 11
lgβ
эксперим.
литер[1].
Co3+ + H4X [CoHX]0 + 3H0
19,72
─
Co3+ + H4X [CoX]- + 4H+
40,13
40,6
[1] - Stability Constants Database SCQUERY. Version 1. 38. IUPAC and Academia Software SCQUERY.
3
4.
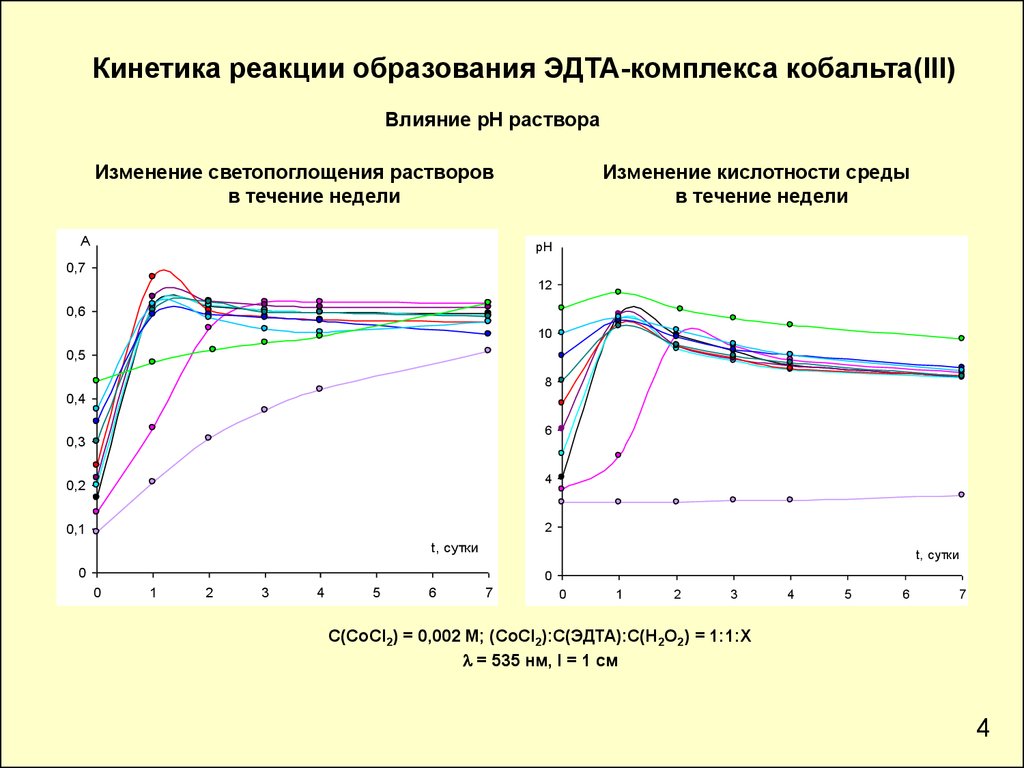
Кинетика реакции образования ЭДТА-комплекса кобальта(III)Влияние рН раствора
Изменение светопоглощения растворов
в течение недели
А
Изменение кислотности среды
в течение недели
pH
0,7
12
0,6
10
0,5
8
0,4
6
0,3
0,2
4
0,1
2
t, сутки
t, сутки
0
0
0
1
2
3
4
5
6
7
0
1
2
3
4
5
6
7
С(СоCl2) = 0,002 М; (СоCl2):С(ЭДТА):С(Н2О2) = 1:1:Х
l = 535 нм, l = 1 см
4
5.
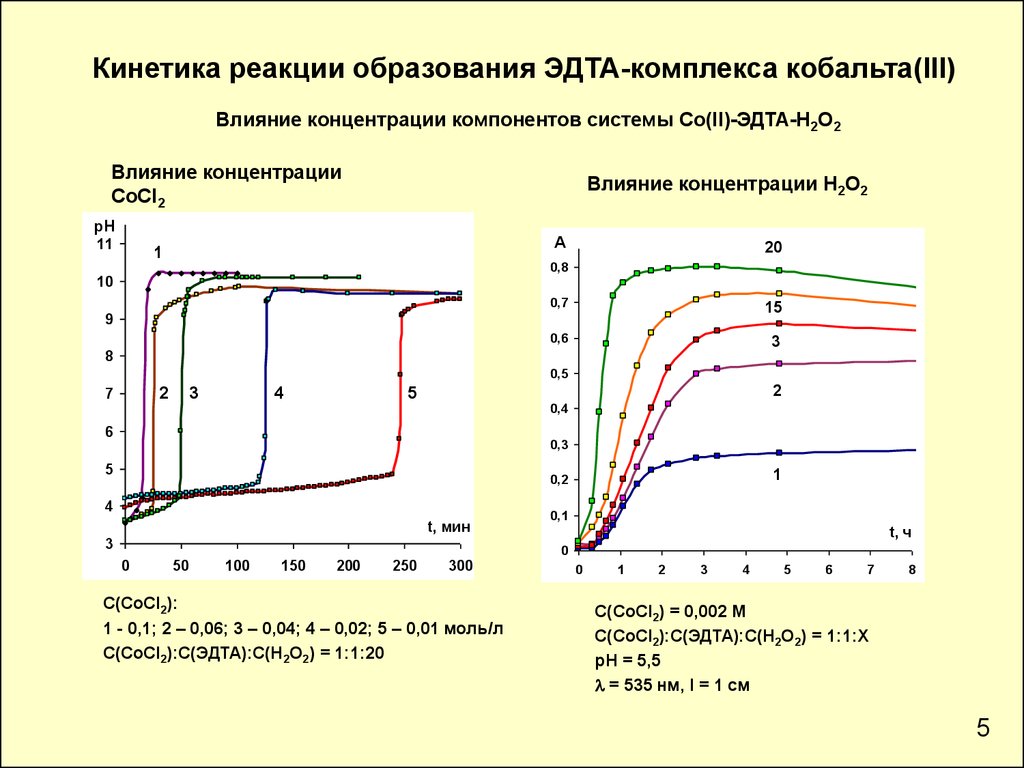
Кинетика реакции образования ЭДТА-комплекса кобальта(III)Влияние концентрации компонентов системы Co(II)-ЭДТА-Н2О2
Влияние концентрации
CoСl2
Влияние концентрации H2O2
рН
11
А
1
20
0,8
10
0,7
15
0,6
3
9
8
0,5
2
7
3
4
2
5
0,4
6
0,3
5
1
0,2
4
t, мин
3
0,1
t, ч
0
0
50
100
150
200
250
300
С(СоCl2):
1 - 0,1; 2 – 0,06; 3 – 0,04; 4 – 0,02; 5 – 0,01 моль/л
С(СоCl2):С(ЭДТА):С(Н2О2) = 1:1:20
0
1
2
3
4
5
6
7
8
С(СоCl2) = 0,002 М
С(СоCl2):С(ЭДТА):С(Н2О2) = 1:1:Х
рН = 5,5
l = 535 нм, l = 1 см
5
6.
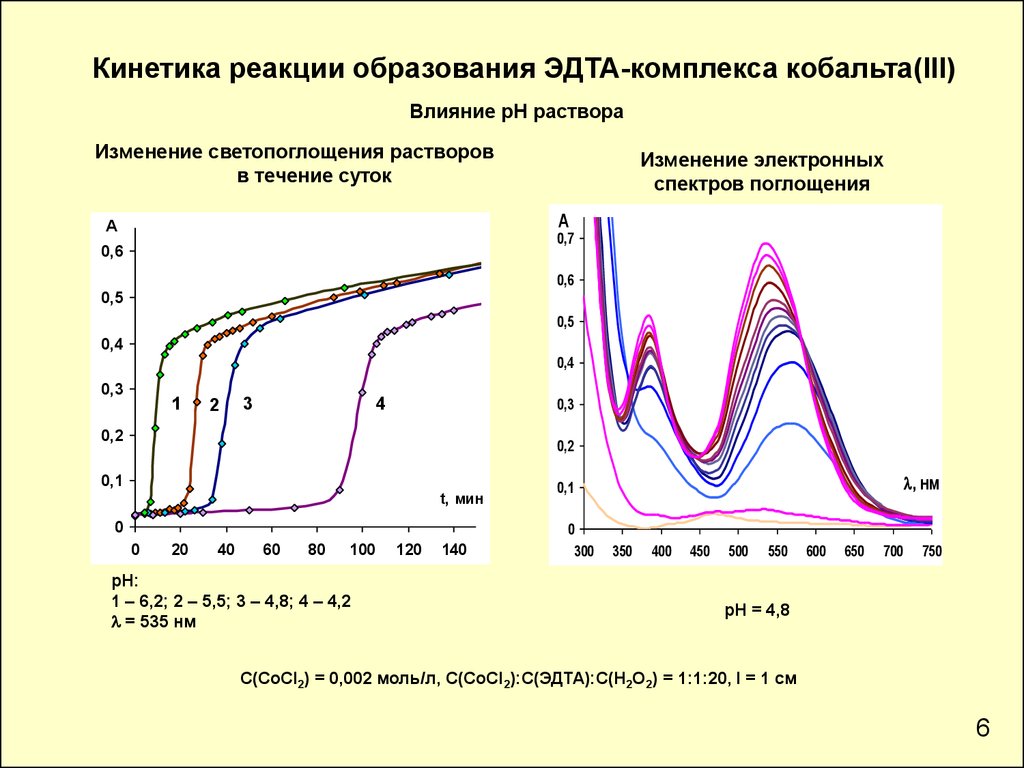
Кинетика реакции образования ЭДТА-комплекса кобальта(III)Влияние рН раствора
Изменение светопоглощения растворов
в течение суток
Изменение электронных
спектров поглощения
А
А
0,7
0,6
0,6
0,5
0,5
0,4
0,4
0,3
1
2
3
4
0,3
0,2
0,2
0,1
t, мин
0
0
20
40
60
80
100
рН:
1 – 6,2; 2 – 5,5; 3 – 4,8; 4 – 4,2
l = 535 нм
120
140
l, нм
0,1
0
300
350
400
450
500
550
600
650
700
750
рН = 4,8
С(СoCl2) = 0,002 моль/л, С(СоCl2):С(ЭДТА):С(Н2О2) = 1:1:20, l = 1 см
6
7.
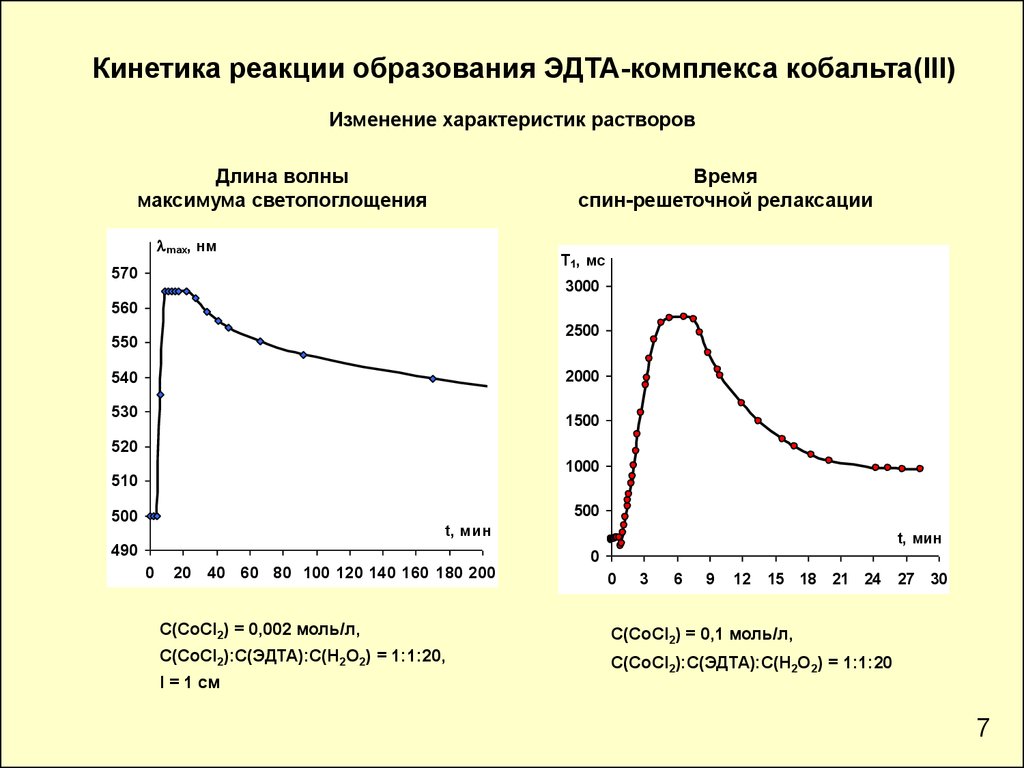
Кинетика реакции образования ЭДТА-комплекса кобальта(III)Изменение характеристик растворов
Длина волны
максимума светопоглощения
Время
спин-решеточной релаксации
l max, нм
Т1, мс
570
3000
560
2500
550
2000
540
530
1500
520
1000
510
500
500
t, мин
490
t, мин
0
0
20
40 60 80 100 120 140 160 180 200
0
3
6
9
12
15 18 21 24
С(СoCl2) = 0,002 моль/л,
С(СoCl2) = 0,1 моль/л,
С(СоCl2):С(ЭДТА):С(Н2О2) = 1:1:20,
С(СоCl2):С(ЭДТА):С(Н2О2) = 1:1:20
l = 1 см
27 30
7
8.
Схемы образования ЭДТА-комплекса кобальта(III)в растворах
Co2+ + ЭДТА4- → [CoЭДТА]2[CoЭДТА]2- + H2O2 → [CoЭДТА]- + 2OH-
2H2O2
OH-
O2 + 2H2O
2[CoЭДТА]2- + O2 → [ЭДТАCo – O2 – CoЭДТА]n-
[ЭДТАCo - O2 - CoЭДТА]n- + 2H2O → 2[CoЭДТА]- + 4OH-
8
9.
Спасибо за внимание!9



 Химия
Химия