Похожие презентации:
Электронная природа химических связей в органических соединениях
1. Электронная природа химических связей в органических соединениях.
2. Введение
Виды химической связи
Основные положения строения атома
Виды орбиталей
Сигма-связь, пи-связь
Метод валентных связей
Основные положение ВС
3.
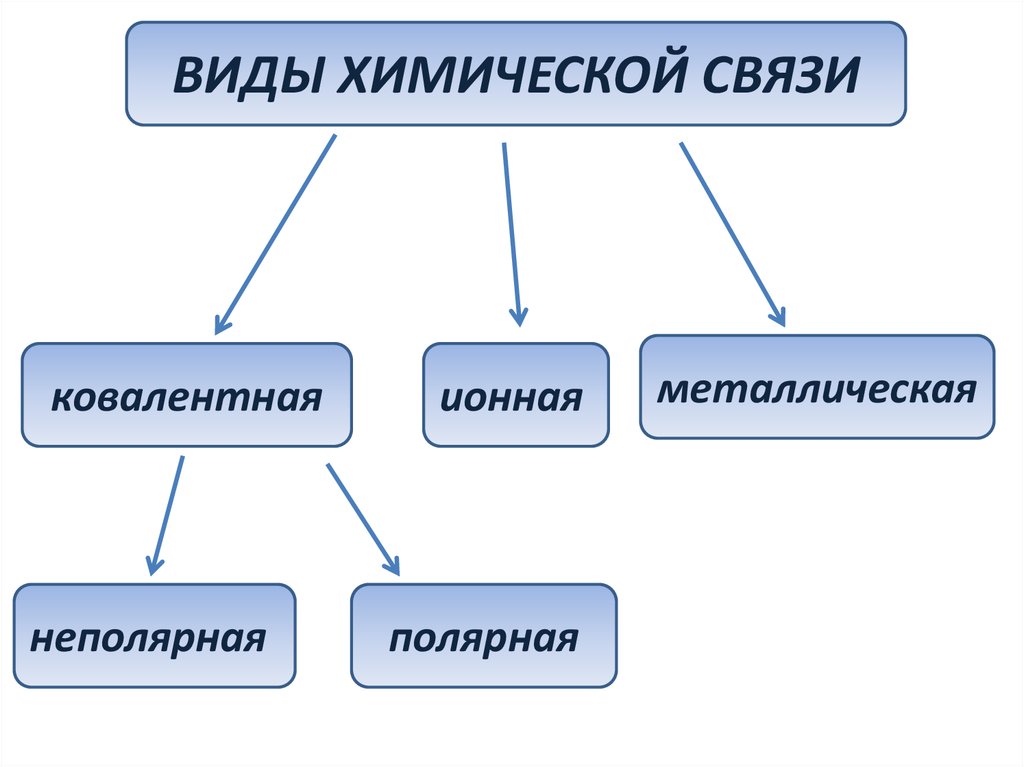
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИковалентная
неполярная
ионная
полярная
металлическая
4.
Металлическая –в простых веществах-металлах
Al
Na
Ba
Fe
Mg
5.
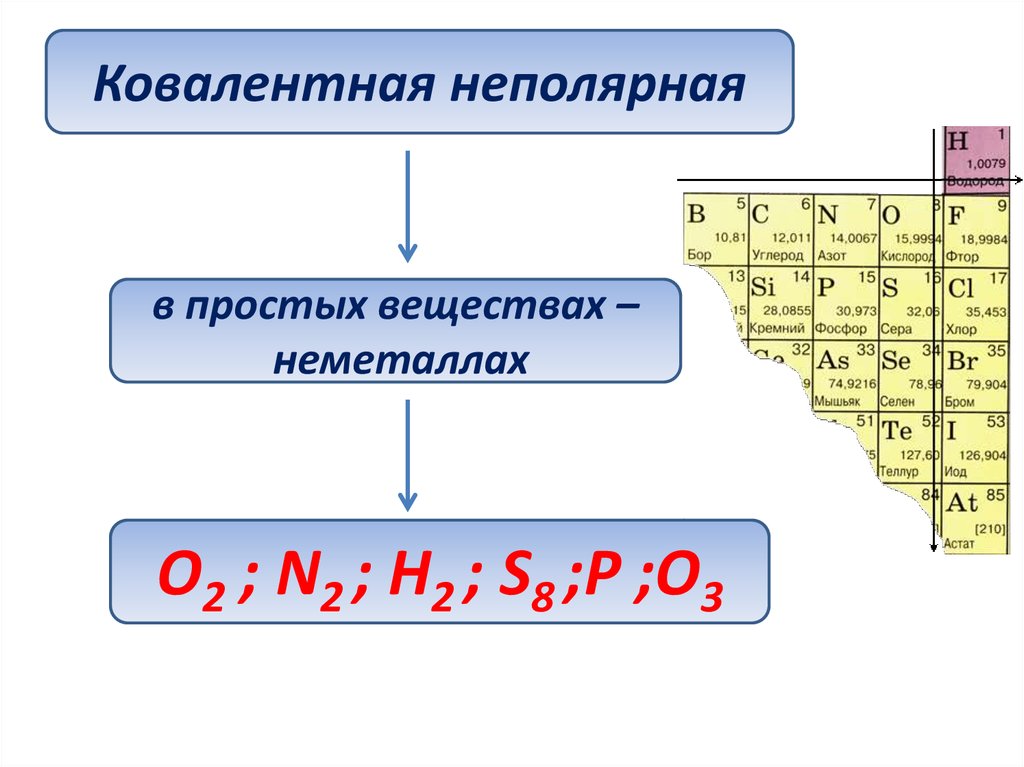
Ковалентная неполярнаяв простых веществах –
неметаллах
O2 ; N2 ; H2 ; S8 ;P ;O3
6.
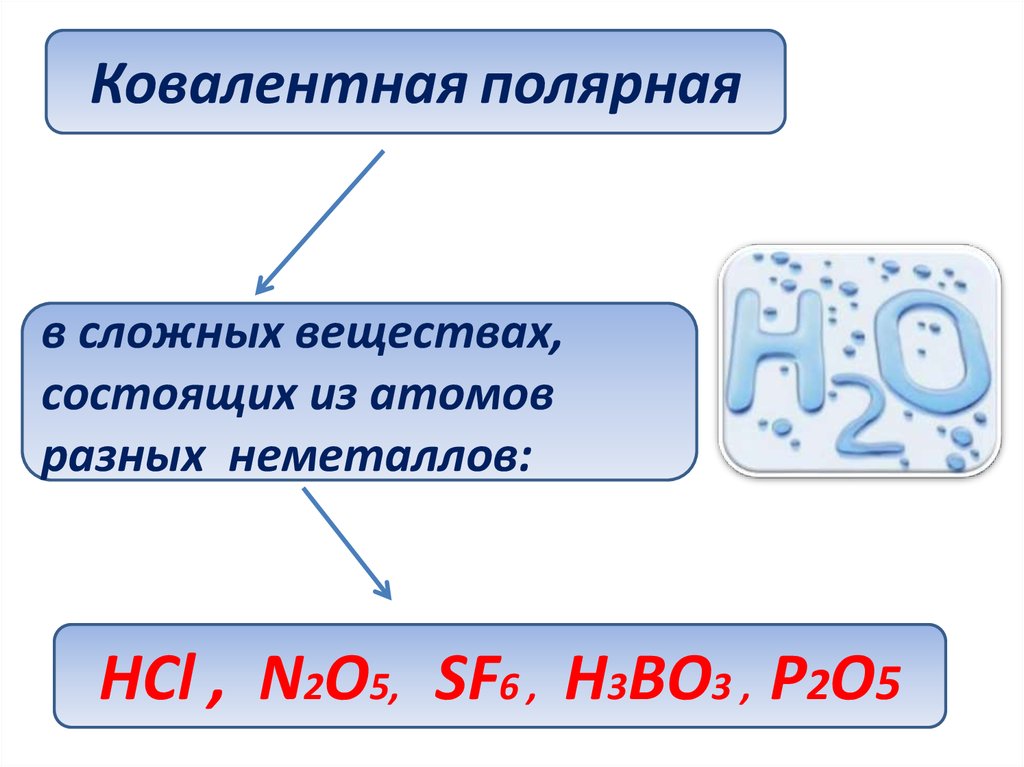
Ковалентная полярнаяв сложных веществах,
состоящих из атомов
разных неметаллов:
НСl , N2O5, SF6 , H3BO3 , Р2О5
7.
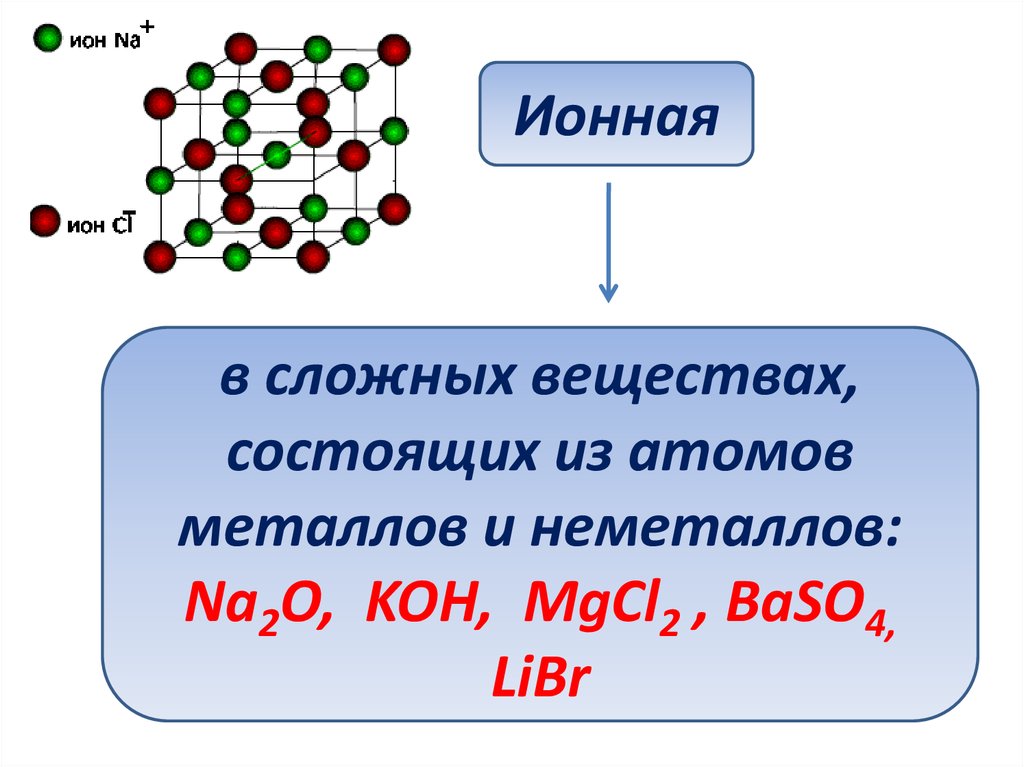
Ионнаяв сложных веществах,
состоящих из атомов
металлов и неметаллов:
Na2O, KOH, MgCl2 , BaSO4,
LiBr
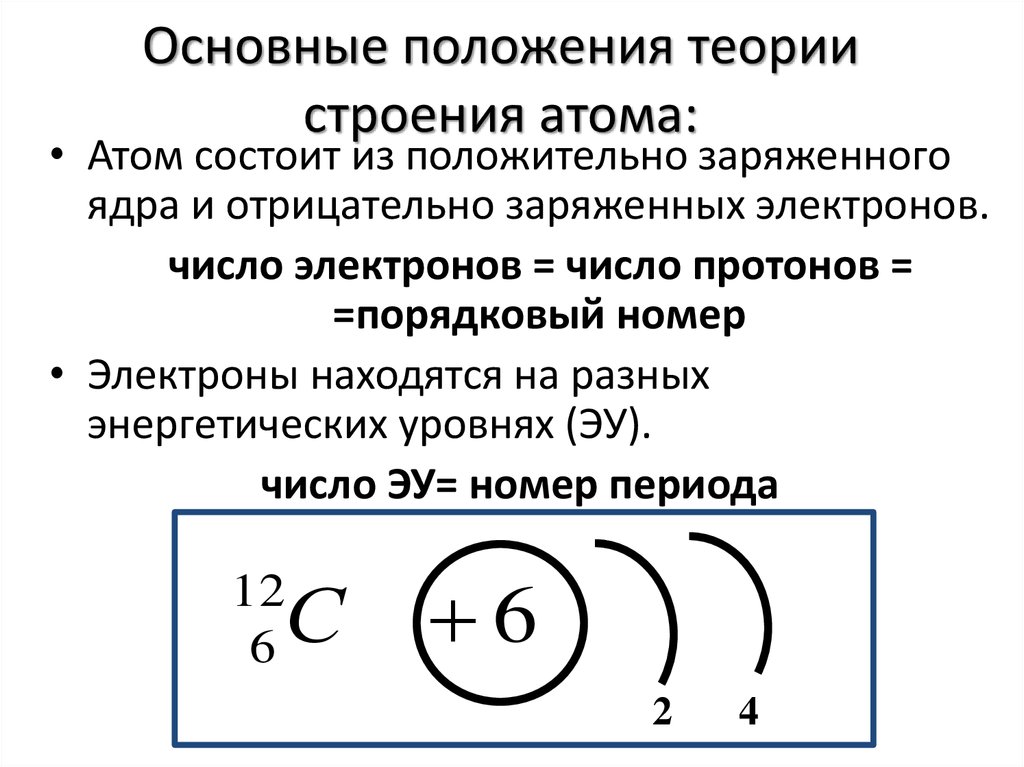
8. Основные положения теории строения атома:
• Атом состоит из положительно заряженногоядра и отрицательно заряженных электронов.
число электронов = число протонов =
=порядковый номер
• Электроны находятся на разных
энергетических уровнях (ЭУ).
число ЭУ= номер периода
С
12
6
6
2
4
9.
Основные положения теориистроения атома:
• Нельзя проследить траекторию движения
электрона. Область, в которой нахождение
электрона наиболее вероятно, называют
орбиталью.
• Орбитали различаются по форме, размерам
и энергии.
На одной орбитали – не более 2-х
электронов!
10. Виды орбиталей (по форме):
• s-орбиталь• р-орбиталь
• d-орбиталь
• f-орбиталь
11. Основные положения теории строения атома:
• Сначала заполняются орбитали с самойнизкой энергией (ближайшие к ядру).
• Равные по энергии орбитали сначала
заполняются единичными электронами.
2s
2р
12.
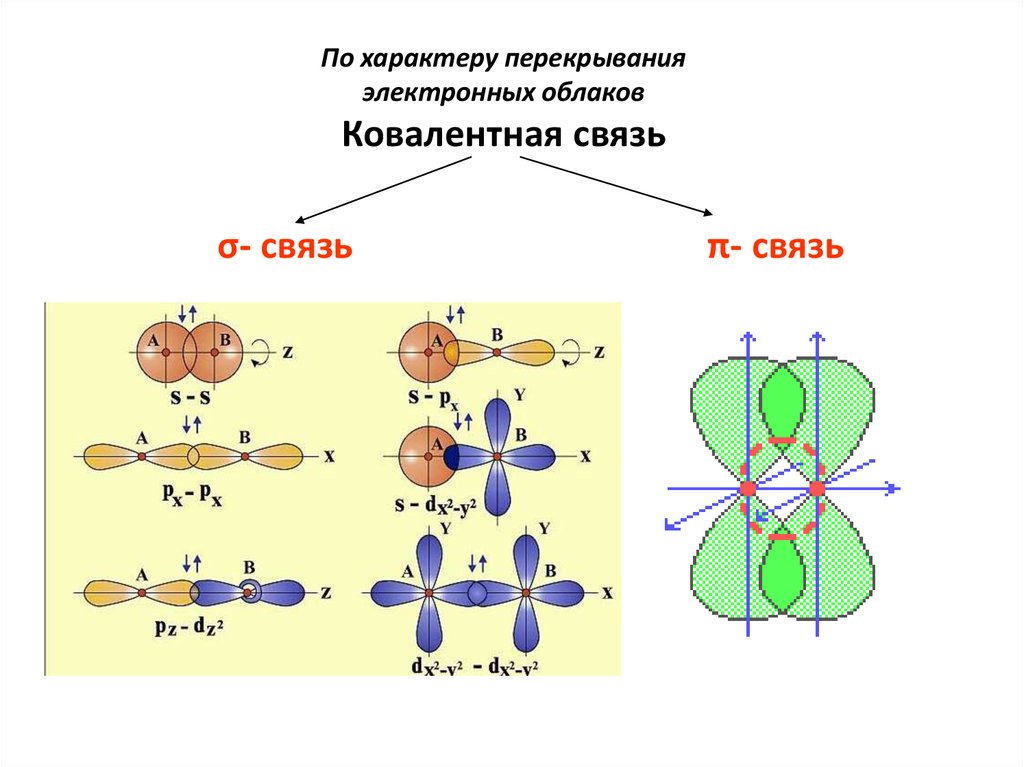
По характеру перекрыванияэлектронных облаков
Ковалентная связь
σ- связь
π- связь
13. Химические связи, образующиеся в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов, называют
σ-связями.Химические связи, образующиеся в
результате перекрывания орбиталей в двух
областях, называют π-связями.
14. Метод валентных связей (ВС)
• Связанные между собой атомы в молекуле удерживаются вместепри помощи одной или нескольких общих эл-ных пар
• Химическая связь между двумя атомами локализована в месте
перекрывания атомных орбиталей (локализованная
двухцентровая связь)
• Научное объяснение гипотезы дано В. Гейтлером и Ф. Лондоном
(1927) путем приближенного решения уравнения Шредингера для
молекулы водорода
• Гипотеза образования ков. связи за счет обобществления эл-нов
дана Льюисом
15. Основные положения метода ВС
• Ков. связь образуют два электрона спротивоположными спинами,
принадлежащие двум атомам
• При образовании связи происходит
перекрывание АО и увеличение электронной
плотности между ними, что приводит к
уменьшению энергии
• Связь реализуется в направлении
наибольшего перекрывания АО









 Химия
Химия








