Похожие презентации:
Излучение атомарного водорода
1. Излучение атомарного водорода
Оптические спектрыи строение атомов
Спектральные серии
Формула Бальмера
Строение атома
по Резерфорду
Постулаты Н. Бора.
Теория атома Н. Бора
с квантованием момента
импульса электрона
в стационарных состояниях.
2.
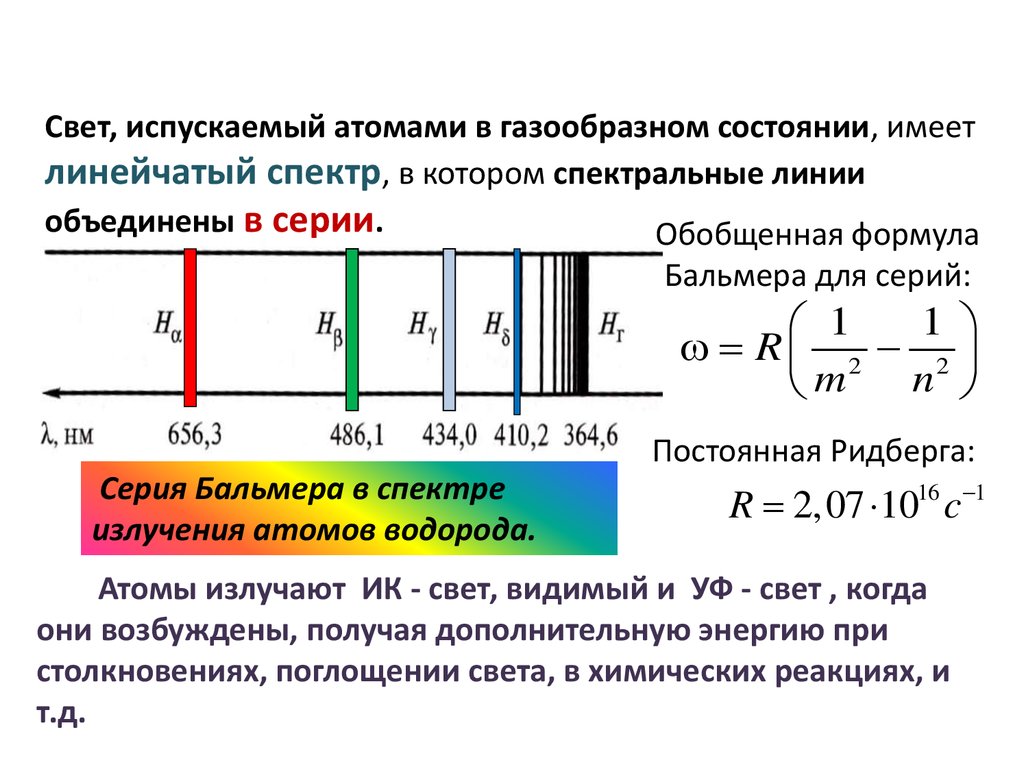
Оптические спектры и строение атомовСвет, испускаемый атомами в газообразном состоянии, имеет
линейчатый спектр, в котором спектральные линии
объединены в серии.
Обобщенная формула
Бальмера для серий:
1
1
R 2 2
n
m
Постоянная Ридберга:
Серия Бальмера в спектре
излучения атомов водорода.
R 2,07 1016 c 1
Атомы излучают ИК - свет, видимый и УФ - свет , когда
они возбуждены, получая дополнительную энергию при
столкновениях, поглощении света, в химических реакциях, и
т.д.
3.
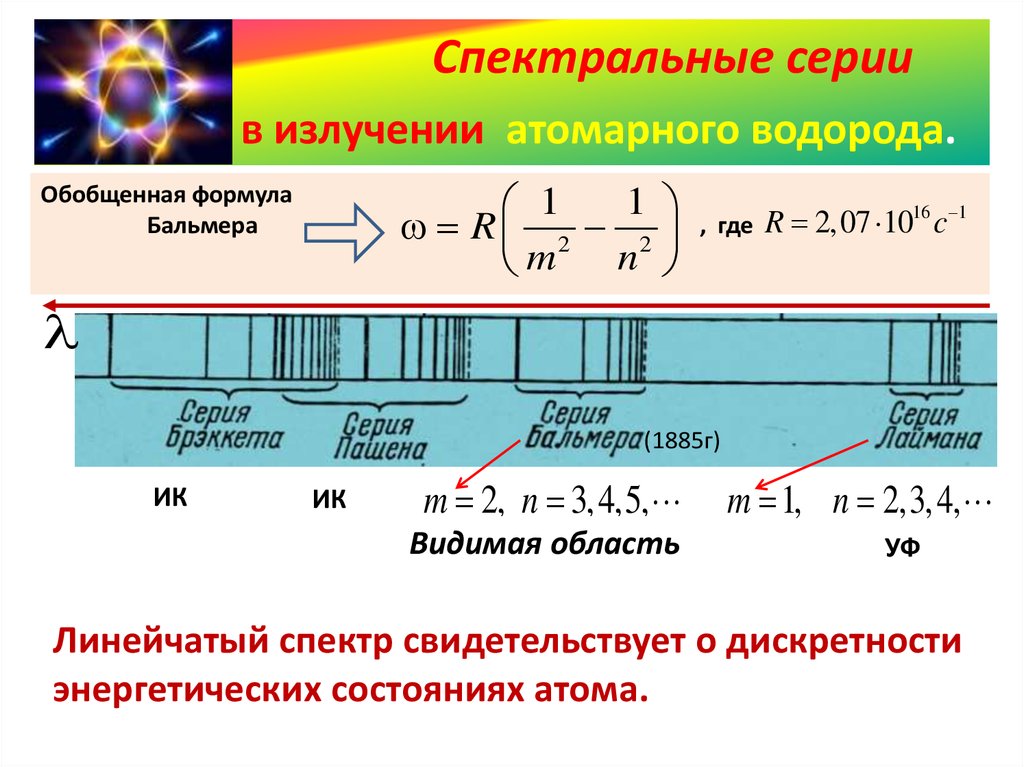
Спектральные сериив излучении атомарного водорода.
1
1
R 2 2
n
m
Обобщенная формула
Бальмера
, где
R 2,07 1016 c 1
(1885г)
ИК
ИК
m 2, n 3,4,5,
Видимая область
m 1, n 2,3,4,
УФ
Линейчатый спектр свидетельствует о дискретности
энергетических состояниях атома.
4.
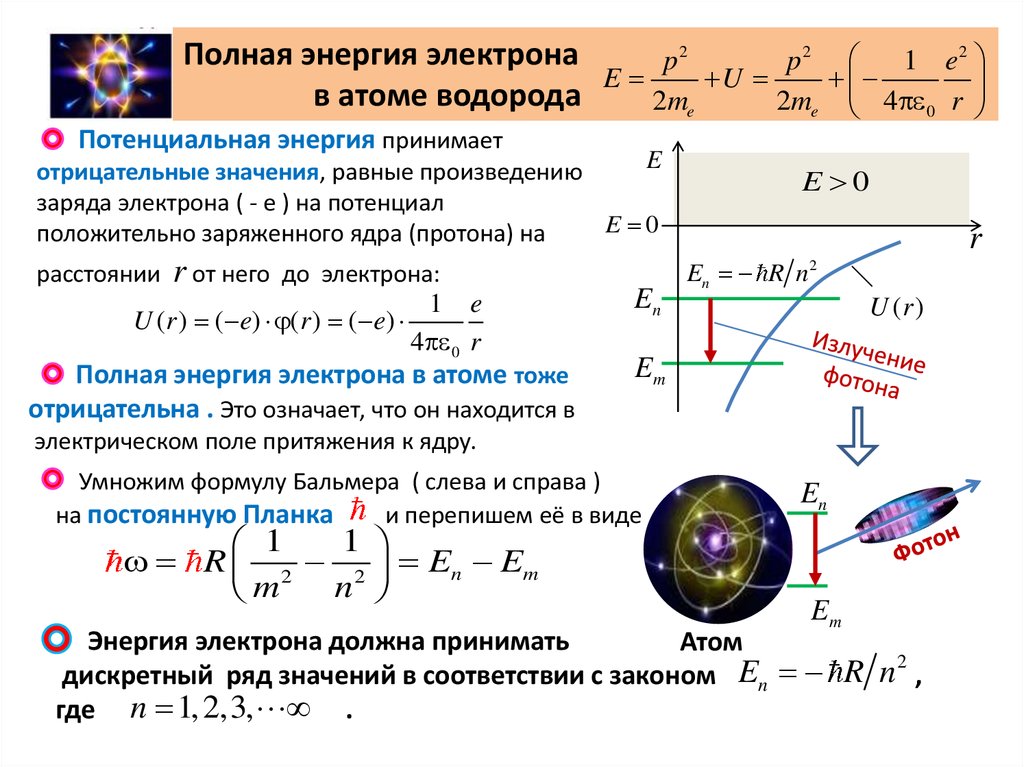
Полная энергия электронаp2
p2
1 e2
E
U
в атоме водорода
2me
2me 4 0 r
Потенциальная энергия принимает
E
отрицательные значения, равные произведению
заряда электрона ( - е ) на потенциал
E 0
положительно заряженного ядра (протона) на
расстоянии
r от него
до электрона:
1 e
U (r ) ( e) (r ) ( e)
4 0 r
Полная энергия электрона в атоме тоже
отрицательна . Это означает, что он находится в
En
E 0
r
En R n 2
U (r )
Em
электрическом поле притяжения к ядру.
Умножим формулу Бальмера ( слева и справа )
на постоянную Планка
и перепишем её в виде
1
1
R 2 2 En Em
n
m
En
Em
Энергия электрона должна принимать
Атом
2
дискретный ряд значений в соответствии с законом En R n ,
где n 1, 2,3, .
5.
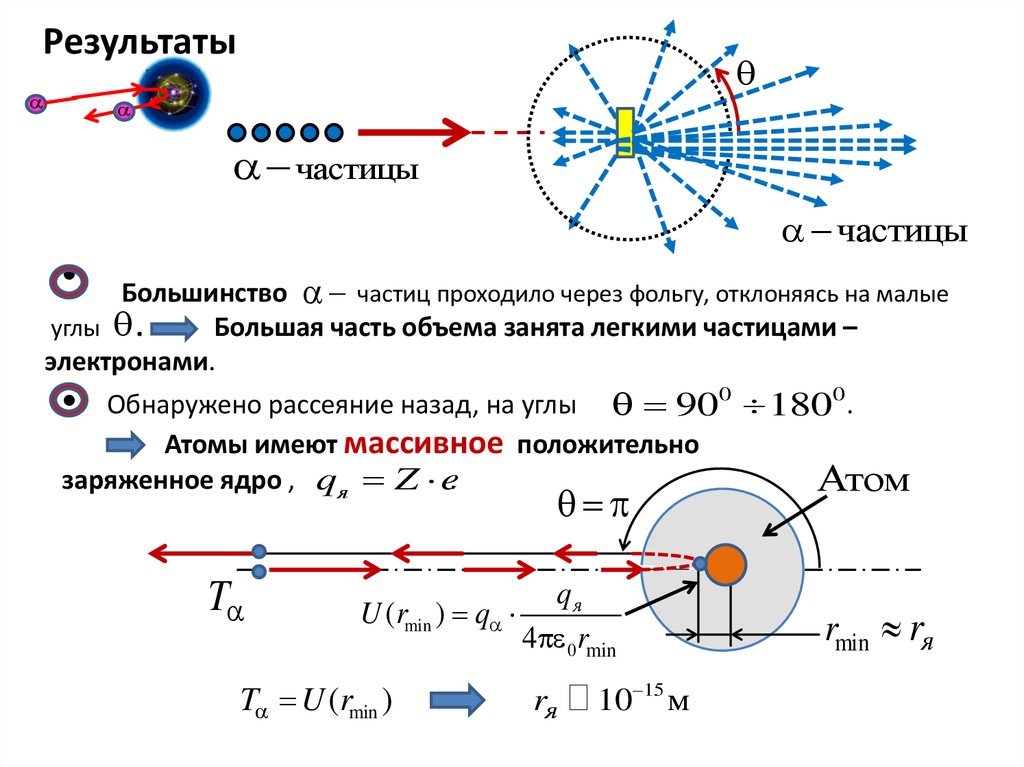
Опыты Резерфорда по рассеяниюальфа-частиц веществом.
Некоторые элементы (уран, радий, и др.)
Обладают способностью испускать быстрые
заряженные альфа-частицы ( ) , которые при
столкновениях могут проникать внутрь атомов и
давать сведения об их внутреннем устройстве.
4
2
Альфа-частицы – ядра атома гелия He ,
состоящие из двух протонов и двух нейтронов,
заряд частицы q 2e 3, 2 10 19 Кл , имеют
скорость v 107 м с
и кинетическую энергию Т (4 9) МэВ
6.
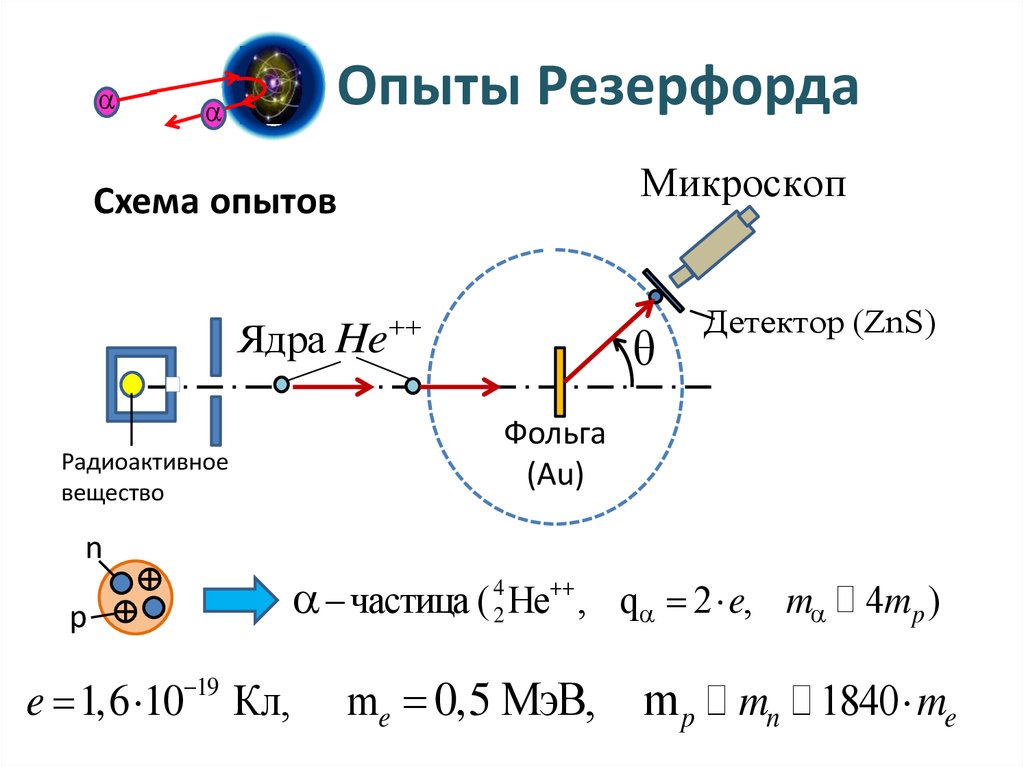
Опыты РезерфордаМикроскоп
Схема опытов
Ядра He
Радиоактивное
вещество
Детектор (ZnS)
Фольга
(Au)
n
p
e 1,6 10 19 Кл,
частица ( 42 He , q 2 e, m 4mp )
me 0,5 МэВ,
m p mn 1840 me
7.
Результатычастицы
частицы
Большинство частиц проходило через фольгу, отклоняясь на малые
углы .
Большая часть объема занята легкими частицами –
электронами.
Обнаружено рассеяние назад, на углы 900 1800 .
Атомы имеют массивное положительно
заряженное ядро , qя Z e.
T
qя
U (rmin ) q
4 0 rmin
T U (rmin )
rя
10 15 м
Атом
rmin rя
8.
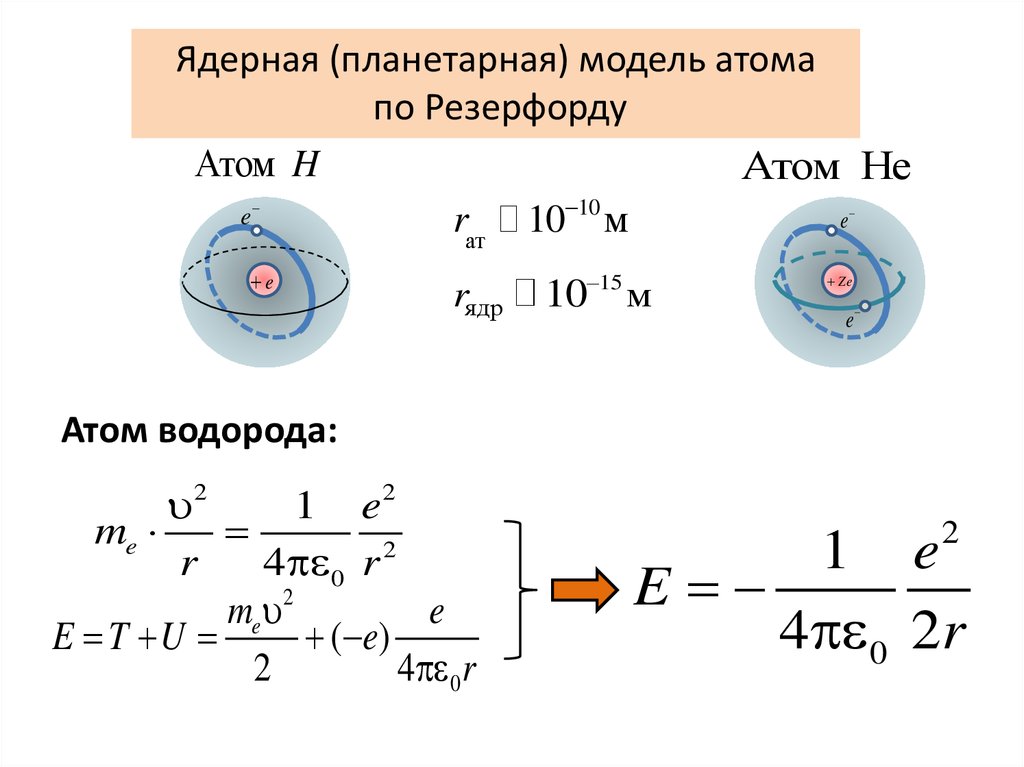
Ядерная (планетарная) модель атомапо Резерфорду
Атом H
Атом He
e
e
rат 10 10 м
e
rядр
10 15 м
Ze
e
Атом водорода:
1 e
me
2
r
4 0 r
me 2
e
E T U
( e)
2
4 0 r
2
2
2
1 e
E
4 0 2r
9.
ee
Проблемы
Атом – стабильное (устойчивое) образование.
Величины E , r , v не должны изменяться. Кроме того
электрон – заряженная частица, которая движется в атоме с
ускорением. По законам электродинамики электрон должен
излучать электромагнитные волны и тем самым терять свою
энергию.
Атом Резерфорда не может быть устойчивым!
Излучение по
E
1 2e2 2
a
3 ц.стр. законам
t 4 0 3c
электродинамики
1
e2
Центростремительное
aц.стр.
me 4 0 r 2 ускорение электрона
1 e2
E
4 0 2r
Энергия электрона
в атоме
Резерфорда
Электрон, находясь на
круговой орбите с радиусом
r0 10 10 м
падает на ядро через
время
3 2 3
r
2 0 me c
10
(4 0 )
10
c
4
4e
10.
Атом Нильса БораДатский физик-теоретик в 1913 г. разработал первую квантовую теорию атома,
которая опиралась на модель атома Резерфорда, закономерности в атомных
спектрах и гипотезу Планка о квантовании энергии осциллятора и введении
постоянной
в теорию теплового излучения.
Постулаты Н.Бора
1). О существовании стационарных состояний и квантовании момента
импульса. В атоме существует дискретный набор стационарных (разрешенных)
орбит радиусов r1 , r2 , r3 , .
Момент импульса электрона
Mp r p
в этих состояниях принимает целочисленные значения, кратные
rn pn n
, где
n=1, 2, 3, … .
:
( для круговых орбит)
Находясь на стационарной орбите, электрон имеет неизменное
значение энергии и, вопреки законам классической электродинамики, не
излучает энергию.
2). О поглощении и испускании квантов излучения. Излучение или
поглощение кванта излучения (фотона)
происходит при переходе из
одного стационарного состояния в другое путем квантового скачка при
соблюдении закона сохранении энергии:
En Em
11.
Теория Н. Бора атома водорода Н и иона гелия He .Vn2
1 Ze e
2
(1) me
rn 4 0 rn
(2) rn meVn n
(3)
2-й закон Ньютона
Квантование момента импульса
me vn2
me vn2
Ze2
En Eкин U
( e) я
2
2
4 0 rn
2
n2
2
rn 4 0
n rБ
2
me Ze
Z
Ze 2
vn
4 0
1
n
rБ 4 0
2
me e
2
0,53 10
10
м
1 Ze2 1
En
4 0 2rБ n2
1 Ze2
En
4 0 2rn
n 1, 2,3,
12.
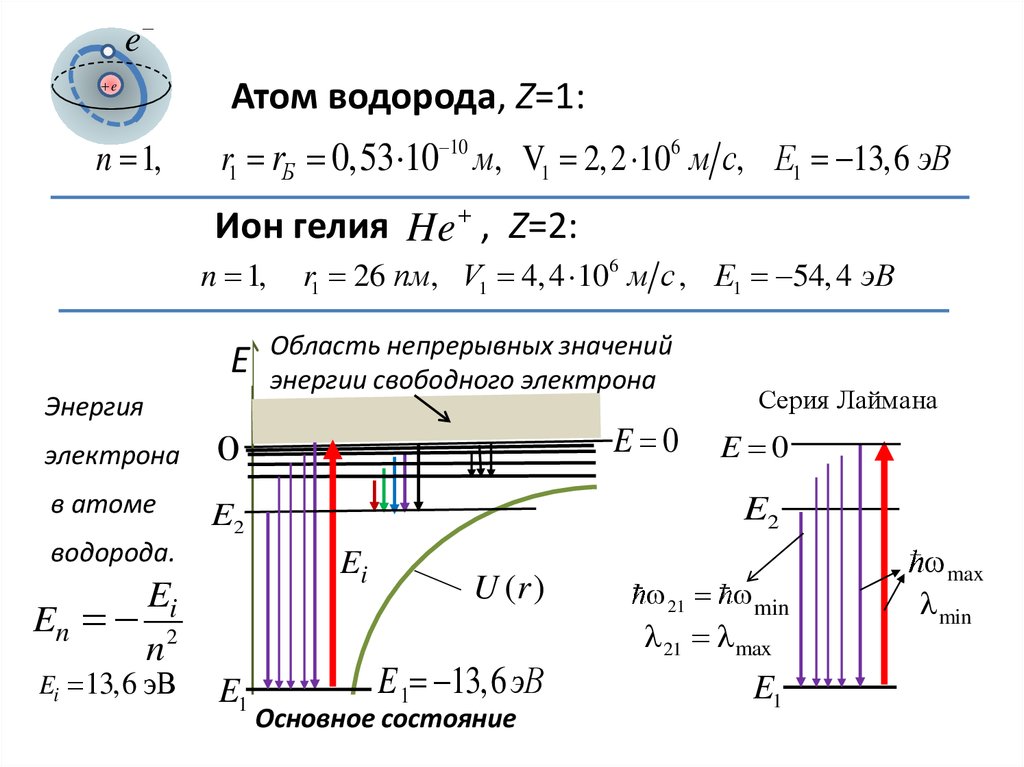
ee
n 1,
Атом водорода, Z=1:
r1 rБ 0,53 10 10 м, V1 2, 2 106 м с, E1 13,6 эВ
Ион гелия He , Z=2:
n 1,
E
Энергия
электрона
0
в атоме
E2
водорода.
Область непрерывных значений
энергии свободного электрона
E 0
E1
Серия Лаймана
E 0
E2
Ei
Ei
En 2
n
Ei 13,6 эВ
r1 26 пм, V1 4, 4 106 м с , E1 54, 4 эВ
U (r )
E 1 13,6 эВ
Основное состояние
21 min
21 max
E1
max
min
13.
О теории Н. БораИз теории Бора следует формула для частот излучения
En Em
1
e2 1
1
1
2 1
Z
Z
R
2
4 0 2 rБ m2 n 2
n2
m
2
атома водорода и других водородоподобных образований,
таких как ионы He (Z 2), Li (Z 3), Be ( Z 4).
Формула для частот при Z=1 совпадает с формулой Бальмера,
где
1 e2
R
2,07 1016 с 1
точно соответствует величине,
4 0 2rБ
найденной из оптических экспериментов.
Дальнейшее открытие новых квантовых законов физики
показало, что планетарная модель атома просто неверна.
Однако это первая квантовая теория, которая имела большое
значение для дальнейшего развития физических
представлений о строении атомов и молекул.
14.
Как физики начинают изучать новые явления(на примере атома водорода)
Физики начинают изучать новые явления с введения подходящих единиц
измерения из имеющихся констант. Так, для электрона в атоме константами
являются его заряд , масса электрона и константа в законе Кулона:
19
e 1,6 10 Кл
,
30
,
me 0,91 10 кг 1 4 0 9 10 Н м Кл
9
2
2
.
Но, комбинируя эти константы, нельзя получить величину, имеющую
размерность длины. Это означает, что в классической механике атом
невозможен – электрон не может двигаться стационарно.
Положение изменилось с появлением постоянной Планка
1,05 10 34 Дж с
a0
Величина, имеющая размерность длины, равна
2
2
10
4 0 me e 0,53 10 м (характерный размер
атома).








 Физика
Физика








