Похожие презентации:
Атом водорода и водородоподобные ионы
1. Атом водорода и водородоподобные ионы
Физикаатома
En
Атом
Атом водорода
и
водородоподобные ионы
Em
2.
Излучение атомарноговодорода
• Оптические спектры
• и строение атомов
Спектральные серии
Формула Бальмера
Строение атома
Теория атома Н. Бора
по Резерфорду
с квантованием момента
Постулаты Н. Бора.
импульса электрона
в стационарных состояниях.
3.
Радиоактивность. Альфа-частицыОткрытие радиоактивности: в 1896г. (Франция А.Беккерель).
Некоторые радиоактивные элементы (уран, радий, и др.) обладают
способностью испускать быстрые заряженные альфа-частицы, которые при
столкновениях могут проникать внутрь атомов и давать сведения об их
внутреннем устройстве.
4
2
Альфа-частицы – ядра атома гелия He
состоящие из двух протонов и двух нейтронов.
19
Заряд частицы q 2e 3, 2 10 Кл .
Частицы имеют скорость
и кинетическую энергию
n
,
107 м с
v
Т (4 9) МэВ .
Элементарный заряд и массы:
e 1,6 10 19 Кл,
me 0,5 МэВ,
mp
mn
1840 me
p
4.
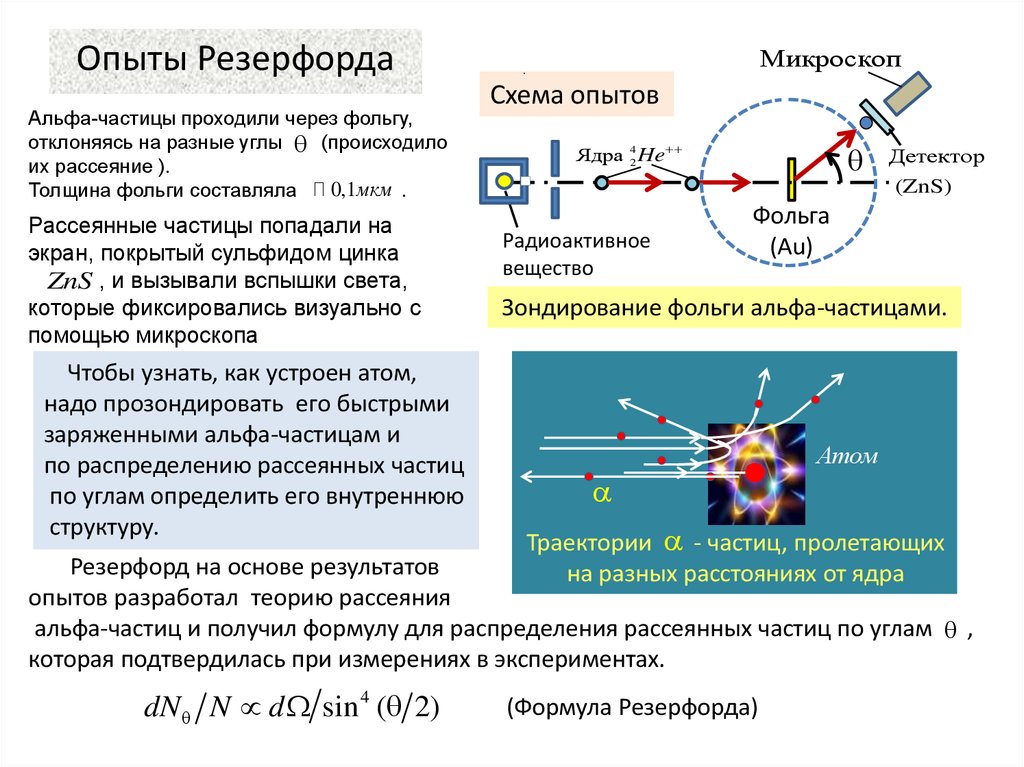
Опыты РезерфордаАльфа-частицы проходили через фольгу,
отклоняясь на разные углы (происходило
их рассеяние ).
0,1мкм .
Толщина фольги составляла
Рассеянные частицы попадали на
экран, покрытый сульфидом цинка
ZnS , и вызывали вспышки света,
которые фиксировались визуально с
помощью микроскопа
Чтобы узнать, как устроен атом,
надо прозондировать его быстрыми
заряженными альфа-частицам и
по распределению рассеянных частиц
по углам определить его внутреннюю
структуру.
Микроскоп
.
Схема опытов
Ядра 42 He
Детектор
(ZnS)
Радиоактивное
вещество
Фольга
(Au)
Зондирование фольги альфа-частицами.
Атом
Траектории - частиц, пролетающих
на разных расстояниях от ядра
Резерфорд на основе результатов
опытов разработал теорию рассеяния
альфа-частиц и получил формулу для распределения рассеянных частиц по углам ,
которая подтвердилась при измерениях
в экспериментах.
dN N d sin 4 ( 2)
(Формула Резерфорда)
5.
Результаты опытовчастиц
проходило через фольгу,
отклоняясь на малые углы .
Оказалось, что из 10 4 альфа
1). Большинство
частицы
с
м
-частиц лишь одна отклоняется
0
на угол 10 .
Вывод:
Большая часть объема занята легкими частицами – электронами.
2). Изредка встречаются и альфа-частицы, отклоняющиеся на тупые углы вплоть
до угла 1800 .
Вывод:
Атомы имеют массивное положительно заряженное ядро,
радиус которого значительно меньше, чем радиус атома.
Оценка радиуса ядра из ситуации с лобовым столкновением.
частица, приближаясь
к ядру, попадает в тормозящее
T
электрическое поле ядра.
qя
В
точке
поворота:
U
(
r
)
q
Её кинетическая энергия
min
4 0 rmin
уменьшается и в точке поворота,
когда r rmin обращается в нуль.
Из закона сохранения энергии
T U (rmin )
следует
Атом
rmin rя
rя 4 10 14 м
6.
Ядерная (планетарная)модель атома по Резерфорду
e
Атом H
e
rядр
p
10 10 м
10 15 м
rат
Проблемы:
Атом – стабильное (устойчивое) образование.
Величины E , r , v не должны изменяться.
Но электрон – заряженная частица, которая движется
в атоме с ускорением. По законам электродинамики
электрон должен излучать электромагнитные волны и
тем самым терять свою энергию.
Атом Резерфорда не может быть устойчивым!
E
1 2e2 2 Излучение по законам
a
1)
3 ц.стр. электродинамики
t 4 0 3c
1
e2
Центростремительное
aц.стр.
2
me 4 0 r ускорение электрона
1 e 2 Энергия электрона в
2) E
4 0 2r атоме Резерфорда
Электрон, находясь на круговой
10
орбите с радиусом r0 10 м ,
падает на ядро через время
3
2 0
r me2c3
10
(4 0 )
10
c
4
4e
Другое важное возражение против планетарной модели заключается в том,
что она допускает непрерывный спектр излучения атомами. А из опытов следует,
что спектр излучения, характерный для каждого атома , состоит из отдельных
строго определенных длин волн.
7.
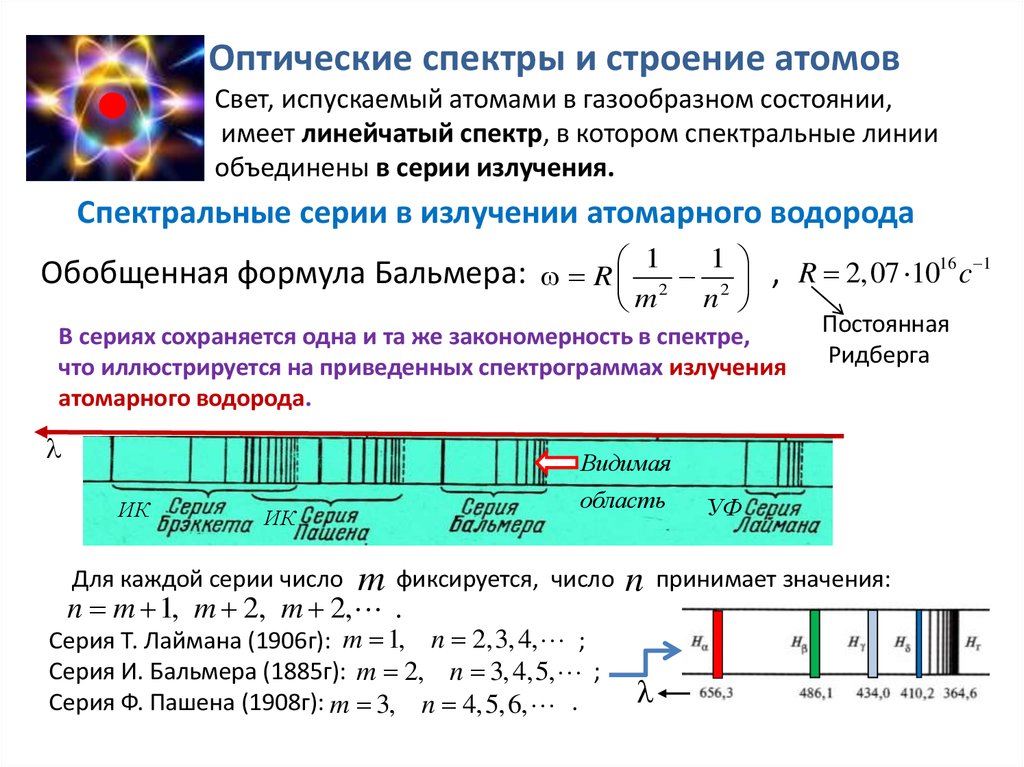
Оптические спектры и строение атомовСвет, испускаемый атомами в газообразном состоянии,
имеет линейчатый спектр, в котором спектральные линии
объединены в серии излучения.
Спектральные серии в излучении атомарного водорода
Обобщенная формула Бальмера: R 12 12 , R 2,07 1016 c 1
m
n
В сериях сохраняется одна и та же закономерность в спектре,
что иллюстрируется на приведенных спектрограммах излучения
атомарного водорода.
Постоянная
Ридберга
Видимая
ИК
область
ИК
Для каждой серии число
m
фиксируется, число
n m 1, m 2, m 2, .
Серия Т. Лаймана (1906г): m 1, n 2,3, 4, ;
Серия И. Бальмера (1885г): m 2, n 3, 4,5, ;
Серия Ф. Пашена (1908г): m 3, n 4,5, 6, .
n
УФ
принимает значения:
8.
Атом Нильса БораДатский физик-теоретик в 1913 г. разработал первую квантовую теорию
атома, которая опиралась на модель атома Резерфорда, закономерности в атомных
спектрах и гипотезу Планка о квантовании энергии осциллятора и введении
34
постоянной 1,05 10 Дж с в теорию теплового излучения.
К тому времени сложилась ситуация, в которой законы классической механики и
электродинамики непримиримо противоречили экспериментам.
Линейчатые спектры свидетельствовали о дискретности энергетических
состояний атома.
Планетарная модель атома Резерфорда оказалась неустойчивой.
Кроме того, комбинируя константы
, me , 1 4 0 ,
относящиеся к электрону в атоме, нельзя получить величину, имеющую
размерность длины. Это означает, что в классической механике атом невозможен –
электрон не может двигаться стационарно.
e
Положение изменилось с появлением постоянной Планка, имеющей
размерность момента импульса. Величина, имеющая размерность длины,
равна a0 4 0 2 me e2 0,53 10 10 м (характерный размер атома )
Самым простым атомом является атом водорода , имеющий единственный
электрон. Масса протона в 1840 раз больше массы электрона. В первом приближении
можно считать орбиты электрона круговыми орбитами, скорость мала по
сравнению со скоростью света, а ядро неподвижным.
9.
Постулаты Н.Бора1). О существовании стационарных состояний и квантовании момента
импульса. В атоме существует дискретный набор стационарных (разрешенных)
орбит радиусов r1 , r2 , r3 , .
Момент импульса электрона
Lp r p
в этих состояниях принимает целочисленные значения, кратные
rn pn n
, где
n=1, 2, 3, … .
:
( для круговых орбит)
Находясь на стационарной орбите, электрон имеет неизменное
значение энергии и, вопреки законам классической электродинамики, не
излучает энергию.
2). О поглощении и испускании квантов излучения.
Излучение или поглощение кванта излучения (фотона)
происходит при переходе из одного стационарного
состояния в другое путем квантового скачка
при соблюдении закона сохранении энергии:
En Em
En
Атом
Em
10.
Энергия электрона в атомеПотенциальная энергия принимает
U (r ) ( e) (r ) ( e)
отрицательные значения, равные произведению
заряда электрона ( - е ) на потенциал положительно
заряженного ядра на расстоянии
r от него
до электрона:
Полная энергия электрона в атоме
тоже отрицательна . Это означает, что он
p2
p2
E
U
2me
2me
находится в электрическом поле притяжения
к ядру.
Теория Н.Бора атома водорода
meVn2
Ze2
En Eкин U
2
4 0 rn
(1)
Vn2
1 Ze e
me
2
(2)
rn 4 0 rn
1
1
1 Ze2
En
(4)
4 0 2rn
2
n2
rn 4 0
n rБ (5)
me Ze2
Z
2
1 Ze2
4
r
0
H и иона гелия 42 He .
.
rn meVn n , n 1,2,3, (3)
1 Ze
4 0 r
1
Z 2 e4 1
En
2 (6)
2
(4 0 ) 2 rБ n
11.
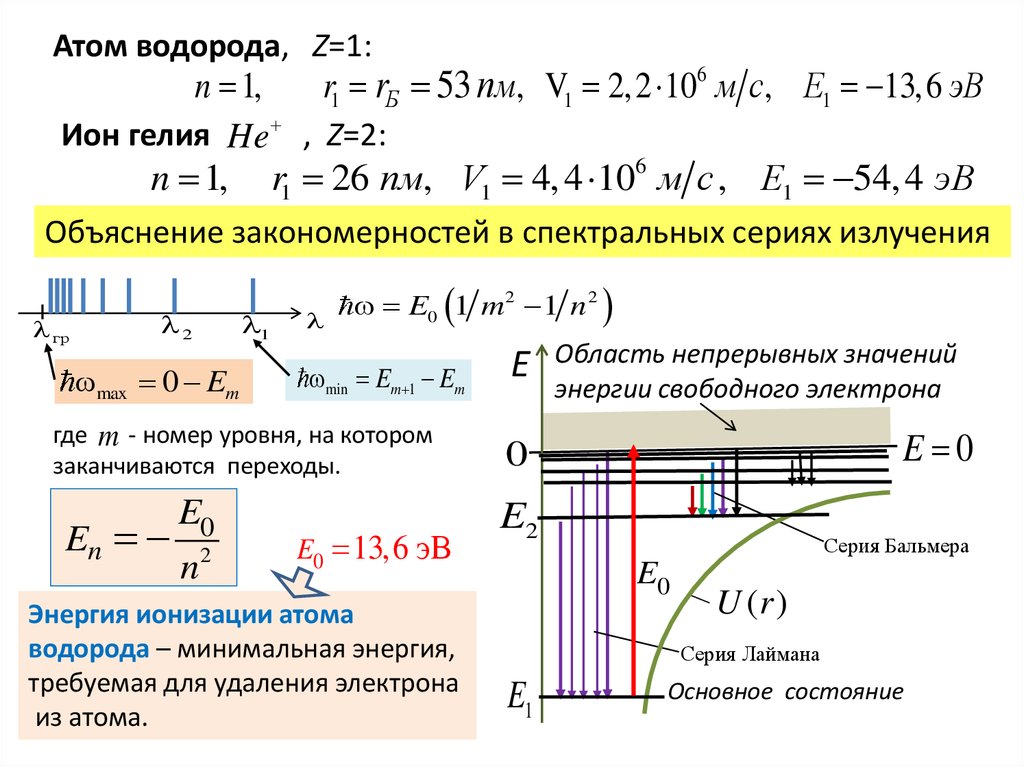
Атом водорода, Z=1:n 1,
r1 rБ 53 пм, V1 2, 2 106 м с, E1 13,6 эВ
Ион гелия He , Z=2:
n 1, r1 26 пм, V1 4, 4 106 м с , E1 54, 4 эВ
Объяснение закономерностей в спектральных сериях излучения
гр
2
max 0 Em
1
E0 1 m 2 1 n 2
min Em 1 Em
где m - номер уровня, на котором
заканчиваются переходы.
E0
En 2
n
E0 13,6 эВ
Энергия ионизации атома
водорода – минимальная энергия,
требуемая для удаления электрона
из атома.
E
Область непрерывных значений
энергии свободного электрона
E 0
0
E2
Серия Бальмера
E0
U (r )
Серия Лаймана
E1
Основное состояние
12.
О теории Н. БораНильс Бор поверил результатам экспериментов и видоизменил планетарную модель
атома путем введения постулатов, согласно которым в атоме существуют совершенно
недопустимые с точки зрения законов классической механики и электродинамики
стационарные орбиты. Радиусы орбит находится из условия квантования момента
импульса, согласно которому имеются строго определённые состояния вращения.
Излучение или поглощение квантов энергии возможно только при переходе из
одного стационарного состояния в другое.
Из теории Бора следует формула для частот излучения
En Em
1
e4 1
1
1
1
2
Z
Z
E
0
2
4 0 2 rБ m2 n 2
n2
m
2
атома водорода и других водородоподобных образований, таких как
ионы He ( Z 2), Li ( Z 3), Be ( Z 4).
Формула для частот при Z=1 совпадает
с формулой Бальмера, где
4
Постоянная Ридберга R 1 e 2,07 1016 с 1
4 0 2rБ
точно соответствует величине, найденной из оптических экспериментов.
Дальнейшее открытие новых квантовых законов физики показало, что
планетарная модель атома просто неверна.
Однако это первая квантовая теория, которая имела большое значение для
дальнейшего развития физических представлений о строении атомов и молекул.








 Физика
Физика








