Похожие презентации:
Карбонильные соединения и карбоновые кислоты. Лекция № 4
1. Реакционная способность карбонильных соединений
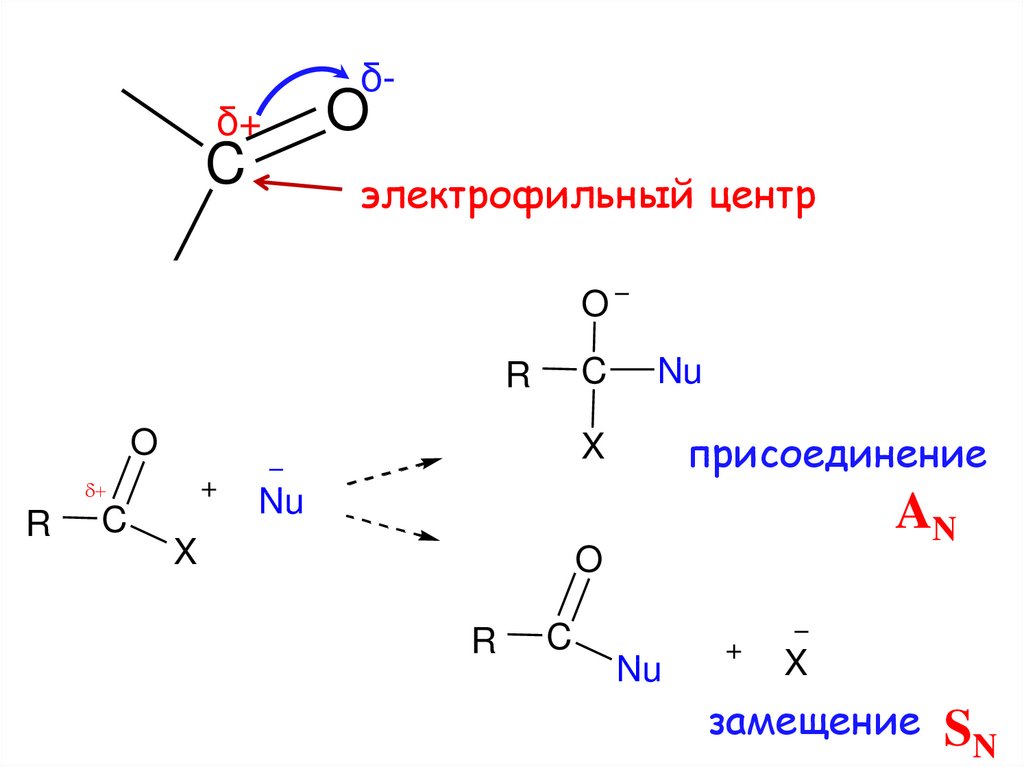
OC
Реакционная способность
карбонильных соединений
2.
RO
R
C
C
H
R
R
O
O
C
OH
R
R
O
R
O
C
C
O
C
NH2
OR
R
O
C
SR
NHR
R
O
C
Cl
3.
δ+C
δ-
O
электрофильный центр
O
C
R
O
R
присоединение
X
C
Nu
Nu
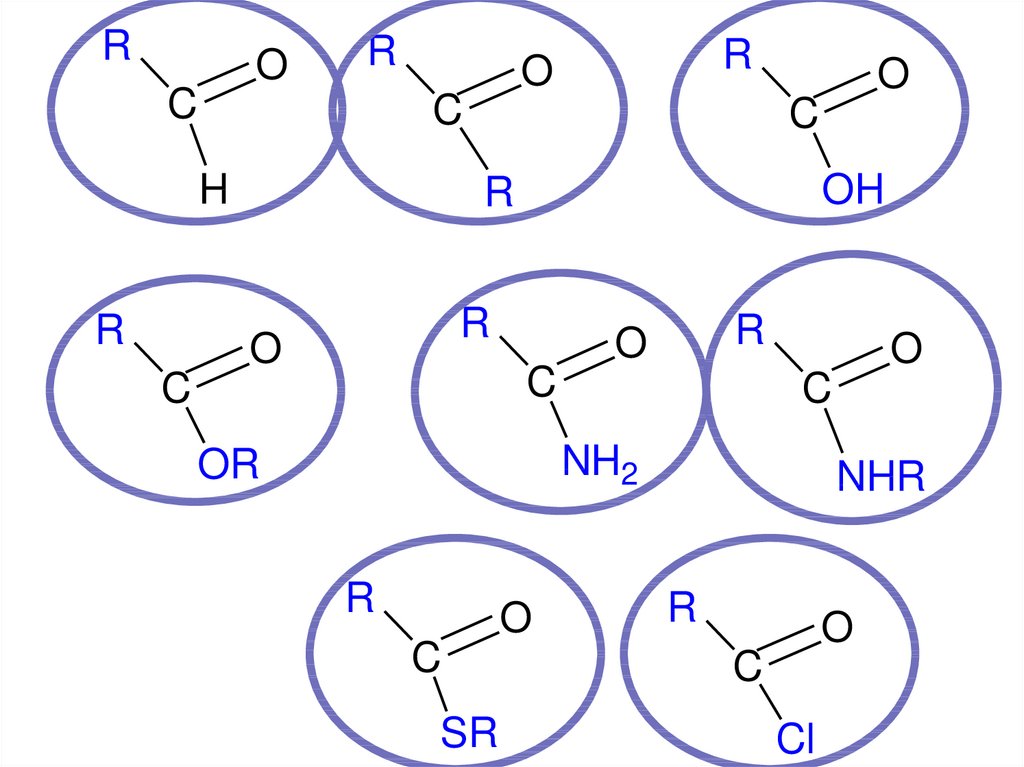
X
AN
O
R
C
Nu
X
замещение
SN
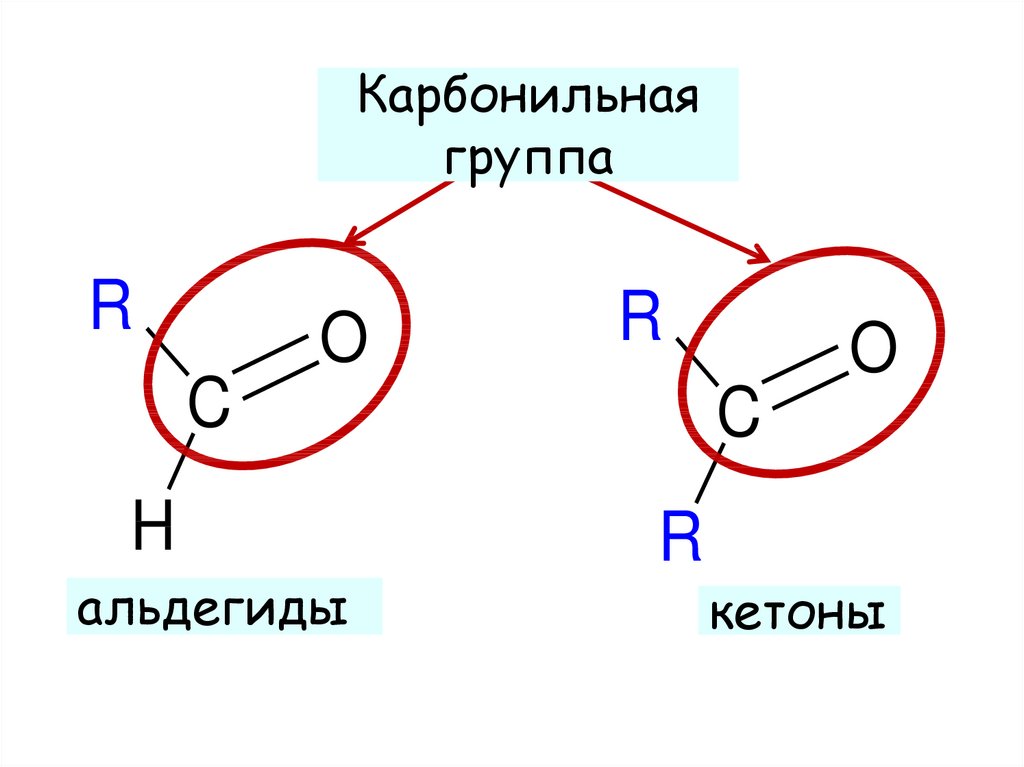
4. Реакционная способность альдегидов и кетонов
5.
Карбонильнаягруппа
R
O
R
C
H
альдегиды
O
C
R
кетоны
6.
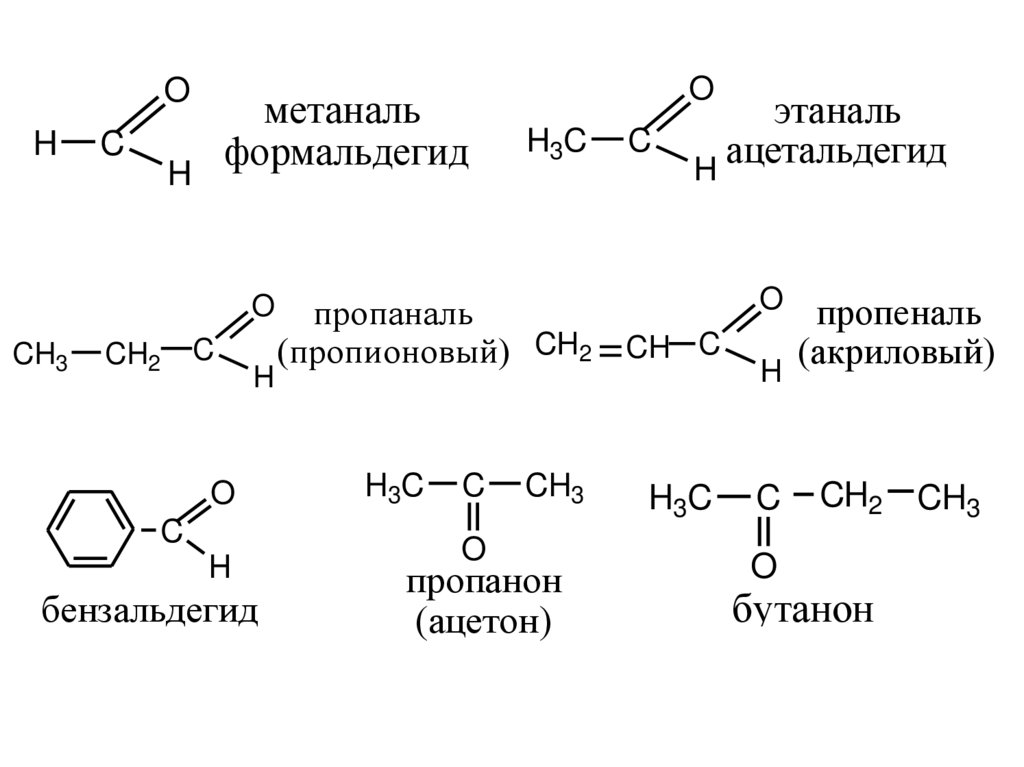
OH
C
метаналь
формальдегид
H
O
CH3
C
CH2
H
O
C
H
бензальдегид
O
H3C
C
этаналь
ацетальдегид
H
пропаналь
(пропионовый) CH2 = CH C
H3C
C
O
CH3
пропанон
(ацетон)
H3C
O
H
C
O
пропеналь
(акриловый)
CH2 CH3
бутанон
(метилэтилкетон)
7.
Физические свойства• низшие альдегиды и кетоны
хорошо растворимы в воде
• ацетон летуч
8.
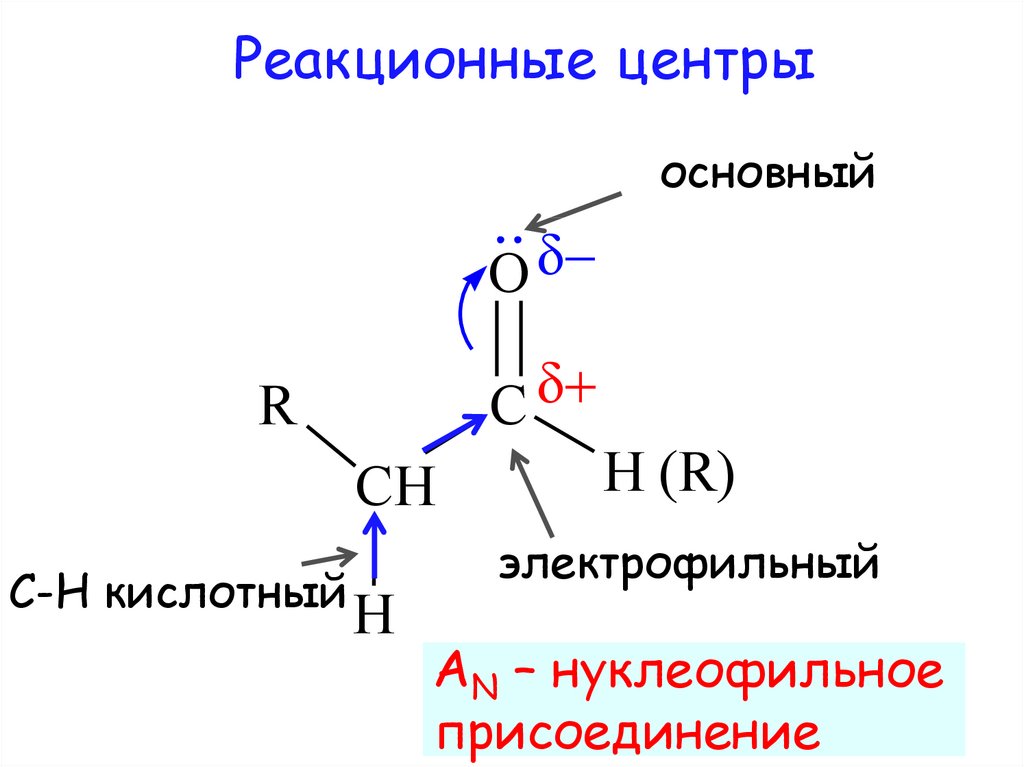
Реакционные центрыосновный
C
R
CH
С-Н кислотный
H
H (R)
электрофильный
AN – нуклеофильное
присоединение
9. Скорость реакций AN зависит:
1) от величины положительногозаряда на атоме углерода
карбонильной группы
2) пространственной доступности
электрофильного центра
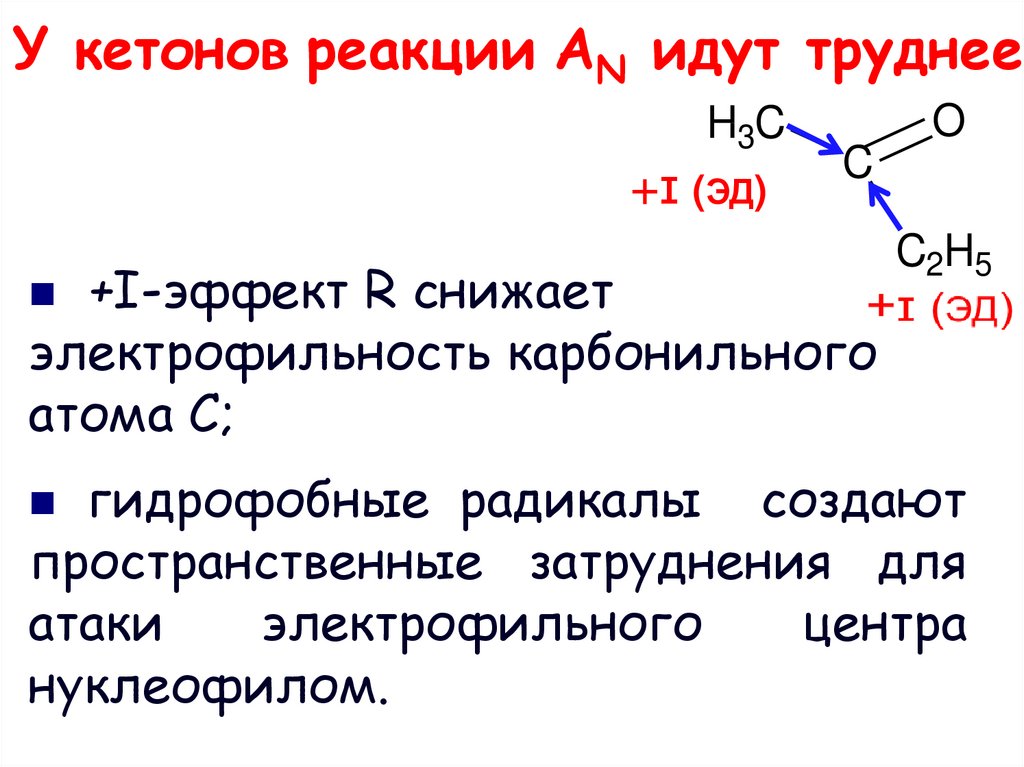
10. У кетонов реакции AN идут труднее
H3C+ɪ (ЭД)
O
C
+I-эффект R снижает
электрофильность карбонильного
атома С;
C2H5
гидрофобные радикалы создают
пространственные затруднения для
атаки
электрофильного
центра
нуклеофилом.
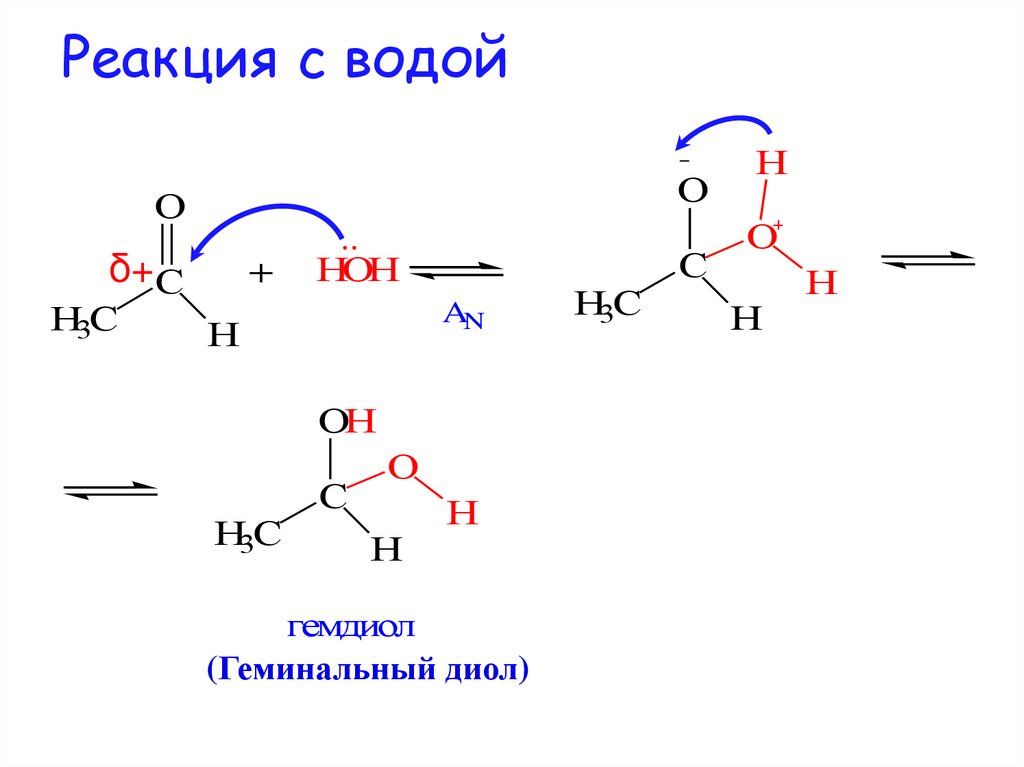
11. Реакция с водой
OO
δ+C
H3C
+
HOH
AN
H
OH
H3C
C
O
H
H
гемдиол
(Геминальный диол)
H3C
C
H
O
H
H
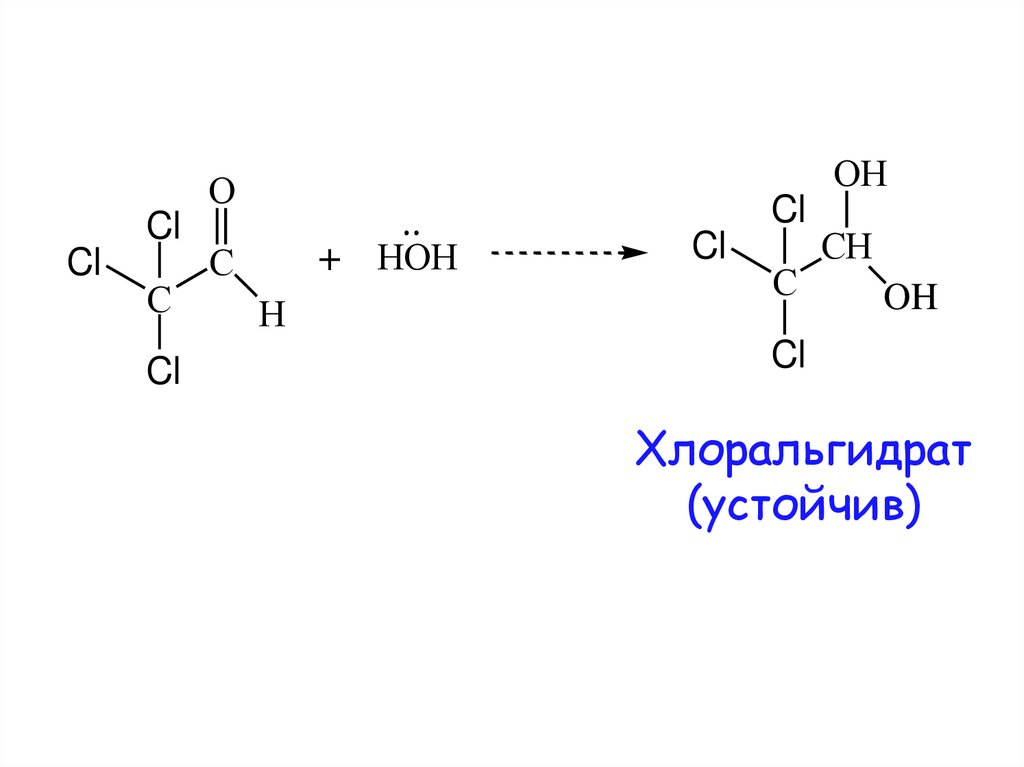
12.
OHO
Cl
Cl
C
Cl
Cl
+ HOH
C
H
Cl
C
CH
OH
Cl
Хлоральгидрат
(устойчив)
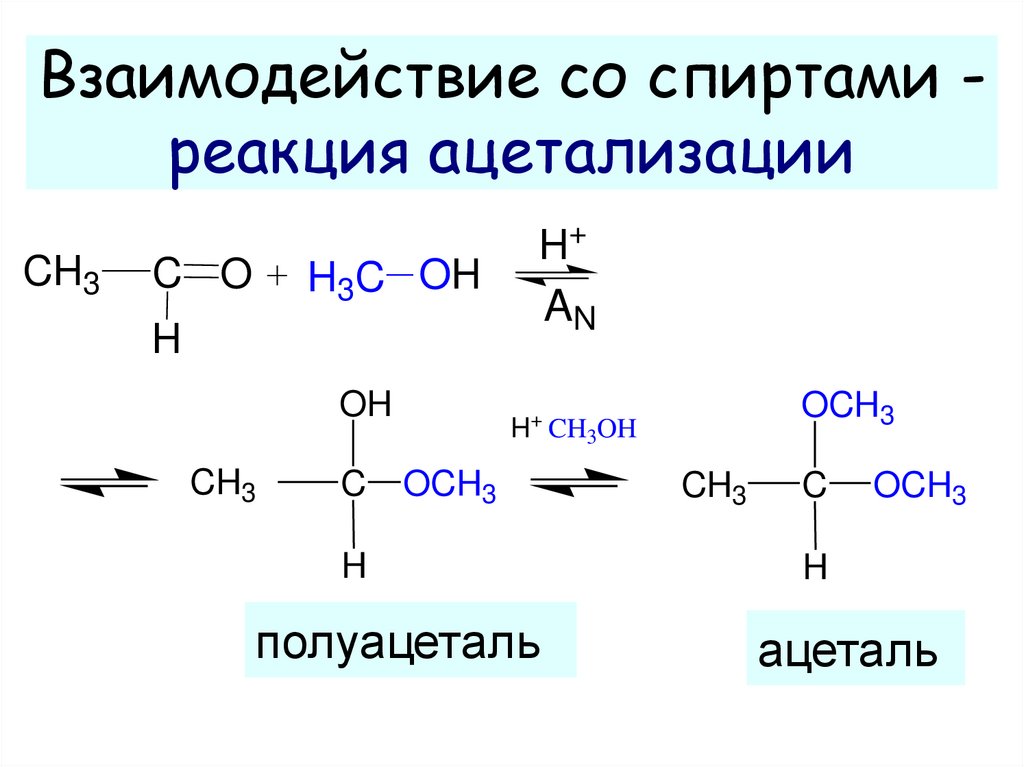
13. Взаимодействие со спиртами - реакция ацетализации
Взаимодействие со спиртами реакция ацетализацииCH3
C O
H3C OH
H+
AN
H
OH
CH3
C
OCH3
H+ CH3OH
OCH3
H
полуацеталь
CH3
C
OCH3
H
ацеталь
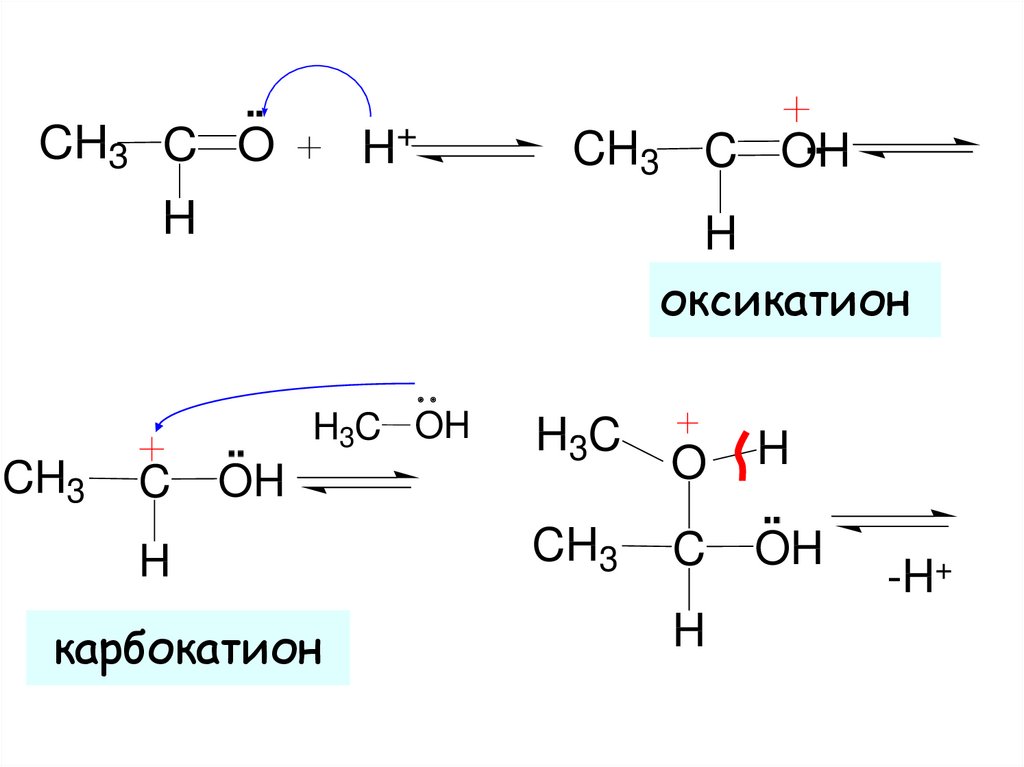
14.
▪▪H+
CH3 C O
▪▪
CH3 C OH
H
H
оксикатион
H3C OH
CH3
C
OH
H
карбокатион
H3C
O
H
CH3
C
OH
H
-H+
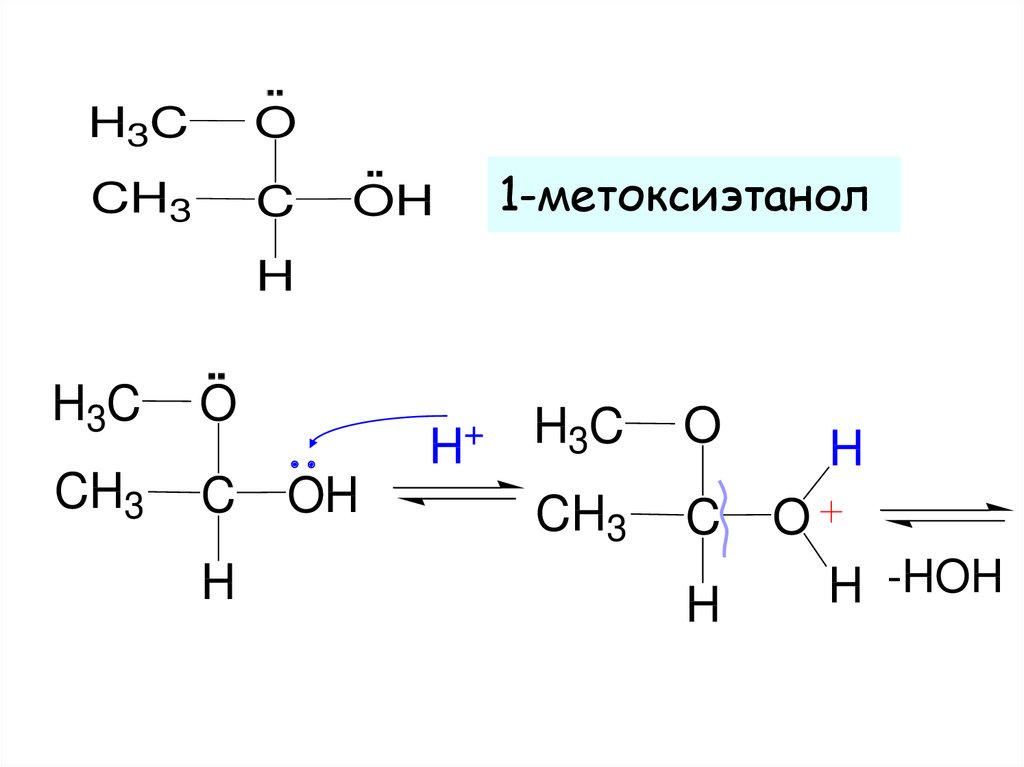
15.
H3CO
CH3
C
1-метоксиэтанол
OH
H
H3C
O
CH3
C
H
+
H
OH
H3C
O
CH3
C
H
H
O
H -HOH
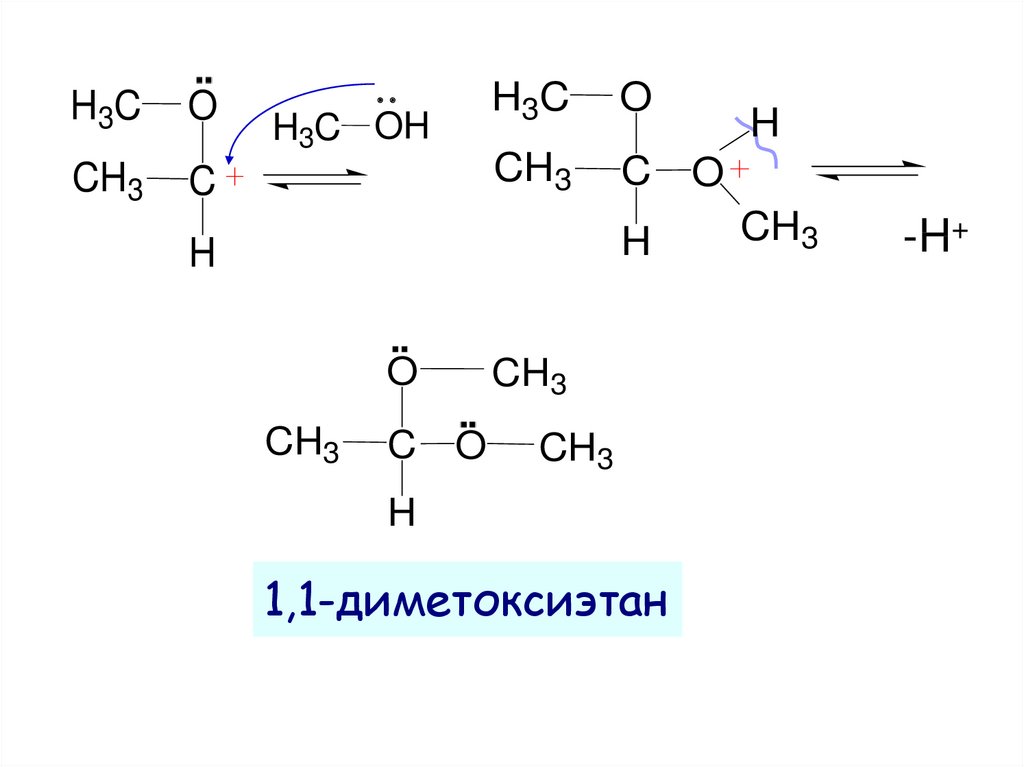
16.
H3CO
CH3
C
H3C OH
H3C
O
CH3
C
H
H
O
CH3
C
CH3
O
CH3
H
1,1-диметоксиэтан
H
O
CH3
-H+
17.
Реакция ацетализацииилежит в основе образования
циклических форм
моносахаридов
18.
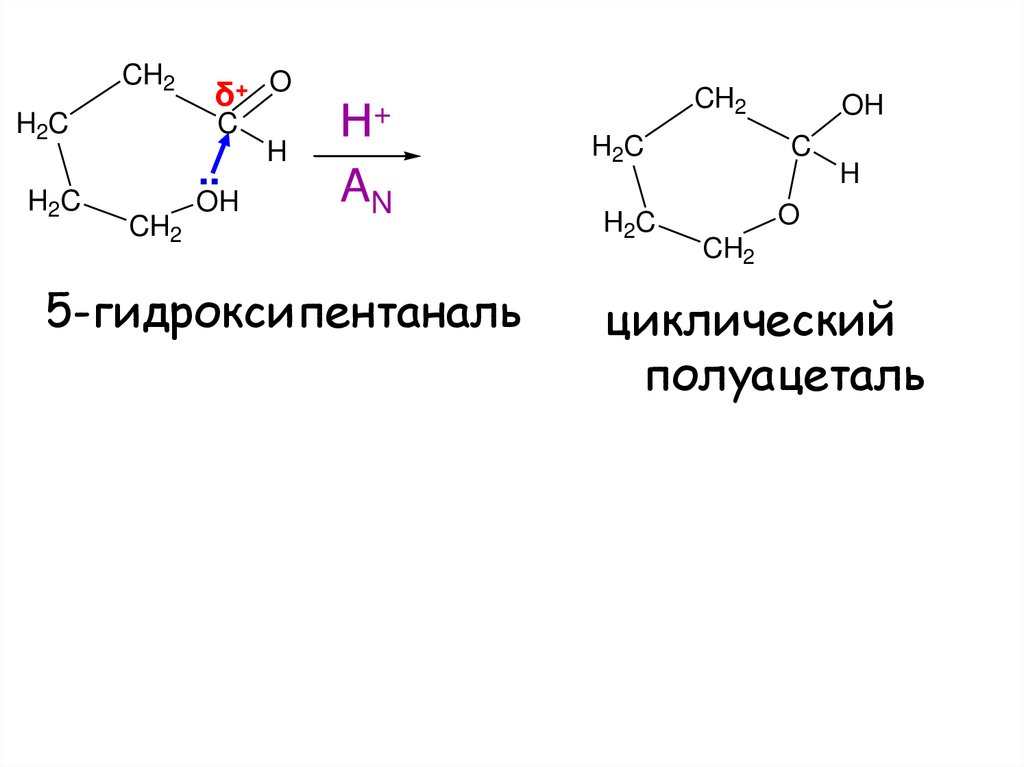
CH2H2C
H2C
δ+ O
C
..
CH2
OH
H
Н+
AN
5-гидроксипентаналь
CH2
H2C
H2C
OH
C
H
O
CH2
циклический
полуацеталь
19.
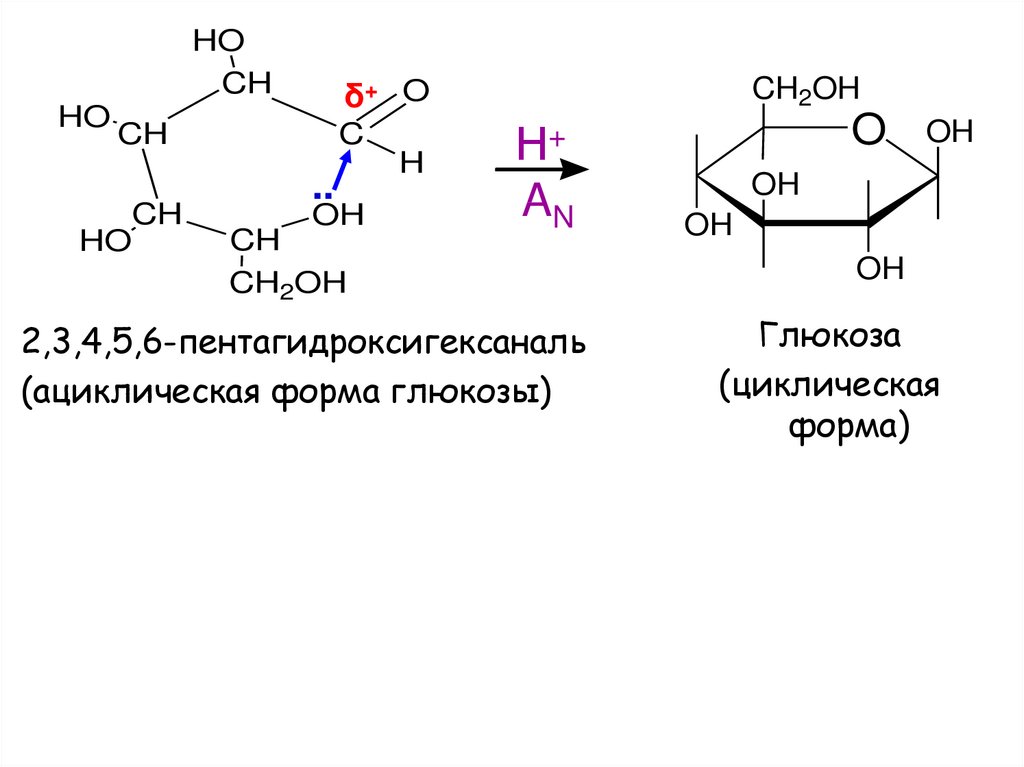
HOCH
HO
δ+ O
CH
CH
HO
C
..
OH
CH
CH2OH
H
CH2OH
Н+
AN
2,3,4,5,6-пентагидроксигексаналь
(ациклическая форма глюкозы)
O
OH
OH
OH
OH
Глюкоза
(циклическая
форма)
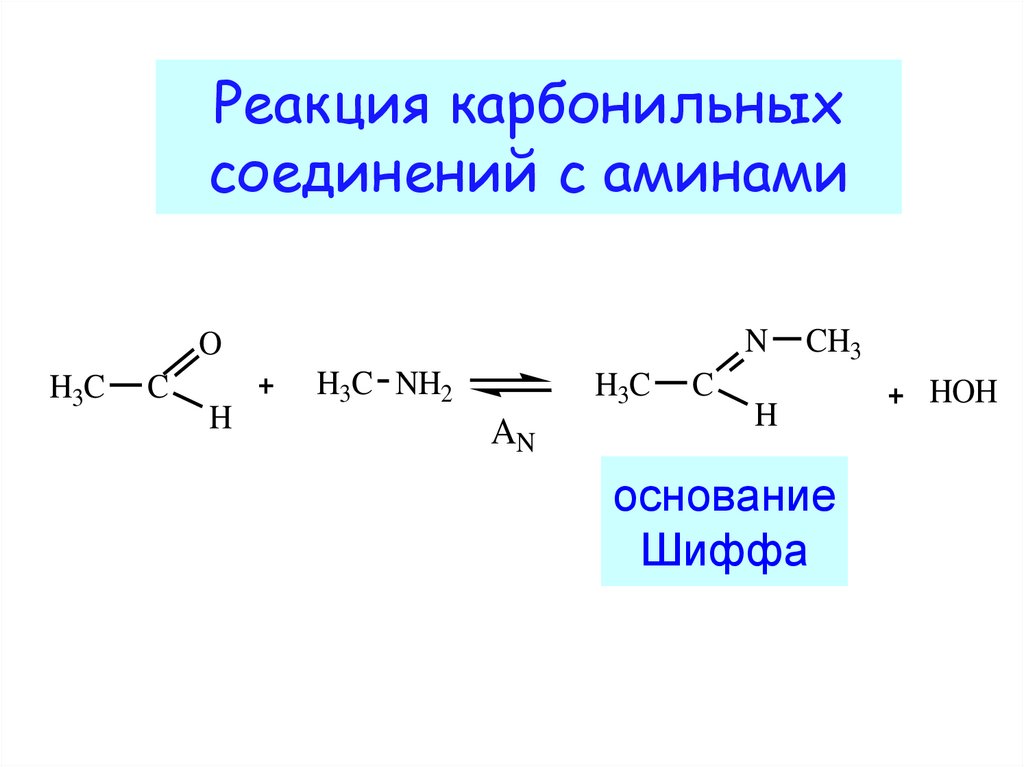
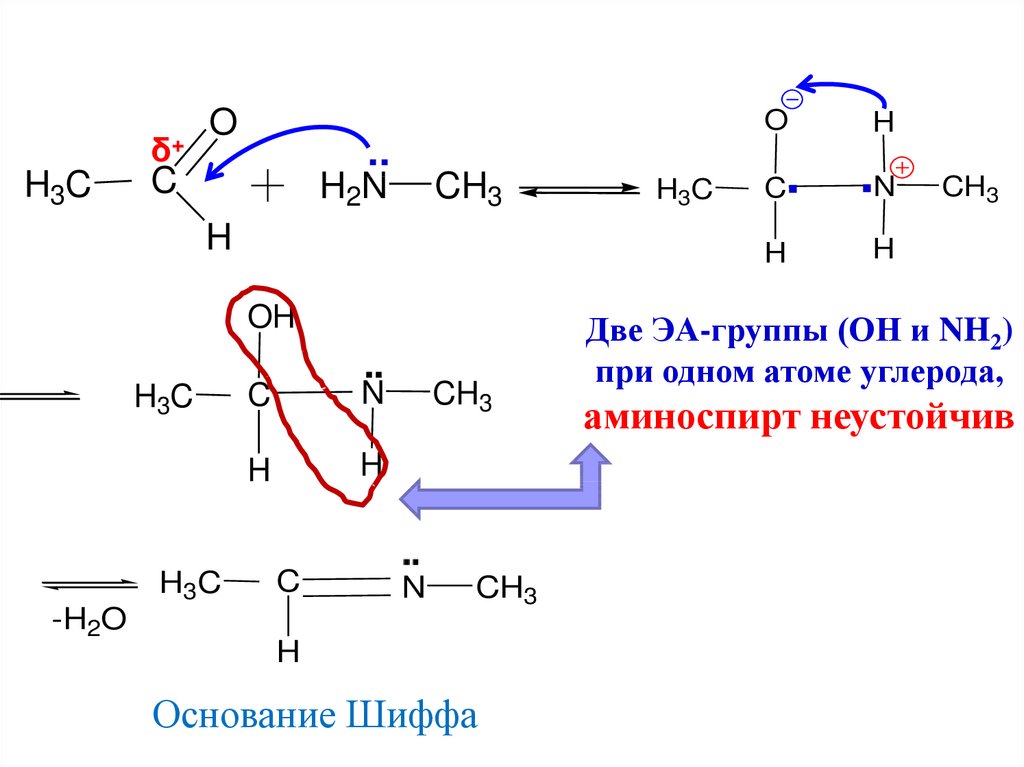
20. Реакция карбонильных соединений с аминами
NO
H3C
C
H
H3C NH2
H3C
AN
CH3
C
H
основание
Шиффа
HOH
21.
δ+H3C
O
..
C
H2N
CH3
H
OH
H3C
H3C
▪▪
C
N
H
H
C
-H2O
CH3
N
CH3
H
Основание Шиффа
H3C
O
H
C▪
▪N
H
H
CH3
Две ЭА-группы (ОН и NH2)
при одном атоме углерода,
аминоспирт неустойчив
22.
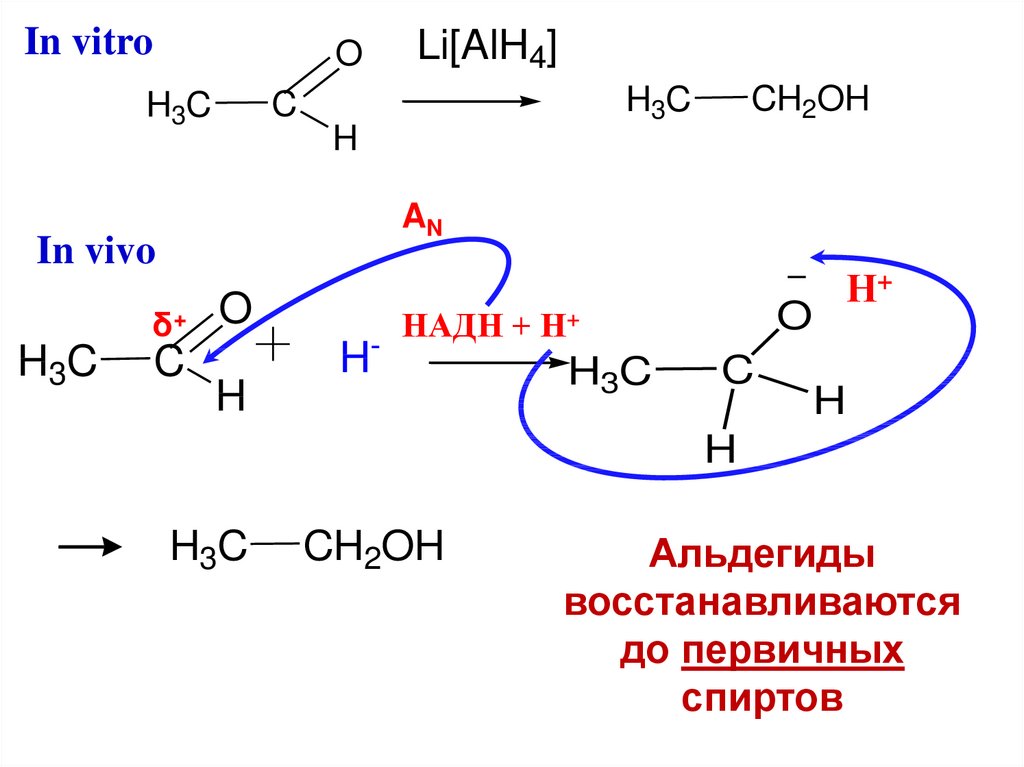
Восстановление карбонильныхсоединений идет по механизму АN
in vitro - с участием Li[AlH4]
in vivo
- с участием фермента НАДН + Н+
нуклеофил в обоих случаях –
гидрид-анион - Н
23.
In vitroO
CH2OH
H3C
C
H3C
H
AN
In vivo
δ+
H3C
Li[AlH4]
C
O
H
H-
O
НАДН + Н+
H3C
Н+
C
H
H
H3C
CH2OH
Альдегиды
восстанавливаются
до первичных
спиртов
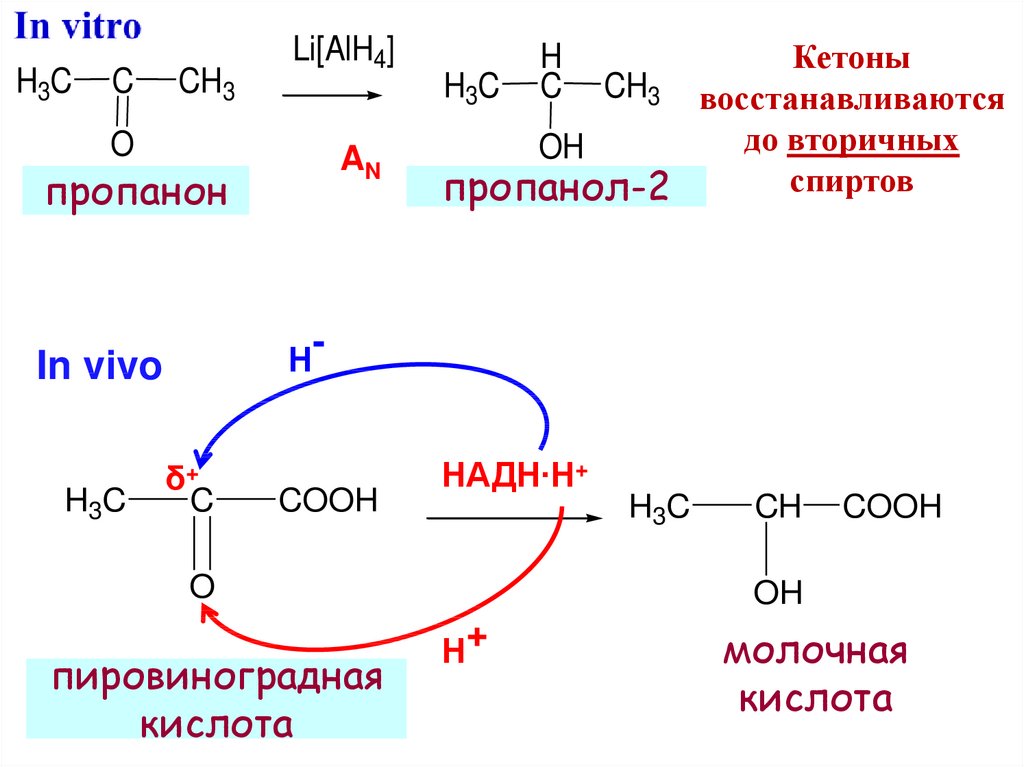
24.
H3CC
CH3
Li[AlH4]
O
AN
пропанон
-
Н
In vivo
H3C
Кетоны
H3C
CH3 восстанавливаются
до вторичных
OH
спиртов
пропанол-2
H
C
δ+
C
COOH
НАДН∙Н+
O
пировиноградная
кислота
H3C
CH
COOH
OH
Н+
молочная
кислота
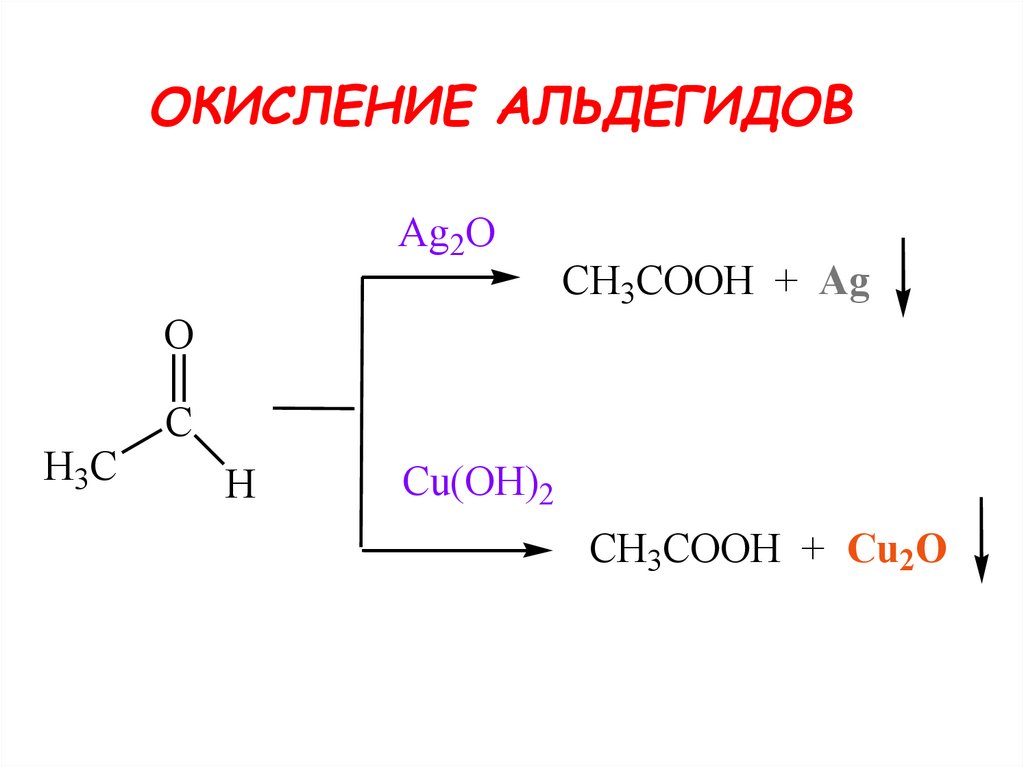
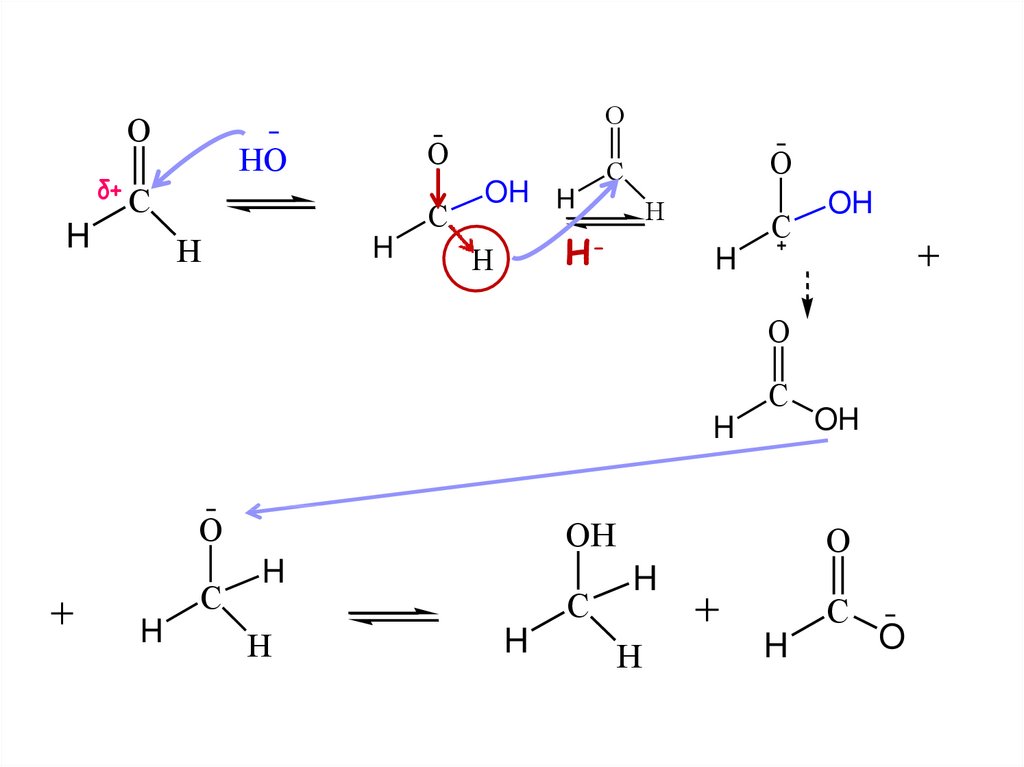
25. ОКИСЛЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
альдегидыокисляются легко,
до карбоновых кислот
кетоны - трудно, с разрывом С-С
связей
26.
ОКИСЛЕНИЕ АЛЬДЕГИДОВAg2O
СH3COOH + Ag
O
H3C
C
H
Cu(OH)2
СH3COOH + Cu2O
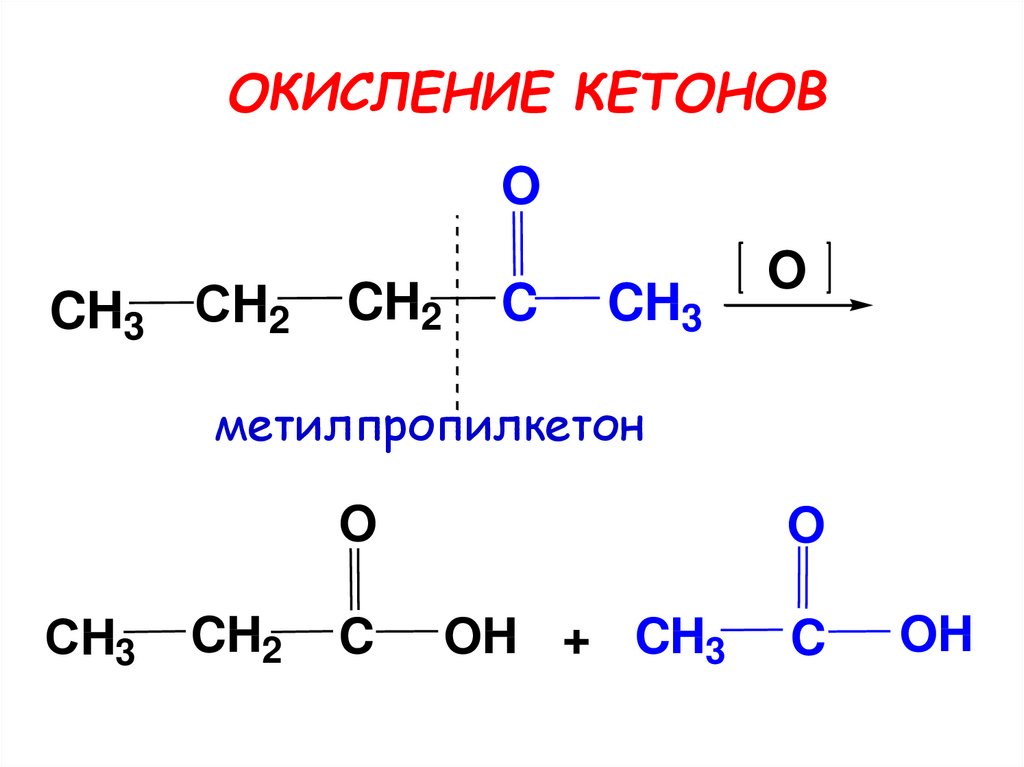
27. ОКИСЛЕНИЕ КЕТОНОВ
OCH3 СH2
CH2
C
CH3
O
метилпропилкетон
O
СH3
CH2
C
O
OH + CH3
C
OH
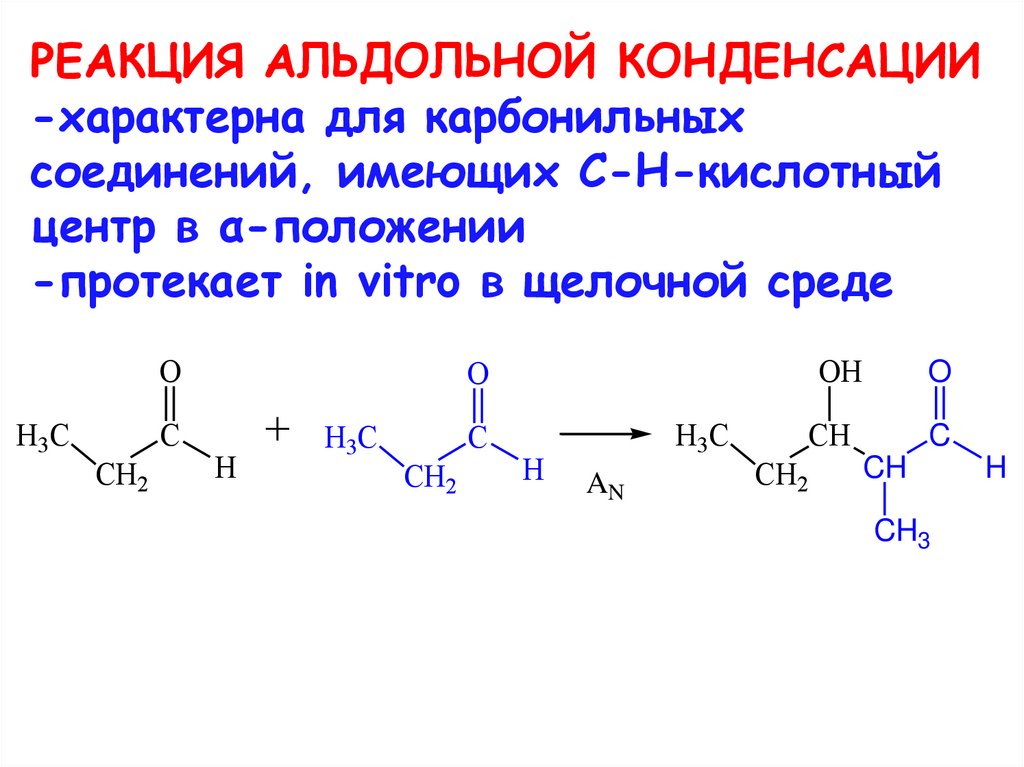
28. РЕАКЦИЯ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ -характерна для карбонильных соединений, имеющих C-H-кислотный центр в α-положении -протекает in
vitro в щелочной средеO
H3C
C
CH2
OH
O
H
H3C
C
CH2
H
H3C
AN
O
CH
CH2
C
CH
CH3
H
29.
OH3C
C
CH
O
OH
H
H3C
-HOH
C
CH
H
H
O
H3C
CH2
C
O
H
H3C
CH
CH2
CH3
CH
O
C
H
НОН
-ОН-
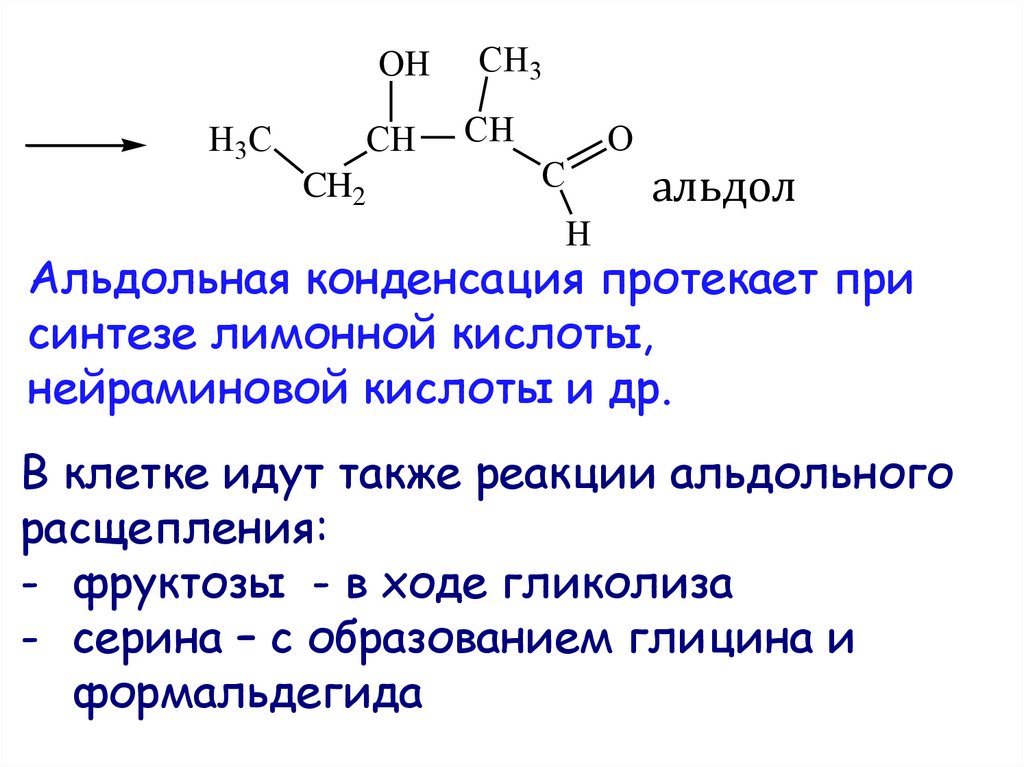
30. альдол
OHH3C
CH
CH2
CH3
CH
C
O
альдол
H
Альдольная конденсация протекает при
синтезе лимонной кислоты,
нейраминовой кислоты и др.
В клетке идут также реакции альдольного
расщепления:
- фруктозы - в ходе гликолиза
- серина – с образованием глицина и
формальдегида
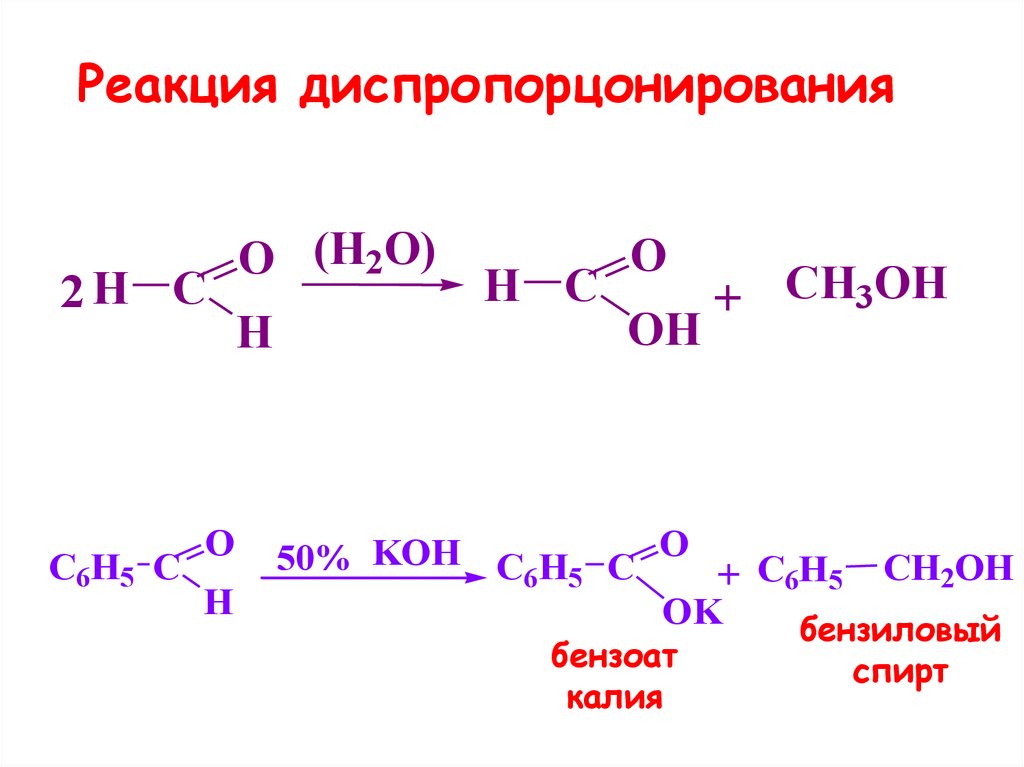
31. Реакция диспропорцонирования
• характерна для альдегидов, неимеющих С-Н-кислотного центра
в α-положении
• протекает in vitro в щелочной
среде
32. Реакция диспропорцонирования
2H CC6H5 C
O
H
O (H2O)
H
H C
O
OH
+ CH3OH
50% KOH C6H5 C O + C H CH2OH
6 5
OK
бензиловый
бензоат
калия
спирт
33.
34.
OO
δ+
O
HO
C
H
C
H
H
OH H
O
C
H
H-
H
C
OH
H
O
C
H
O
C
H
OH
H
H
C
H
OH
O
H
H
C
H
O
35. Формалин – 40% р-р формальдегида
-используется дляконсервирования анатомических
препаратов
-как дезинфицирующее средство
-вызывает денатурацию белков за
счет взаимодействия с NH2группами
36. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
OC
OH
Карбоксильная группа
37.
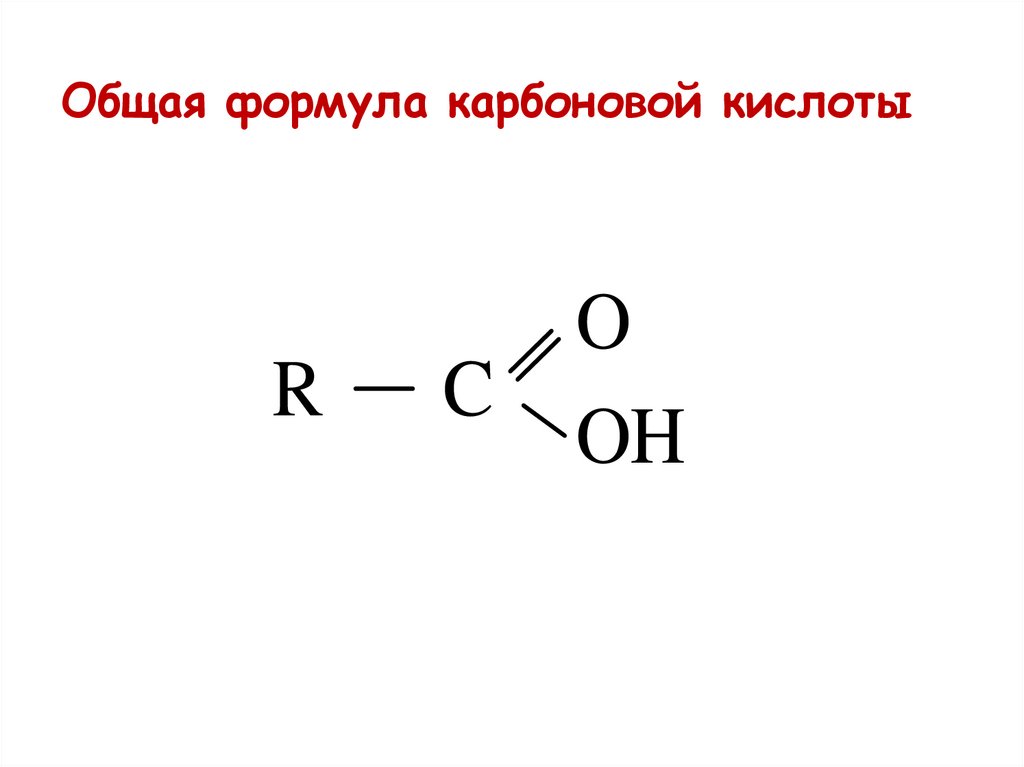
Общая формула карбоновой кислотыR
C
O
OH
38.
Физические свойстваНизшие кислоты (муравьиная,
уксусная, пропионовая) бесцветные
жидкости, хорошо растворимы в воде
Кислоты с числом 4-9 атомов
углерода – маслянистые жидкости с
неприятным запахом
Высшие кислоты – твердые вещества,
нерастворимые в воде
39.
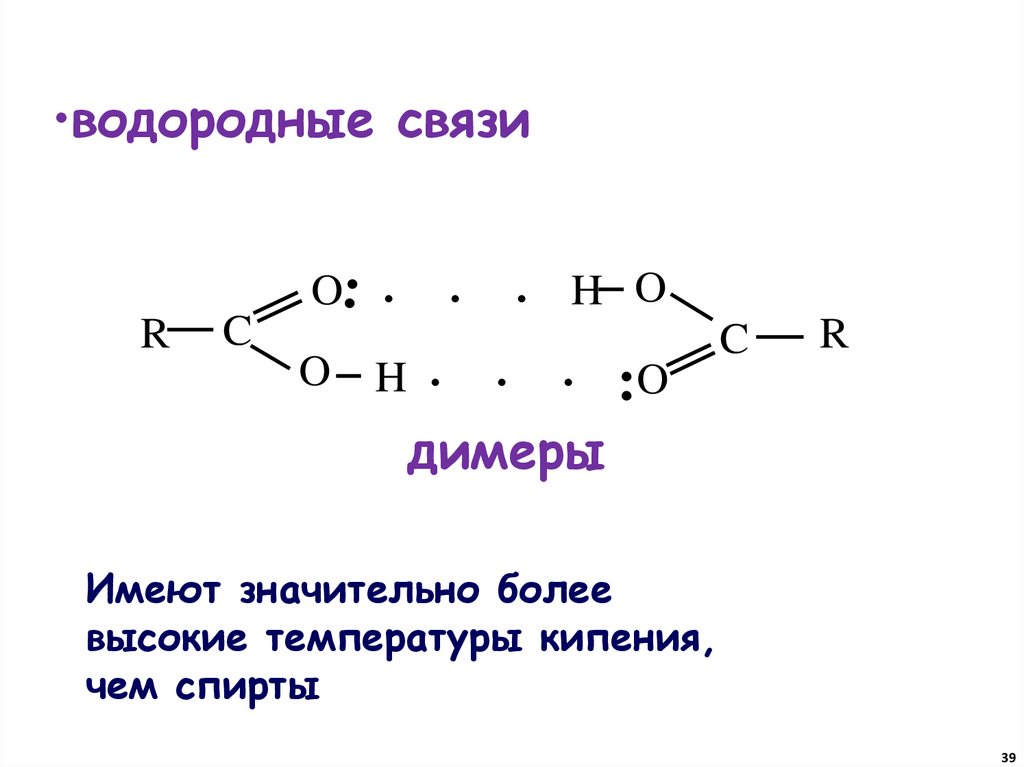
•водородные связи.. .
O
R
C
O
H
. . H O
. . . ..O
C
R
димеры
Имеют значительно более
высокие температуры кипения,
чем спирты
39
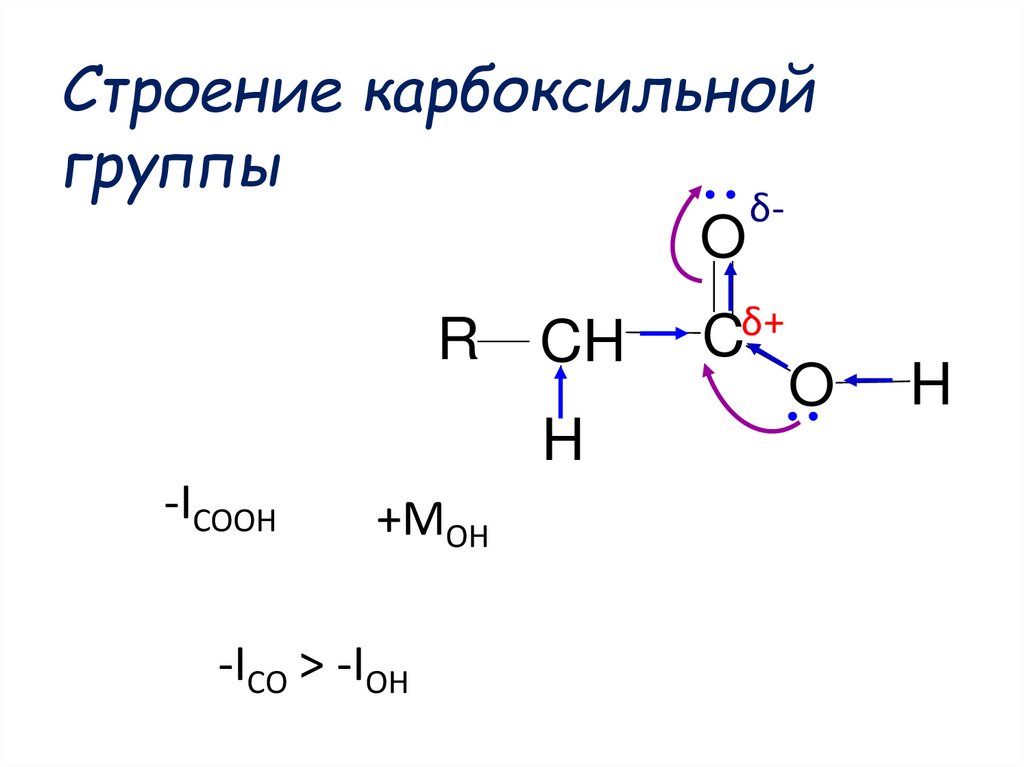
40. Строение карбоксильной группы
OR
CH
H
-ICOOH
+MOH
-ICO > -IOH
δ-
Cδ+
O
H
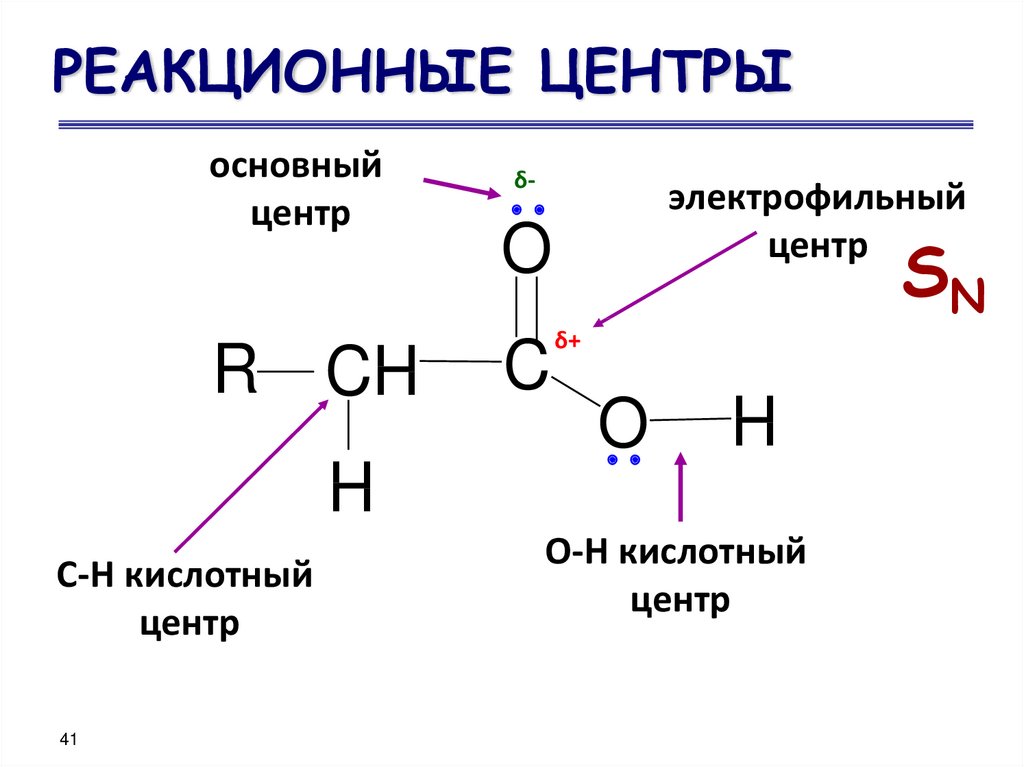
41. РЕАКЦИОННЫЕ ЦЕНТРЫ
основныйцентр
R CH
δ-
электрофильный
центр
SN
O
C
δ+
O
H
H
С-Н кислотный
центр
41
О-Н кислотный
центр
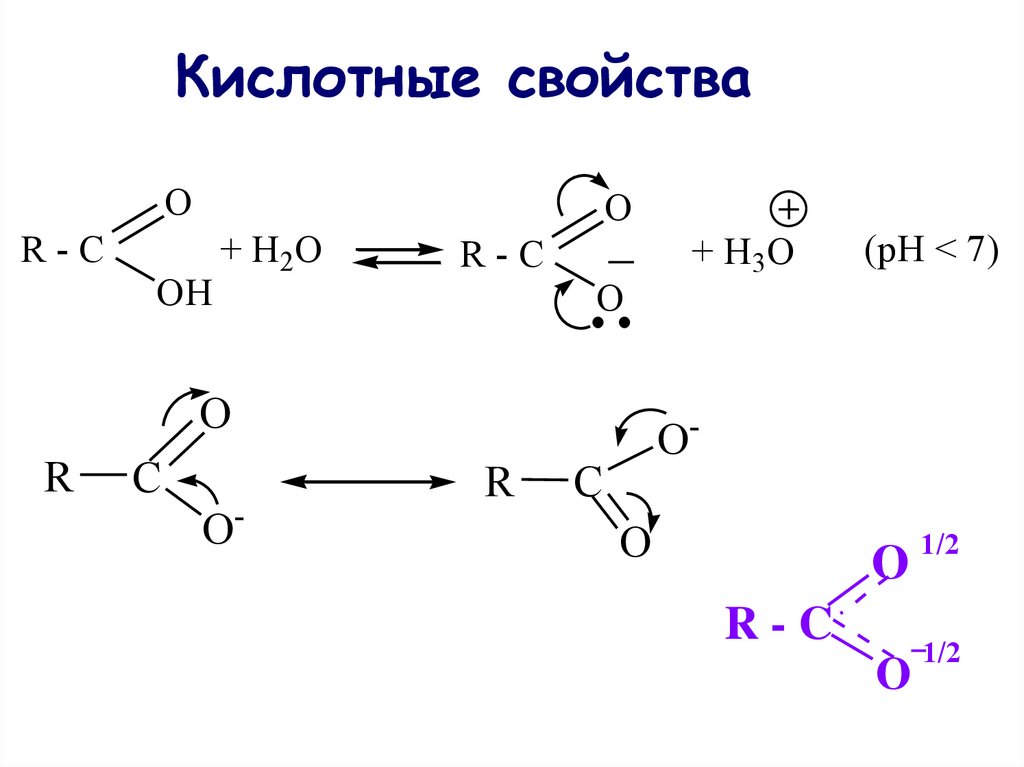
42. Кислотные свойства
OR-C
OH
+ H2 O
O
R-C
O
O
R
C
O-
R
+ H3O
(pH < 7)
O-
C
O
R-C
О
1/2
O
1/2
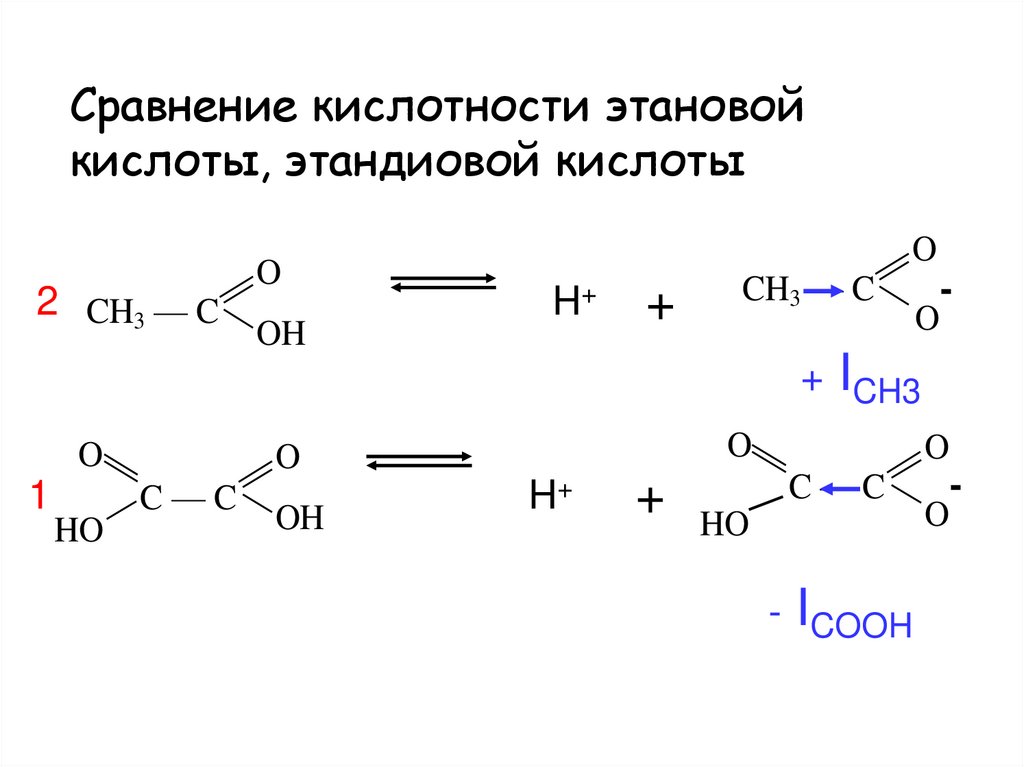
43. Сравнение кислотности этановой кислоты, этандиовой кислоты
2 CH3 — CO
OH
H+
+
CH3 — C
O
-
O
+ ICH3
O
C—C
1
HO
O
O
OH
H+
+
C—C
HO
- ICOOH
O
-
O
44.
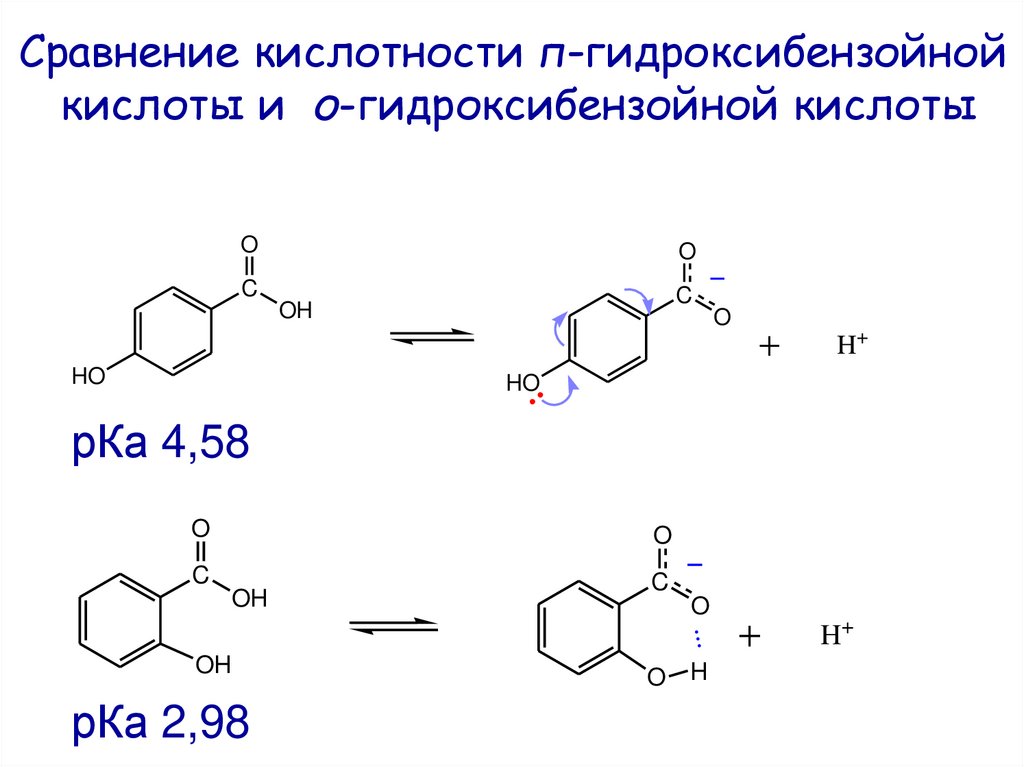
Сравнение кислотности п-гидроксибензойнойкислоты и о-гидроксибензойной кислоты
O
O
C
C
OH
HO
O
H+
HO
рКа 4,58
O
O
C
C
O
...
OH
OH
рКа 2,98
O H
H+
45.
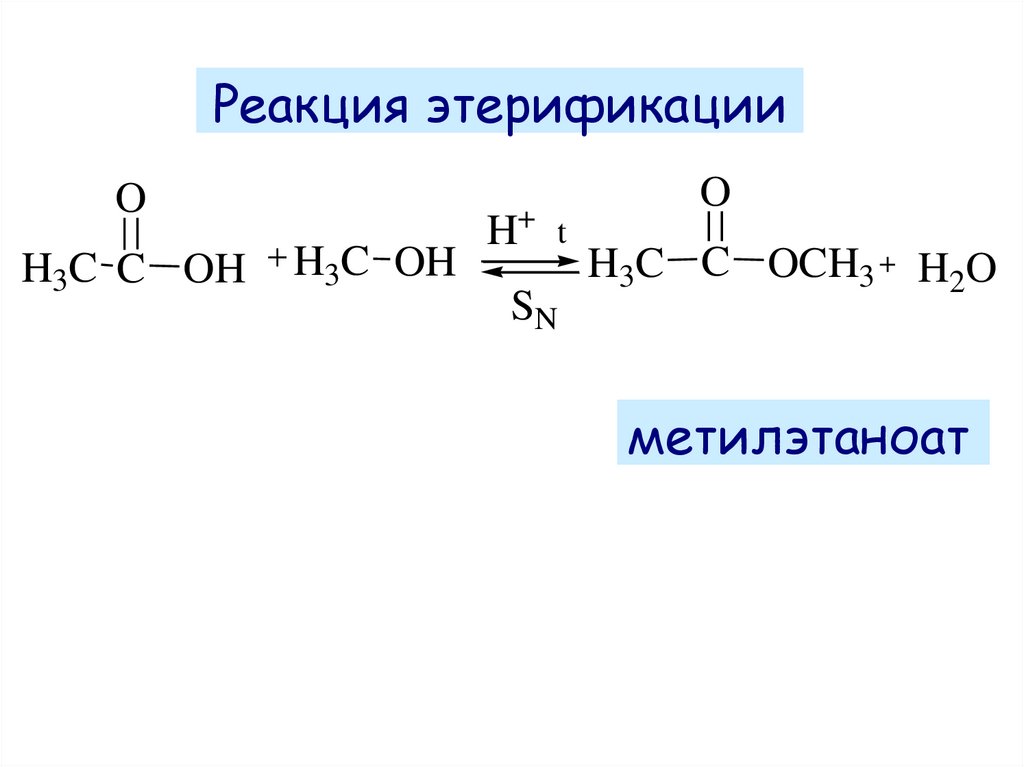
Реакция этерификацииO
H3C C OH
H3C OH
H+
O
t
SN
H3C C OCH3
H2O
метилэтаноат
46.
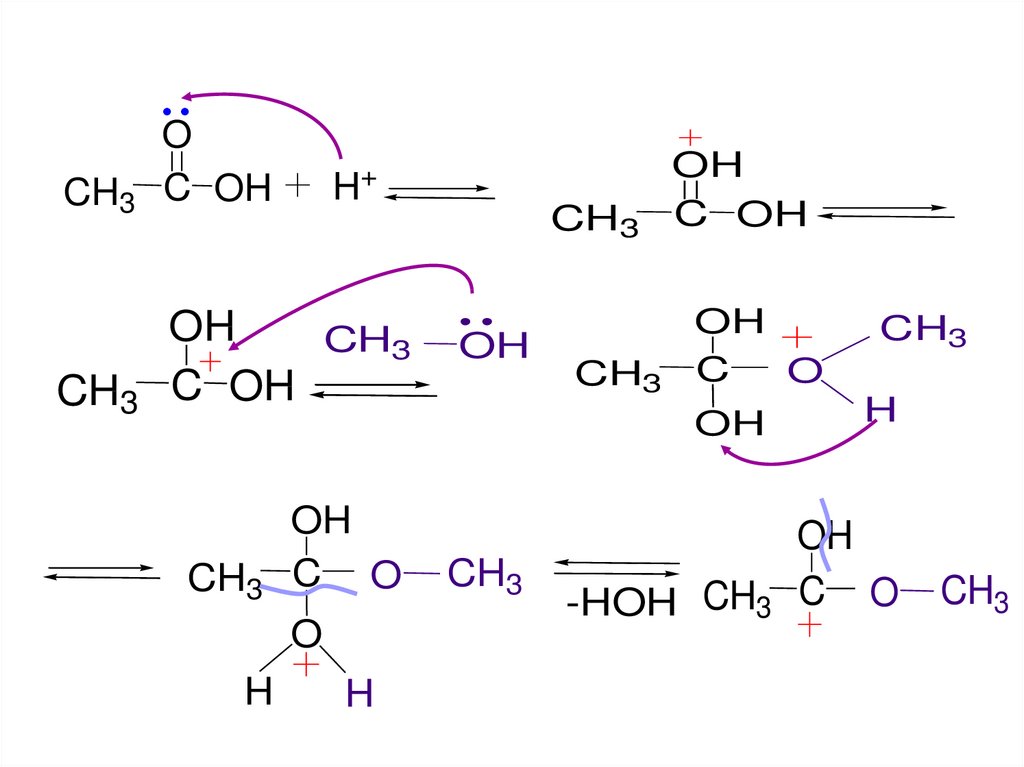
CH3O
C OH
CH3
OH
CH3
C OH
CH3
H
+
OH
C O
O
H
H
CH3
OH
CH3
CH3
OH
C OH
OH
C
O
CH3
OH
H
-HOH CH3
OH
C O
CH3
47.
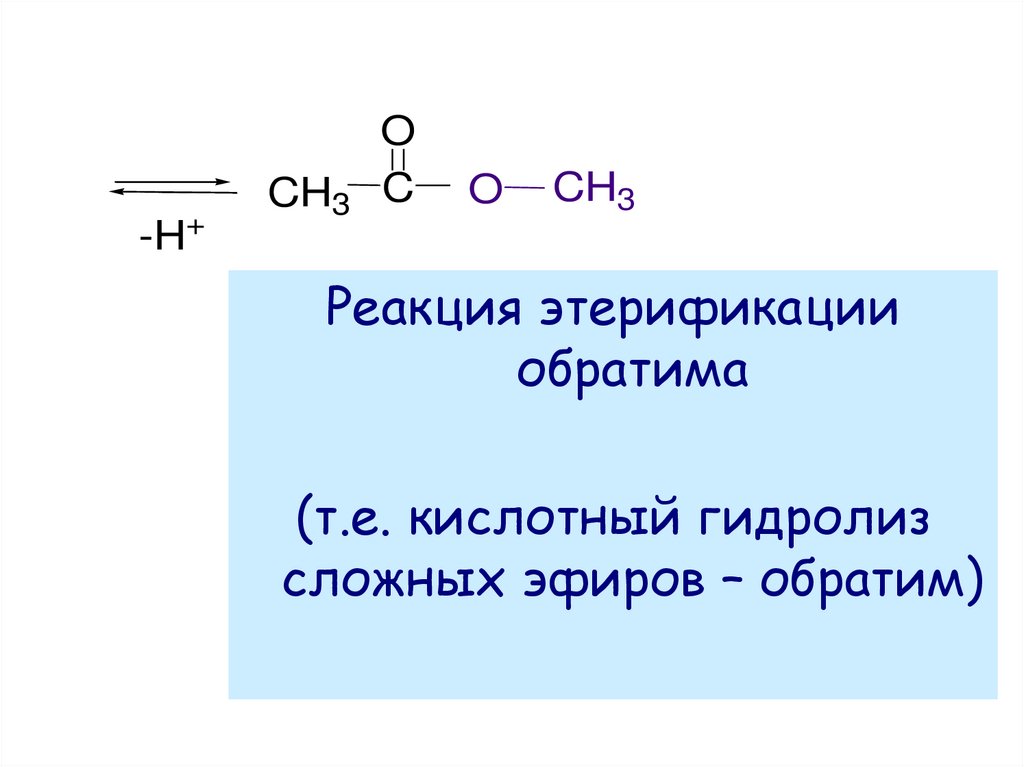
-H+CH3
O
C
O
CH3
Реакция этерификации
обратима
(т.е. кислотный гидролиз
сложных эфиров – обратим)
48.
49.
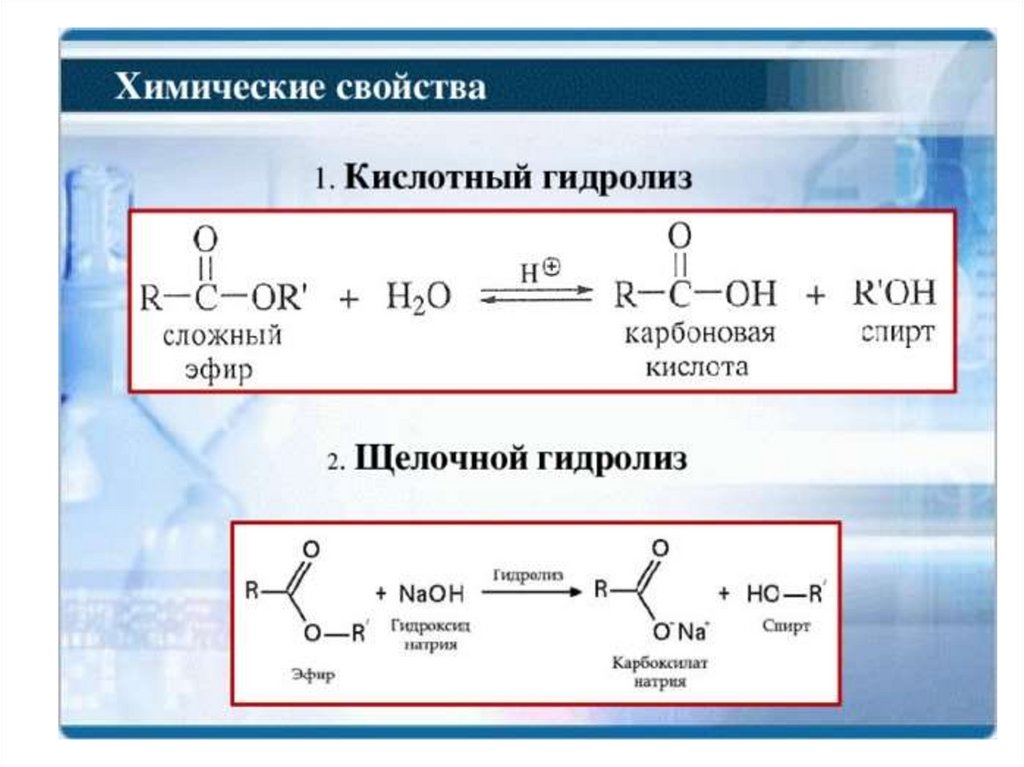
Щелочной гидролиз необратимCH3
O
C
O
+OH
CH3
CH3
O
C
O
CH3
-СН3ОН
OH
O
CH3
C
O
50. Реакции декарбоксилирования
ОтщеплениеСО2
Характерны
для карбоновых
кислот, содержащих в αположении электроноакцептор
HOOC
COOH
CO2
H
COOH
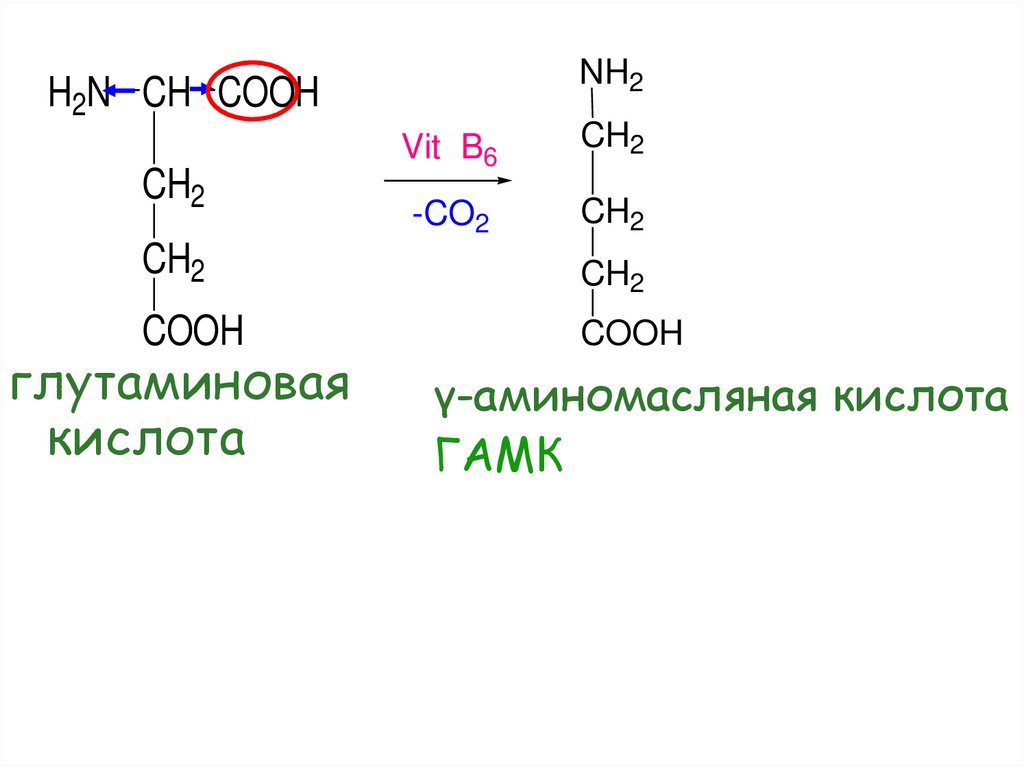
51.
NH2H2N CH COOH
CH2
Vit B6
CH2
-CO2
CH2
CH2
CH2
COOH
COOH
глутаминовая
кислота
γ-аминомасляная кислота
ГАМК
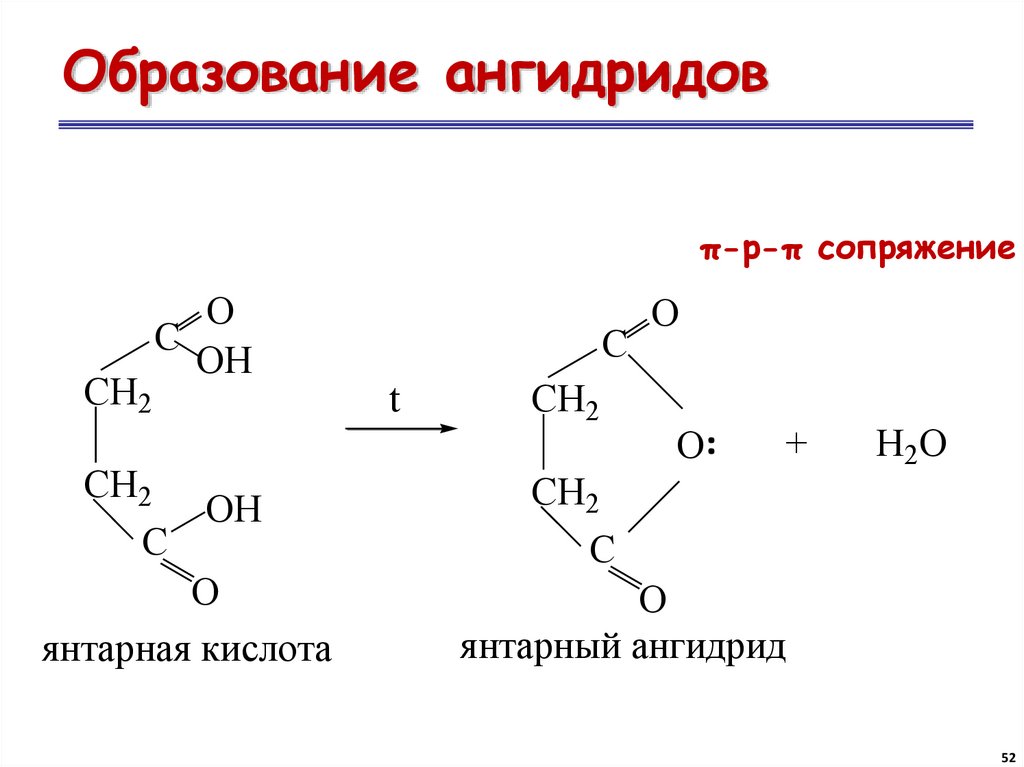
52. Образование ангидридов
π-р-π сопряжениеC
t
СН2
O
O
..
СН2
O
C
OH
СН2
ОН
C
О
янтарная кислота
+
СН2
C
Н2О
О
янтарный ангидрид
52
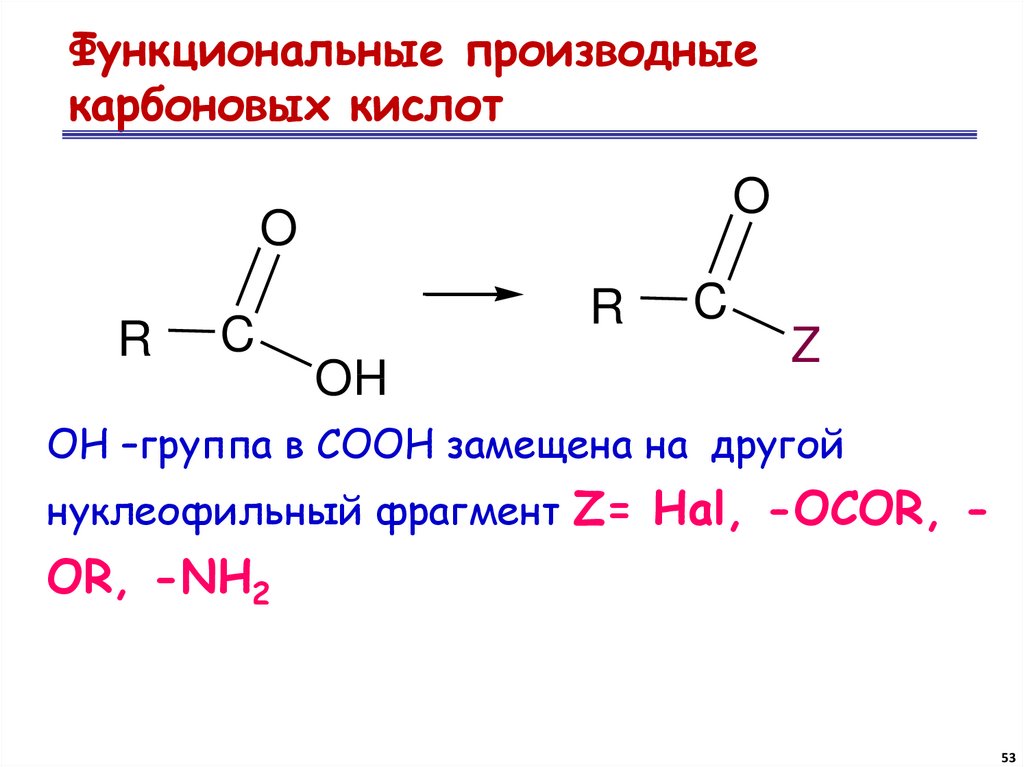
53. Функциональные производные карбоновых кислот
OO
R
C
R
OH
C
Z
ОН –группа в СООН замещена на другой
нуклеофильный фрагмент Z= Hal, -OCOR, -
OR, -NH2
53
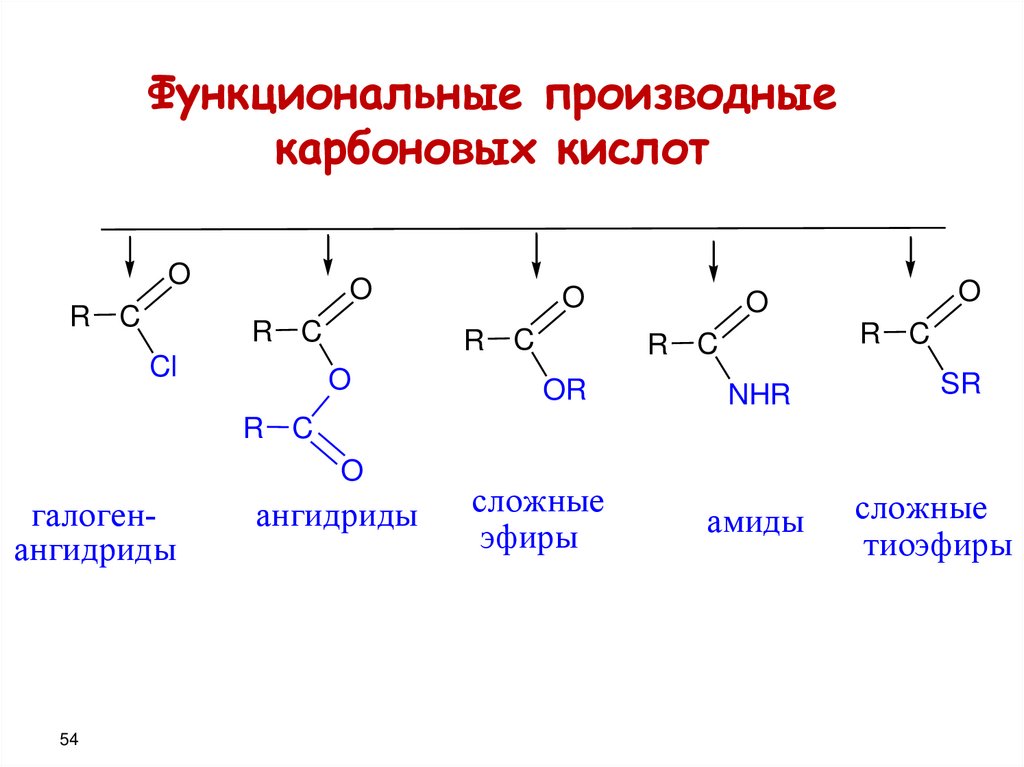
54.
Функциональные производныекарбоновых кислот
O
R C
O
R C
Cl
O
R C
O
R C
R C
OR
O
O
NHR
SR
R C
O
галогенангидриды
54
ангидриды
сложные
эфиры
амиды
сложные
тиоэфиры
55.
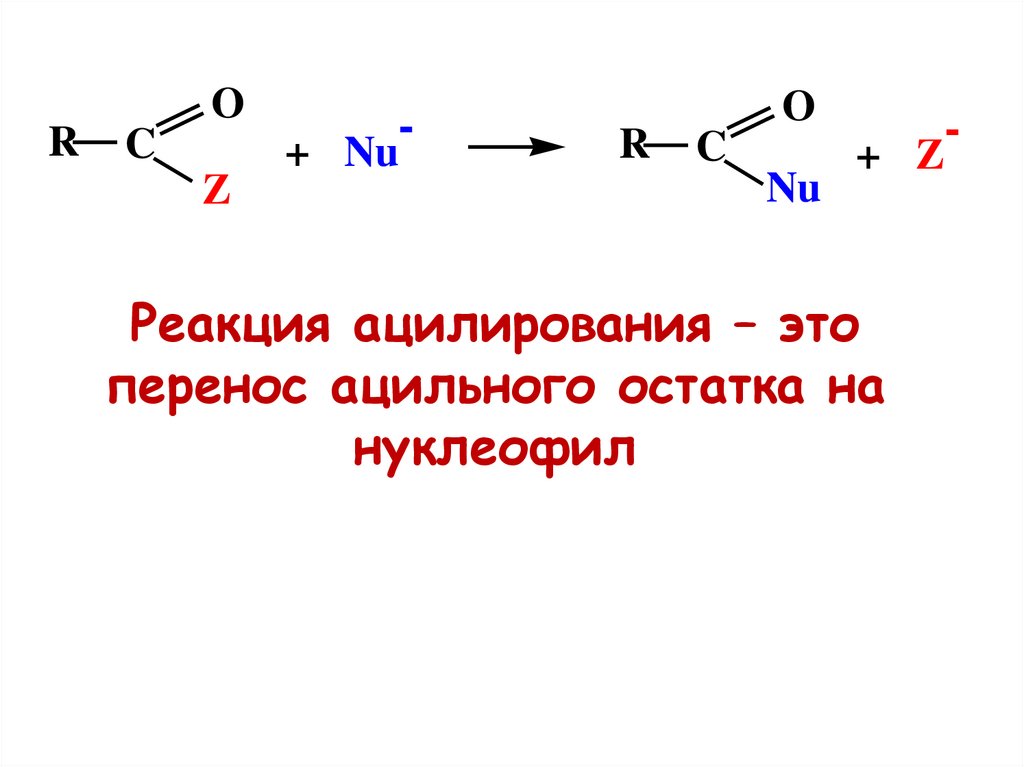
RO
C
Z
-
+ Nu
R
O
C
Nu
-
+ Z
Реакция ацилирования – это
перенос ацильного остатка на
нуклеофил
56. Реакции ацилирования (in vitro)
Rδ+
O
C
-
+ Nu
Cl
R
O
C
Nu
+ Cl
-
Сl – ЭА
Наибольшей ацилирующей способностью
обладают галогенангидриды
56
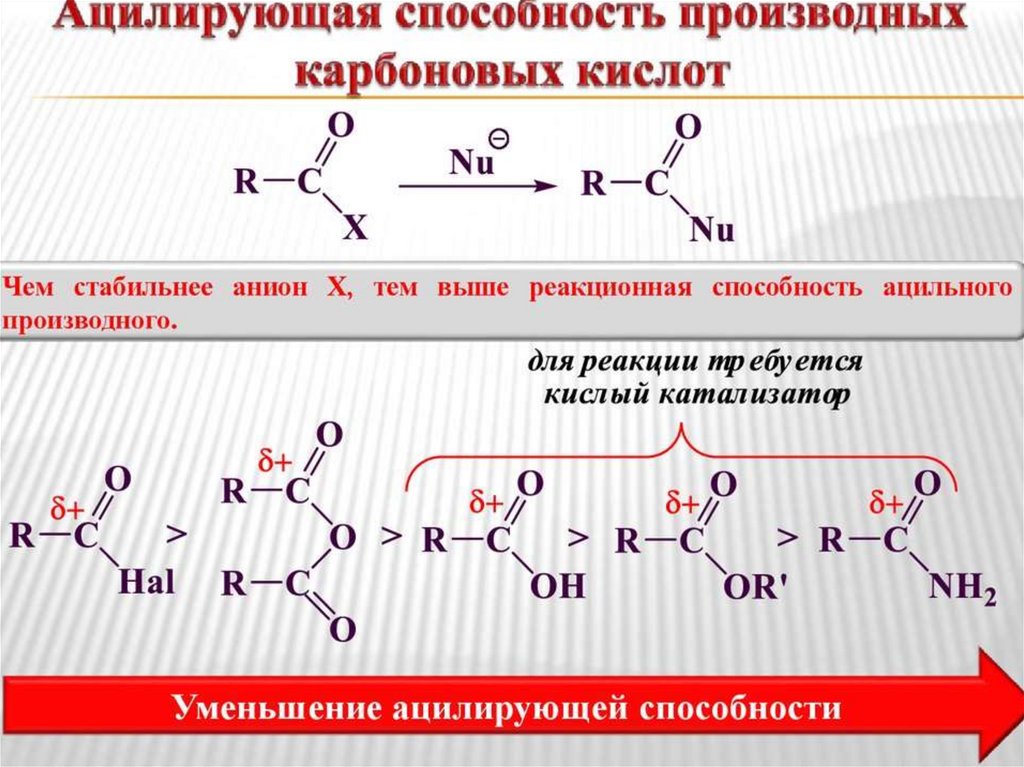
57.
Реакционная способность в реакциях SN(ацилирующая способность) определяется:
• Величиной эффективного
положительного заряда на атоме
углерода карбонильной группы
• Стабильностью уходящей группы
57
58.
In vitroδ+ уменьшается
O
R C
>
O
R C
O
Cl
>
O
>
R C
O
R C
OR
NHR
R C
O
стабильность уходящей группы уменьшается
реакционная способность уменьшается
58
59.
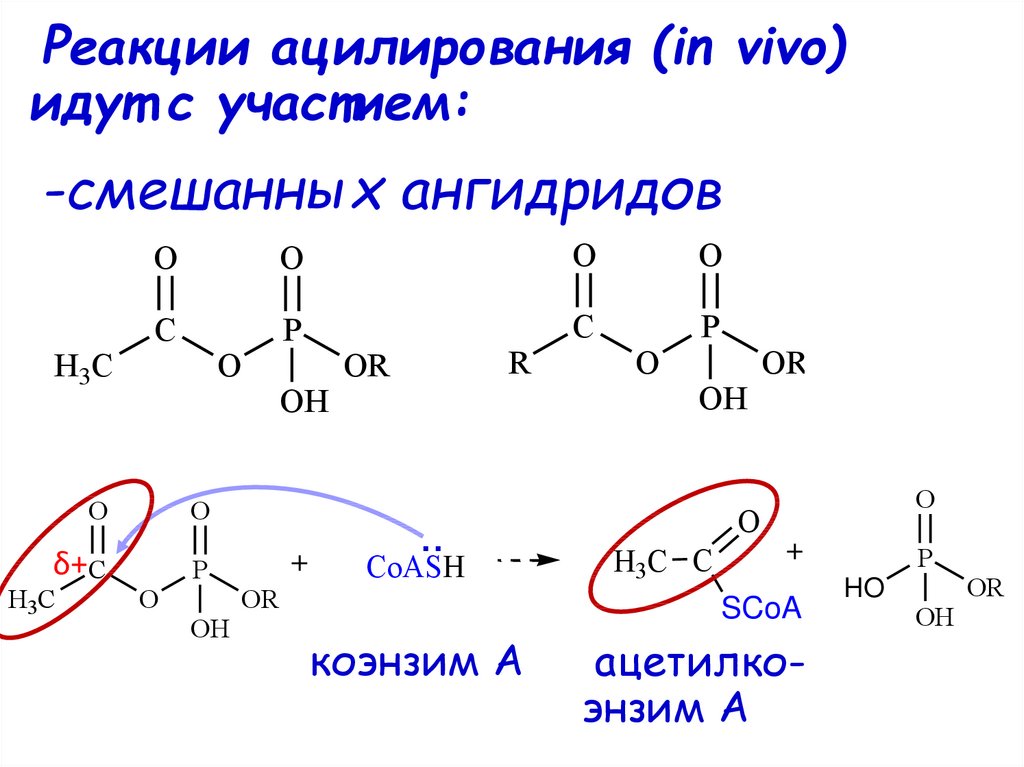
60.
Реакции ацилирования (in vivo)идут с участием:
-смешанных ангидридов
H3C
O
O
O
O
C
P
C
P
O
O
O
δ+C
P
H3C
O
OH
OH
R
OR
..
CoASH
OR
O
OH
OR
O
P
H3C C
SCoA
коэнзим А
O
ацетилкоэнзим А
HO
OH
OR
61.
Реакции ацилирования (in vivo) идут сучастием:
-сложных тиоэфиров
O
R
O
C
H3C
SR
δ+ O
H 3C C
SCoA
C
SR
..
CH3
HO
CH2
CH3
N
CH2
CH3
холин
O
H 3C C
-CoASH
CH3
O
CH2
CH3
N
CH2
CH3
ацетилхолин
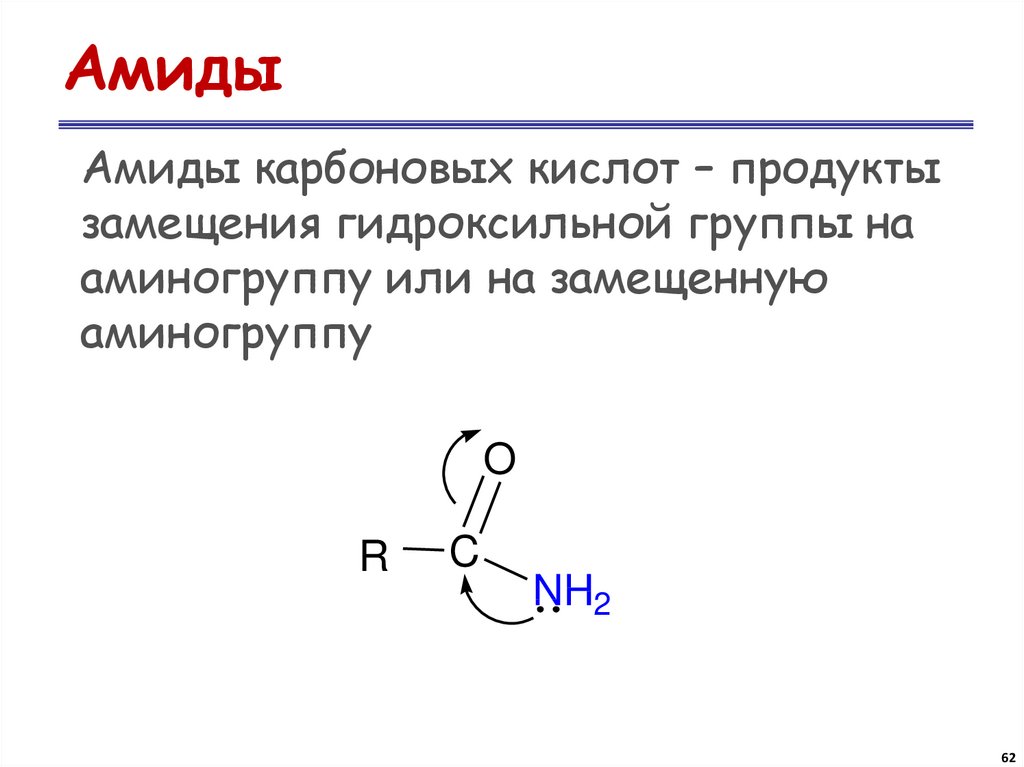
62. Амиды
Амиды карбоновых кислот – продуктызамещения гидроксильной группы на
аминогруппу или на замещенную
аминогруппу
O
R
C
NH2
62
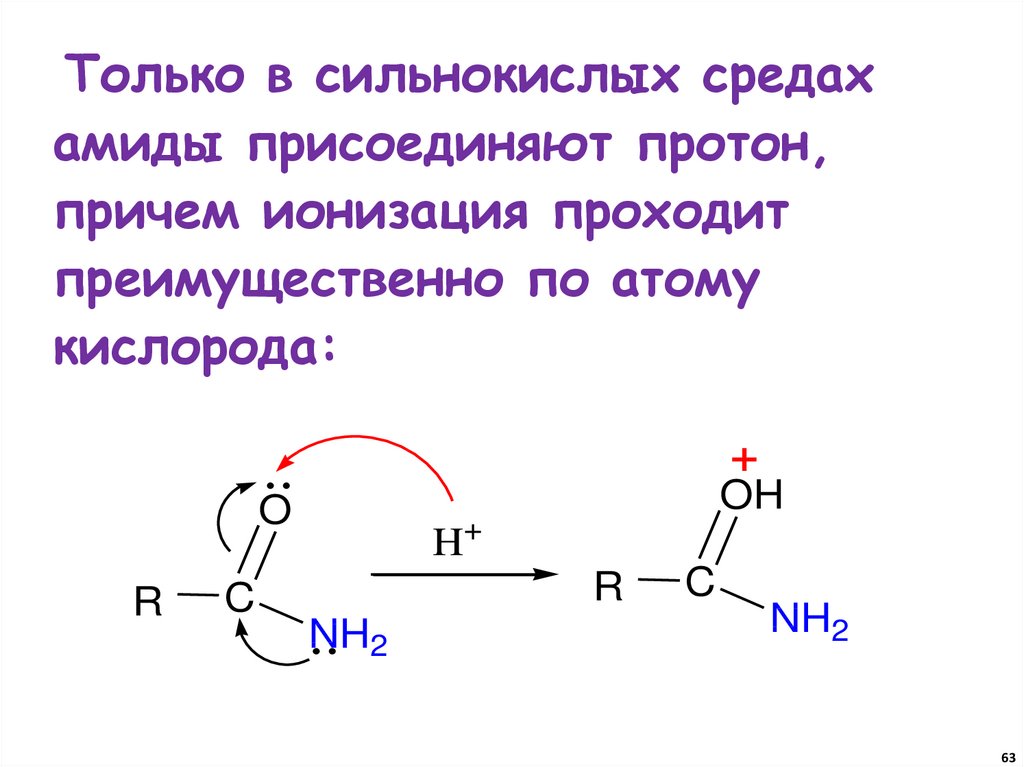
63.
Только в сильнокислых средахамиды присоединяют протон,
причем ионизация проходит
преимущественно по атому
кислорода:
+
OH
O
R
C
H+
R
NH2
C
NH2
63
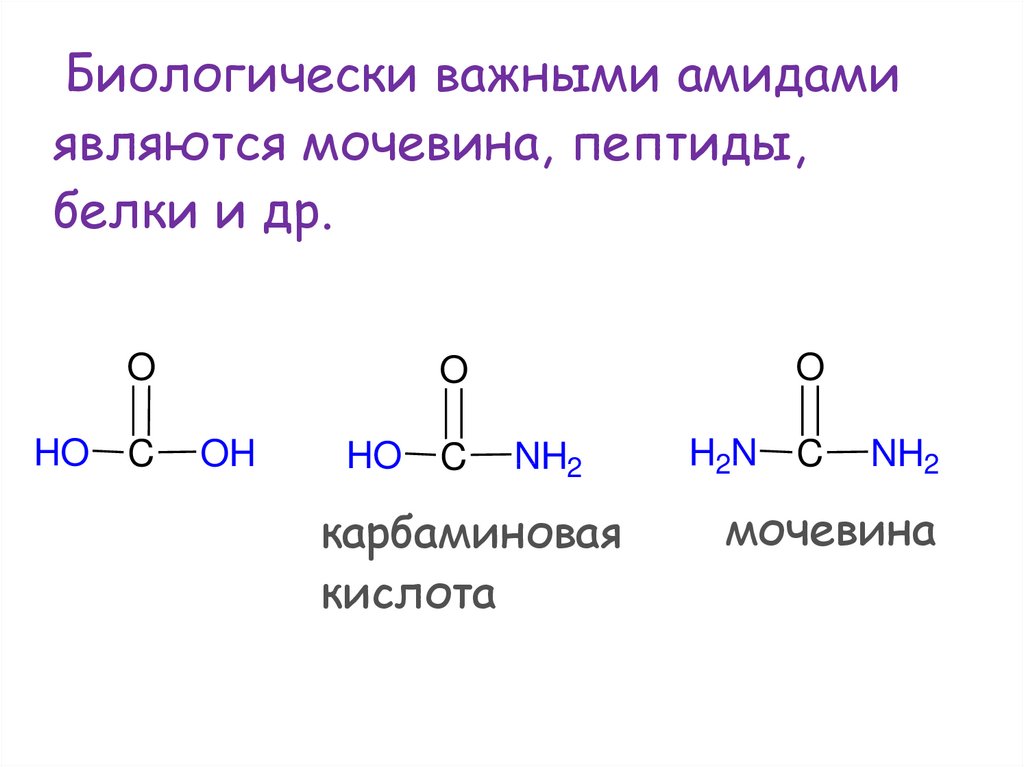
64.
Биологически важными амидамиявляются мочевина, пептиды,
белки и др.
O
HO
C
O
O
OH
HO
C
NH2
карбаминовая
кислота
H2N
C
NH2
мочевина



















 Химия
Химия








