Похожие презентации:
Лекция 9. Реакции нуклеофильного замещения(Sn) в ряду карбоновых кислот
1.
ЛЕКЦИЯ 9РЕАКЦИИ
НУКЛЕОФИЛЬНОГО
ЗАМЕЩЕНИЯ (SN) В РЯДУ
КАРБОНОВЫХ КИСЛОТ
2.
ПЛАН9.1 Классификация и
номенклатура карбоновых кислот
9.2. Электронное и
пространственное строение
карбоксильной группы
9.3 Реакции нуклеофильного
замещения (SN), их роль
3. Предельные одноосновные карбоновые кислоты
9.1 Классификация и номенклатуракарбоновых кислот
Предельные одноосновные карбоновые
кислоты
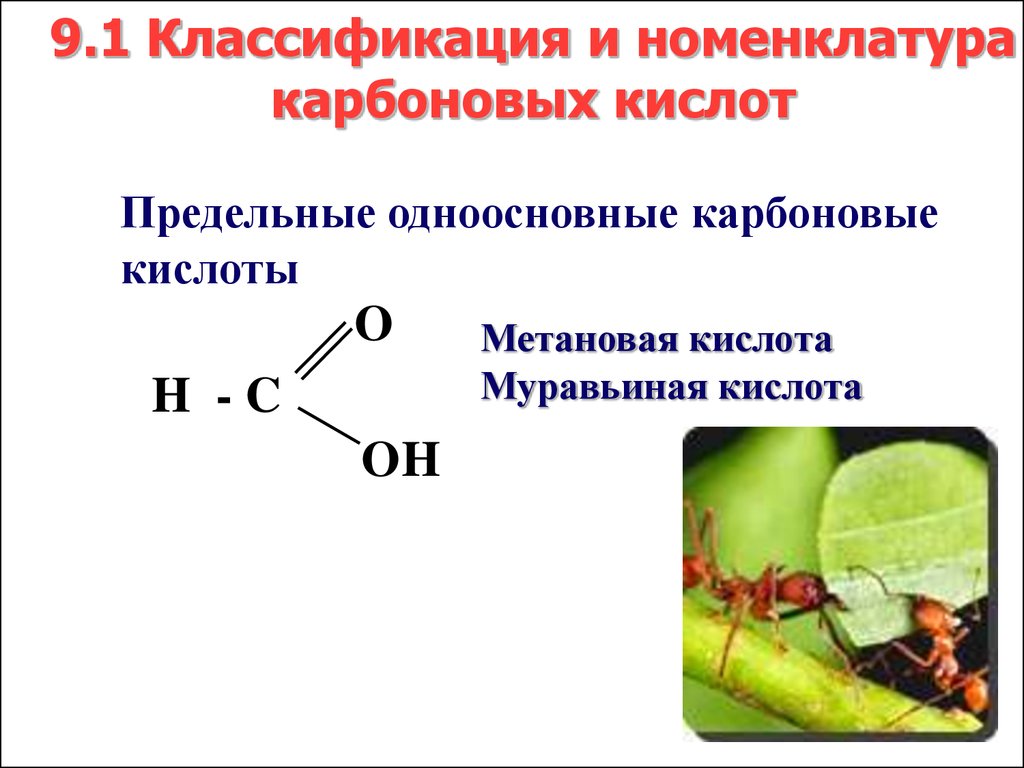
O
H -C
OH
Метановая кислота
Муравьиная кислота
4.
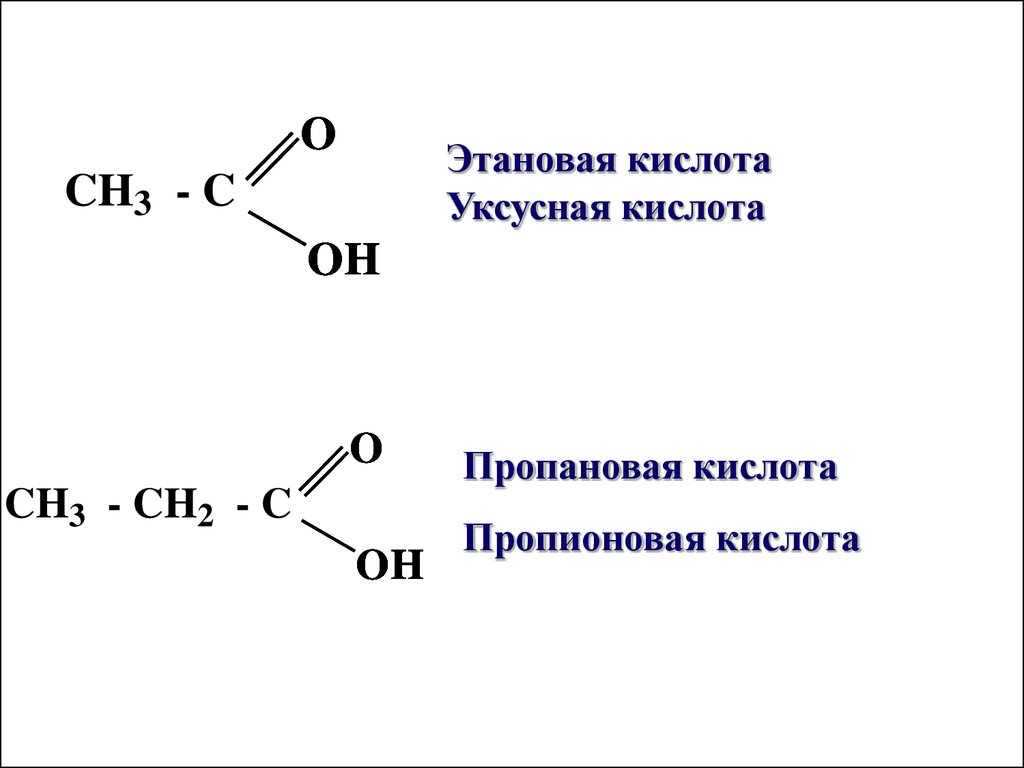
OЭтановая кислота
Уксусная кислота
CH3 - C
OH
O
CH3 - CH2 - C
OH
Пропановая кислота
Пропионовая кислота
5.
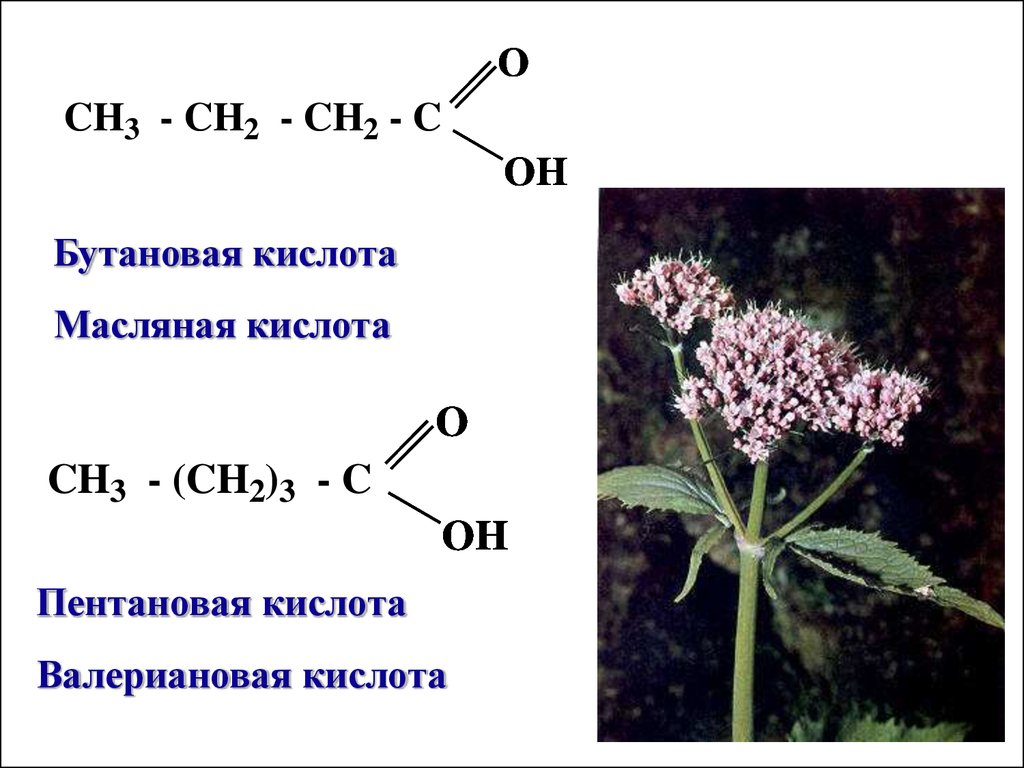
OCH3 - CH2 - CH2 - C
OH
Бутановая кислота
Масляная кислота
O
CH3 - (CH2)3 - C
OH
Пентановая кислота
Валериановая кислота
6.
OCH3 - (CH2)4 - C
OH
Гексановая кислота
Капроновая кислота
Козы являются источником
капроновой, каприловой и
каприновой кислот:
CH3(CH2)nCOOH n = 4, 6, 8
7.
OПальмитиновая кислота
CH3 - (CH2)14 - C
OH
O
Маргариновая кислота
CH3 - (CH2)15 - C
OH
O
CH3 - (CH2)16 - C
OH
Стеариновая кислота
8. ДВУХОСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ
ДВУХОСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫHOOC - COOH
Этандиовая кислота
Щавелевая кислота
Пропандиовая кислота
HOOC - CH2 - COOH
Малоновая кислота
9.
HOOC - CH2 - CH2 - COOHБутандиовая кислота
Янтарная кислота
HOOC - CH2 - CH2 - CH2 - COOH
Пентандиовая
Глутаровая кислота
10.
Непредельные одноосновные кислотыH2C = CH - COOH
H3C - CH = CH - COOH
пропеновая, акриловая
бутен-2-овая , кротоновая
11.
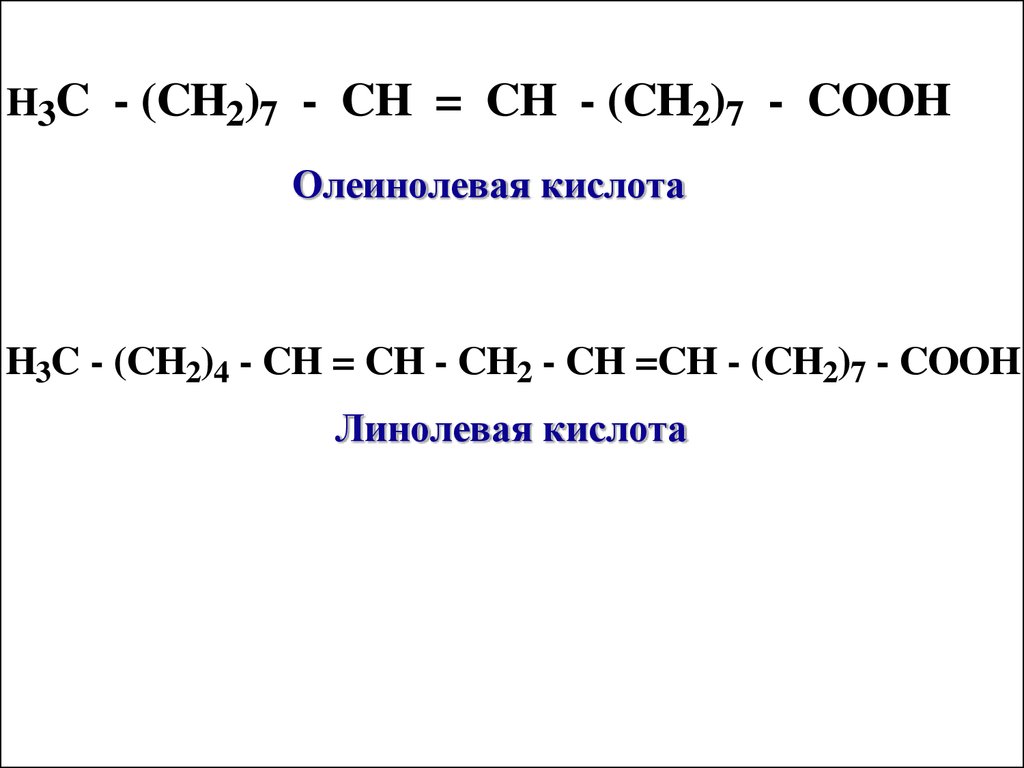
H3C - (CH2)7 - CH = CH - (CH2)7 - COOHОлеинолевая кислота
H3C - (CH2)4 - CH = CH - CH2 - CH =CH - (CH2)7 - COOH
Линолевая кислота
12.
H3C-CH2-CH =CH-CH2-CH=CH-CH2-CH=CH-(CH2)7 - COOHЛиноленовая кислота
H3C-(CH2)4-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)3-COOH
Арахидоновая кислота
13. АРОМАТИЧЕСКИЕ КИСЛОТЫ
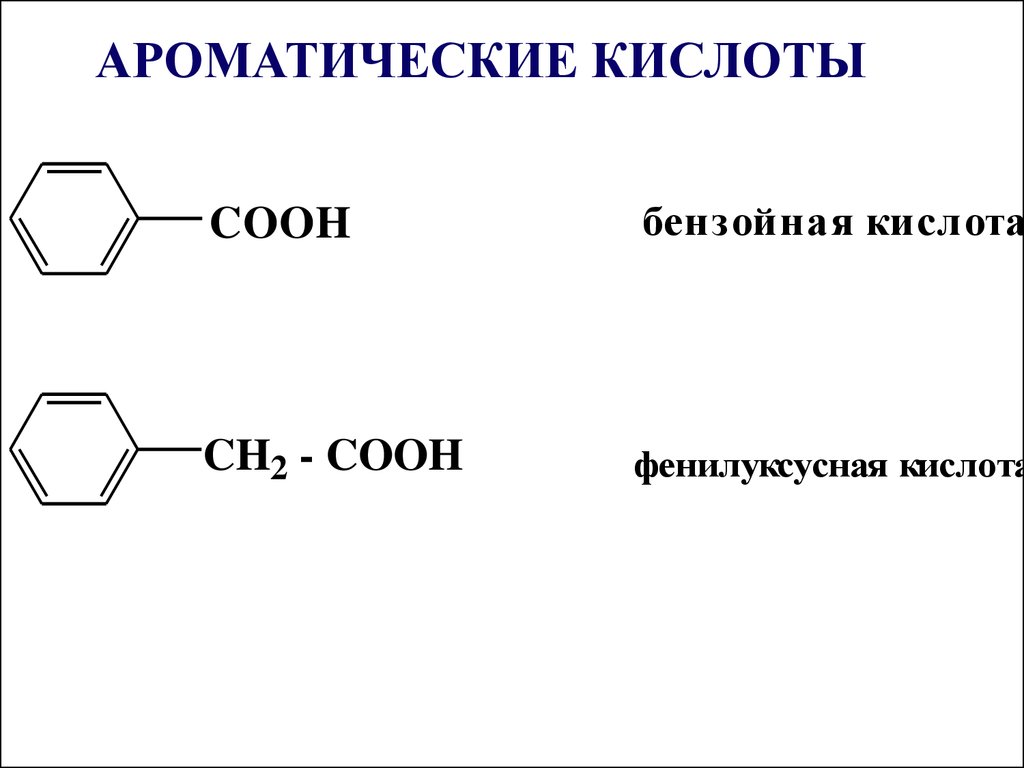
COOHбензойная кислота
CH2 - COOH
фенилуксусная кислота
14.
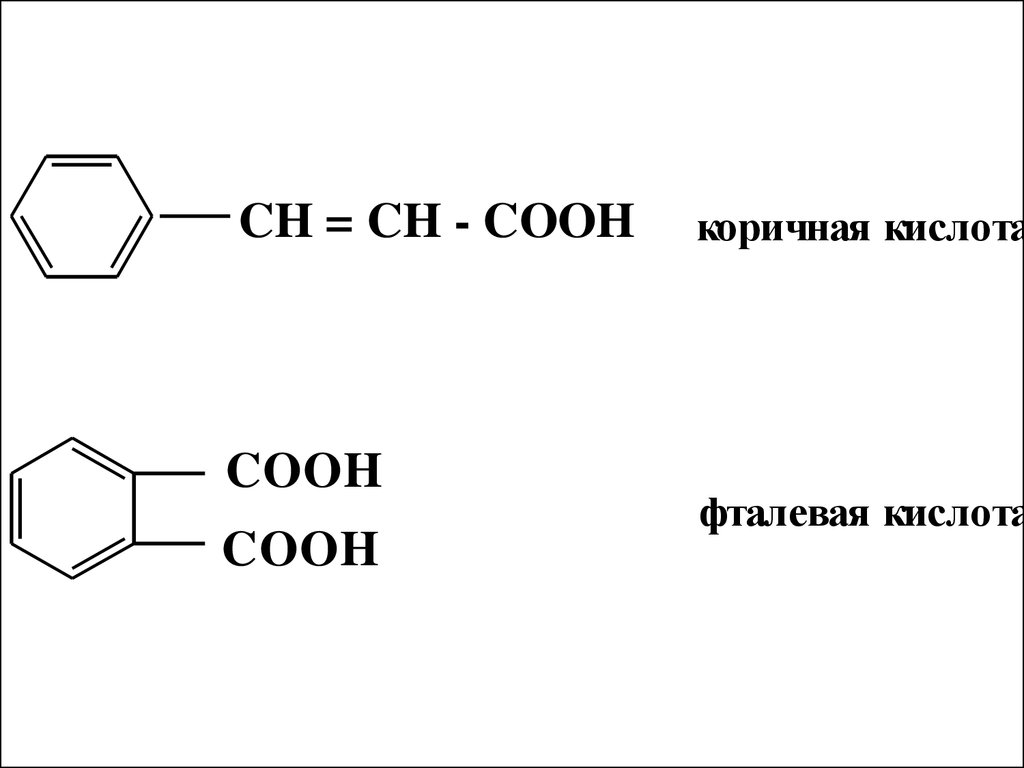
CH = CH - COOHCOOH
COOH
коричная кислота
фталевая кислота
15. НЕПРЕДЕЛЬНЫЕ ДВУХОСНОВНЫЕ КИСЛОТЫ
HOOCCOOH
C
H
H
HOOC
H
C
H
м алеиновая кислота
C
фум аровая кислота
C
COOH
16.
9.2. Электронное ипространственное строение
карбоксильной группы
Карбоксильная группа
состоит из карбонильной и
гидроксильной групп,
взаимно влияющих друг на
друга, что приводит к
новому качеству
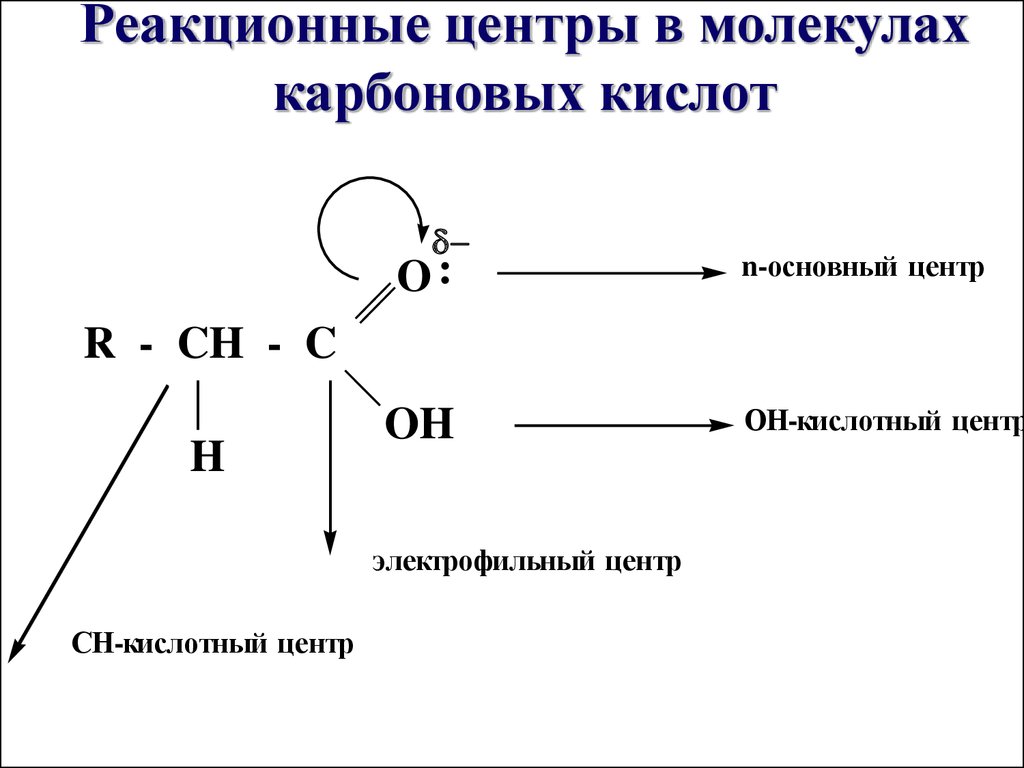
17. Реакционные центры в молекулах карбоновых кислот
O:n-основный центр
R - CH - C
H
OH
электрофильный центр
СН-кислотный центр
ОН-кислотный центр
18.
Характеристика реакционнойспособности карбоновых кислот:
•У карбоновых кислот повышены
основные свойства атома кислорода по
сравнению с оксосоединениями;
•За счет р,π-сопряжения в карбоксильной группе кислотность по
сравнению со спиртами сильно
повышена;
19.
•У карбоновых кислот частичныйположительный заряд на
карбоксильном атоме углерода
меньше, чем в оксосоединениях, т.е.
кислоты менее активны к
восприятию атаки нуклеофильным
реагентом, поэтому для кислот
характерны реакции SN, а не AN, как
для оксосоединений
20.
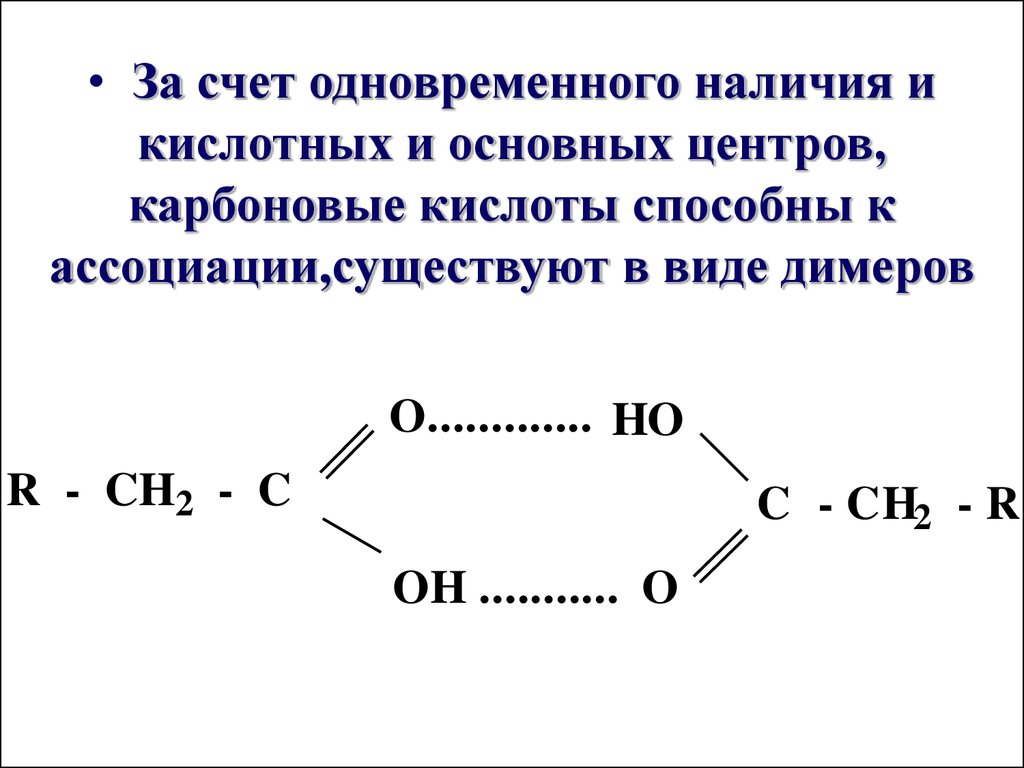
• За счет одновременного наличия икислотных и основных центров,
карбоновые кислоты способны к
ассоциации,существуют в виде димеров
O............. HO
R - CH2 - C
C - CH2 - R
OH ........... O
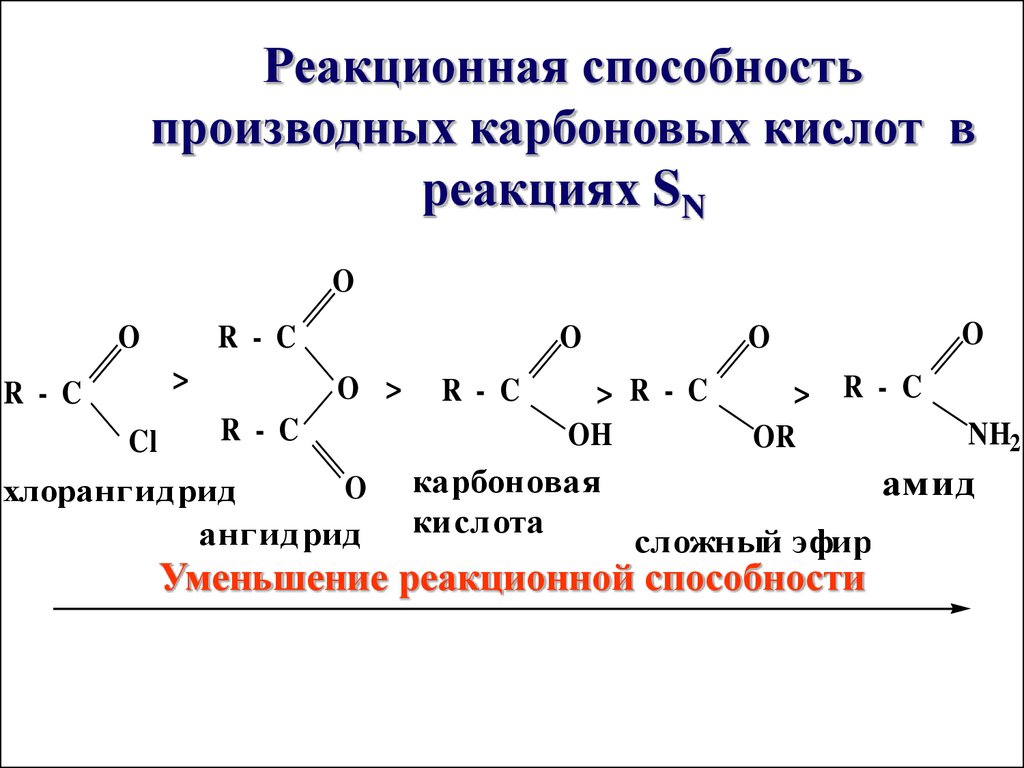
21. Реакционная способность производных карбоновых кислот в реакциях SN
Реакционная способностьпроизводных карбоновых кислот в
реакциях SN
O
O
R - C
>
R - C
Cl
O >
R - C
O
хлорангидрид
ангидрид
R - C
O
O
> R - C
OH
>
OR
карбоновая
кислота
O
R - C
NH2
амид
сложный эфир
Уменьшение реакционной способности
22.
9.3 Реакции нуклеофильногозамещения (SN), их роль
Реакции SN характерны для
карбоновых кислот и их
функциональных производных,
что обусловлено полярностью
связи С - Х
Х - ОН; -Наl; ОR; -OCOR; -NH2
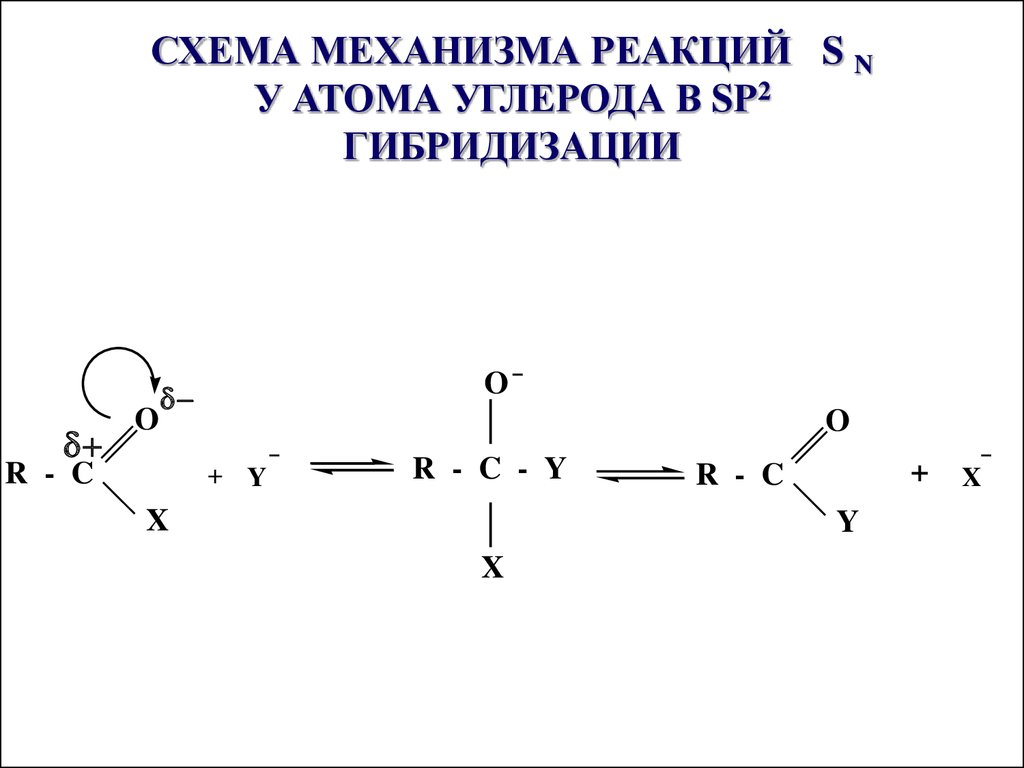
23. СХЕМА МЕХАНИЗМА РЕАКЦИЙ S N У АТОМА УГЛЕРОДА В SР2 ГИБРИДИЗАЦИИ
СХЕМА МЕХАНИЗМА РЕАКЦИЙ S NУ АТОМА УГЛЕРОДА В SР2
ГИБРИДИЗАЦИИ
O
O
R - C
O
+ Y
R - C - Y
X
+
R - C
Y
X
X
24.
Реакция протекает при наличиисильного нуклеофила Y- и хорошо
уходящей группы Х- Увеличение
реакционной способности карбоновых
кислот в SN реакциях осуществляется
путем повышения электрофильности
атома углерода карбоксильной группы,
что достигается либо использованием
кислотного катализа, либо введением в
карбоксильную группу более сильных
электроноакцепторов, чем ОН-группа,
например галогена
25.
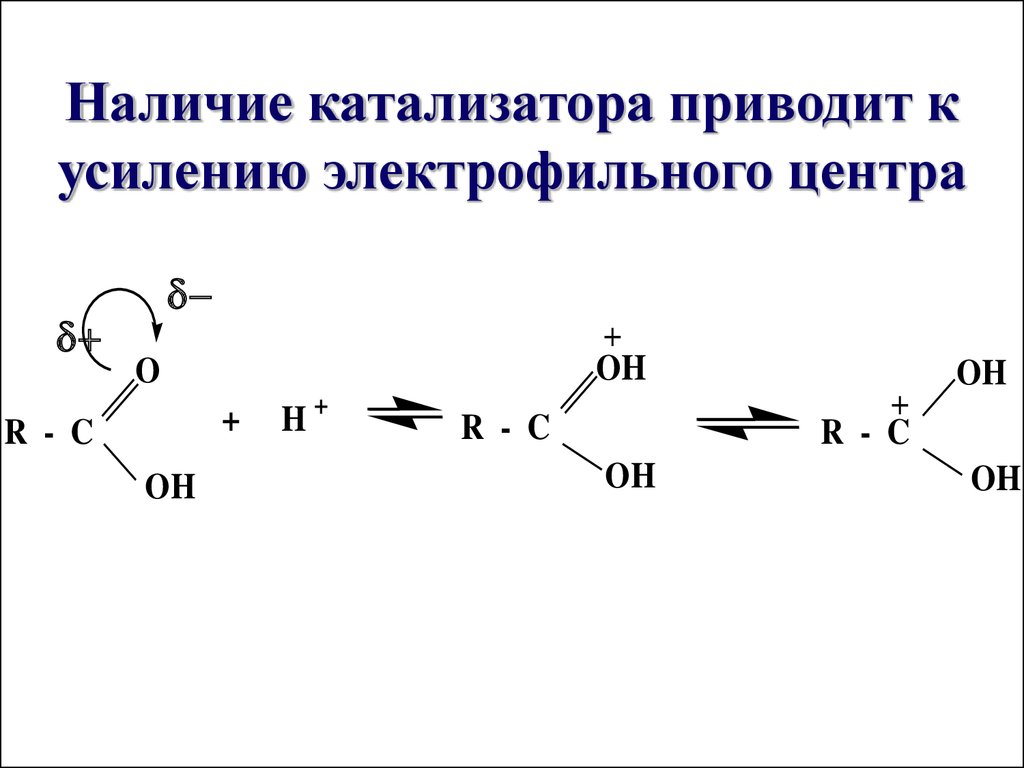
Наличие катализатора приводит кусилению электрофильного центра
+
OH
O
+
R - C
OH
H+
+
R - C
R - C
OH
OH
OH
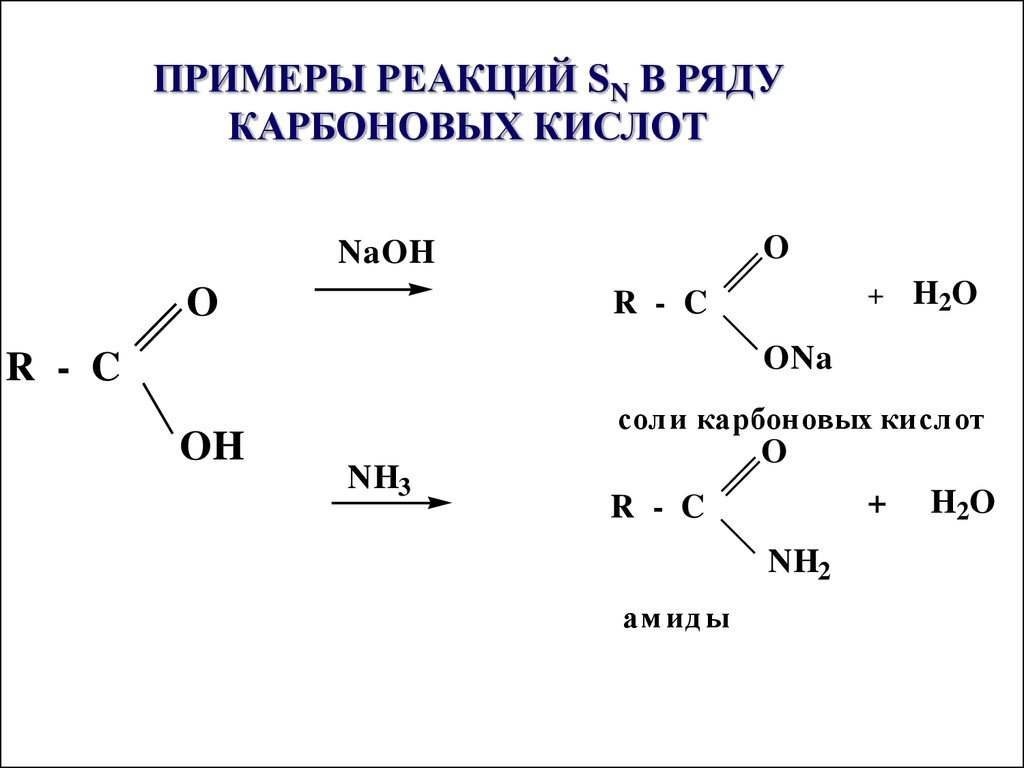
26. ПРИМЕРЫ РЕАКЦИЙ SN В РЯДУ КАРБОНОВЫХ КИСЛОТ
ONaOH
O
+
R - C
H2O
ONa
R - C
OH
соли карбоновых кислот
NH3
O
+
R - C
NH2
ам ид ы
H2O
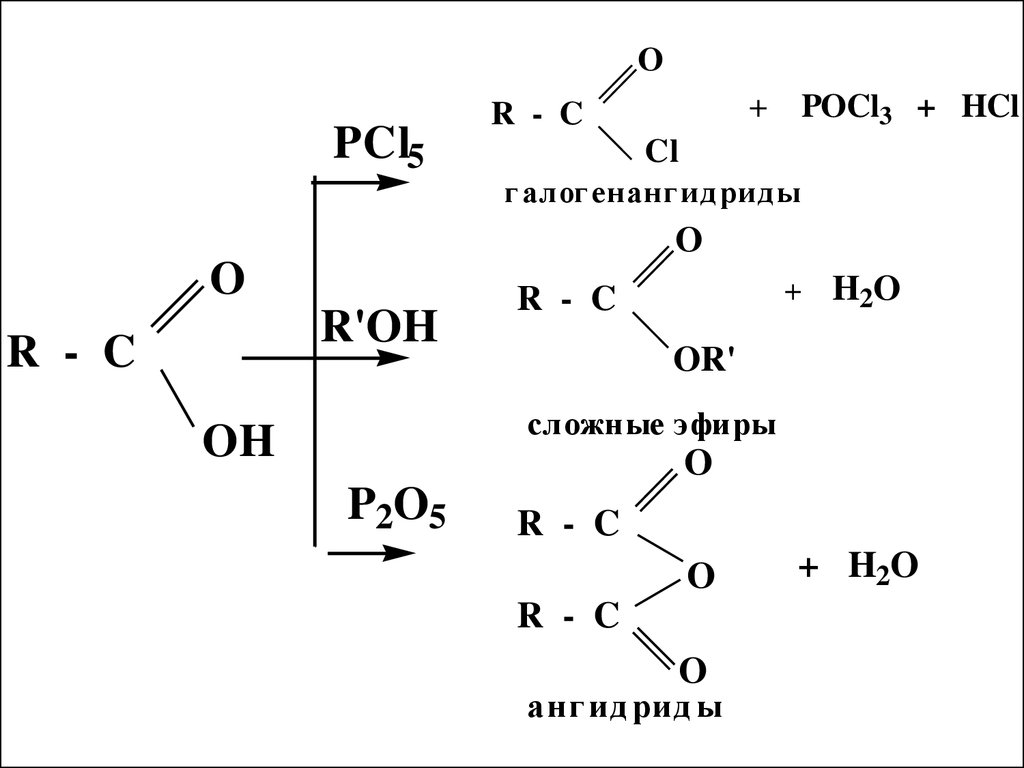
27.
OPCl5
+
R - C
POCl3 + HCl
Cl
г алог енанг ид рид ы
O
O
R'OH
R - C
+ H2O
R - C
OR'
сложные эфиры
OH
O
P2O5
R - C
O
R - C
O
анг ид рид ы
+ H2O
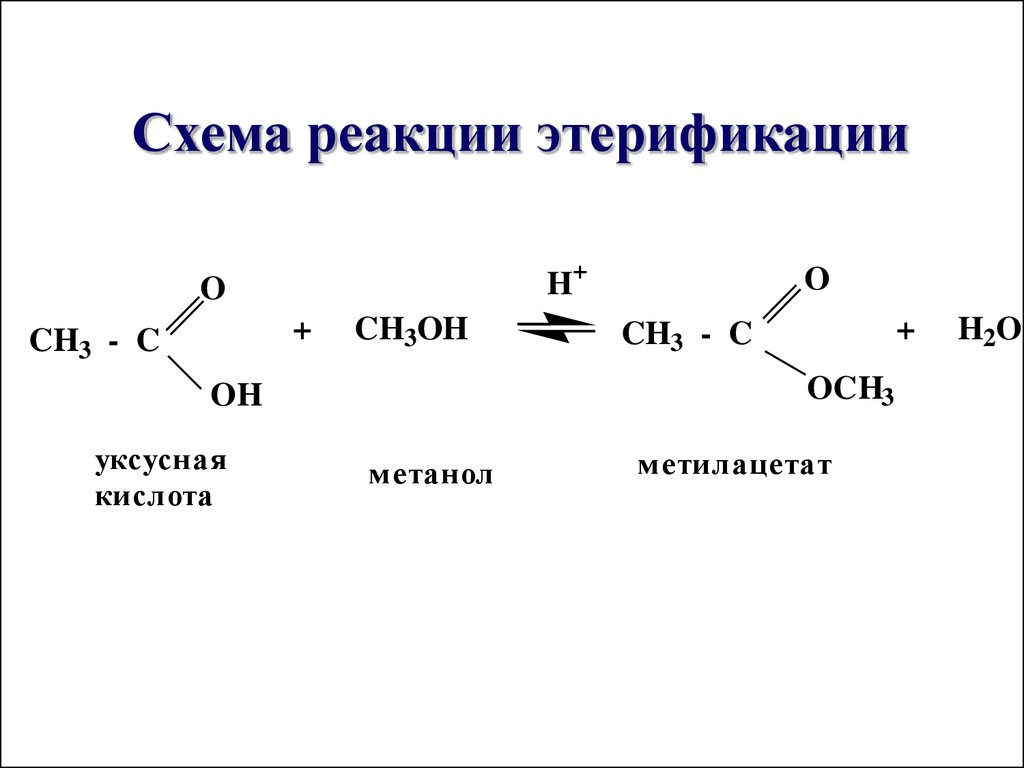
28. Схема реакции этерификации
Схема реакции этерификацииH+
O
+
CH3 - C
CH3OH
+
CH3 - C
OCH3
OH
уксусная
кислота
O
м етанол
м етилацетат
H2O
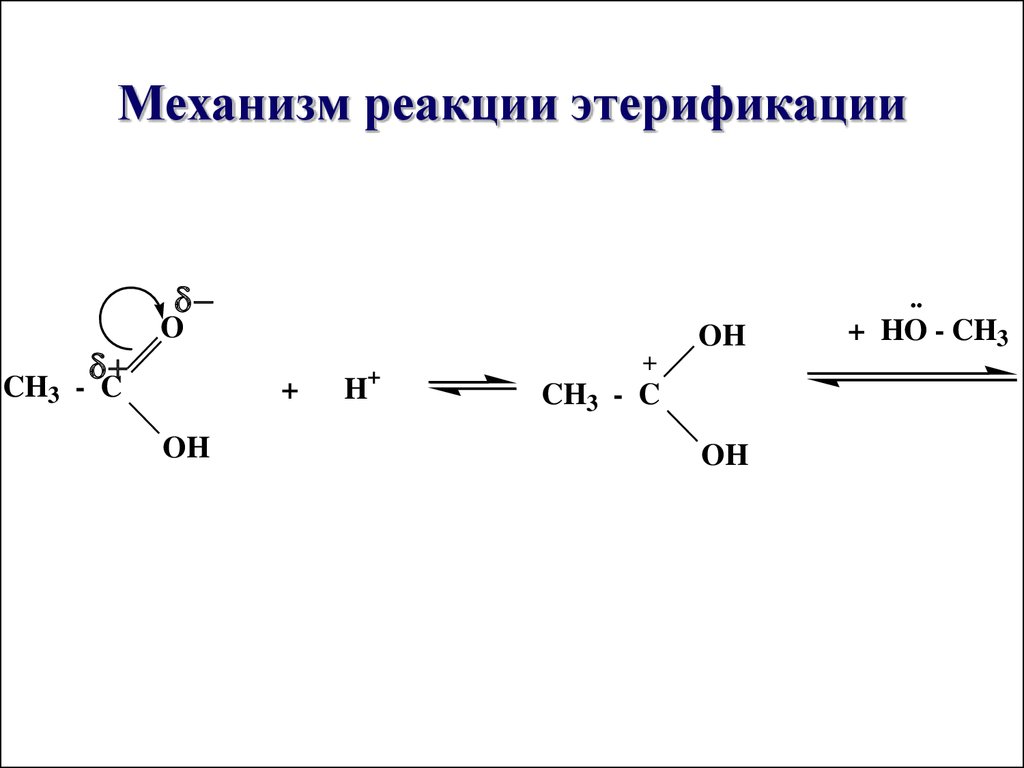
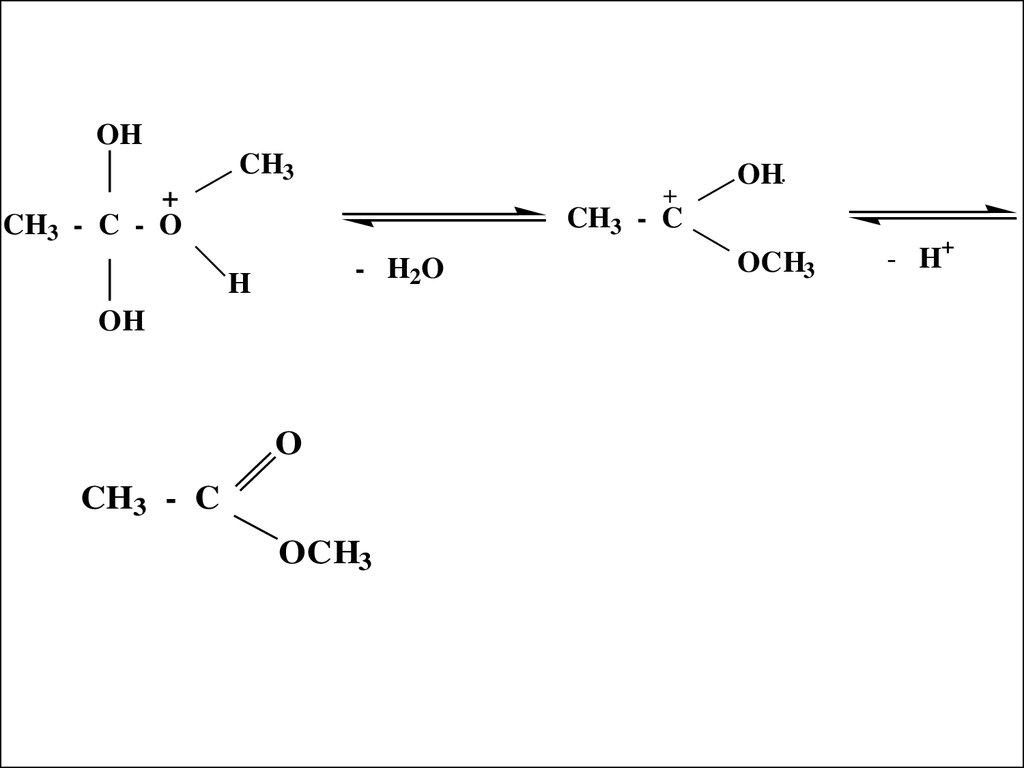
29. Механизм реакции этерификации
..O
CH3 - C
OH
+
OH
+
H
+
CH3 - C
OH
+ HO - CH3
30.
OHCH3
+
+
CH3 - C - O
OH..
CH3 - C
- H2O
H
OH
O
CH3 - C
OCH3
OCH3
- H+
31.
Реакция этерификации протекаетв присутствии минеральных
кислот, т.к. спирт является
слабым нуклеофилом. Все стадии
обратимы, поэтому образующиеся
сложные эфиры являются
нестойкими соединениями и
гидролизуются в кислой среде
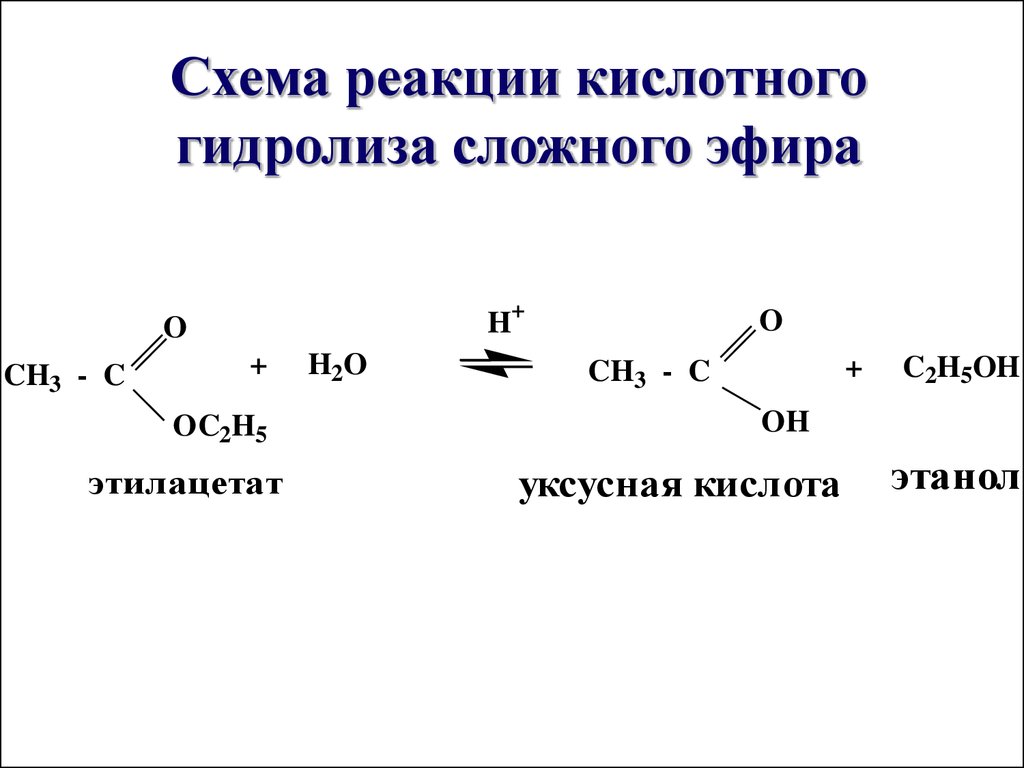
32. Схема реакции кислотного гидролиза сложного эфира
H+O
CH3 - C
+
OC2H5
этилацетат
H2O
O
+
CH3 - C
C2H5OH
OH
уксусная кислота
этанол
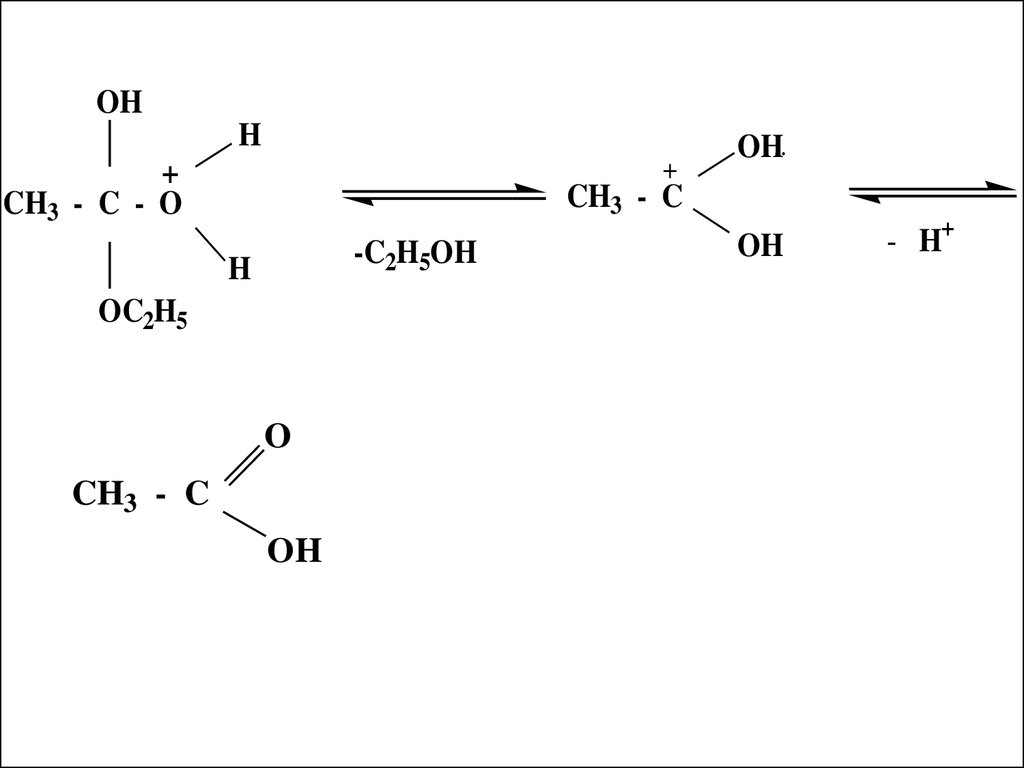
33. Механизм реакции кислотного гидролиза
CH3 - CO
OH
+
OC2H5
+
H
+
..
+ HOH
CH3 - C
OC2H5
34.
OHH
+
+
CH3 - C - O
OH..
CH3 - C
-C2H5OH
H
OC2H5
O
CH3 - C
OH
OH
- H+
35.
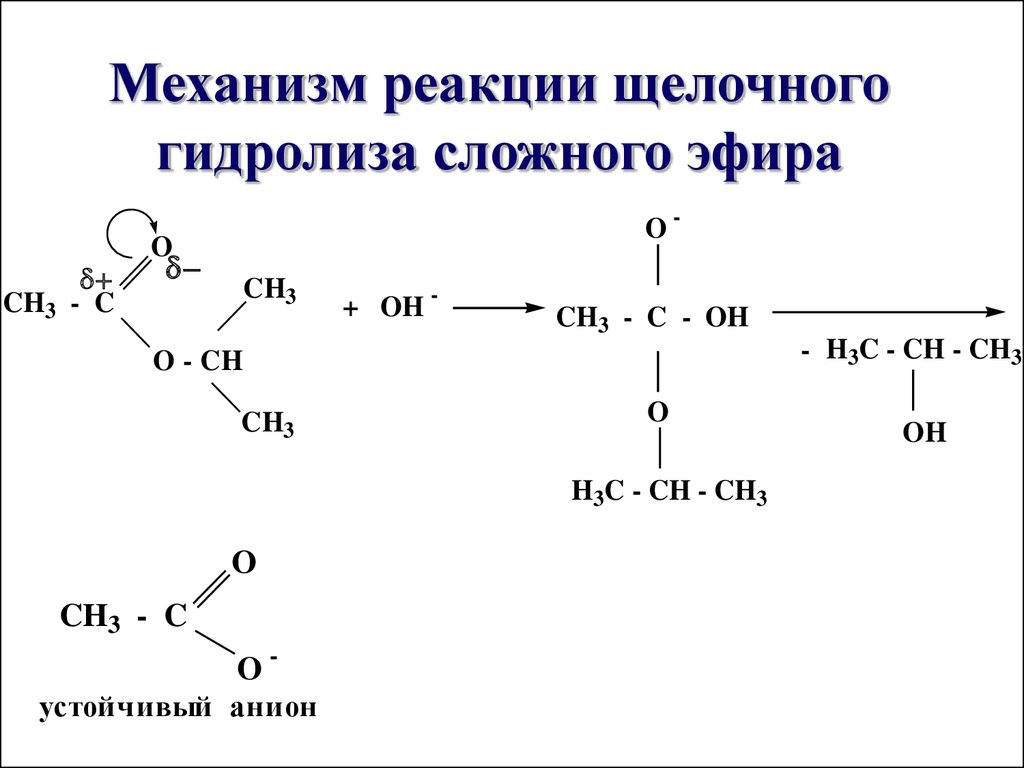
В щелочной средегидролиз необратим,
причиной этого является
образование в щелочной
среде стабильного ацилатиона
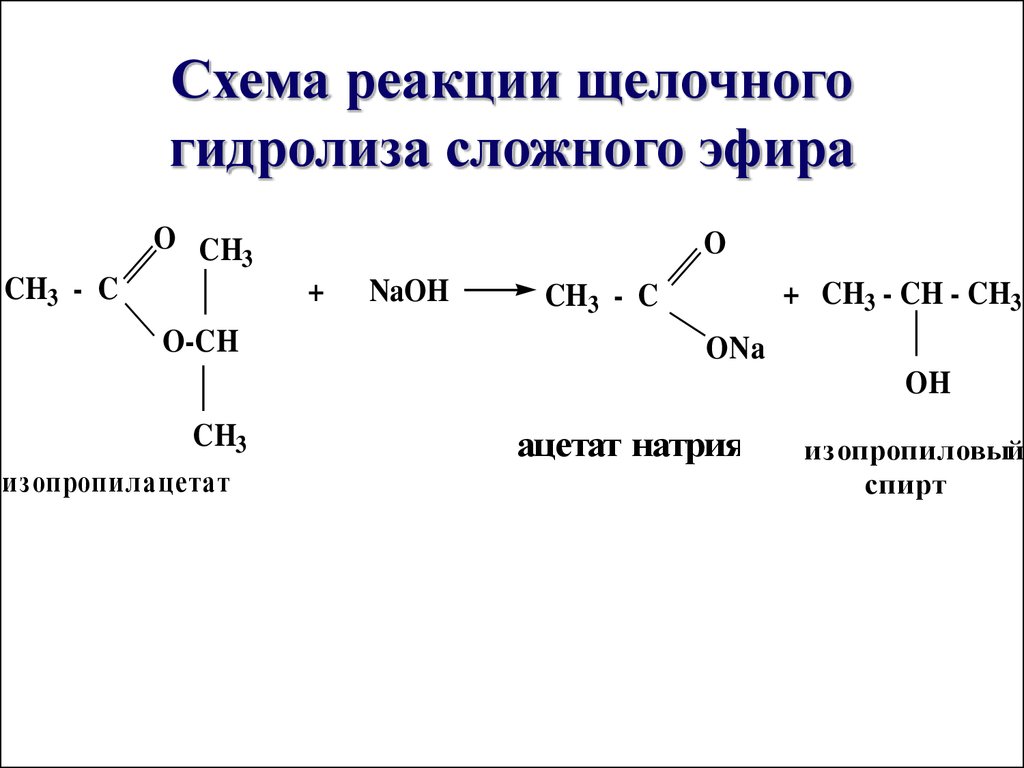
36. Схема реакции щелочного гидролиза сложного эфира
O CH3
CH3 - C
O
+
O-CH
NaOH
+ CH3 - CH - CH3
CH3 - C
ONa
OH
CH3
изопропилацетат
ацетат натрия
изопропиловый
спирт
37. Механизм реакции щелочного гидролиза сложного эфира
CH3 - CO-
O
CH3
+ OH -
CH3 - C - OH
- H3C - CH - CH3
O - CH
CH3
O
H3C - CH - CH3
O
CH3 - C
Oустойчивый анион
OH
38.
Для практического получениясложных эфиров обычно используют
реакцию ацилирования спиртов
галогенангидридами или
ангидридами кислот, при этом выход
эфиров составляет от 60 до 80 % ( в
отличие от ацилирования кислотами,
где выход составляет приблизительно
30 – 40 %)
39.
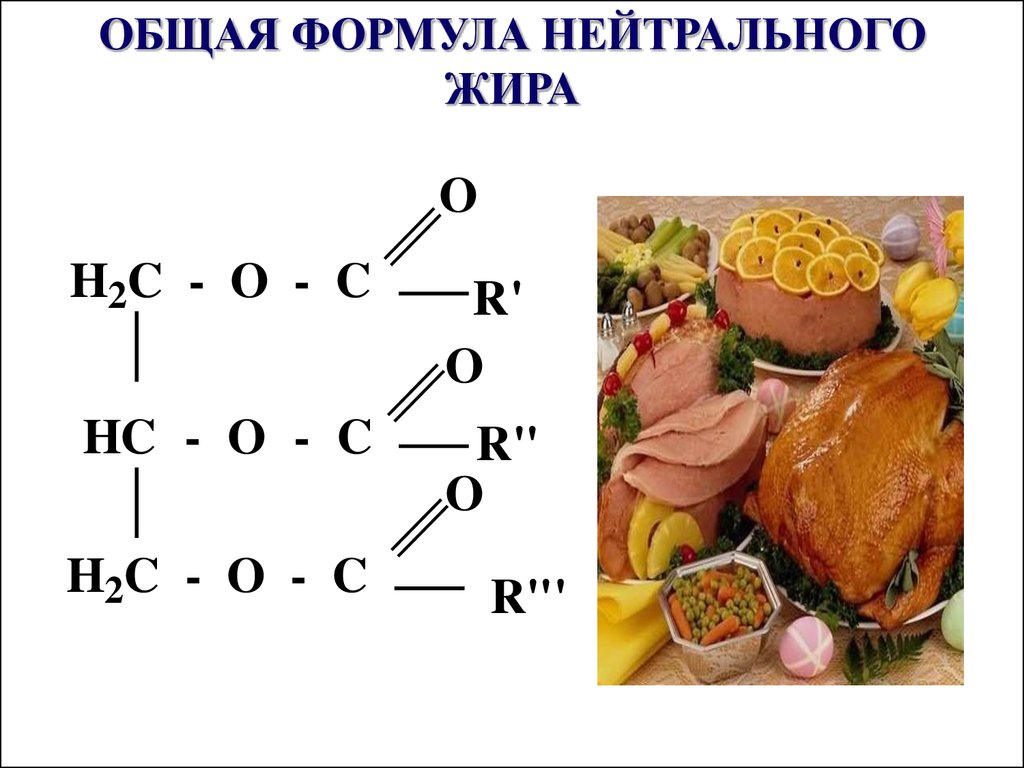
Сложными эфирамиявляются жиры и липиды,
в образовании которых
принимают участие
многоатомные спирты и
ВЖК
40. ОБЩАЯ ФОРМУЛА НЕЙТРАЛЬНОГО ЖИРА
OH2C - O - C
R'
O
HC - O - C
R"
O
H2C - O - C
R"'
41.
Многие лекарственныепрепараты являются
сложными эфирами. Поэтому
всегда следует учитывать
возможность их гидролиза в
кислой среде желудка и
щелочной – кишечника
42.
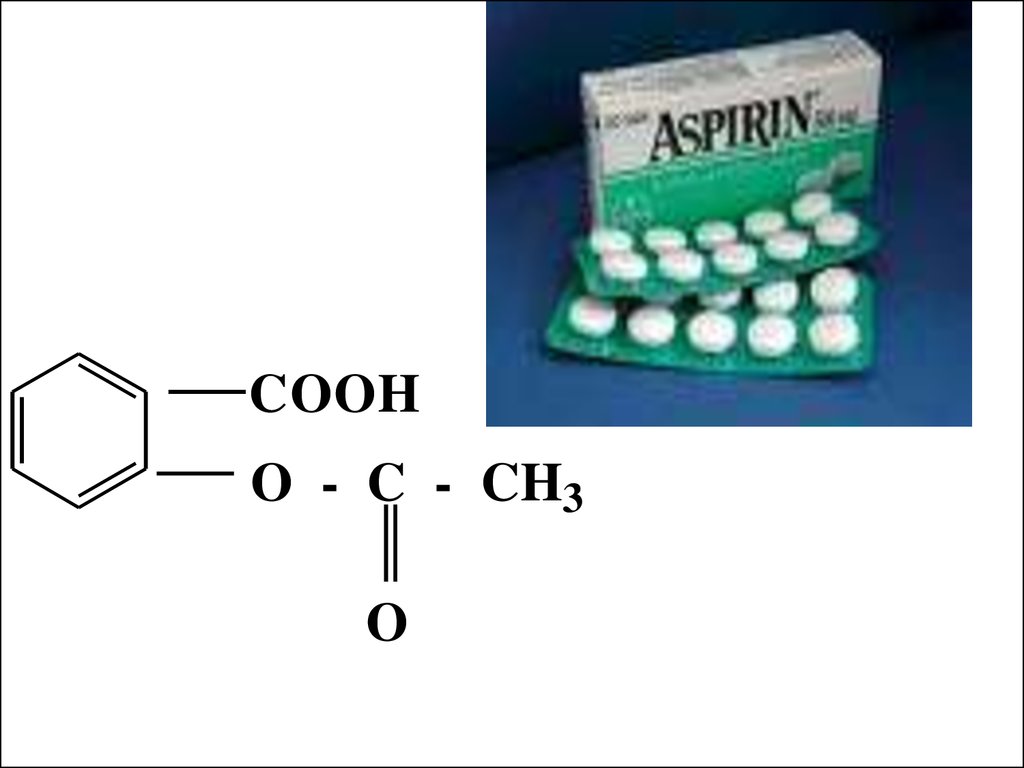
COOHO - C - CH3
O
43.
Аспириниспользовали при
лечении зубной,
головной боли и
артритов на
протяжении 100
лет. Но только в
1969 Джон Вейн
пояснил механизм
его действия
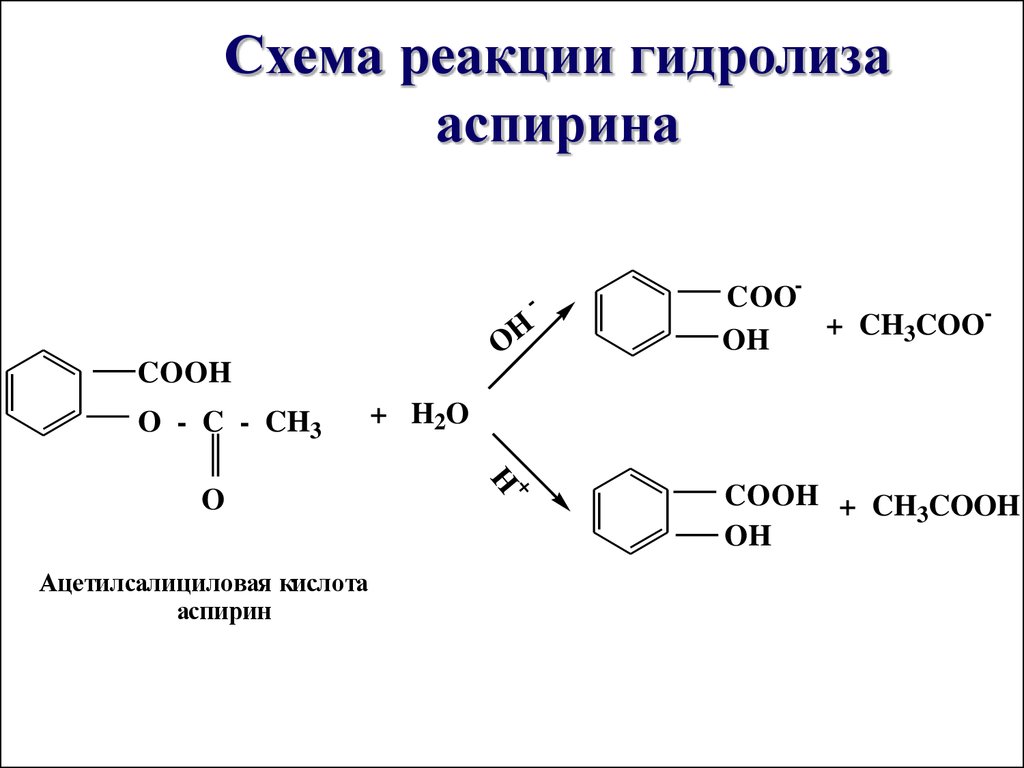
44. Схема реакции гидролиза аспирина
-OH
COOH
O - C - CH3
+
Ацетилсалициловая кислота
аспирин
+ H2O
H
O
COO+
CH
COO
3
OH
COOH + CH COOH
3
OH
45.
Сложные тиоэфиры наряду сосложными эфирами
являются наиболее
распространенными
в природе производными
карбоновых кислот. В
организме таким
представителем биологическиактивных тиоэфиров является
ацетил КоА
46.
Oпереносчик ацетильной группы in vivo .
CH3 - C
S - KoA
Ацетил КоА
-
O
O
+ У-
CH3 - C
S - KoA
-
CH3 - C
У
+ KoASH
47.
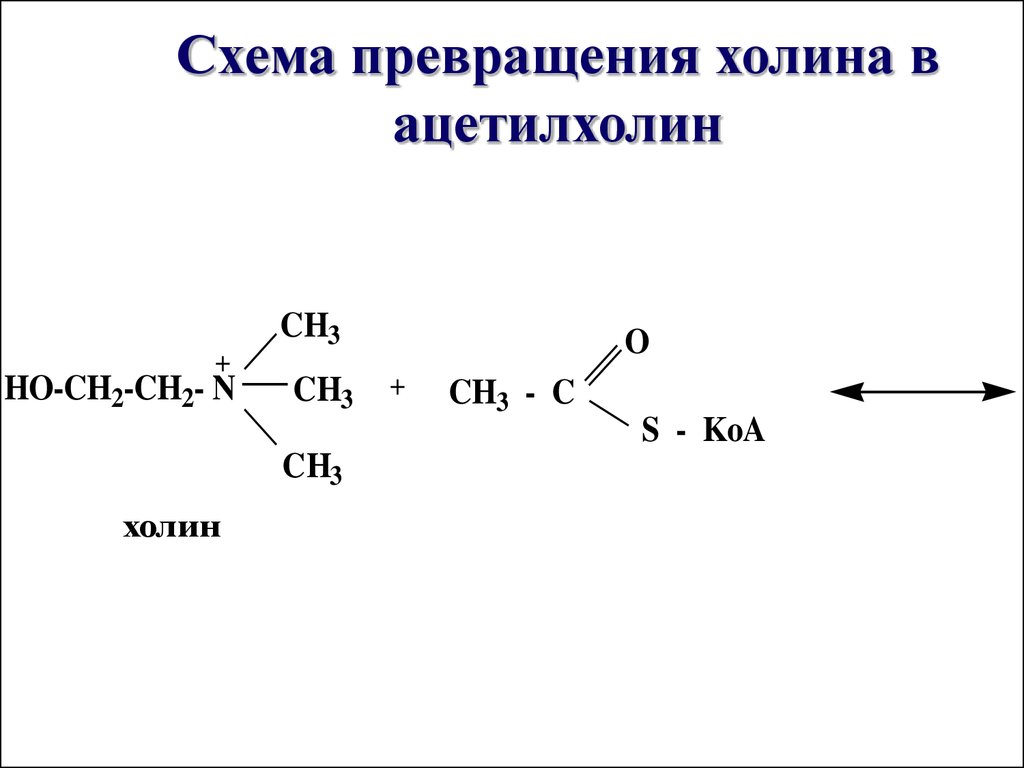
Таким образомосуществляется превращение
холина в ацетилхолин –
нейромедиатор, посредник
при передаче нервного
импульса
48. Схема превращения холина в ацетилхолин
CH3+
HO-CH2-CH2- N
CH3
O
+
CH3 - C
S - KoA
CH3
холин
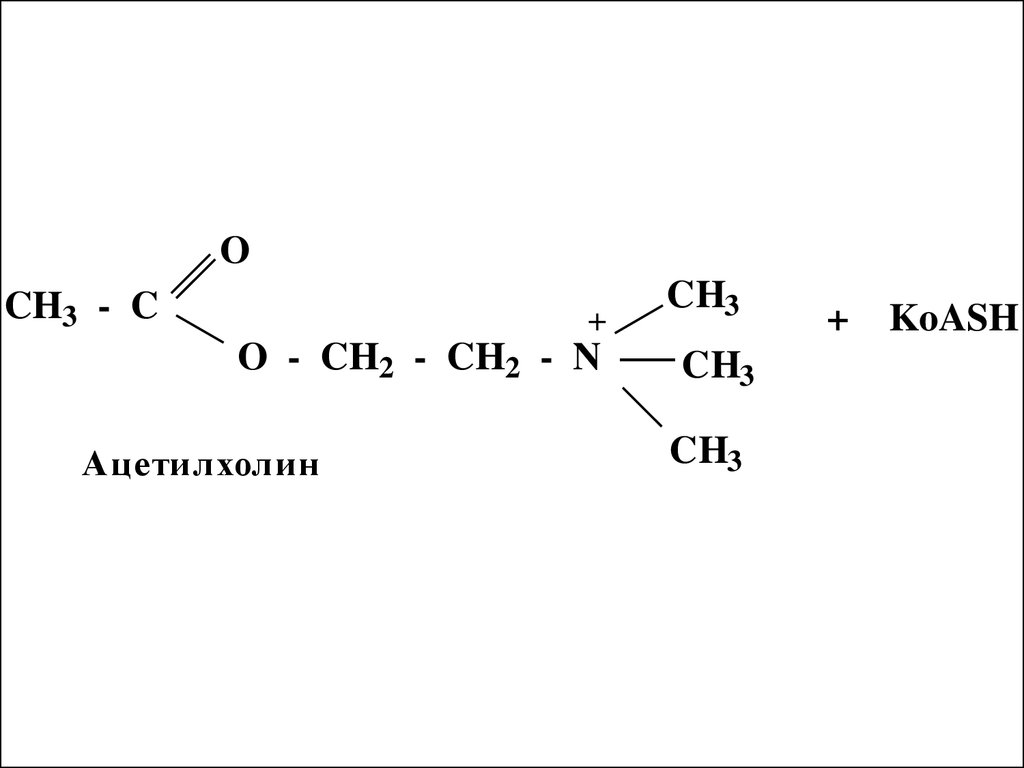
49.
OCH3 - C
+
O - CH2 - CH2 - N
Ацетилхолин
CH3
CH3
CH3
+
KoASH
50.
При передаче нервного импульсаацетилхолин синтезируется в
окончаниях нервных волокон и
мигрирует к белковому рецептору
следующей нервной клетки.
Связывание ацетилхолина с
белковым рецептором является
причиной передачи сигнала далее, а
ацетилхолин гидролизуется,
оставляя клетку готовой для приема
следующего сигнала
51. Схемы реакций декарбоксилирования
Реакции декарбоксилированиякарбоновых кислот – энергетически
выгодный процесс
Декарбоксилирование характерно для
кислот у которых в -положении
имеется электроноакцепторный
заместитель
52.
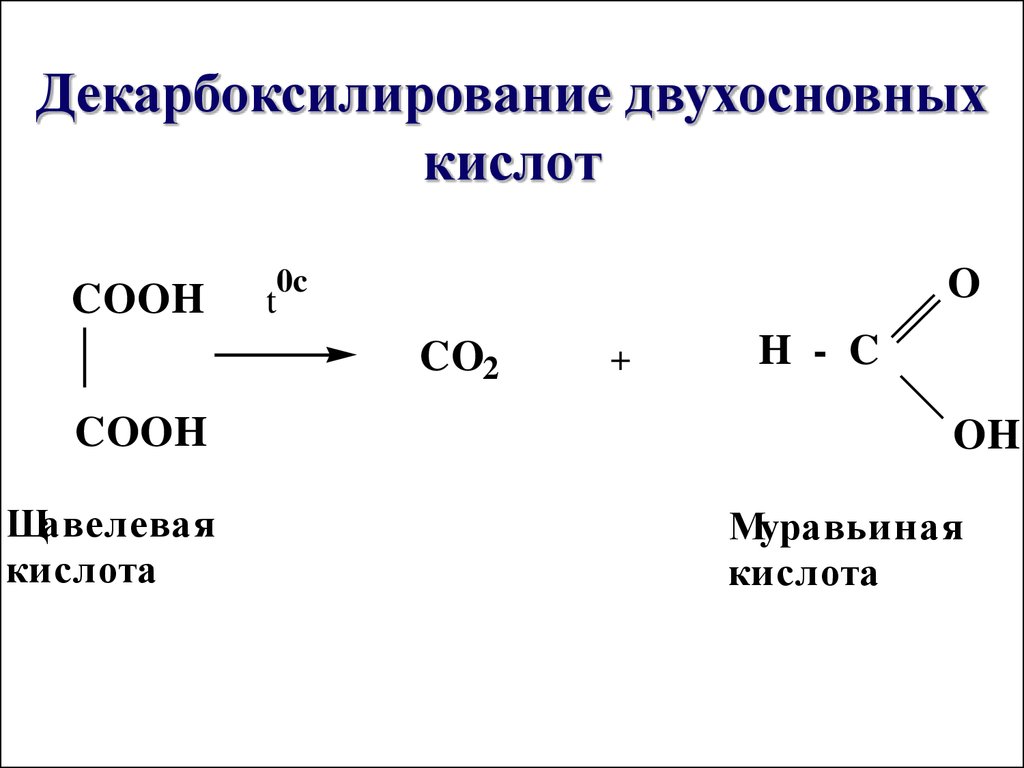
Декарбоксилирование двухосновныхкислот
COOH
t
O
0c
CO2
COOH
Щавелевая
кислота
+
H - C
OH
Муравьиная
кислота
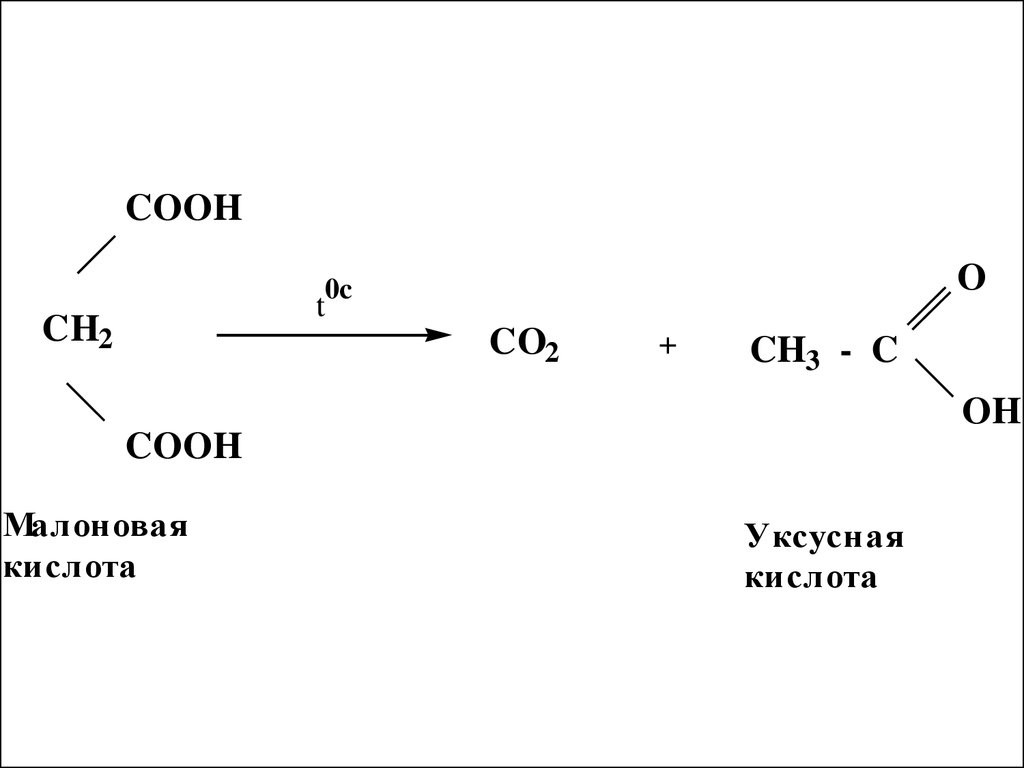
53.
COOHt
CH2
O
0c
CO2
+
CH3 - C
OH
COOH
Малоновая
кислота
Уксусная
кислота
54.
При декарбоксилированииянтарной и глутаровой кислот
происходит образование
циклических ангидридов, что
обусловлено образованием пятиили шестичленных
гетероциклов, имеющих
устойчивые конформации
"полукресла” и “кресла”
55.
OCH2
CH2
C
OH
OH
C
oc
t
CH2
C
O
- H2O
O
Янтарная
кислота
O
CH2
C
O
Янтарный анг ид рид
56.
В биологических системахреакции декарбоксилирования
протекают с участием
ферментов – декарбоксилаз
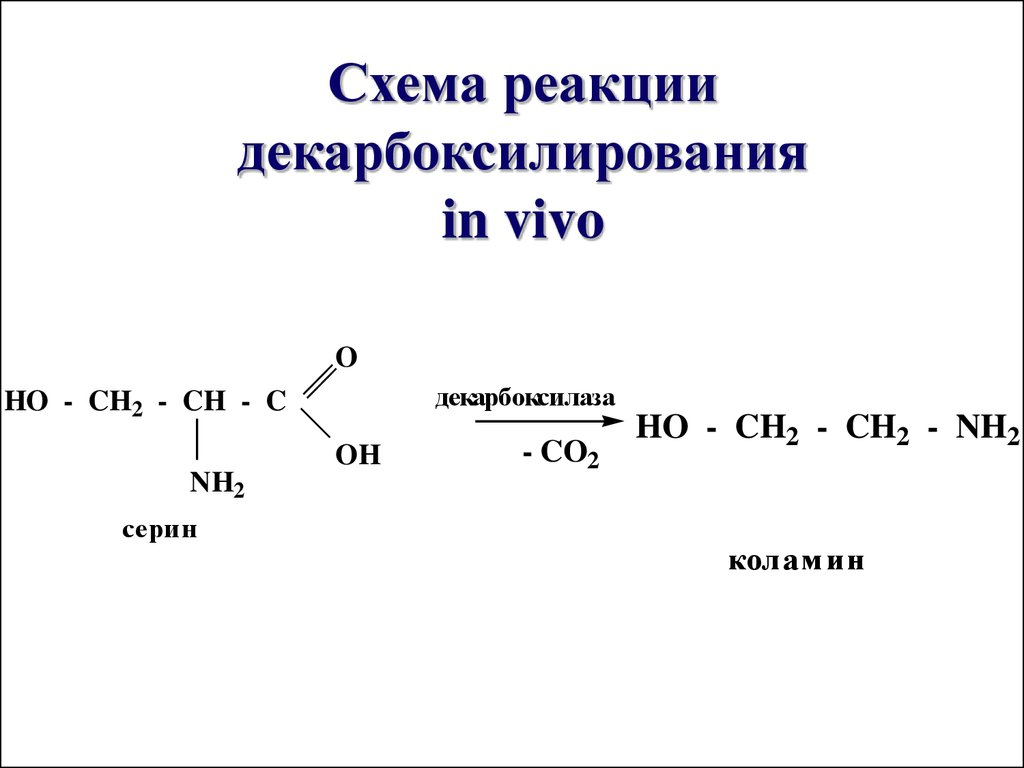
Декарбоксилирование
аминокислот приводит к
образованию биогенных аминов
57. Схема реакции декарбоксилирования in vivo
Схема реакциидекарбоксилирования
in vivo
O
декарбоксилаза
HO - CH2 - CH - C
OH
NH2
серин
- CO2
HO - CH2 - CH2 - NH2
колам ин
58.
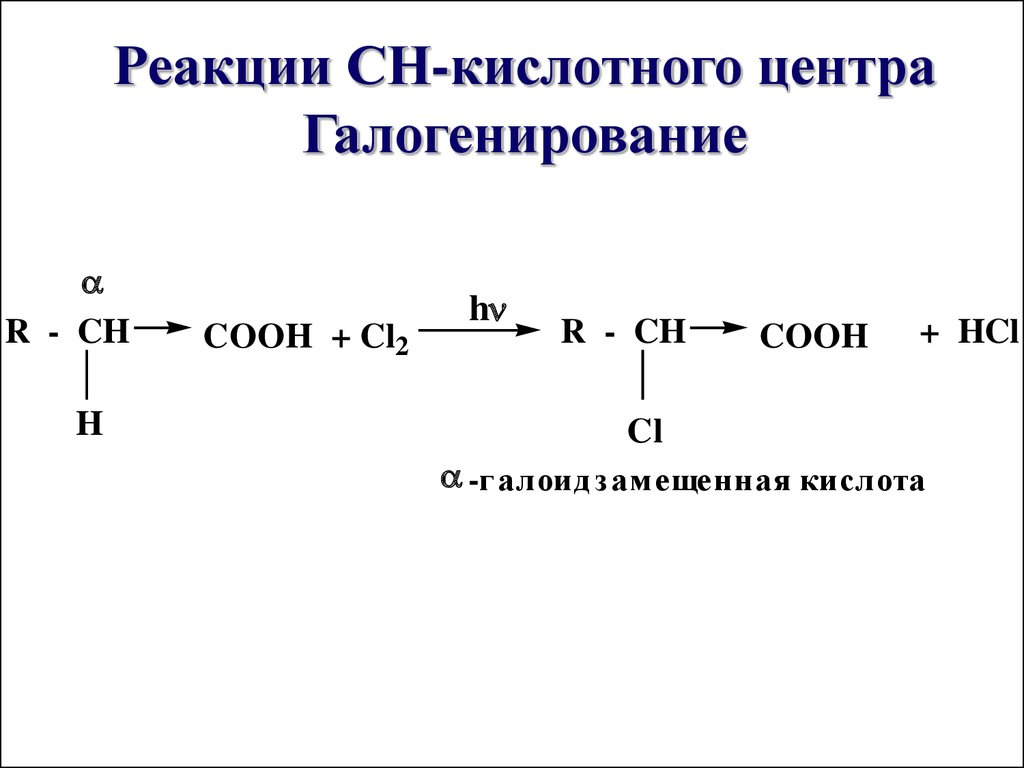
В насыщенныхалифатических кислотах в
результате ЭА-влияния
карбоксильной группы
появляется
СН - кислотный центр у αуглеродного атома
59. Реакции СН-кислотного центра Галогенирование
R - CHH
COOH + Cl2
h
R - CH
COOH
+ HCl
Cl
-г алоид зам ещенная кислота
60.
Спасибоза внимание !































 Химия
Химия