Похожие презентации:
Органические соединения серы
1.
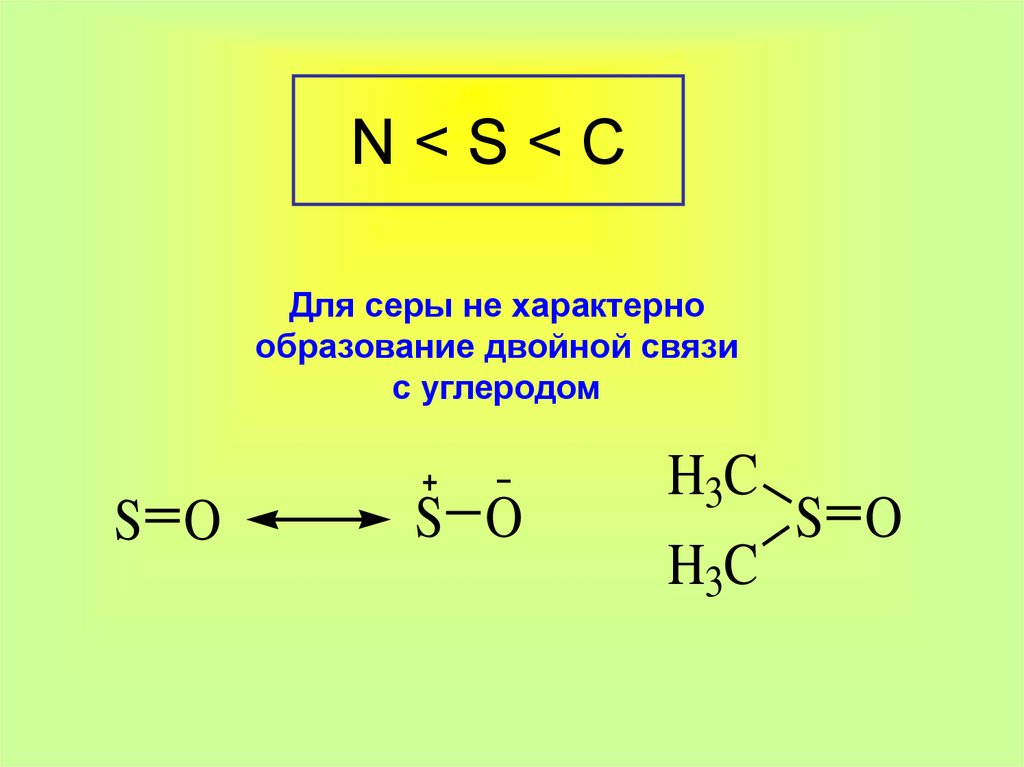
2. N < S < C
N<S<CДля серы не характерно
образование двойной связи
с углеродом
S O
S O
H3C
H3C
S O
3.
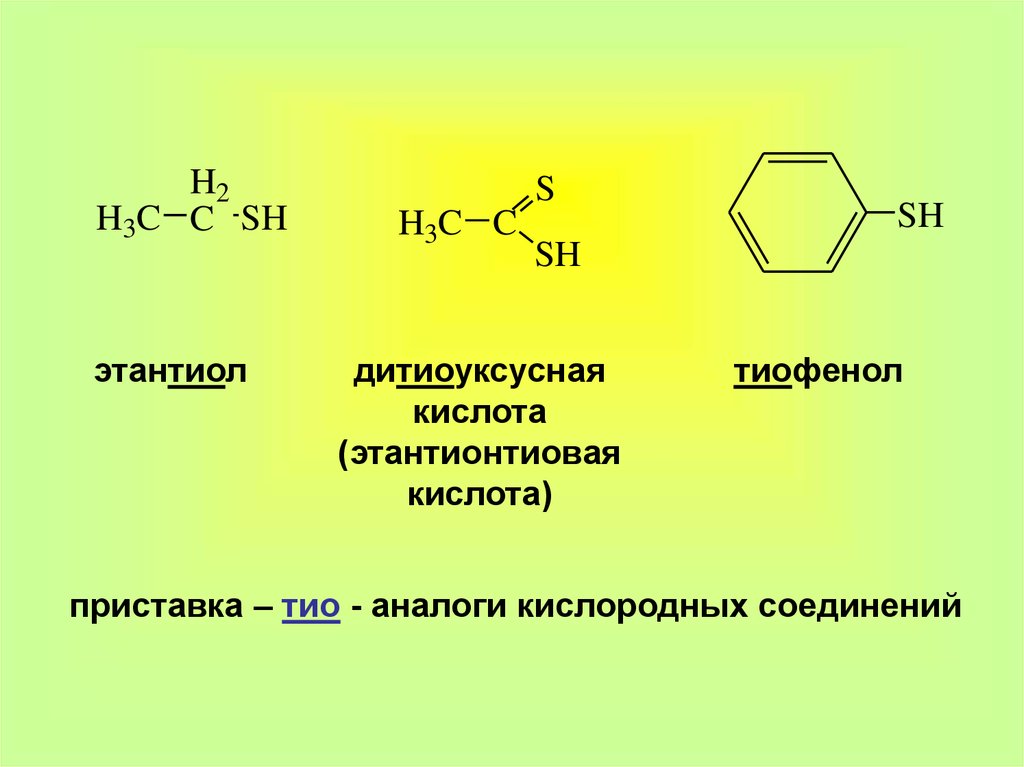
H2H3C C SH
этантиол
S
H3C C
SH
SH
дитиоуксусная
кислота
(этантионтиовая
кислота)
тиофенол
приставка – тио - аналоги кислородных соединений
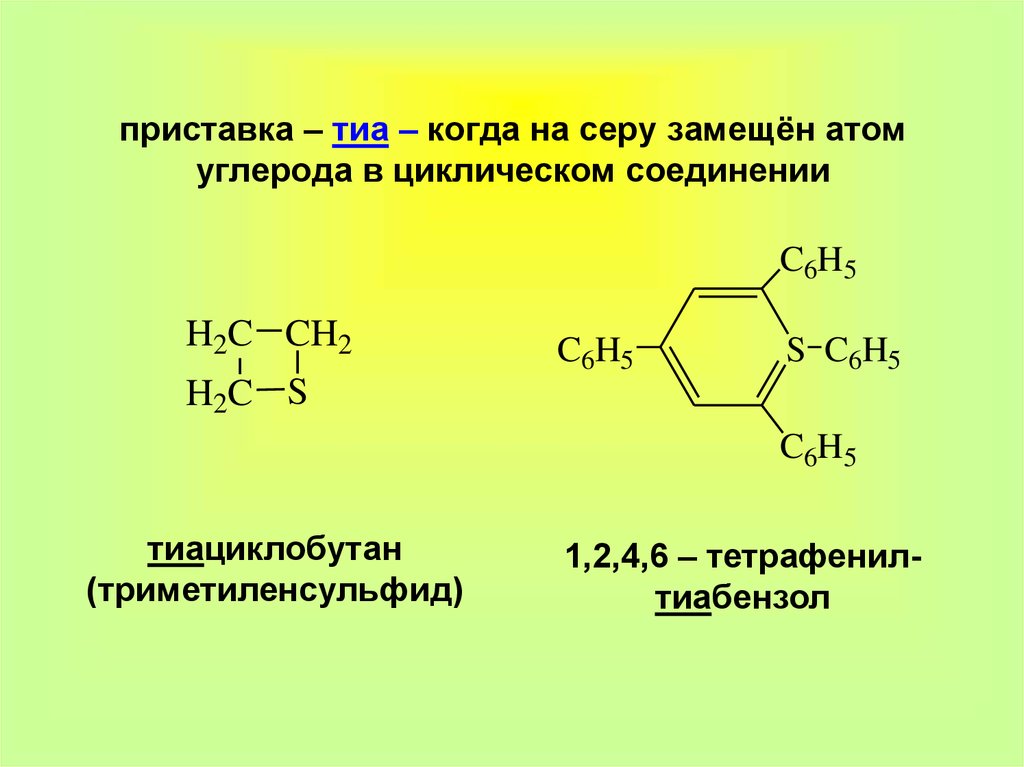
4. приставка – тиа – когда на серу замещён атом углерода в циклическом соединении
C6H5H2C CH2
C 6H5
S C 6H 5
H 2C S
C6H5
тиациклобутан
(триметиленсульфид)
1,2,4,6 – тетрафенилтиабензол
5. Тиолы (тиоспирты, меркаптаны)
RSH – corpus mercurium captans,т.е. тело, любящее ртуть.
Мягкое основание Льюиса
(ЖМКО) →Hg++, Pt++, Pb++, Cu++.
6.
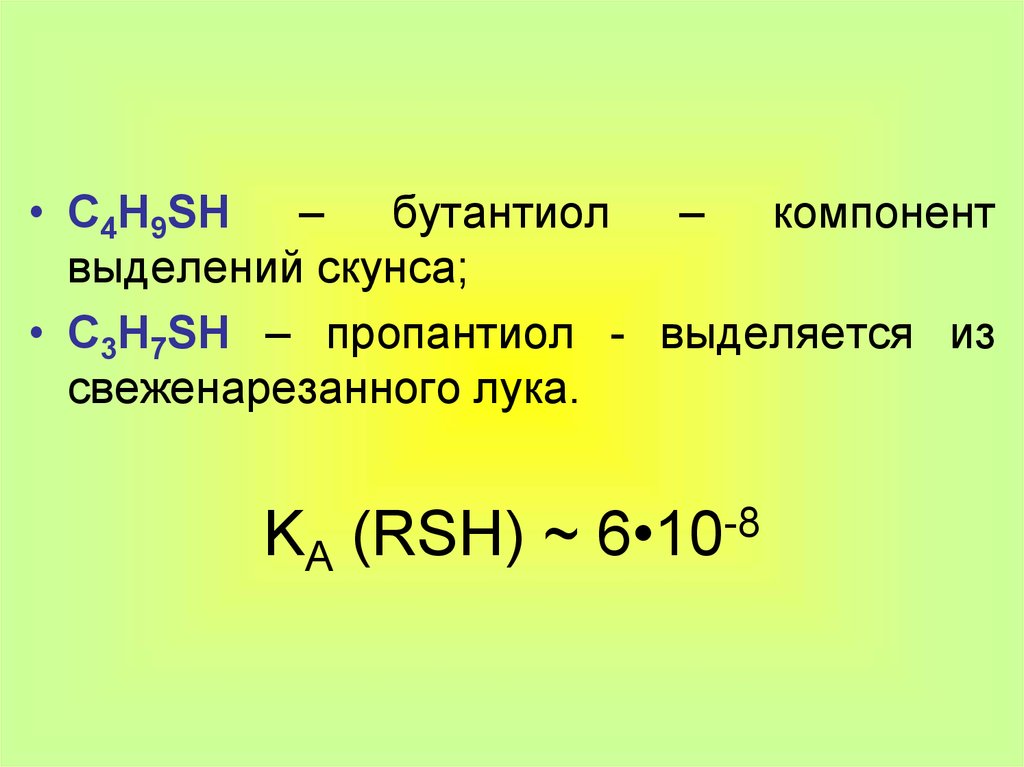
• C4H9SH – бутантиол – компонентвыделений скунса;
• C3H7SH – пропантиол - выделяется из
свеженарезанного лука.
KA (RSH) ~ 6•10-8
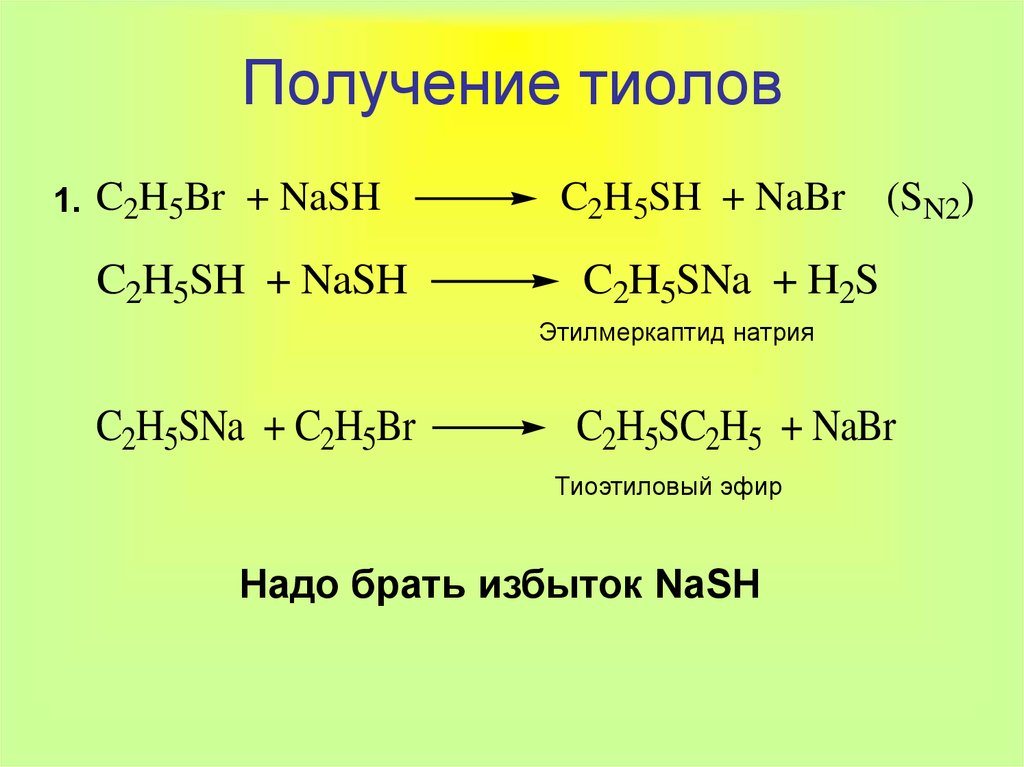
7. Получение тиолов
1. C2H5Br + NaSHC2H5SH + NaSH
C2H5SH + NaBr
(SN2)
C2H5SNa + H2S
Этилмеркаптид натрия
C2H5SNa + C2H5Br
C2H5SC2H5 + NaBr
Тиоэтиловый эфир
Надо брать избыток NaSH
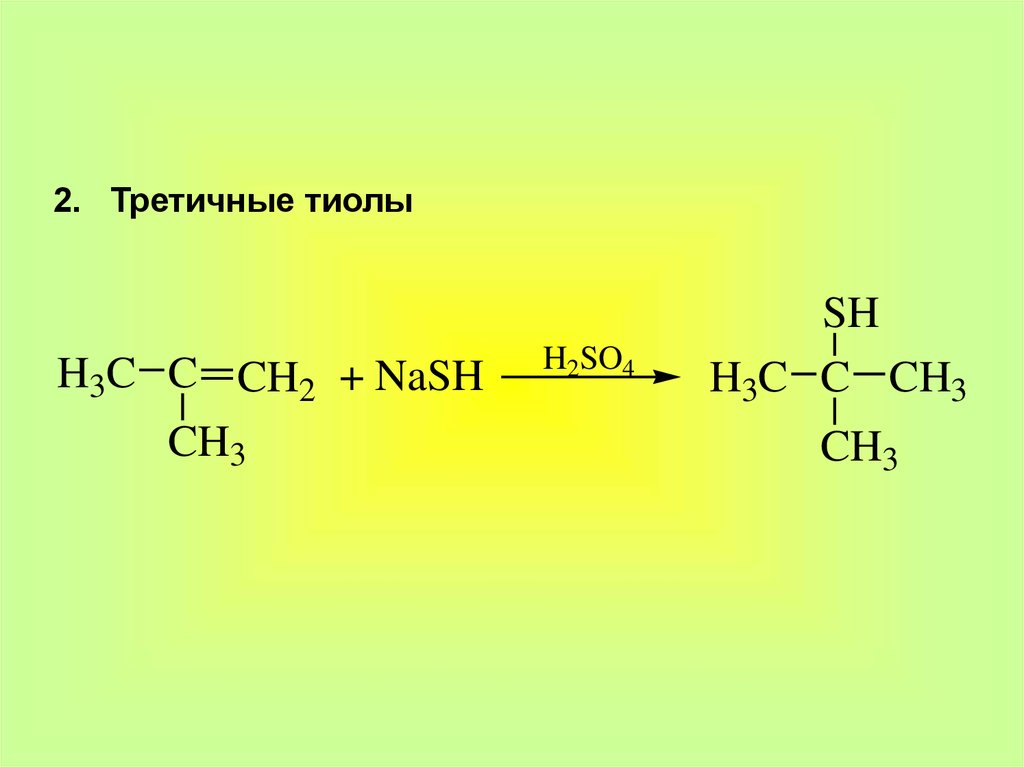
8.
2. Третичные тиолыH3C C CH2 + NaSH
CH3
H2SO4
SH
H3C C CH3
CH3
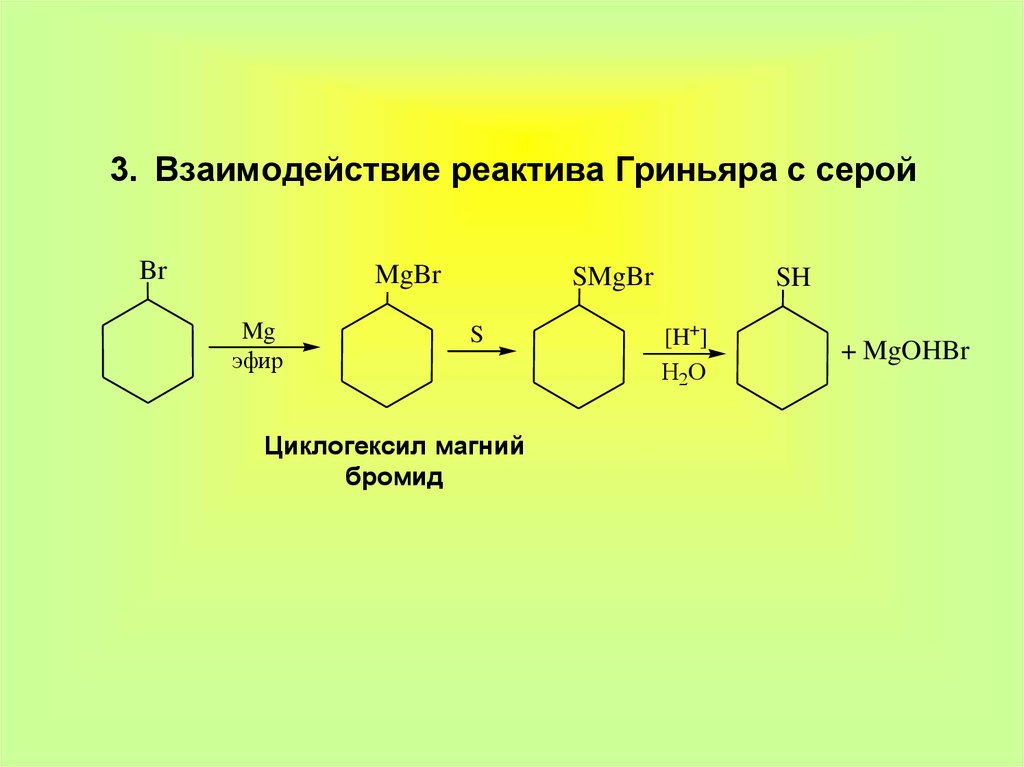
9. 3. Взаимодействие реактива Гриньяра с серой
BrMgBr
Mg
эфир
SMgBr
S
Циклогексил магний
бромид
SH
[H+]
H2O
+ MgOHBr
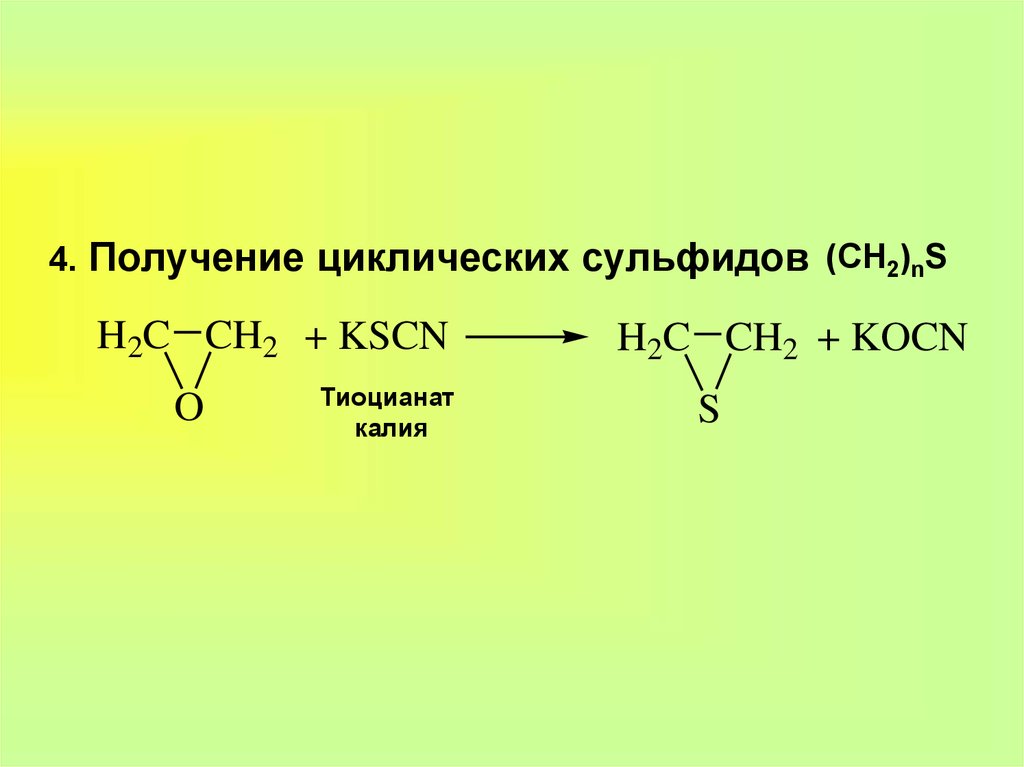
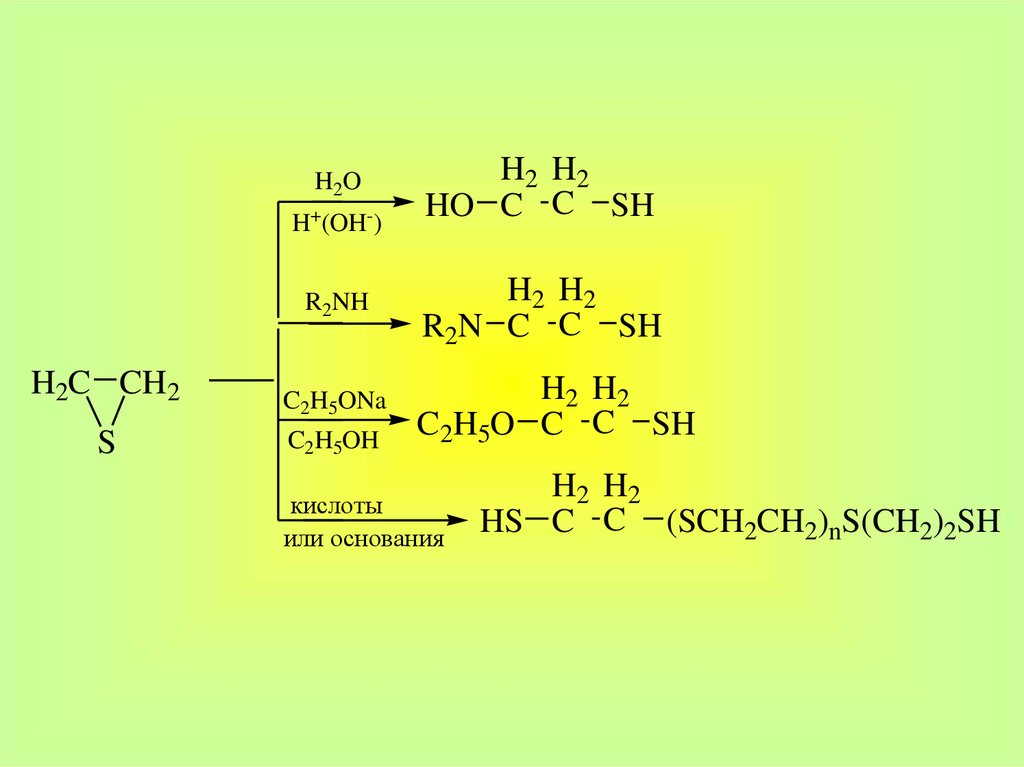
10. 4. Получение циклических сульфидов
(CH2)nSH2C CH2 + KSCN
O
Тиоцианат
калия
H2C CH2 + KOCN
S
11.
H2OH+(OH-)
R2NH
H2C CH2
C2H5ONa
S
C2H5OH
H2 H2
HO C C SH
H2 H2
R2N C C SH
H2 H2
C2H5O C C SH
кислоты
или основания
H2 H2
HS C C (SCH2CH2)nS(CH2)2SH
12. Водородные связи слабее, чем в спиртах:
СпиртыТкип
Тиолы
Ткип
CH3OH
65 0С
CH3SH
7,6 оС
C2H5OH
78,5 оС
C2H5SH
34,7 оС
pKa H2S в воде ~ 7,02
pKa С2Н5SH в воде ~ 10,9
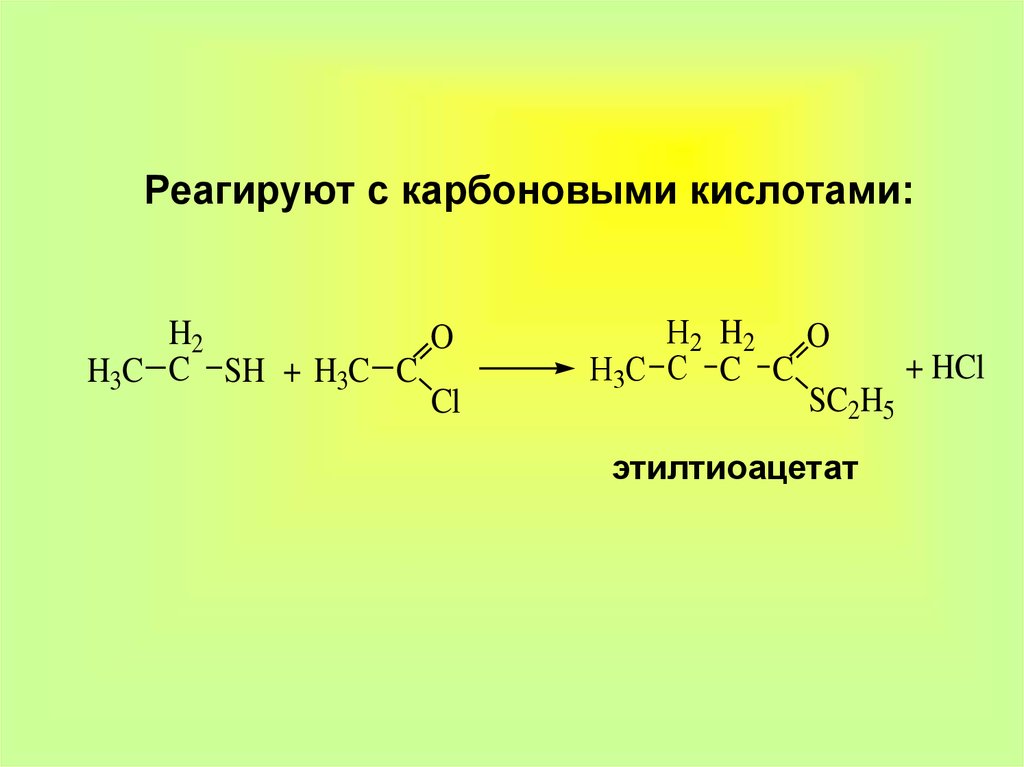
13. Реагируют с карбоновыми кислотами:
H2O
H3C C SH + H3C C
Cl
H2 H2 O
+ HCl
H3C C C C
SC2H5
этилтиоацетат
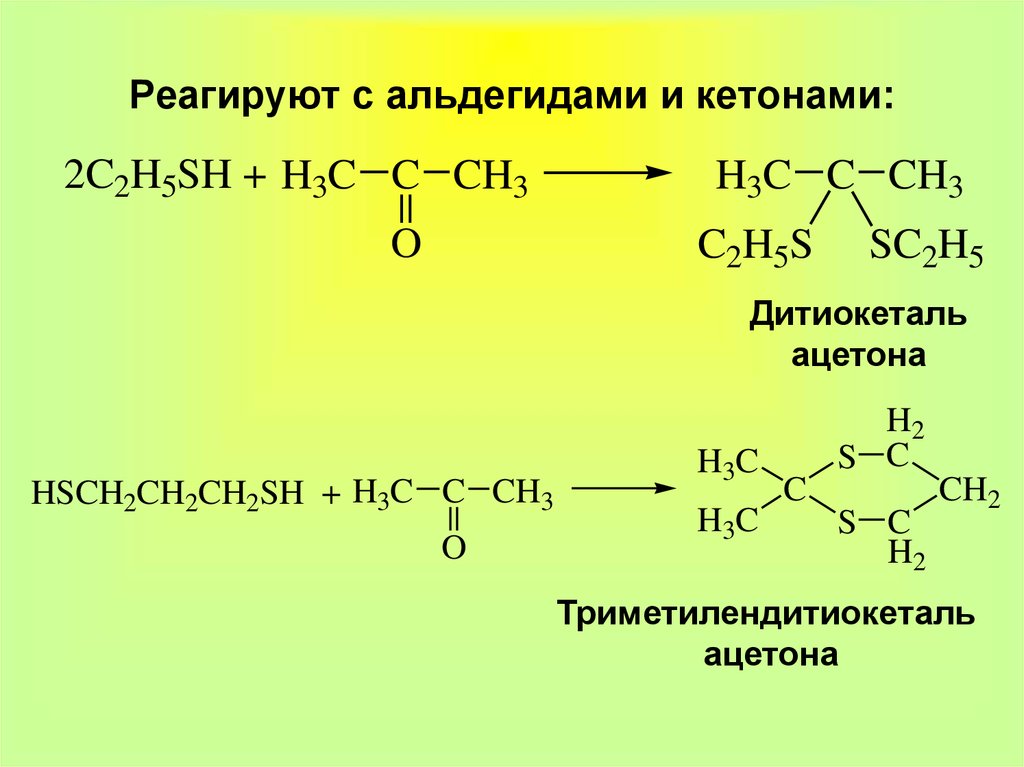
14. Реагируют с альдегидами и кетонами:
2C2H5SH + H3C C CH3O
H3C C CH3
C2H5S
SC2H5
Дитиокеталь
ацетона
HSCH2CH2CH2SH + H3C C CH3
O
H3C
H3C
H2
S C
C
S C
H2
CH2
Триметилендитиокеталь
ацетона
15. Реагируют с тяжелыми металлами Нерастворимые соли (меркаптиды) (RS)2Hg – меркаптид ртути
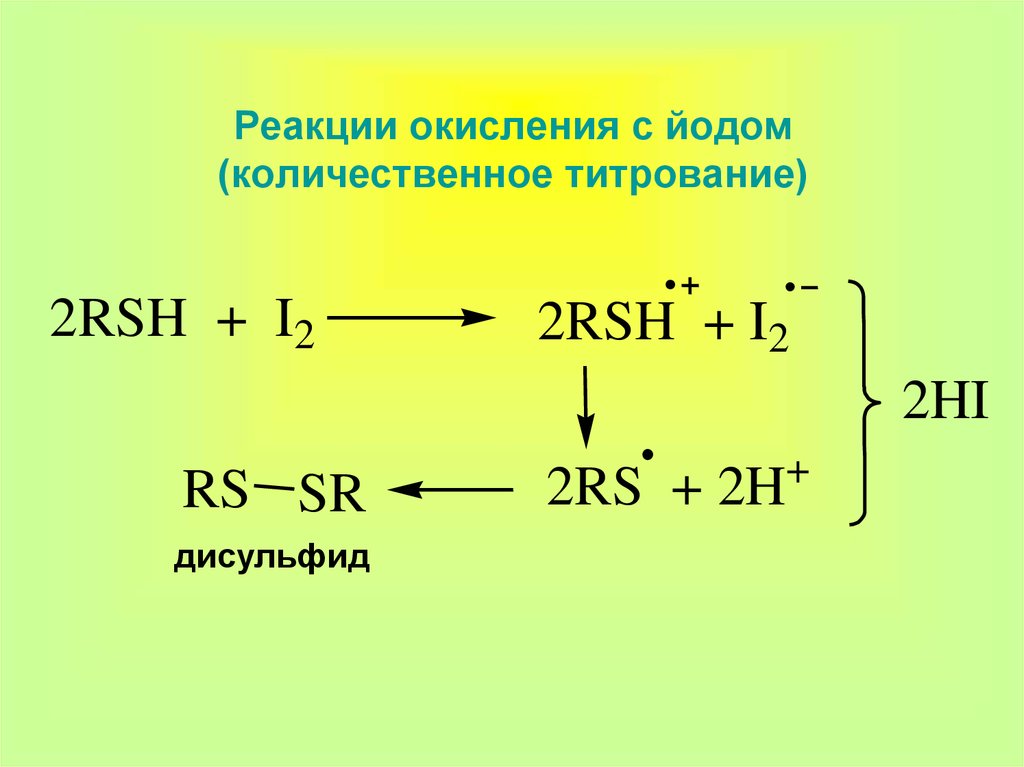
16. Реакции окисления с йодом (количественное титрование)
2RSH + I22RSH + I2
2HI
RS SR
дисульфид
2RS + 2H
+
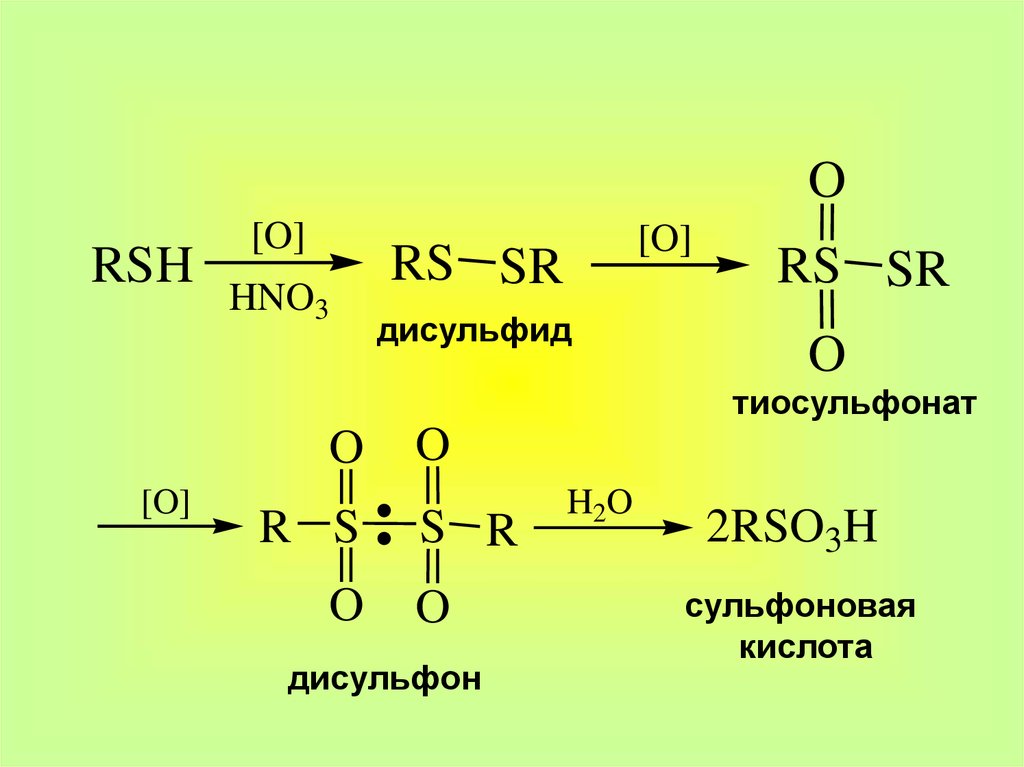
17.
ORSH
[O]
HNO3
[O]
RS SR
дисульфид
RS SR
O
тиосульфонат
O
[O]
R S
O
O
S R
O
дисульфон
H2 O
2RSO3H
сульфоновая
кислота
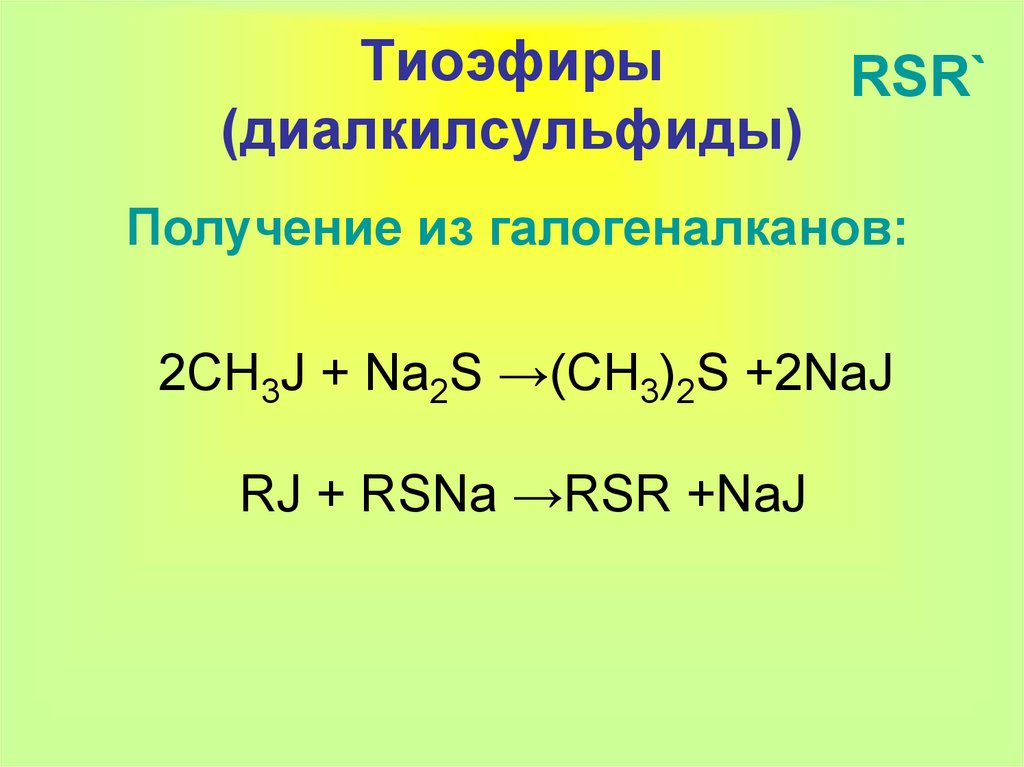
18. Тиоэфиры (диалкилсульфиды)
ТиоэфирыRSR`
(диалкилсульфиды)
Получение из галогеналканов:
2CH3J + Na2S →(CH3)2S +2NaJ
RJ + RSNa →RSR +NaJ
19.
• По реакции присоединения меркаптанов колефинам в присутствии радикальных
инициаторов или наличии акцепторных
заместителей в алкене:
CH3SH + H 2C
CHCH 2CN
укс. ангидрид
hv, 24ч
H2
H3C S C CH2CH 2CN
4-(метилтио)бутиронитрил
20.
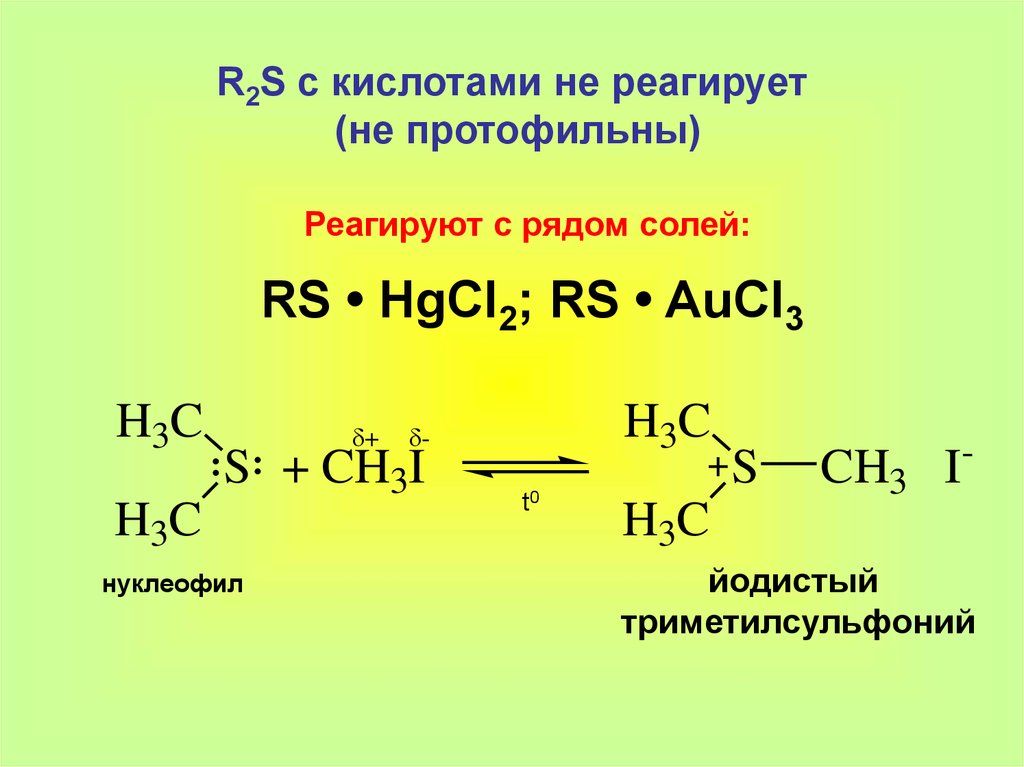
R2S с кислотами не реагирует(не протофильны)
Реагируют с рядом солей:
RS • HgCl2; RS • AuCl3
H3C
δ+
S + CH3I
H3C
нуклеофил
H3C
δt0
S
CH3 I-
H3C
йодистый
триметилсульфоний
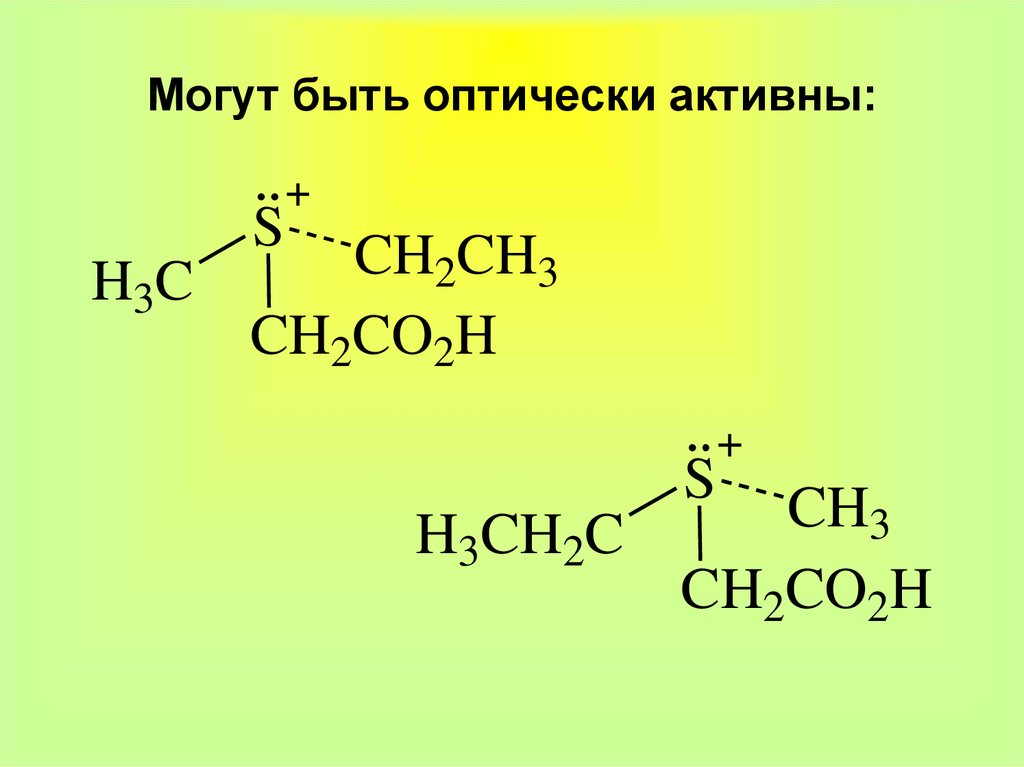
21. Могут быть оптически активны:
SCH
CH
2
3
H3C
CH2CO2H
S
CH
3
H3CH2C
CH2CO2H
22.
Температура кипения(CH3)2O
-24 0С
(CH3)2S
38 оС
(C2H5)2O
35 оС
(C2H5)2S
92 оС
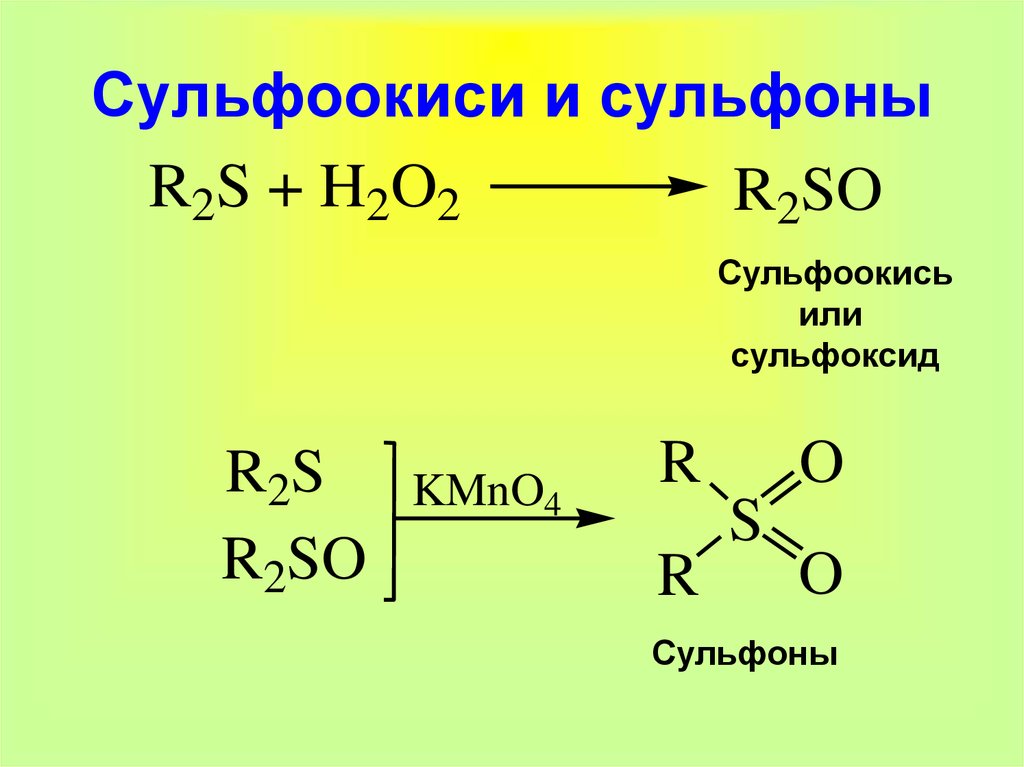
23. Сульфоокиси и сульфоны
R2S + H2O2R2SO
Сульфоокись
или
сульфоксид
R2S
R2SO
KMnO4
R
R
O
S
O
Сульфоны
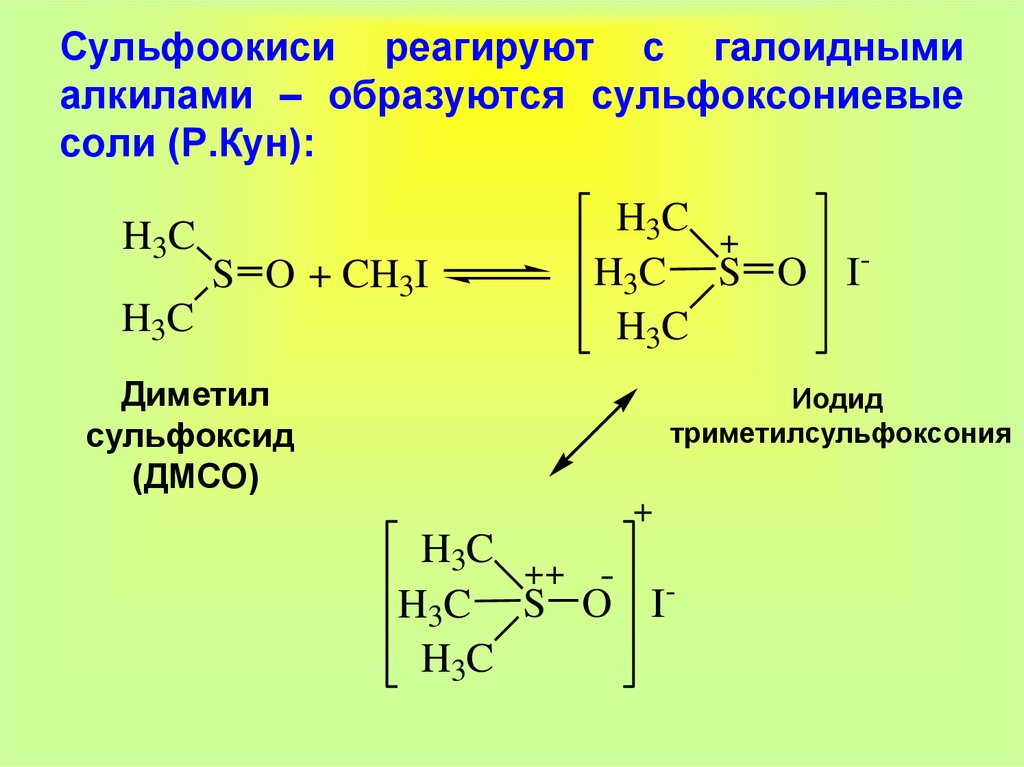
24. Сульфоокиси реагируют с галоидными алкилами – образуются сульфоксониевые соли (Р.Кун):
H3CS O + CH3I
H3C
Диметил
сульфоксид
(ДМСО)
H3C
H3C S O IH3C
Иодид
триметилсульфоксония
H3C
H3C S O IH3C
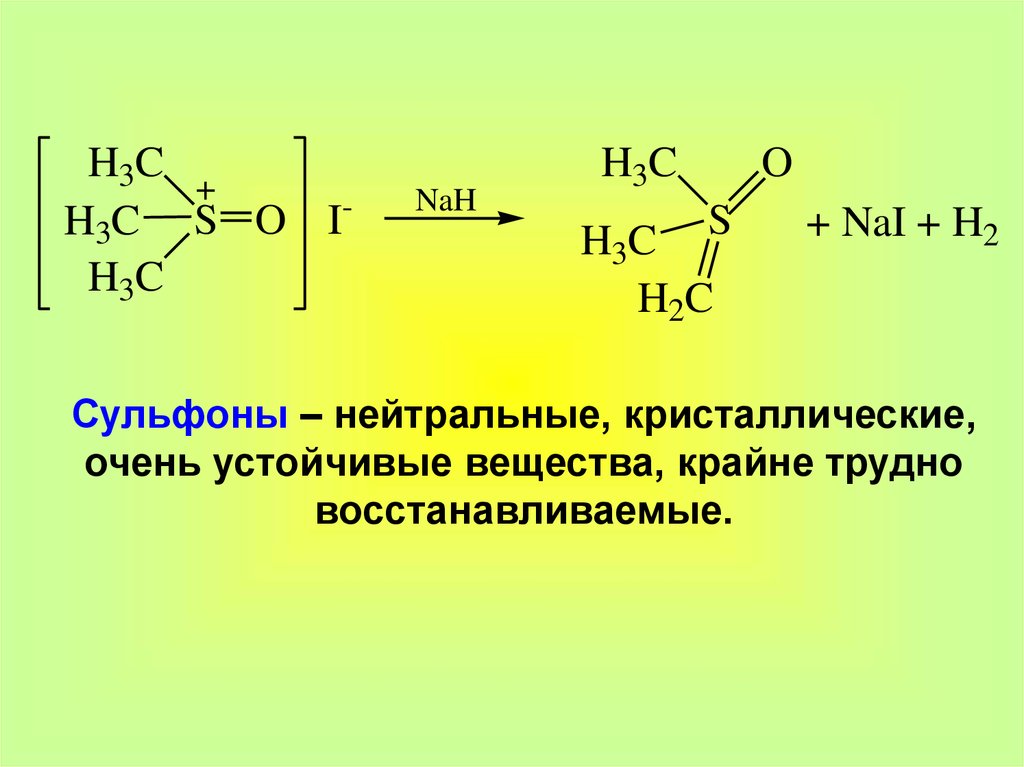
25.
H3CH3C S O IH3C
NaH
H3C
H3C S
H2C
O
+ NaI + H2
Сульфоны – нейтральные, кристаллические,
очень устойчивые вещества, крайне трудно
восстанавливаемые.
26.
В сульфоксидах и особенно в сульфонахα-водородные атомы по отношению к сере подвижны!
C6H5CO2C2H5 + CH3SO2C6H5
C2H5ONa
-C2H5OH
C6H5COCH2SO2C6H5
(конденсация Кляйзена)
27.
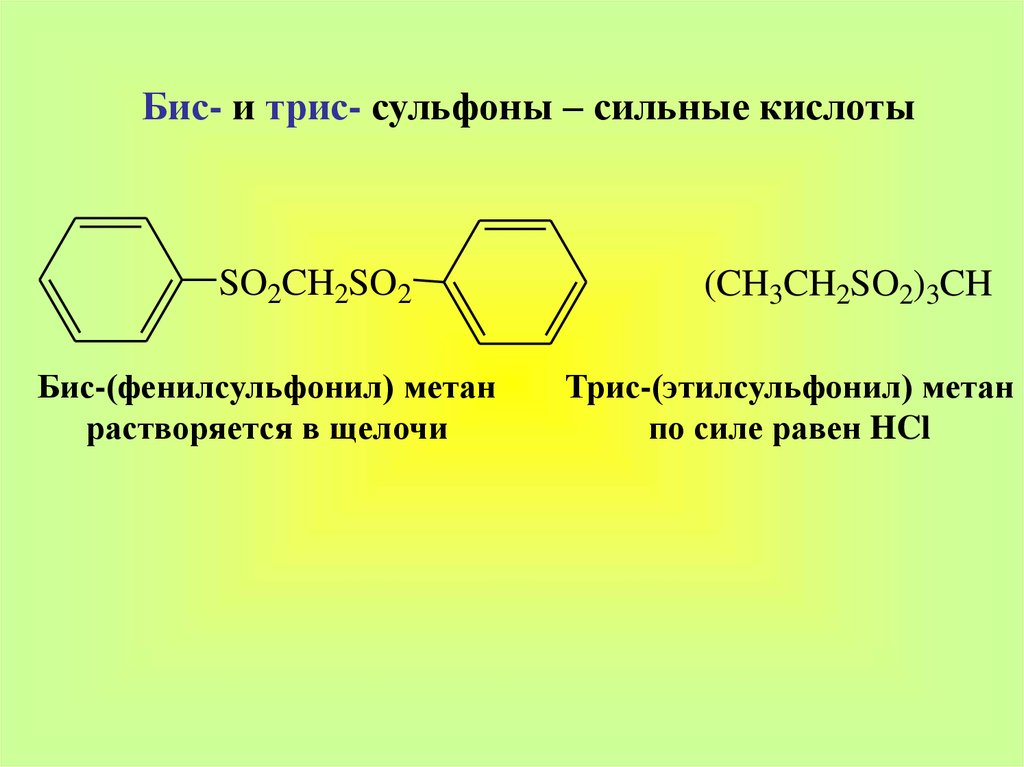
Бис- и трис- сульфоны – сильные кислотыSO2CH2SO2
Бис-(фенилсульфонил) метан
растворяется в щелочи
(CH3CH2SO2)3CH
Трис-(этилсульфонил) метан
по силе равен HCl
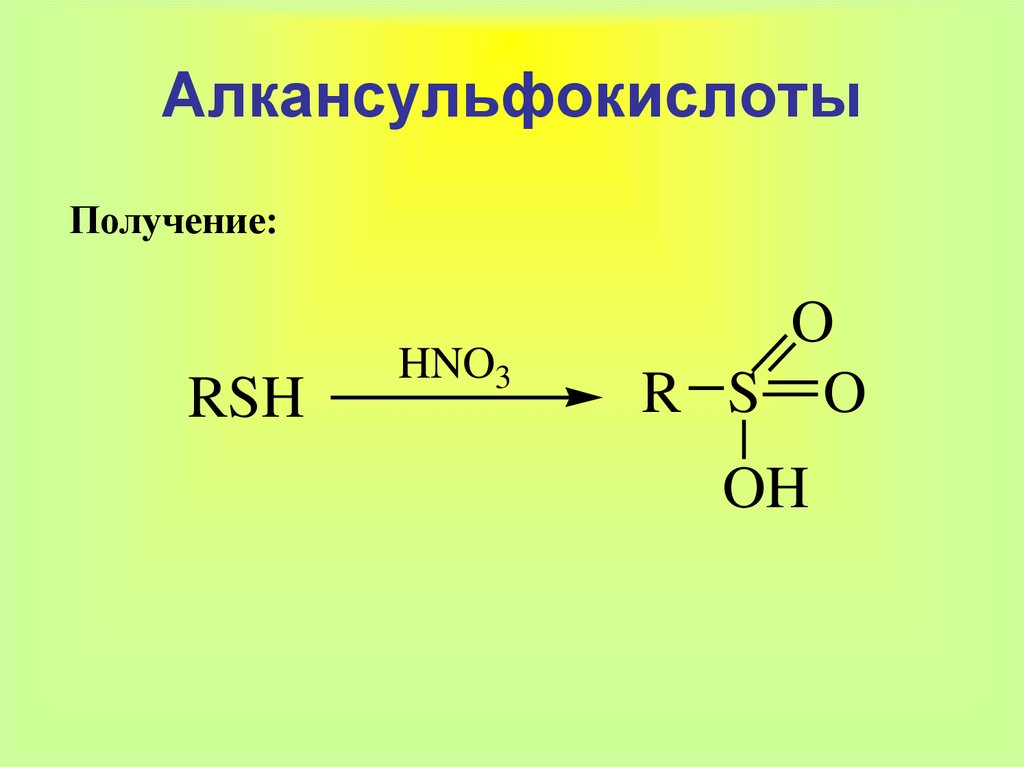
28. Алкансульфокислоты
Получение:RSH
HNO3
O
R S O
OH
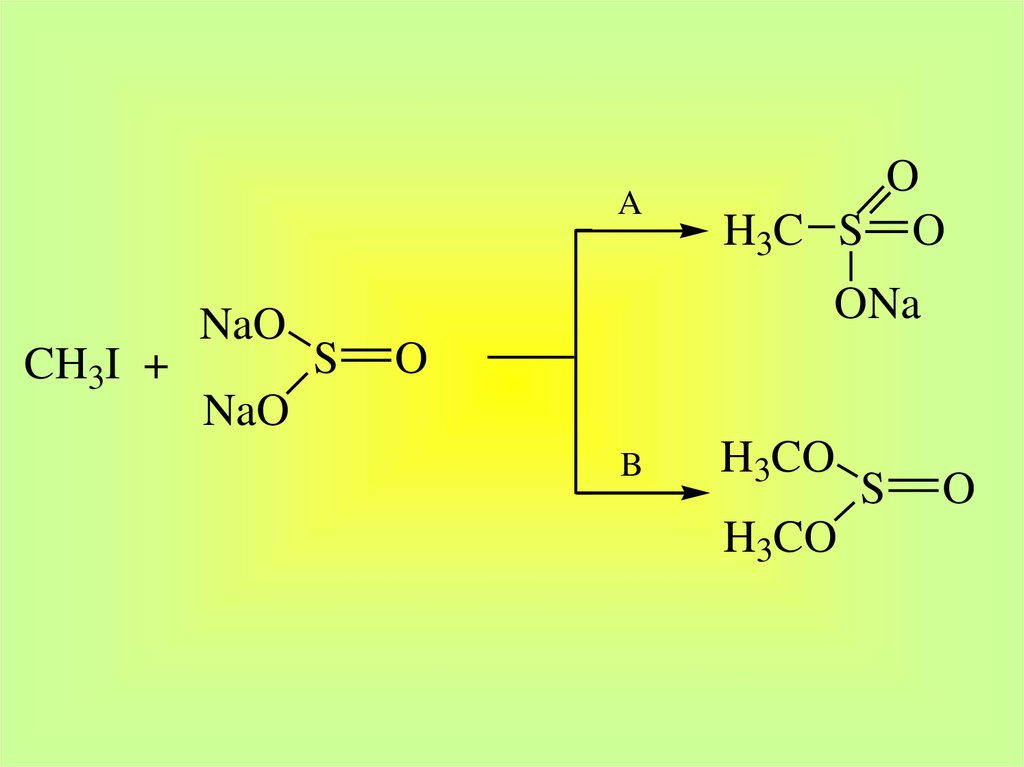
29.
ACH3I +
NaO
O
H3C S O
ONa
S
O
NaO
B
H3CO
H3CO
S
O
30.
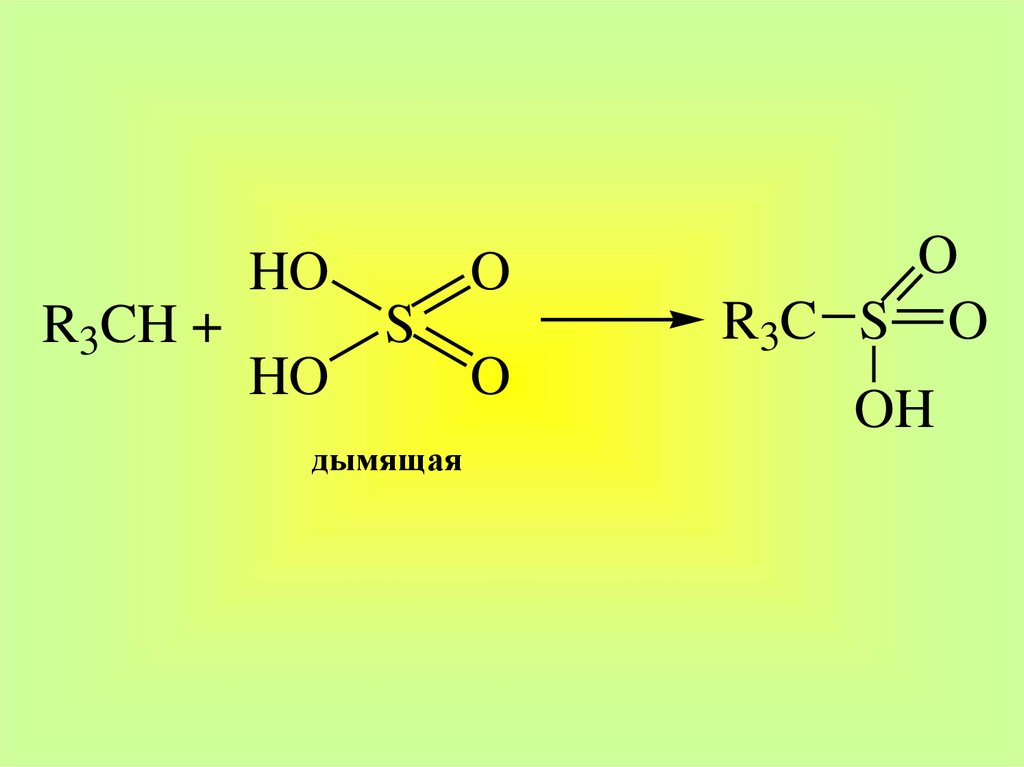
HOR3CH +
O
S
HO
дымящая
O
O
R3C S O
OH
31.
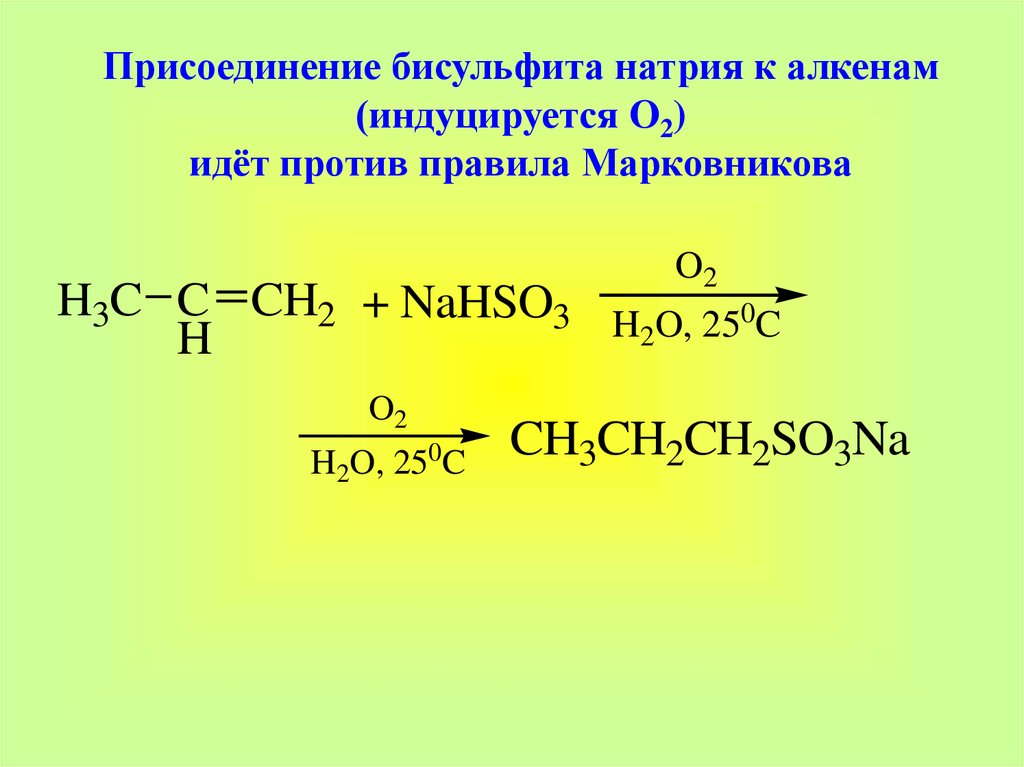
Присоединение бисульфита натрия к алкенам(индуцируется O2)
идёт против правила Марковникова
H3C C CH2 + NaHSO3
H
O2
0
H2O, 25 C
O2
H2O, 250C
CH3CH2CH2SO3Na
32. hν
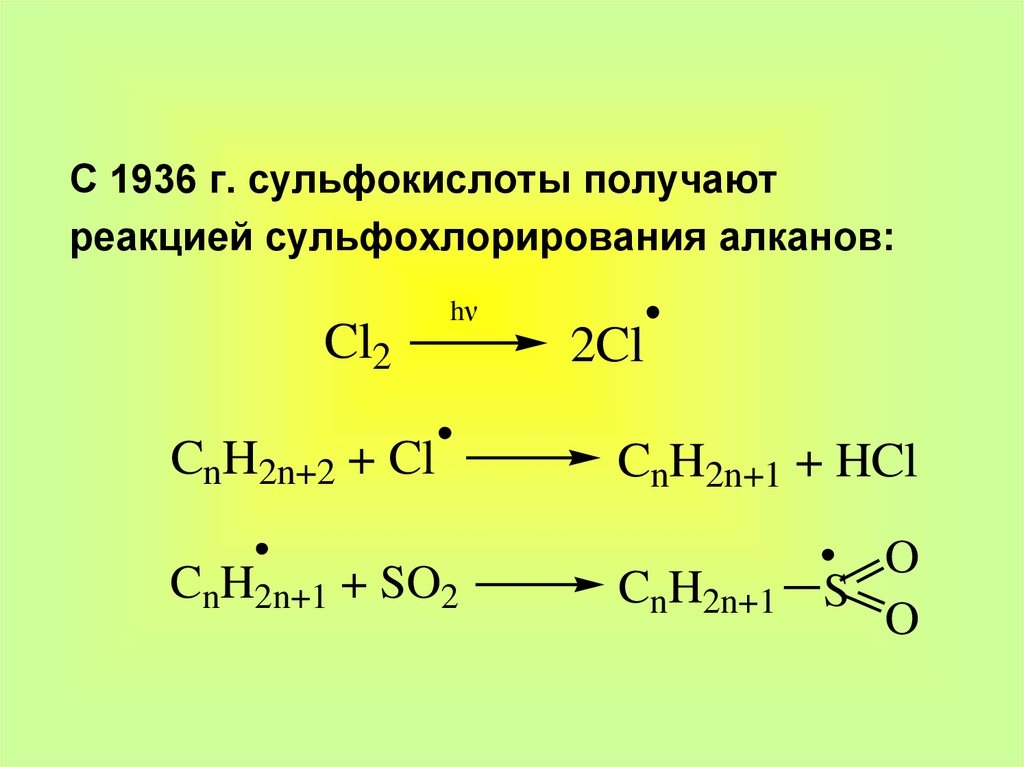
С 1936 г. сульфокислоты получаютреакцией сульфохлорирования алканов:
Cl2
hν
CnH2n+2 + Cl
CnH2n+1 + SO2
2Cl
CnH2n+1 + HCl
CnH2n+1
O
S
O
33.
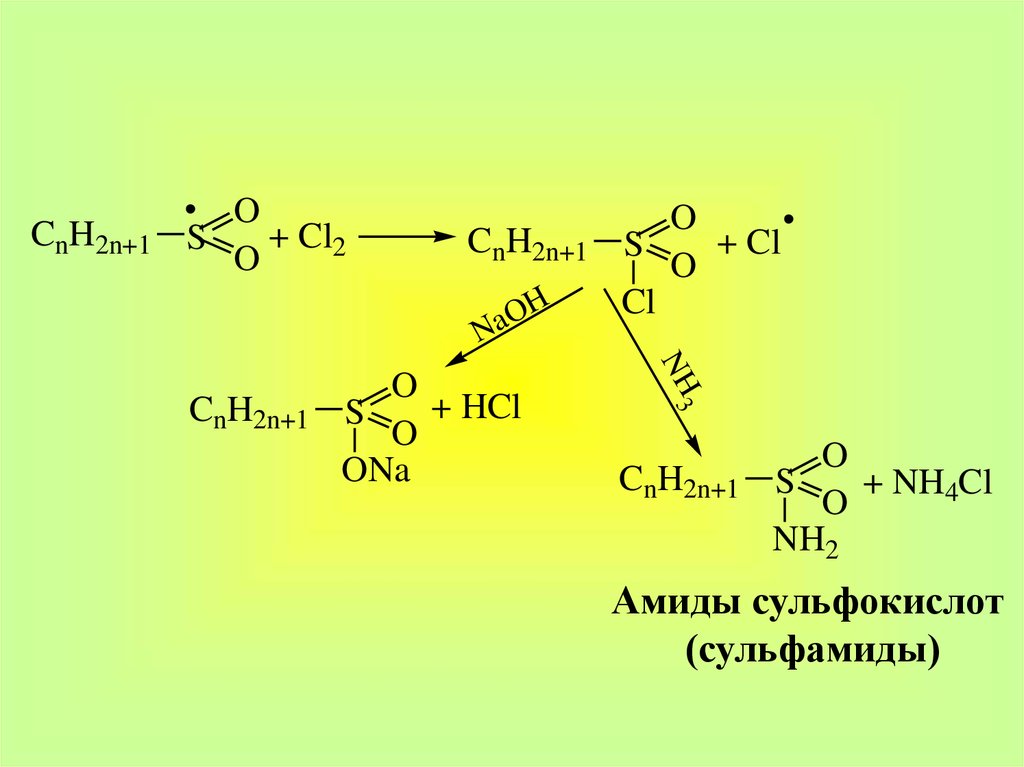
CnH2n+1O
+ Cl2
S
O
CnH2n+1
OH
a
N
NH 3
CnH2n+1
O
+ HCl
S
O
ONa
O
+ Cl
S
O
Cl
CnH2n+1
O
S
+ NH4Cl
O
NH2
Амиды сульфокислот
(сульфамиды)
34. Сернистые производные угольной кислоты
CS2 - сероуглерод бесцветнаяжидкость с приятным запахом
>300 oС - разлагается
Очень огнеопасен и токсичен
35. Растворяет S, P, I2
C + 2S750-10000C
CS2 + 3Cl2
CS2 + 2S2Cl2
CS2
2CuO
CS2
CCl4 + S2Cl2
CCl4 + 6S
CO2 + 2CuS
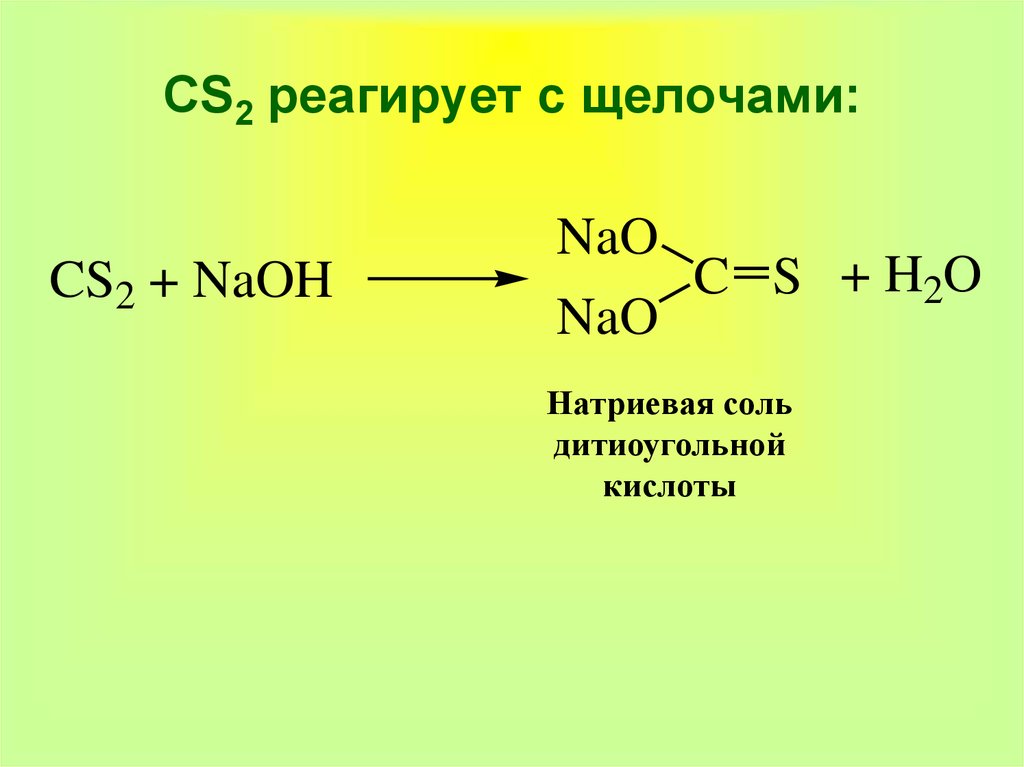
36. CS2 реагирует с щелочами:
CS2 + NaOHNaO
NaO
C S + H2O
Натриевая соль
дитиоугольной
кислоты
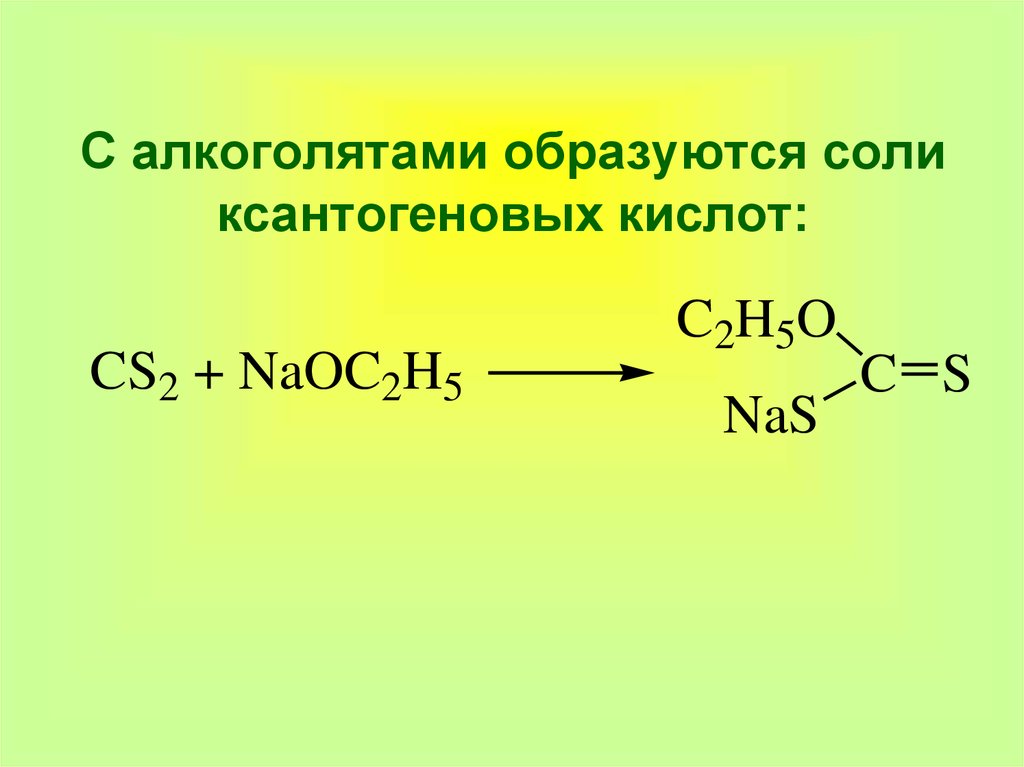
37. С алкоголятами образуются соли ксантогеновых кислот:
CS2 + NaOC2H5C2H5O
NaS
C S
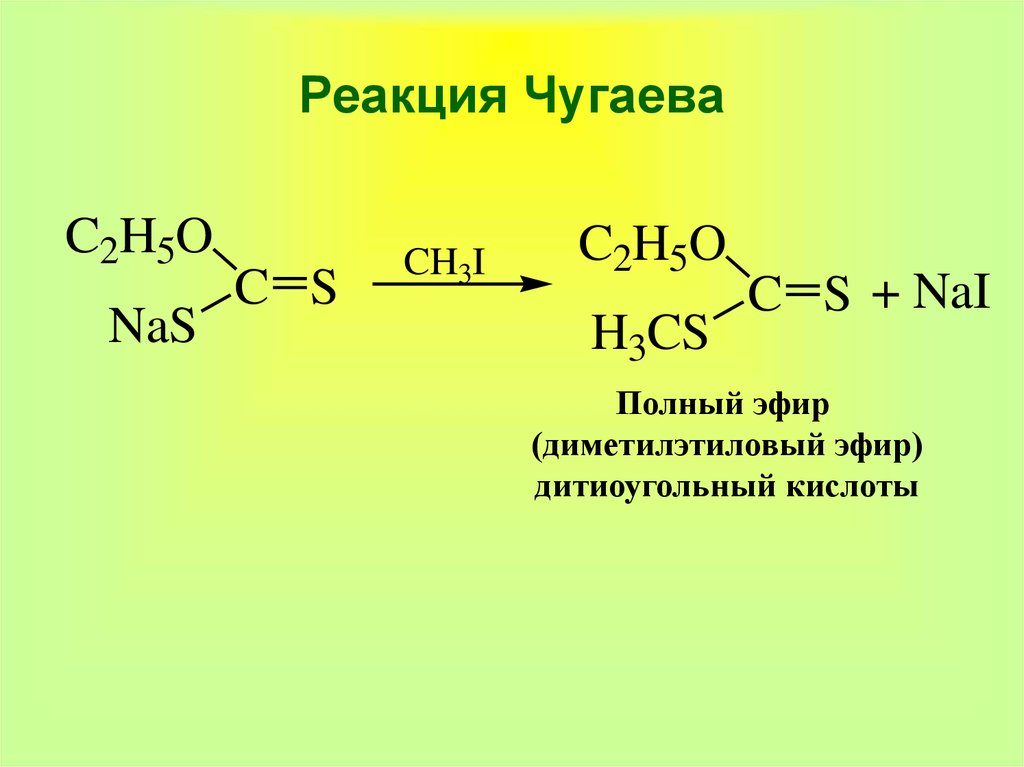
38. Реакция Чугаева
C2H5ONaS
C S
CH3I
C2H5O
H3CS
C S + NaI
Полный эфир
(диметилэтиловый эфир)
дитиоугольный кислоты
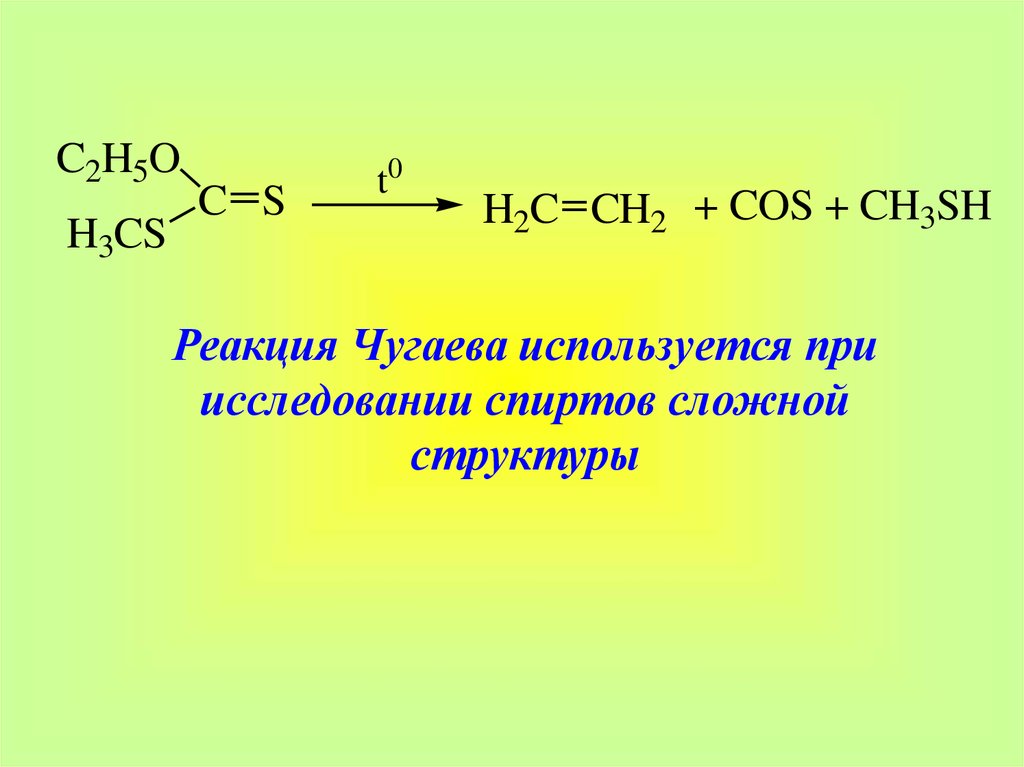
39.
C2H5OH3CS
C S
t0
H2C CH2 + COS + CH3SH
Реакция Чугаева используется при
исследовании спиртов сложной
структуры









 Химия
Химия








