Похожие презентации:
Химическая термодинамика и кинетика. Химическое равновесие
1.
Кафедра химииТема лекции:
Химическая термодинамика и кинетика.
Химическое равновесие
1
2.
ХимическаяХимическая термодинамика
термодинамика
Термодинамика – наука об энергетике процессов.
Термодинамической
системой
называется
объект
природы, состоящий из большого числа молекул и
отделенный от других объектов природы реальной или
воображаемой границей раздела.
Если система обменивается с окружающей средой
массой и теплом, она называется открытой.
Если система обменивается с окружающей средой
энергией (но не массой!), она называется закрытой.
При отсутствии массо- и теплообмена
с внешней средой говорят об
изолированной системе ( m = 0, U = 0).
2
3.
Первый закон термодинамикиЕсли
Если отсутствует
отсутствует теплообмен
теплообмен системы
системы сс
внешней
внешней средой,
средой, запас
запас ее
ее внутренней
внутренней энергии
энергии
остается
остается постоянным
постоянным..
Сообщенная системе теплота Q расходуется на
росто внутренней энергии U и на совершение
работы против внешних сил А
Q = U + A
3
4.
Введем новую функцию состояния:H = U + pV,
которая больше внутренней энергии на
величину работы расширения.
Эта функция состояния (H) называется
энтальпией.
энтальпией При постоянном давлении
теплота, подводимая к системе, идет на
увеличение ее энтальпии.
Q
Qpp == H
H22 -- H
H11 == H
H
Энтальпия эквивалентна внутренней энергии
системы при постоянном давлении.
4
5.
Если в результате реакции теплотавыделяется, т.е. энтальпия системы
понижается ( H<0),
реакция называется экзотермической.
Если повышается ( H>0) – эндотермической.
H
H
исходные
продукты
H > 0
H < 0
продукты
координата реакции
исходные
координата реакции
5
6.
Второй законтермодинамики
Льюис
Любая
Любаясистема,
система,предоставленная
предоставленнаясама
самасебе,
себе,ввсреднем
среднембудет
будет
изменяться
изменятьсяввнаправлении
направлениисостояния,
состояния,отвечающего
отвечающего
максимальной
максимальнойвероятности
вероятности
S
S == kk lnW
lnW
энтропия
6
7.
Энтропия ( S) – функция, приращениекоторой равно теплоте Q, подведенной к
системе в обратимом изотермическом
процессе, деленной на температуру Т, при
которой осуществляется процесс:
SS == Q/Т
Q/Т
Другая формулировка второго начала термодинамики
ВВлюбом
любомнеобратимом
необратимомпроцессе
процессеполная
полнаяэнтропия
энтропиявсех
всех
рассматриваемых
рассматриваемыхтел
телвозрастает
возрастает
S > 0
7
8.
Если в процессе степень беспорядка неизменяется ( S = 0), то направление процесса
определяется изменением энтальпии, и процесс
проходит самопроизвольно в направлении
уменьшения энтальпии.
Если в процессе не происходит энергетических
изменений ( Н = 0), то фактором, определяющим
направление реакции, является энтропия и процесс
пойдет самопроизвольно в направлении, при
котором степень беспорядка возрастает, т.е. в
сторону увеличения энтропии.
Энтропия
Энтропия––мера
мераупорядоченности
упорядоченностипроцесса
процесса
8
9.
Свободная энергияГиббса
Дж. Гиббс
(1839-1903)
ВАЖНО!
В качестве критерия
самопроизвольности процессов
целесообразно ввести новую
функцию состояния,
которая учитывает влияние
обоих факторов.
G = H - T S
Свободная энергия Гиббса (G)
Как
Какиидля
длядругих
другихфункций
функцийсостояния,
состояния,для
длясвободной
свободной
энергии
энергииважно
важноне
неабсолютное
абсолютноезначение
значениефункции,
функции,ааее
ее
изменение
изменениеввходе
ходепроцесса.
процесса.
9
10.
Второе начало термодинамики(определение Гиббса)
ВВ
изотермических
условиях
вв
системе
изотермических
условиях
системе
самопроизвольно
самопроизвольно могут
могут осуществляться
осуществляться только
только
такие
такие процессы,
процессы, вв результате
результате которых
которых свободная
свободная
энергия
энергиясистемы
системыуменьшается
уменьшается ( G 0).
( G 0).
ВВ состоянии
состоянии равновесия
равновесия свободная
свободная энергия
энергия
системы
системыне
неменяется
меняется(G
(G== const,
const, G
G== 0).
0).
Свободная энергия Гиббса –
мера самопроизвольности процесса
10
11. Факторы, определяющие ход процесса
G = H - T SН
S
-
+
Возможность самопроизвольного
процесса
Возможен при любой температуре
-
-
Возможен при низких температурах
+
+
Возможен при высоких температурах
+
-
Процесс невозможен
11
12.
ХимическаяХимическая кинетика
кинетика
Кинетика – наука о механизмах и скоростях
химических реакций
сс22 сс11
cc
VVсрср
tt11 tt22
tt
dc
dc
V
V
dt
dt
aA + bB + cC + …
Закон действующих масс
dd[[A
]]
A
V
V
kk [[A
A]] [[B
B]] [[C
C]] ...
...
dt
dt
12
13.
Константа скорости реакцииравна скорости реакции при
концентрациях веществ,
равных 1 моль/л.
Н.Н. Бекетов
(1826-1911)
Показатели , , частные порядки реакций
n = + + - общий порядок реакций
+ + a+b+c
13
14.
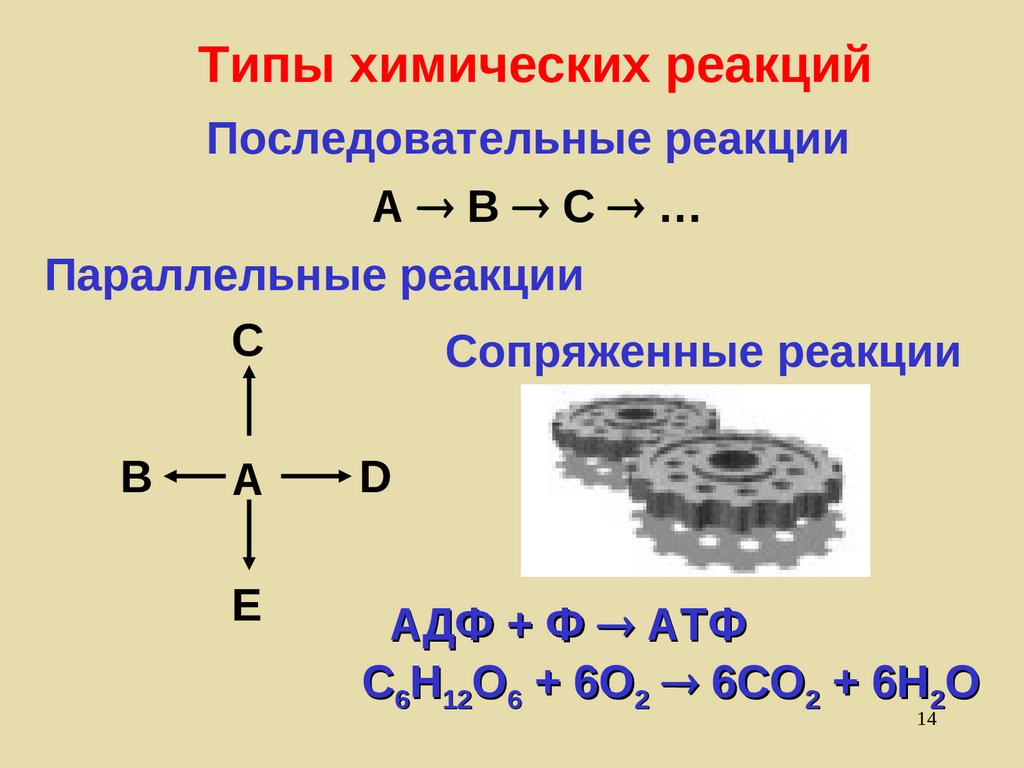
Типы химических реакцийПоследовательные реакции
А B C …
Параллельные реакции
C
Сопряженные реакции
B
A
D
E
АДФ + Ф АТФ
C6H12O6 + 6O2 6CO2 + 6H2O
14
15.
Уравнение Вант-Гоффаtt22 tt11
10
10
V
Vtt22
V
Vtt11
=2
T = 10
Vt 2 Vt1 2
– температурный коэффициент (2 - 4)
При увеличении температуры на 100
скорость реакции возрастает вдвое
Для биореакций может не выполняться!
15
16.
Эффективные соударения16
17.
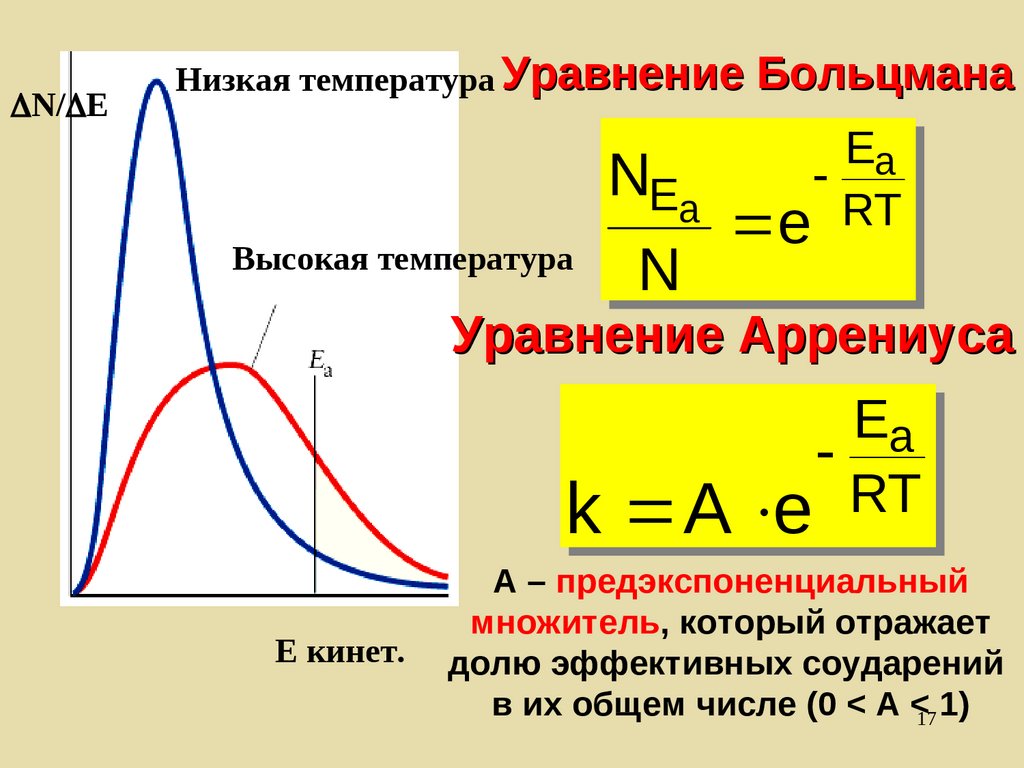
N/ EНизкая температура Уравнение
Высокая температура
Больцмана
EEaa
N
NEEaa
RT
e RT
N
N
e
Уравнение Аррениуса
E
E
aa
RT
A e RT
kk A e
Е кинет.
А – предэкспоненциальный
множитель, который отражает
долю эффективных соударений
в их общем числе (0 < A <17 1)
18.
ЕПереходное
состояние
Исходные
вещества
+
Eакт
E’акт Продукты
+
Ho
Координата реакции
18
19.
H2O2 H2O + OКатализ
Еа, кДж/моль
Относительная
скорость
-
75
1
MnO2
48
2.104
каталаза
23
3.1011
19
20.
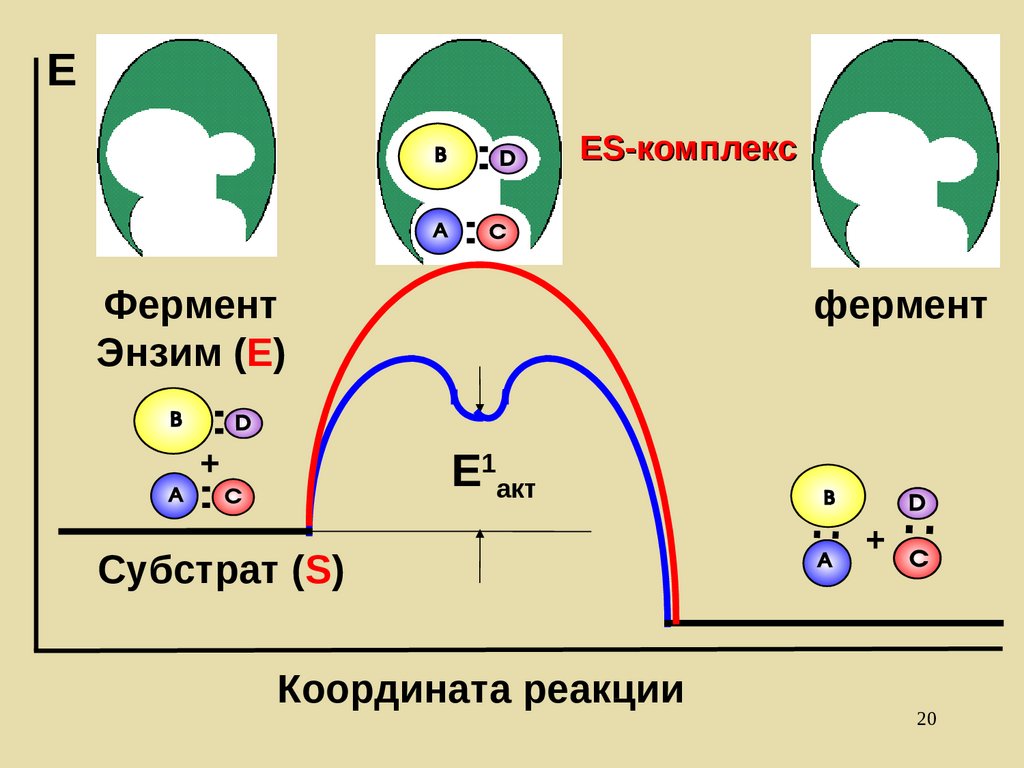
ЕES-комплекс
Фермент
Энзим (Е)
+
фермент
E1акт
Субстрат (S)
Координата реакции
+
20
21.
ХимическоеХимическое равновесие
равновесие
Основные определения
Обратимость
Обратимость –– способность
способность реакции
реакции
протекать
протекать вв двух
двух направлениях
направлениях
aA + bB cC + dD
Условия химического равновесия:
V = V
G = 0
Концентрации
Концентрации веществ
веществ
вв момент
момент достижения
достижения равновесия
равновесия
называются
равновесными
называются равновесными.
равновесными.
равновесными
21
22.
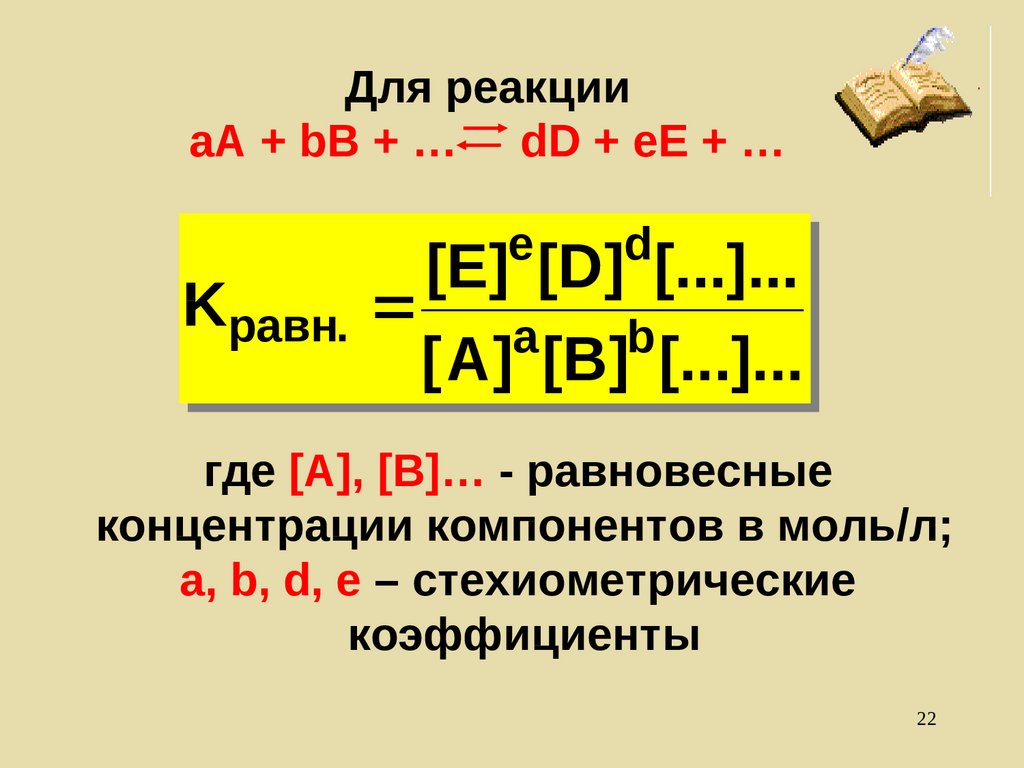
Для реакцииaA + bB + … dD + eE + …
ee
dd
[E] [D ] [...]...
[
E
]
[
D
]
[...]...
K
Kравн
.
равн.
aa
bb
[[A
A]] [[B
B]] [...]...
[...]...
где [A], [B]… - равновесные
концентрации компонентов в моль/л;
a, b, d, e – стехиометрические
коэффициенты
22
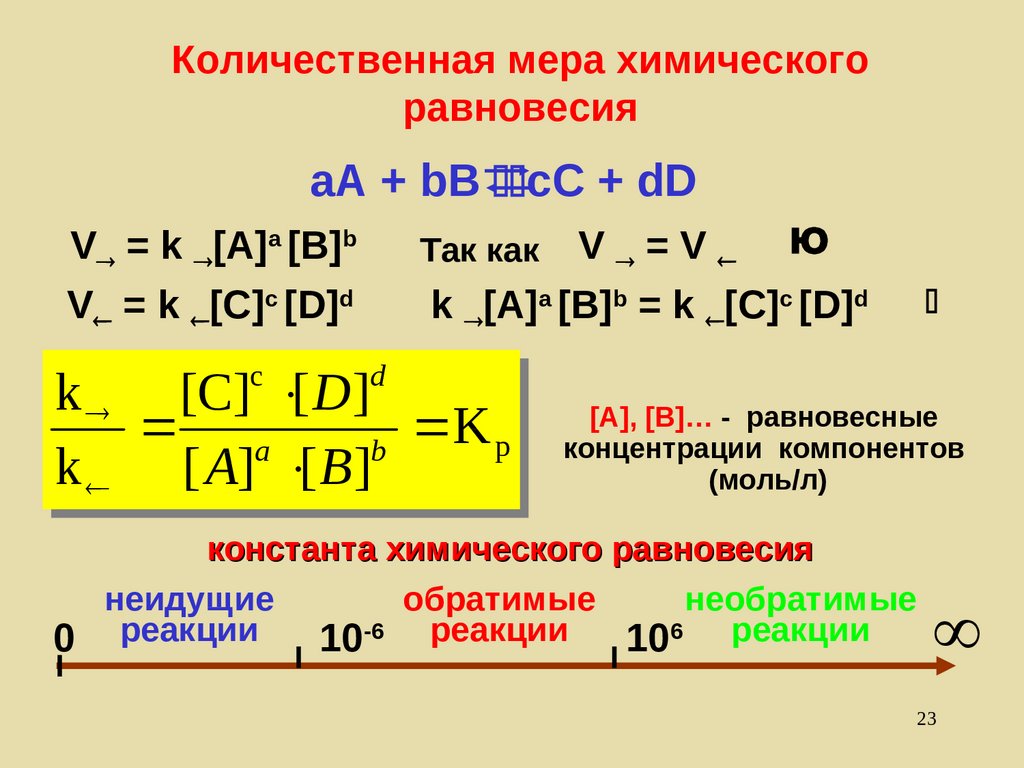
23. Количественная мера химического равновесия
aA + bB cC + dDV =V Ю
k [A]a [B]b = k [С]с [D]d
V = k [A]a [B]b
V = k [С]с [D]d
cc
Так как
dd
kk [C]
[[D
]]
[C]
D
K
aa
bb Kpp
kk [[AA]] [[BB]]
[A], [B]… - равновесные
концентрации компонентов
(моль/л)
константа химического равновесия
неидущие
обратимые
необратимые
0 реакции
10-6 реакции 106 реакции
23
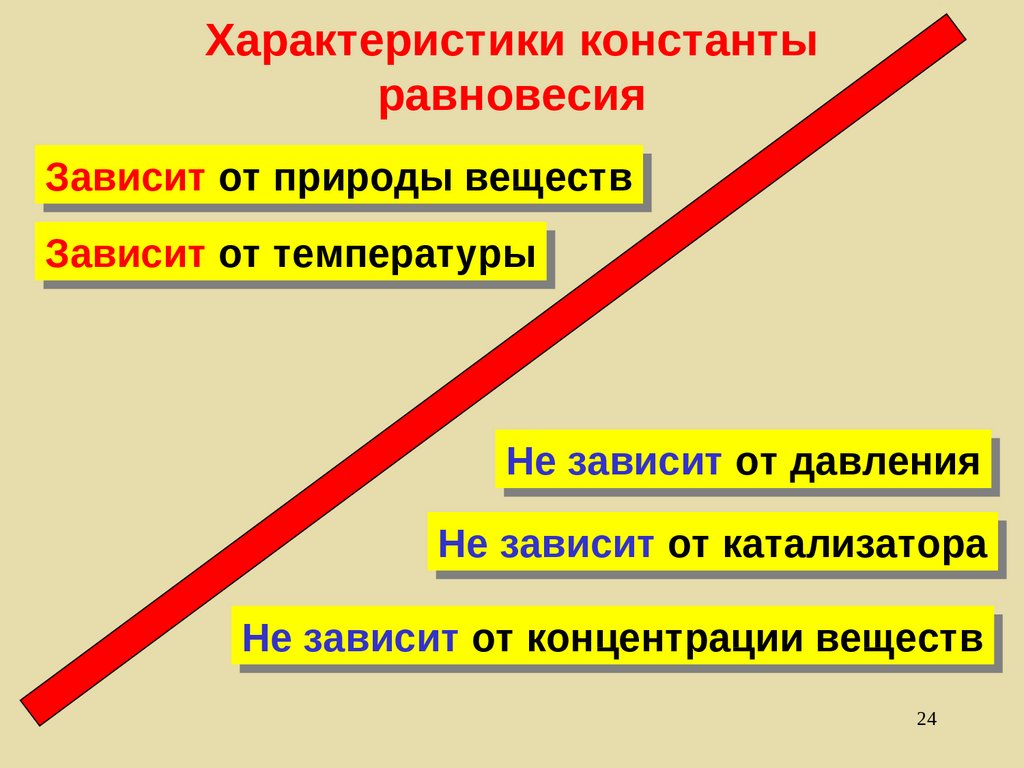
24. Характеристики константы равновесия
ЗависитЗависит от
от природы
природы веществ
веществ
Зависит
Зависит от
от температуры
температуры
Не
Не зависит
зависит от
от давления
давления
Не
Не зависит
зависит от
от катализатора
катализатора
Не
Не зависит
зависит от
от концентрации
концентрации веществ
веществ
24
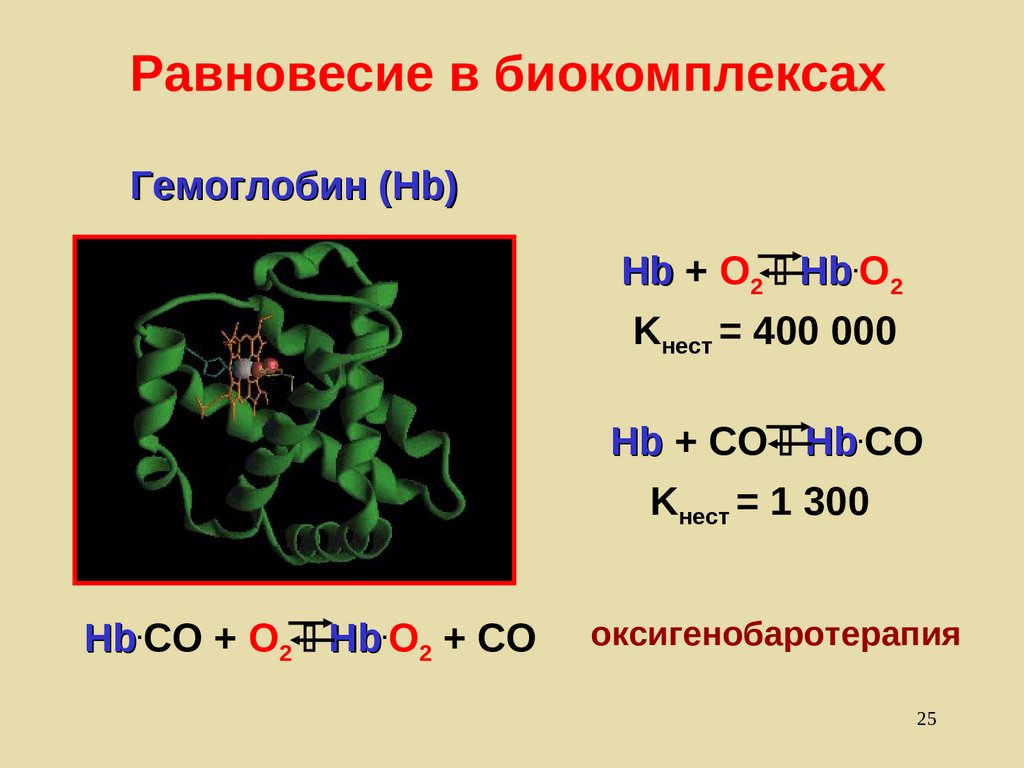
25.
Равновесие в биокомплексахГемоглобин (Hb)
Hb + O2 Hb.O2
Kнест = 400 000
Hb + CO Hb.CO
Kнест = 1 300
Hb.CO + O2 Hb.O2 + CO
оксигенобаротерапия
25
26.
Смещение химического равновесияПринцип Ле-Шателье
Если
Еслина
наравновесную
равновесную систему
системупроизводится
производится
внешнее
внешнее воздействие,
воздействие,
то
торавновесие
равновесиесмещается
смещается вв сторону,
сторону,
противодействующую
противодействующую этому
этому воздействию.
воздействию.
Факторы,
способствующие смещению равновесия
- изменение концентрации веществ
- изменение давления
- изменение температуры
26
27. Влияние концентрации
FeCl3 + 3KCNS Fe(CNS)3 + 3KCl33
[Fe(CNS)
KCl
]]
[Fe(CNS)
][
KCl
33][
K
Kpp
33
[FeCl
[FeCl33][
][KCNS
KCNS]]
Так как величина Кр не зависит от концентрации:
При увеличении [FeCl3] :
При увеличении [KCNS] :
При увеличении [KCl] :
27
28.
Температурная зависимостьконстанты равновесия
Go = - RT ln Kр
Go = Ho - T So
oo
KK11
H
((ТТ22 ТТ11))
H
Ю ln
ln
KK22
RT
RT22TT11
При Ho < 0 (экзотерма) и при T1 > T2, ln K1/K2 < 0,
то есть K1 < K2; следовательно для экзотермического
процесса при понижении температуры происходит
увеличение Kравн., что означает увеличение
концентрации продуктов в равновесной смеси.
При Ho > 0 (эндотерма) и при T1 > T2, ln K1/K2 > 0,
то есть K1 > K2; следовательно для эндотермического
процесса при понижении температуры происходит
уменьшение Kравн., что означает уменьшение
28
концентрации продуктов в равновесной смеси.
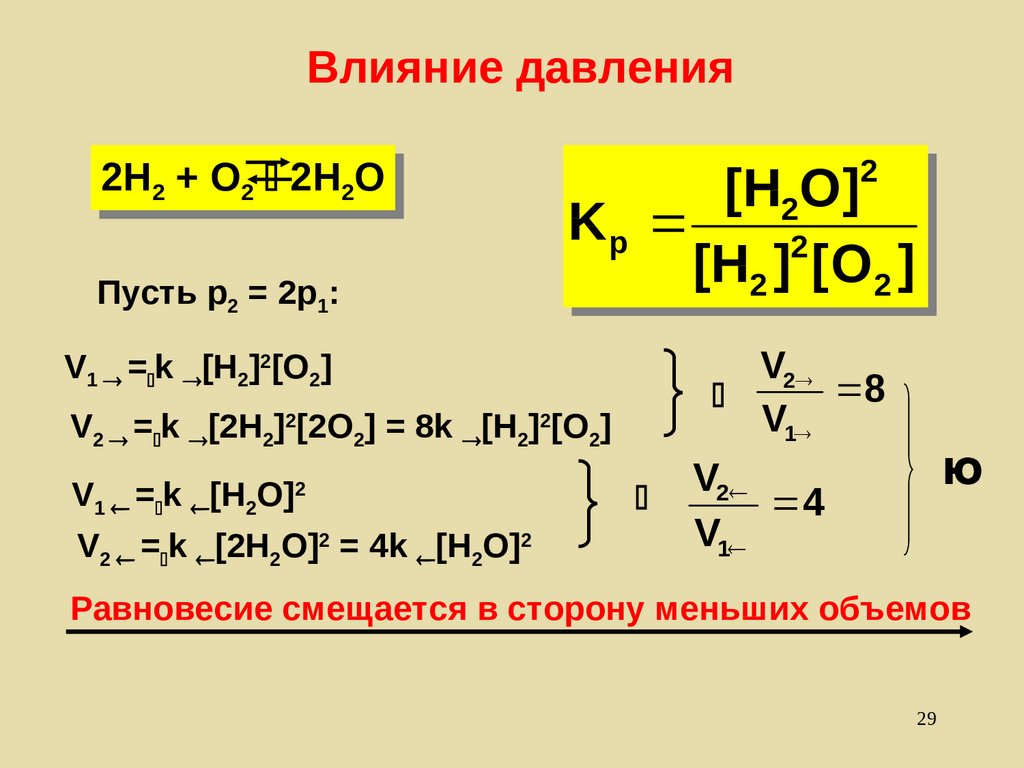
29. Влияние давления
2H2H22 ++ O
O22 2H
2H22O
O
Пусть р2 = 2р1:
22
[H
]]
[H
O
22O
K
Kpp
22
[H
[H22]] [[O
O22]]
V2
8
V1
V1 = k [H2]2[O2]
V2 = k [2H2]2[2O2] = 8k [H2]2[O2]
V1 = k [H2O]
V2 = k [2H2O]2 = 4k [H2O]2
2
Ю
V2
4
V1
Равновесие смещается в сторону меньших объемов
29
30. Правило Бертло
РавновесиеРавновесие будет
будет смещаться
смещаться вв одном
одном
направлении,
направлении, если
если какой-либо
какой-либо из
из
продуктов
продуктов будет
будет покидать
покидать сферу
сферу
реакции,
реакции, будучи
будучи газообразным,
газообразным,
выпадая
выпадая вв осадок
осадок или
или являясь
являясь
малодиссоциированнным
малодиссоциированнным
соединением.
соединением.
30
31. Примеры
NaHCO3 + HCl NaCl + H2O + CO2BaCl2 + Na2SO4 2NaCl + BaSO4
NaOH + HCl NaCl + H2O
31






















 Химия
Химия








