Похожие презентации:
Изомерия и номенклатура спиртов. Физические и химические свойства спиртов
1. Изомерия и номенклатура спиртов. Физические и химические свойства спиртов
2.
1. Можно ли отнести спирты к ранееизученному классу органических
соединений «Углеводороды»?
2. К какому классу органических веществ
относятся спирты?
3. Что такое функциональная группа?
4. Какова функциональная группа спиртов?
Как она называется?
5. Какова общая формула одноатомных
спиртов?
3. Составьте кластеры
1. Классификация спиртов (атомность, строение углеводородного радикала,положение гидроксильной группы)
2. Изомерия и номенклатура спиртов (виды изомерии, примеры изомеров,
принцип и алгоритм номенклатуры изомеров, примеры структурных формул
с названиями)
3. Физические свойства спиртов (агрегатное состояние, водородная связь, цвет,
запах, растворимость в воде, температуры кипения в сравнении с
соответствующими углеводородами)
4. Способы получения и применение спиртов (уравнения реакций, применение
спиртов в различных сферах народного хозяйства)
5. Действие спиртов на организм человека (биологическое действие метанола,
этанола, этиленгликоля, глицерина)
4. Лабораторный опыт «Денатурация белков»
• Инструктивная карта• В пробирках выдан раствор белка куриного яйца.
Прилейте в первую пробирку 1-2 мл воды, а во вторую
столько же этанола. Отметьте изменения в обеих
пробирках. Найдите объяснение происходящих
изменений.
5. СПИРТЫ
Спирты– кислородсодержащие
органические вещества
ПРАВДА
6. СПИРТЫ
Спиртыможно рассматривать как
производные углеводородов
ПРАВДА
7. СПИРТЫ
Функциональнойгруппой спиртов
является карбоксильная группа –
СООН
ЛОЖЬ
8. СПИРТЫ
Вмолекулах спиртов может
находиться только одна
гидроксильная группа
ЛОЖЬ
9. СПИРТЫ
10. СПИРТЫ
Спиртымогут быть газообразными
ЛОЖЬ
11. Спирты
СПИРТЫЭтиловый
спирт не является ядом
ЛОЖЬ
12. СПИРТЫ
Водороднаясвязь между
молекулами спирта прочная
ЛОЖЬ
13. СПИРТЫ
Всеспирты одинаково хорошо
растворяются в воде
ЛОЖЬ
14. СПИРТЫ
Наиболеетоксичный спирт –
бутиловый
ложь
15. СПИРТЫ
Формуламетанола СН3ОН
ПРАВДА
16. СПИРТЫ
Вкачестве антисептика
применяется спирт, формула
которого С2Н5ОН
ПРАВДА
17. СПИРТЫ
Глицерин– одноатомный спирт
ЛОЖЬ
18. СПИРТЫ
Глицеринявляется гомологом
этанола
ЛОЖЬ
19. СПИРТЫ
Общаяформула предельных
одноатомных спиртов СnH2n+1OH
ПРАВДА
20. СПИРТЫ
Дляспиртов не характерна
изомерия положения
функциональной группы
ЛОЖЬ
21. СПИРТЫ
22. СПИРТЫ
Ближайшимгомологом этанола
является гексанол
ЛОЖЬ
23. СПИРТЫ
С2Н5ОН– этанол
С3Н7ОН – пропанол
СН3ОН - метанол
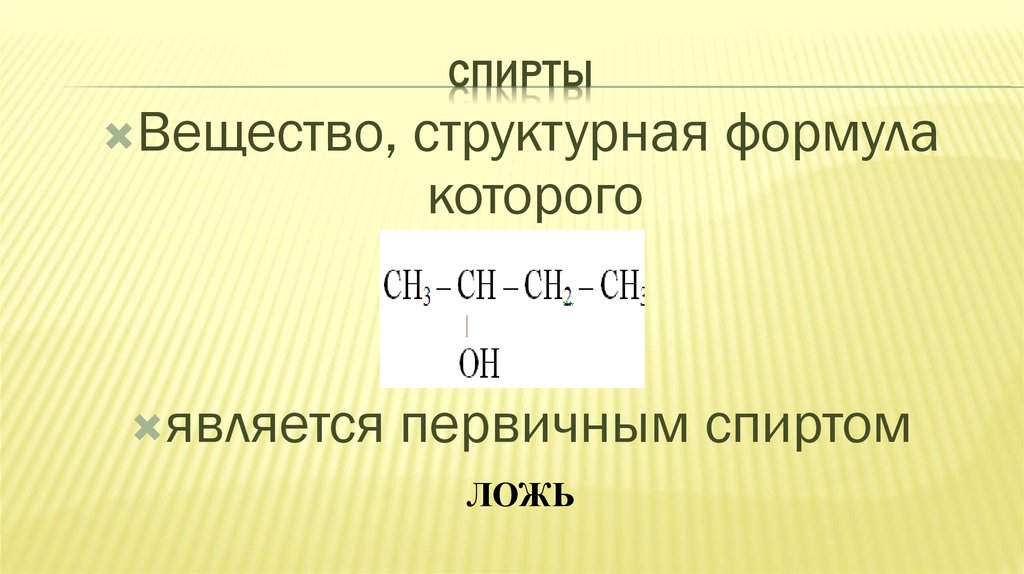
24. СПИРТЫ
Вещество,является
структурная формула
которого
первичным спиртом
ЛОЖЬ
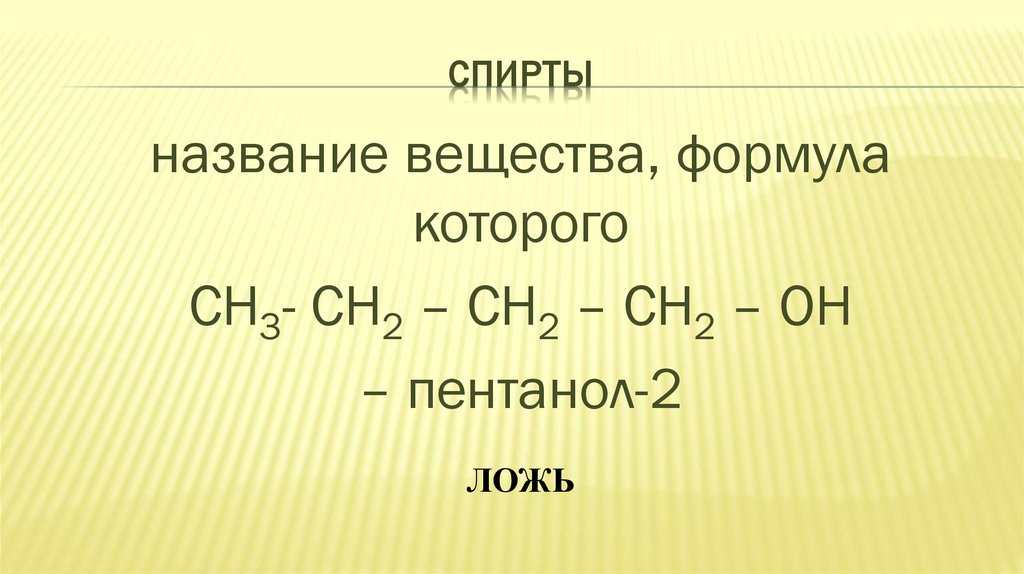
25. СПИРТЫ
название вещества, формулакоторого
СН3- СН2 – СН2 – СН2 – ОН
– пентанол-2
ЛОЖЬ
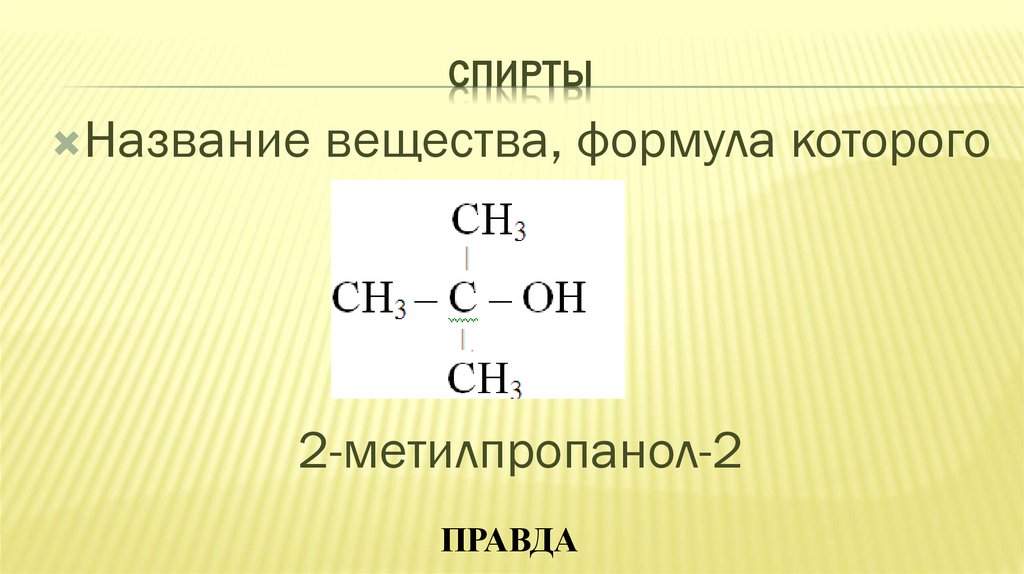
26. СПИРТЫ
Названиевещества, формула которого
2-метилпропанол-2
ПРАВДА
27. СПИРТЫ
Спиртыприменяются для
производства синтетического
каучука
ПРАВДА
28.
29.
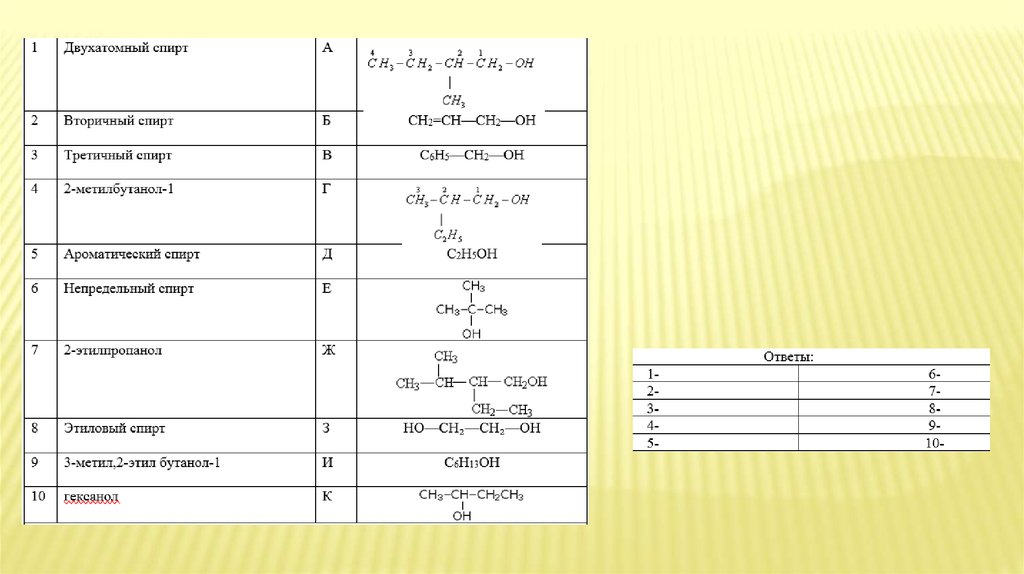
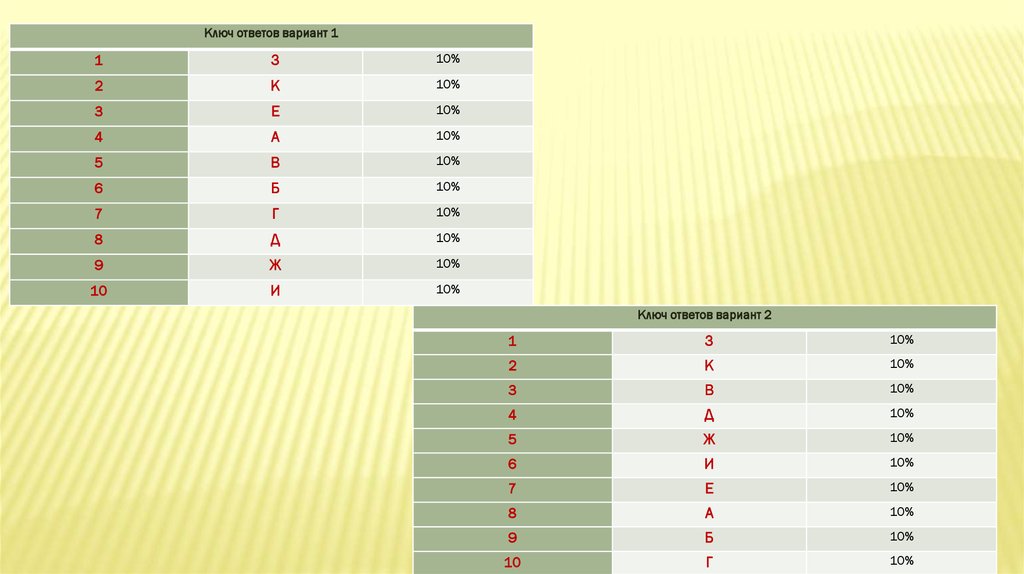
Ключ ответов вариант 11
З
10%
2
К
10%
3
Е
10%
4
А
10%
5
В
10%
6
Б
10%
7
Г
10%
8
Д
10%
9
Ж
10%
10
И
10%
Ключ ответов вариант 2
1
З
10%
2
К
10%
3
В
10%
4
Д
10%
5
Ж
10%
6
И
10%
7
Е
10%
8
А
10%
9
Б
10%
10
Г
10%
30. Горение спиртов
31.
Реакция горенияC2H5OH + 3O2 → 2CO2 ↑ + 3H2O
C4H9OH + 6,5O2 → 4CO2 ↑ + 5H2O
C5H11OH + O2 → 5CO2 ↑ + 6H2O
32. Взаимодействие со щелочными металлами
33. Спирты – это кислоты?
СПИРТЫ – ЭТО КИСЛОТЫ?Спирты реагируют со щелочными металлами. При этом атом водорода гидроксильной
группы замещается на металл. Похоже на кислоту.
2СН3 – OH + 2 Na 2СН3 – ONa + H2
2С2Н5 – OH + 2 Na 2С2Н5 – ONa + H2
2С4Н9 – OH + 2 Na 2С4Н9 – ONa + H2
Но кислотные свойства спиртов слишком слабы, слабы настолько, что спирты не
действуют на индикаторы.
34. Взаимодействие с галогеноводородами
35. Спирты – это основания?
СПИРТЫ – ЭТО ОСНОВАНИЯ?Реакция с галогеноводородами.
Эта реакция обратима и требует катализатора – концентрированной серной кислоты.
СН3–СН2–ОН + H–Br
CH3–CH2–Br + H2O
СПИРТЫ - АМФОТЕРНЫЕ СОЕДИНЕНИЯ!
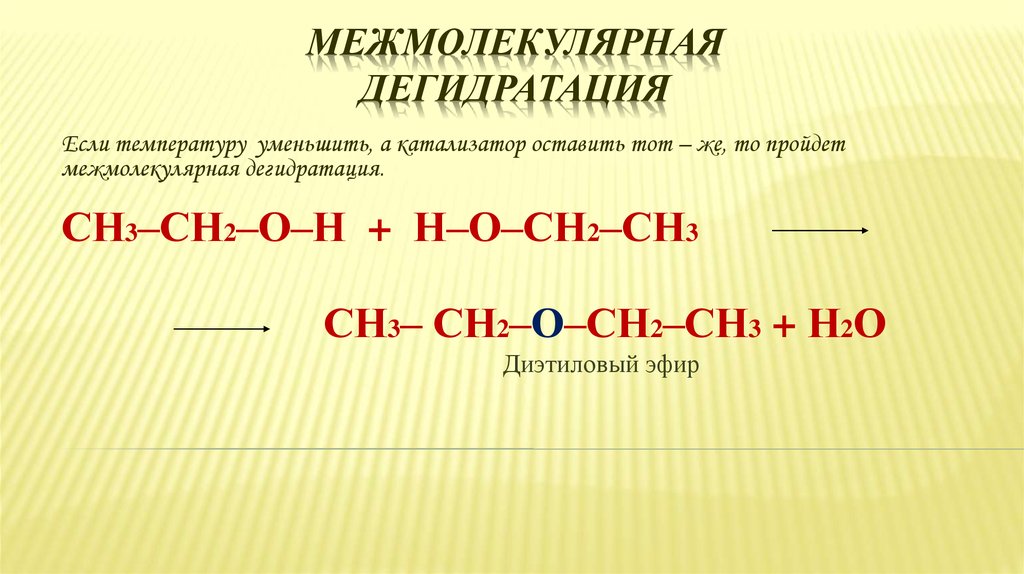
36. Межмолекулярная дегидратация
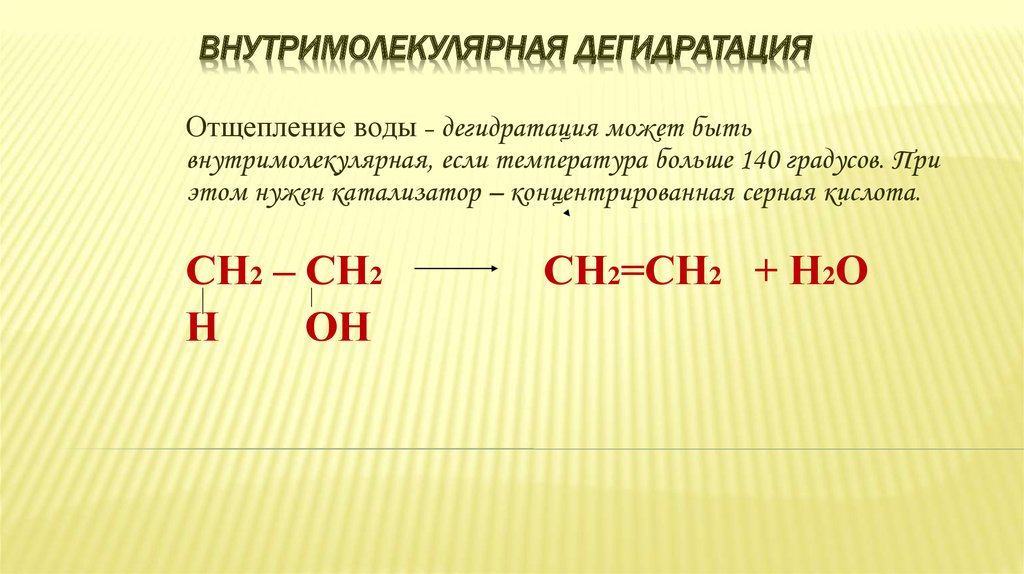
37. Внутримолекулярная дегидратация
ВНУТРИМОЛЕКУЛЯРНАЯ ДЕГИДРАТАЦИЯОтщепление воды – дегидратация может быть
внутримолекулярная, если температура больше 140 градусов. При
этом нужен катализатор – концентрированная серная кислота.
СН2 – СН2
Н
ОН
СН2=СН2 + Н2О
38. Межмолекулярная дегидратация
МЕЖМОЛЕКУЛЯРНАЯДЕГИДРАТАЦИЯ
Если температуру уменьшить, а катализатор оставить тот – же, то пройдет
межмолекулярная дегидратация.
СН3–СН2–О–Н + Н–О–СН2–СН3
СН3– СН2–О–СН2–СН3 + Н2О
Диэтиловый эфир
39. Качественная реакция на многоатомные спирты
40. Лабораторный опыт «качественная реакция на многоатомные спирты»
Инструктивная карта.В две пробирки прилить по 2 мл раствора гидроксида натрия и
добавить небольшое количество раствора сульфата меди до
выпадения осадка. В пробирки добавить растворы из склянки
№1 и №2, пробирки встряхнуть. Описать наблюдения.
Определить, в какой из склянок находился раствор глицерина.
41.
С4Н9OH + NaOHCH3OH + K
C3H7OH + KBr
C2H5OH + C4H9OH
C5H9OH + HI
H2SO4,t
CH3-CH-CH3
ǀ
OH
H2SO4,t
CH3OH
C2H5OH + NaCl
C3H7OH + O2
42.
Ключ ответовС4Н9OH + NaOH не реагирует
2CH3OH + 2K 2CH3OK + H2
20%
C3H7OH + KBr не реагирует
C2H5OH + C4H9OH C2H5OC4H9 + H2O
20%
C5H9OH + HI C5H9I + Н2О
20%
H2SO4,t
CH3-CH-CH3
CH2=CH-CH3 + H2O
ǀ
OH
H2SO4,t
CH3OH не реагирует
20%
C2H5OH + NaCl не реагирует
C3H7OH + 5O2 3CO2 + 4H2O
20%
43. Домашнее задание
ДОМАШНЕЕ ЗАДАНИЕВариант 1
1.Составь уравнения реакций: а) пропанола-1 с калием; б) бромоводорода с З-метилгексанолом-З
2. Осуществить превращения C6H1206 -> С2Н5ОН - -> C2H5CI -> С2Н5ОН -> С2Н5ОС2Н5;
Вариант 2
1.Составь уравнения реакций: внутримолекулярной и межмолекулярной дегидратации 2метилпропанола-1;
2. Осуществить превращения С -> СН4 -> CH3CI -> СН3ОН -> СН3ОСН3
Вариант 3
1.Составь уравнения реакций: а) бутанола-1 с калием; б) горения метанола
2. Осуществить превращения: С2Н6 -> С2Н5Вг-> С2Н4 -> С2Н5ОН
Вариант 4
Составь уравнения реакций: а) образования простого эфира б) иодоводорода с метиловым
спиртом
Осуществить превращения С2Н4 -> С2Н5С1 -> С2Н5ОН--> С2Н5Вг -> С4Н10




































 Химия
Химия








