Похожие презентации:
Способность неопластических клеток модифицировать микроокружение. Лекция 7
1.
Курс «Биология опухолевой клетки»(2019 г.)
Н.Л. Лазаревич
Лекция 7
Способность неопластических клеток
модифицировать микроокружение
2.
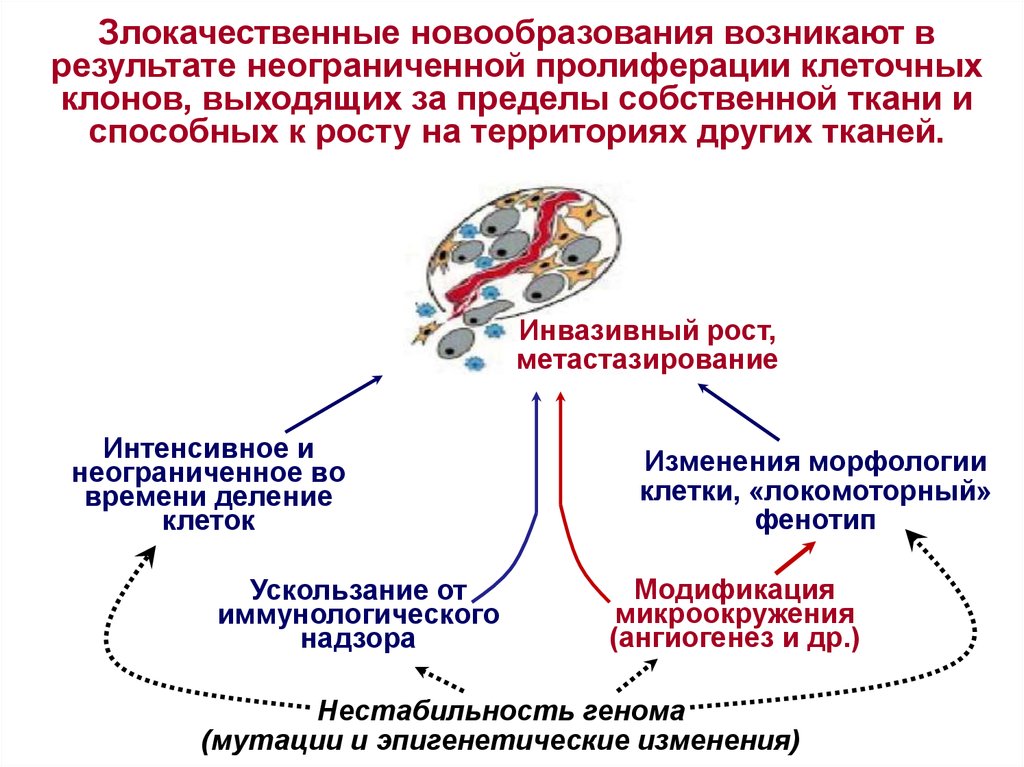
Злокачественные новообразования возникают врезультате неограниченной пролиферации клеточных
клонов, выходящих за пределы собственной ткани и
способных к росту на территориях других тканей.
Инвазивный рост,
метастазирование
Интенсивное и
неограниченное во
времени деление
клеток
Ускользание от
иммунологического
надзора
Изменения морфологии
клетки, «локомоторный»
фенотип
Модификация
микроокружения
(ангиогенез и др.)
Нестабильность генома
(мутации и эпигенетические изменения)
3.
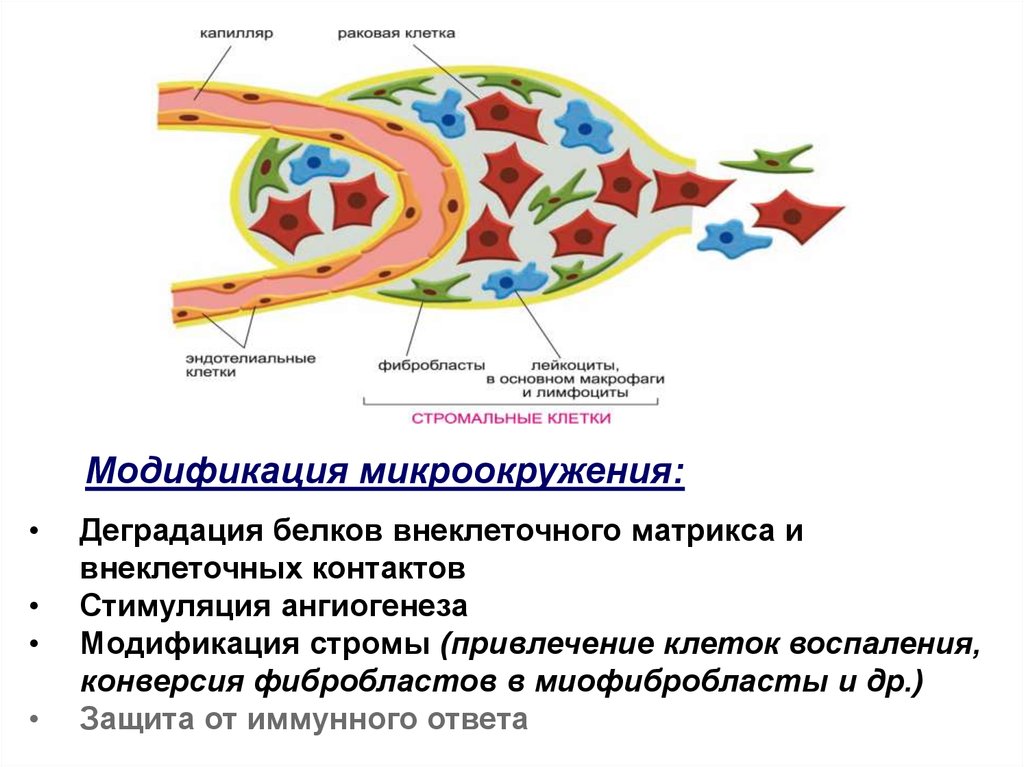
Модификация микроокружения:Деградация белков внеклеточного матрикса и
внеклеточных контактов
Стимуляция ангиогенеза
Модификация стромы (привлечение клеток воспаления,
конверсия фибробластов в миофибробласты и др.)
Защита от иммунного ответа
4.
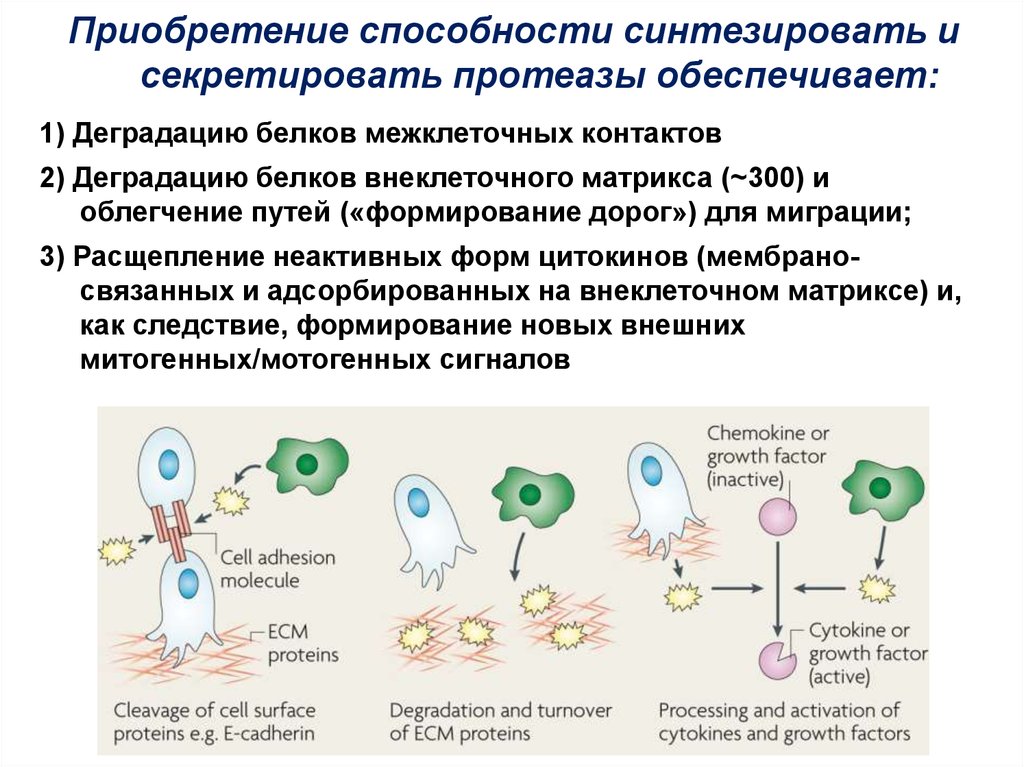
Приобретение способности синтезировать исекретировать протеазы обеспечивает:
1) Деградацию белков межклеточных контактов
2) Деградацию белков внеклеточного матрикса (~300) и
облегчение путей («формирование дорог») для миграции;
3) Расщепление неактивных форм цитокинов (мембраносвязанных и адсорбированных на внеклеточном матриксе) и,
как следствие, формирование новых внешних
митогенных/мотогенных сигналов
5.
В регуляции миграции/пролиферации клетокучаствуют 3 семейства протеаз:
• матриксные металлопротеазы (ММР)
(23 разных секретируемых и мембрано-связанных белка);
• активаторы плазминогена урокиназного типа (uPA);
• цистеинпротеазы (катепсин B и др.)
6.
7.
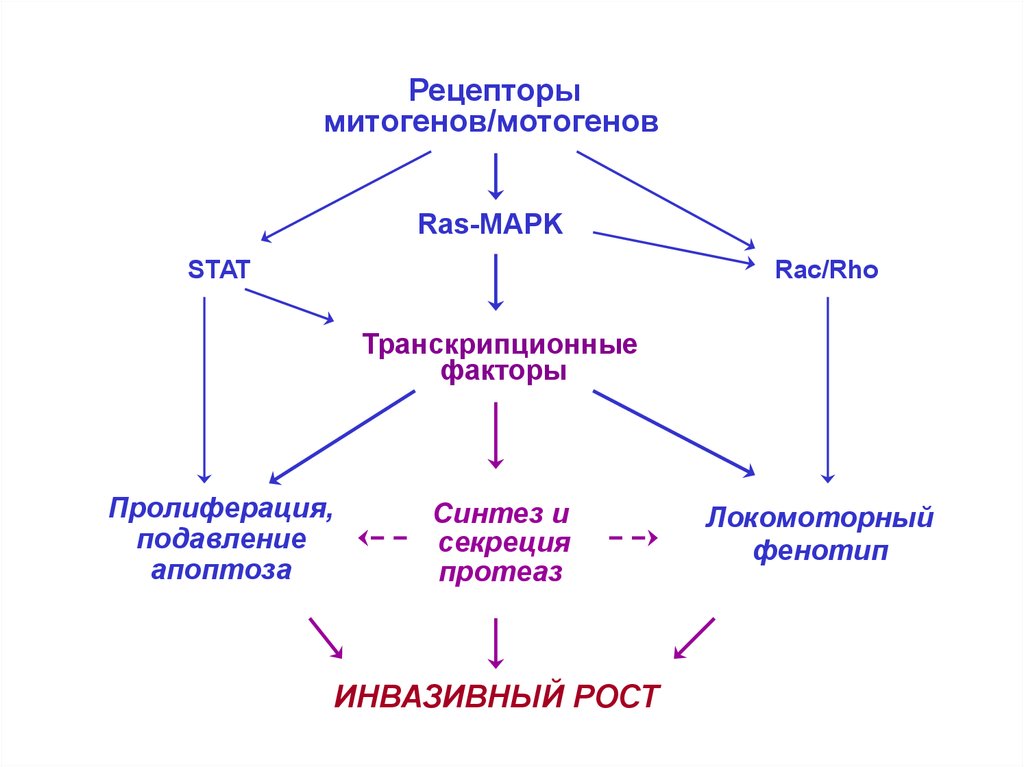
Рецепторымитогенов/мотогенов
Ras-MAPK
STAT
Rac/Rho
Транскрипционные
факторы
Пролиферация,
подавление
апоптоза
Синтез и
секреция
протеаз
ИНВАЗИВНЫЙ РОСТ
Локомоторный
фенотип
8.
Модификация микроокружения:Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения
Модификация стромы
Защита от иммунного ответа путем уничтожения
окружающих Fas-экспрессирующих NK/T-клеток (?)
9.
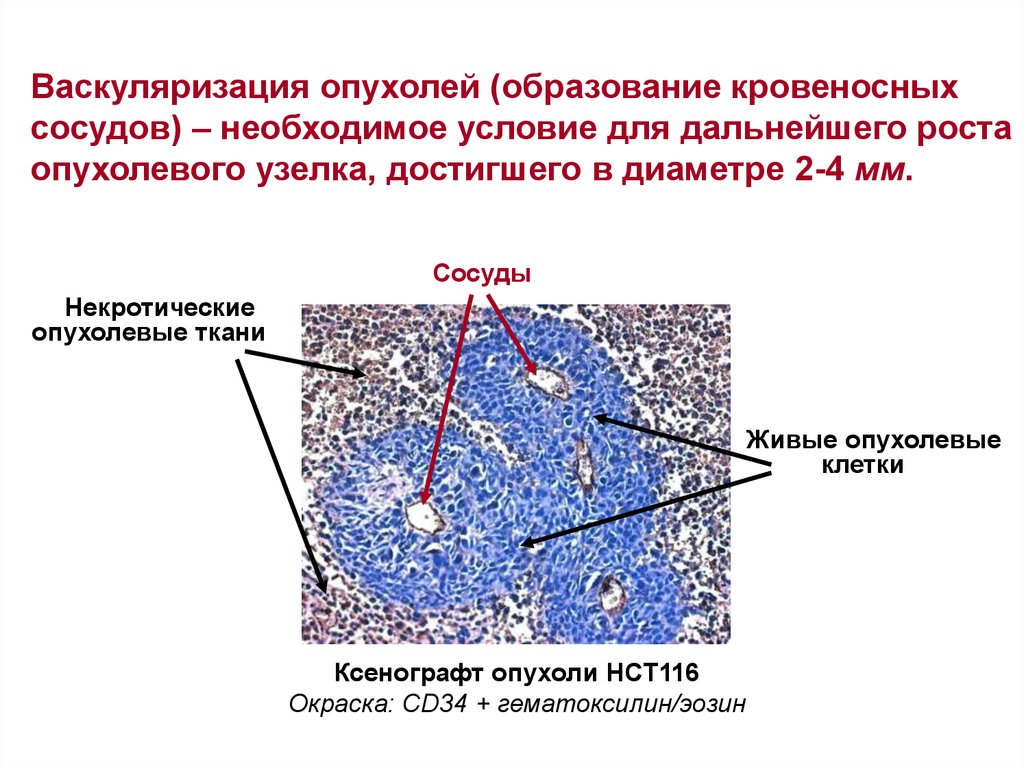
Васкуляризация опухолей (образование кровеносныхсосудов) – необходимое условие для дальнейшего роста
опухолевого узелка, достигшего в диаметре 2-4 мм.
Сосуды
Некротические
опухолевые ткани
Живые опухолевые
клетки
Ксенографт опухоли HCT116
Окраска: CD34 + гематоксилин/эозин
10.
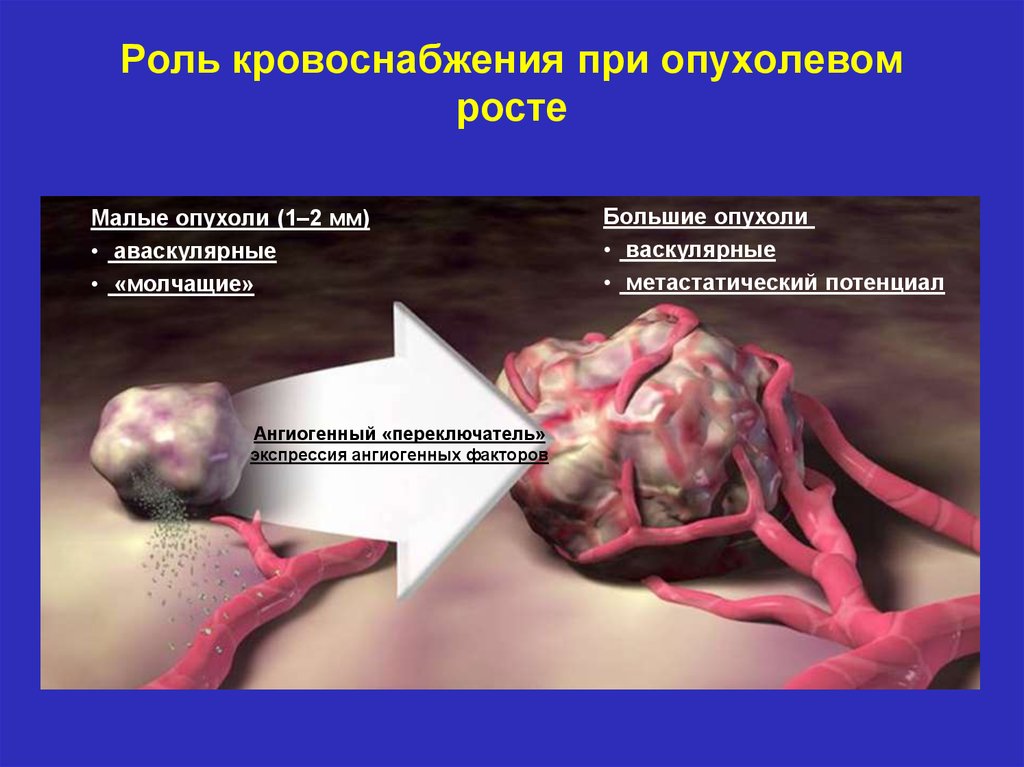
Роль кровоснабжения при опухолевомросте
Малые опухоли (1–2 мм)
• аваскулярные
• «молчащие»
Ангиогенный «переключатель»
экспрессия ангиогенных факторов
Большие опухоли
• васкулярные
• метастатический потенциал
11.
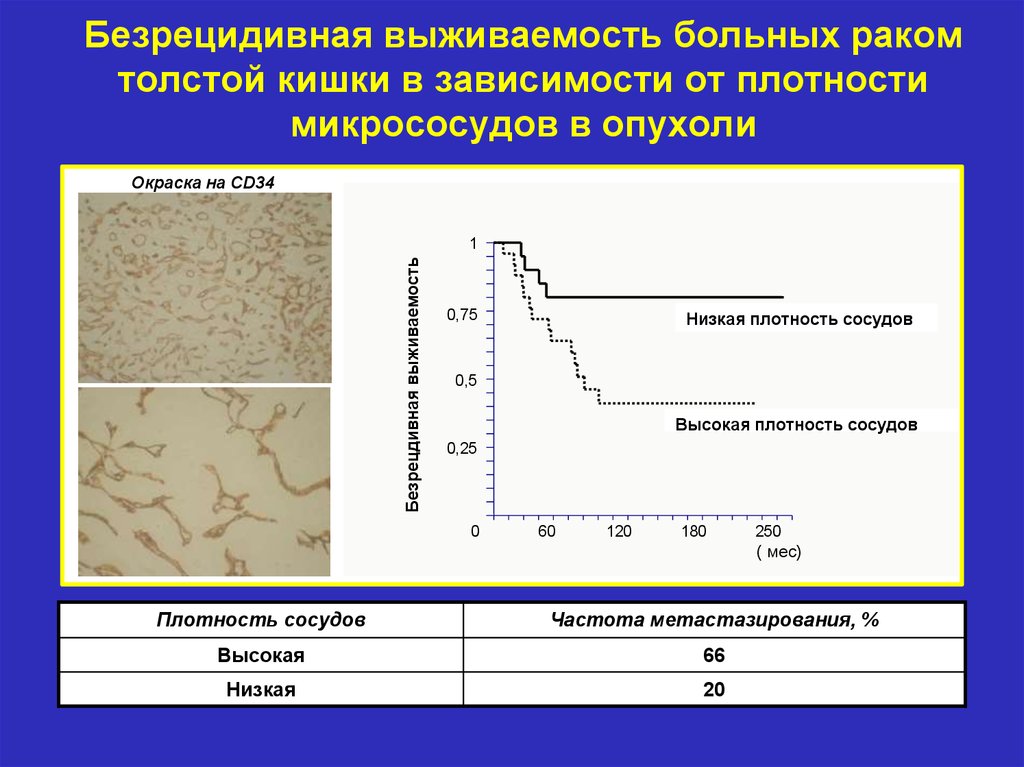
Безрецидивная выживаемость больных ракомтолстой кишки в зависимости от плотности
микрососудов в опухоли
Окраска на CD34
Безрецдивная выживаемость
1
0,75
Низкая плотность сосудов
0,5
Высокая плотность сосудов
0,25
0
60
120
180
250
( мес)
Плотность сосудов
Частота метастазирования, %
Высокая
66
Низкая
20
12.
Сосуды образуются за счет:• васкулогенеза - формирования сосудов из стволовых
клеток (гемангиобластов);
• ангиогенеза – ветвления уже имеющихся мелких
сосудов
В опухолевых тканях сосуды формируются в основном
из эндотелиальных клеток окружающих мелких
сосудов, т.е. за счет ангиогенеза.
13.
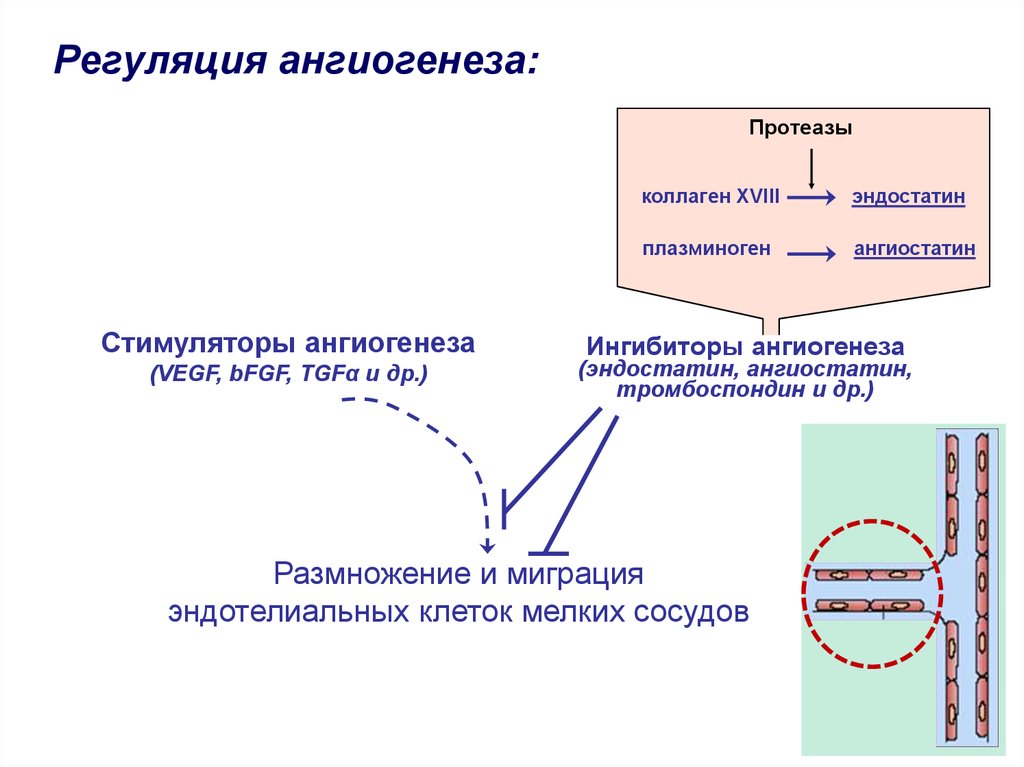
Регуляция ангиогенеза:Протеазы
Стимуляторы ангиогенеза
(VEGF, bFGF, TGFα и др.)
коллаген XVIII
эндостатин
плазминоген
ангиостатин
Ингибиторы ангиогенеза
(эндостатин, ангиостатин,
тромбоспондин и др.)
Размножение и миграция
эндотелиальных клеток мелких сосудов
14.
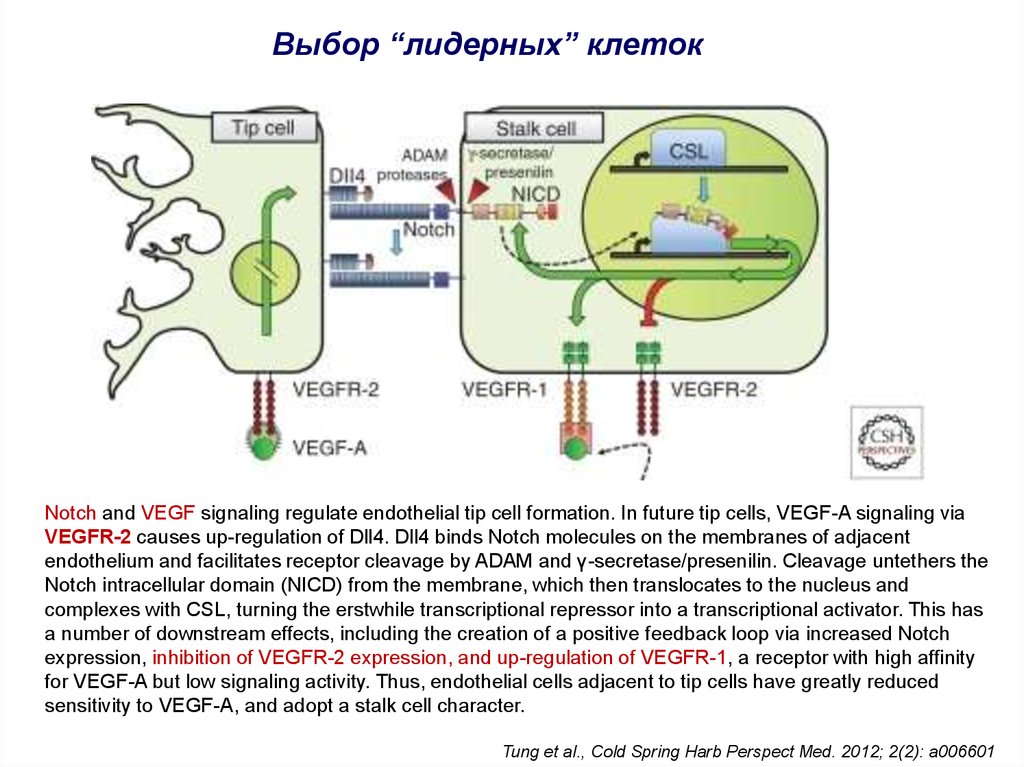
Выбор “лидерных” клетокNotch and VEGF signaling regulate endothelial tip cell formation. In future tip cells, VEGF-A signaling via
VEGFR-2 causes up-regulation of Dll4. Dll4 binds Notch molecules on the membranes of adjacent
endothelium and facilitates receptor cleavage by ADAM and γ-secretase/presenilin. Cleavage untethers the
Notch intracellular domain (NICD) from the membrane, which then translocates to the nucleus and
complexes with CSL, turning the erstwhile transcriptional repressor into a transcriptional activator. This has
a number of downstream effects, including the creation of a positive feedback loop via increased Notch
expression, inhibition of VEGFR-2 expression, and up-regulation of VEGFR-1, a receptor with high affinity
for VEGF-A but low signaling activity. Thus, endothelial cells adjacent to tip cells have greatly reduced
sensitivity to VEGF-A, and adopt a stalk cell character.
Tung et al., Cold Spring Harb Perspect Med. 2012; 2(2): a006601
15.
16.
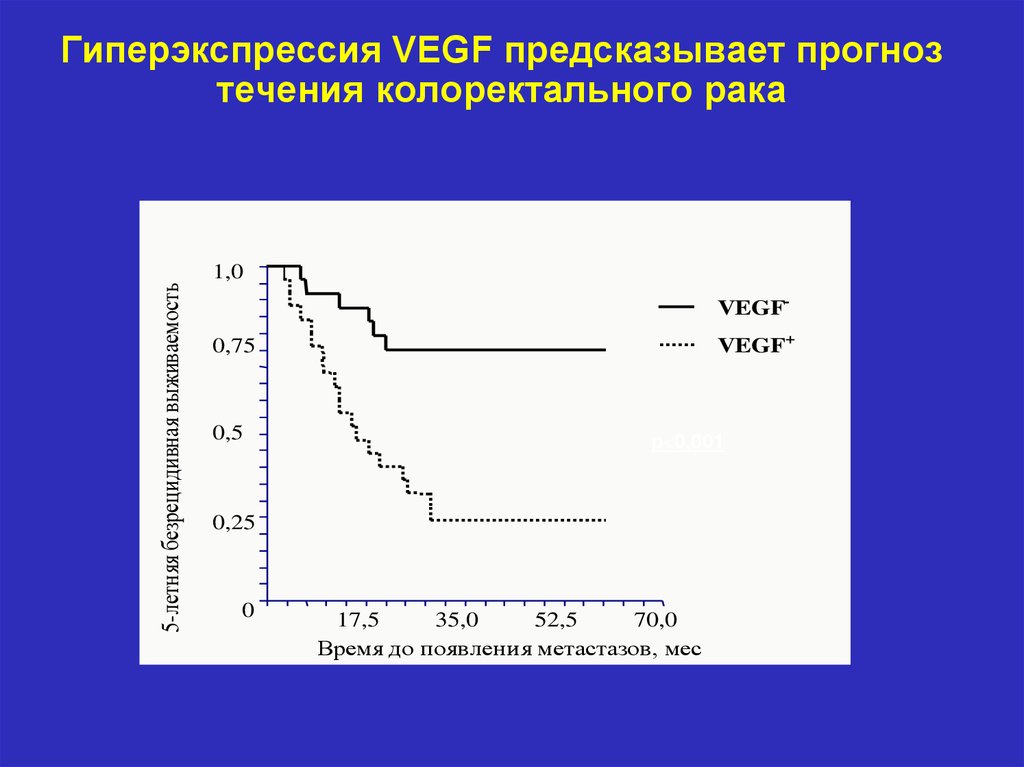
Гиперэкспрессия VEGF предсказывает прогнозтечения колоректального рака
5-летняя безрецидивная выживаемость
1,0
VEGFVEGF+
0,75
0,5
р 0,001
0,25
0
17,5
35,0
52,5
70,0
Время до появления метастазов, мес
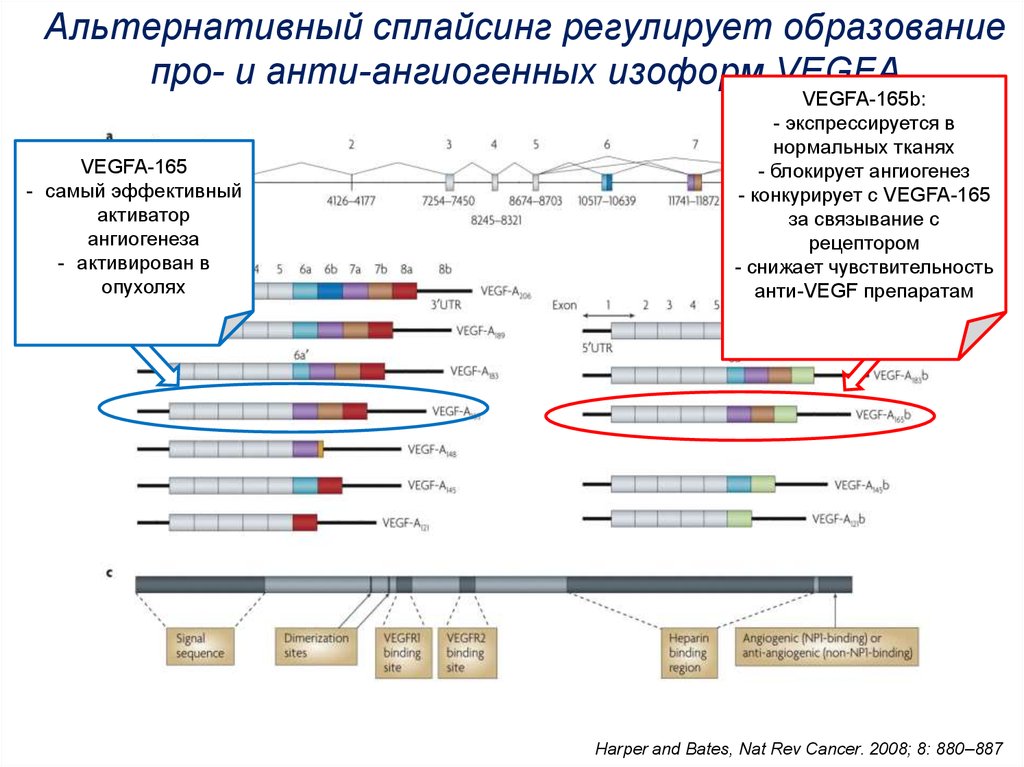
17. Альтернативный сплайсинг регулирует образование про- и анти-ангиогенных изоформ VEGFA
VEGFA-165- самый эффективный
активатор
ангиогенеза
- активирован в
опухолях
VEGFA-165b:
- экспрессируется в
нормальных тканях
- блокирует ангиогенез
- конкурирует с VEGFA-165
за связывание с
рецептором
- снижает чувствительность
анти-VEGF препаратам
Harper and Bates, Nat Rev Cancer. 2008; 8: 880–887
18.
Figure 13.3 The Biology of Cancer (© Garland Science 2007)19.
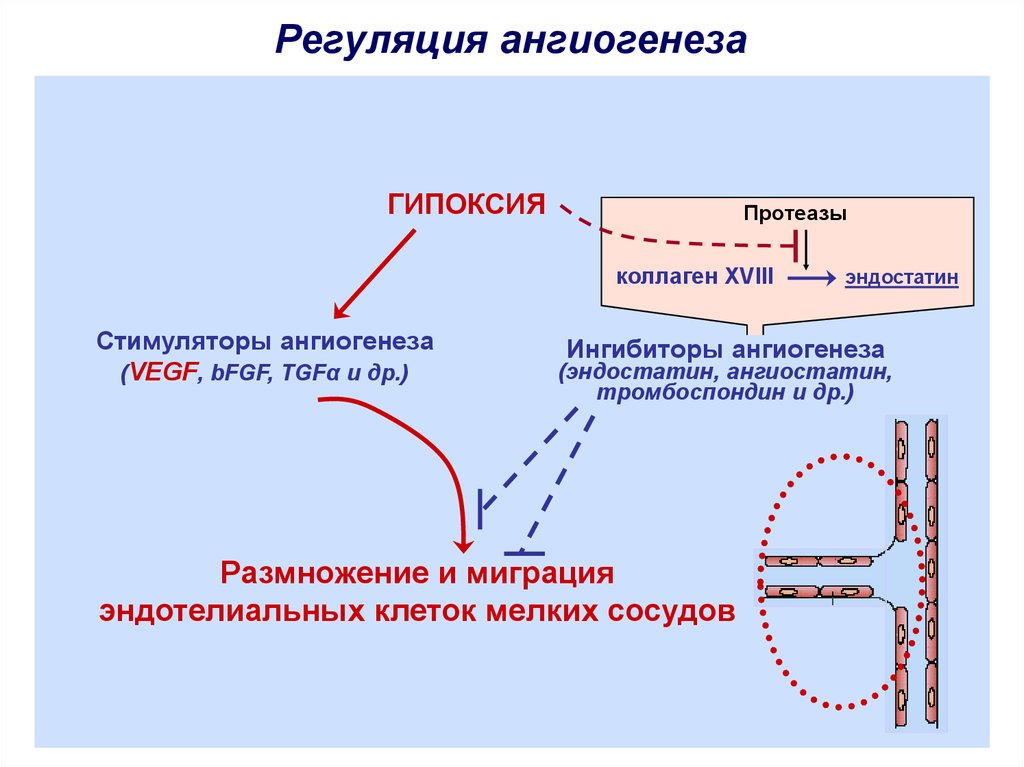
Регуляция ангиогенезаГИПОКСИЯ
Протеазы
коллаген XVIII
Стимуляторы ангиогенеза
(VEGF, bFGF, TGFα и др.)
эндостатин
Ингибиторы ангиогенеза
(эндостатин, ангиостатин,
тромбоспондин и др.)
Размножение и миграция
эндотелиальных клеток мелких сосудов
20.
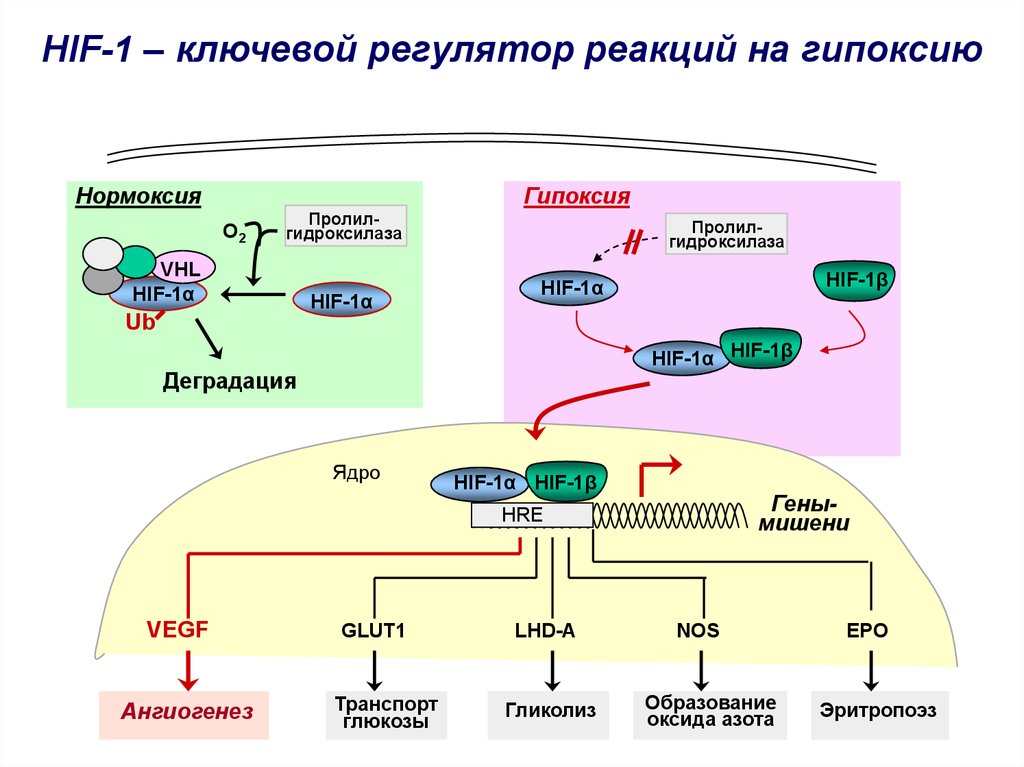
HIF-1 – ключевой регулятор реакций на гипоксиюНормоксия
Гипоксия
O2
Пролилгидроксилаза
VHL
HIF-1α
HIF-1α
Пролилгидроксилаза
HIF-1β
HIF-1α
Ub
HIF-1α HIF-1β
Деградация
Ядро
HIF-1α HIF-1β
Генымишени
HRE
VEGF
Ангиогенез
GLUT1
Транспорт
глюкозы
LHD-A
Гликолиз
NOS
Образование
оксида азота
EPO
Эритропоэз
21.
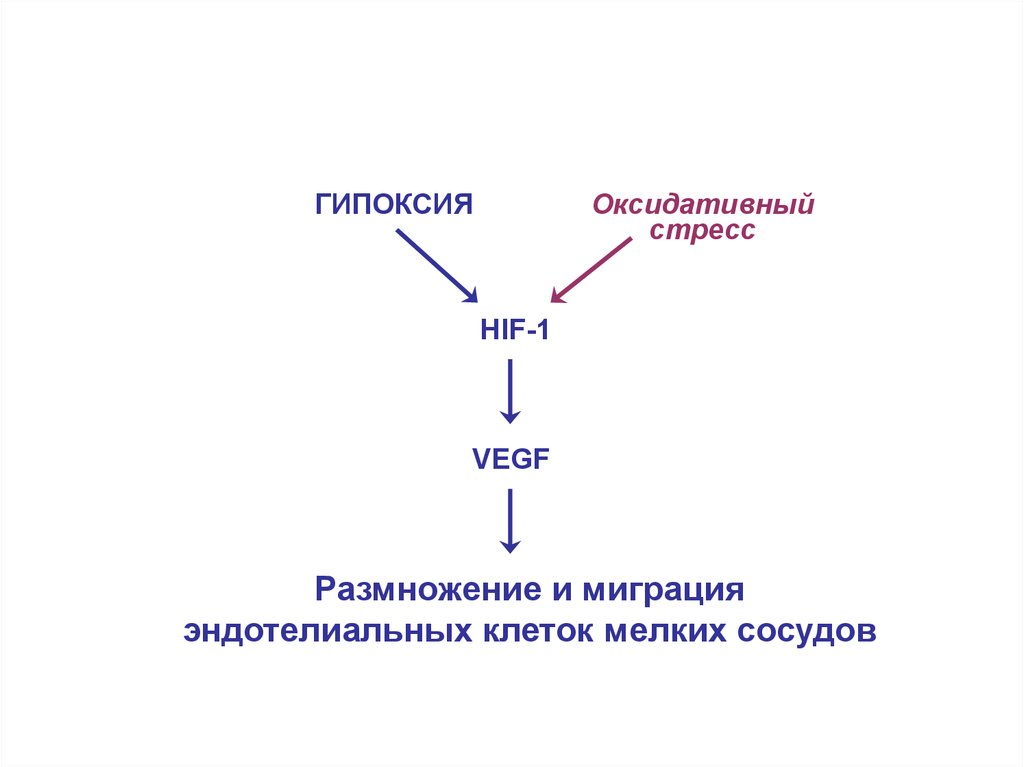
ГИПОКСИЯОксидативный
стресс
HIF-1
VEGF
Размножение и миграция
эндотелиальных клеток мелких сосудов
22.
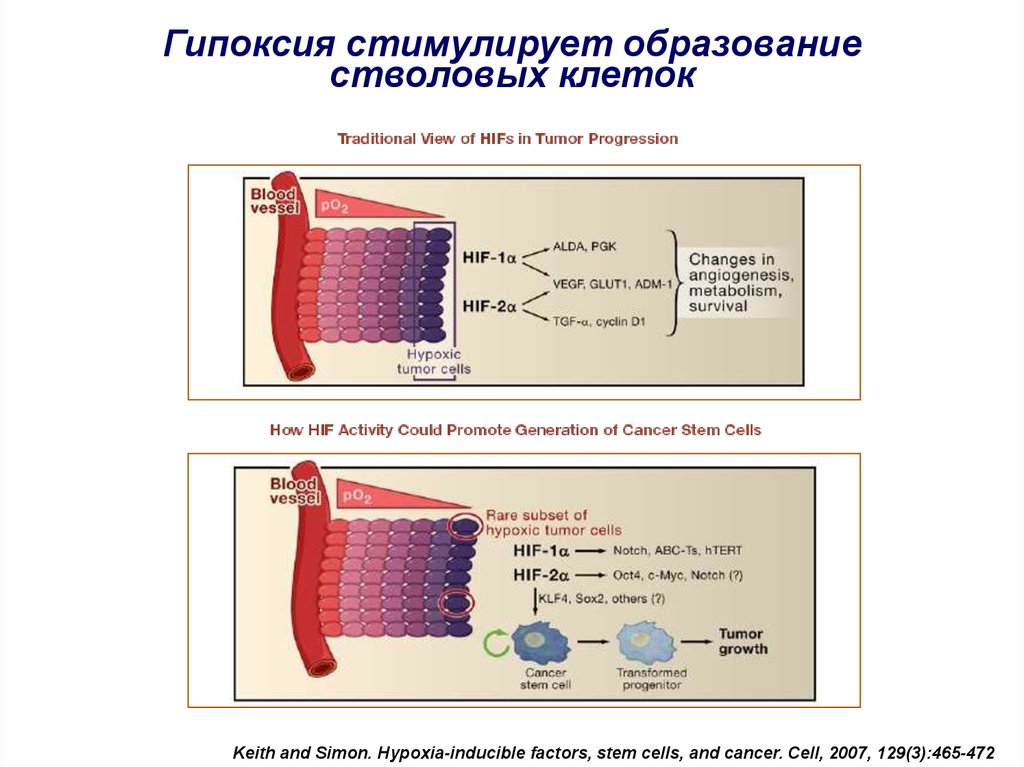
Гипоксия стимулирует образованиестволовых клеток
Keith and Simon. Hypoxia-inducible factors, stem cells, and cancer. Cell, 2007, 129(3):465-472
23.
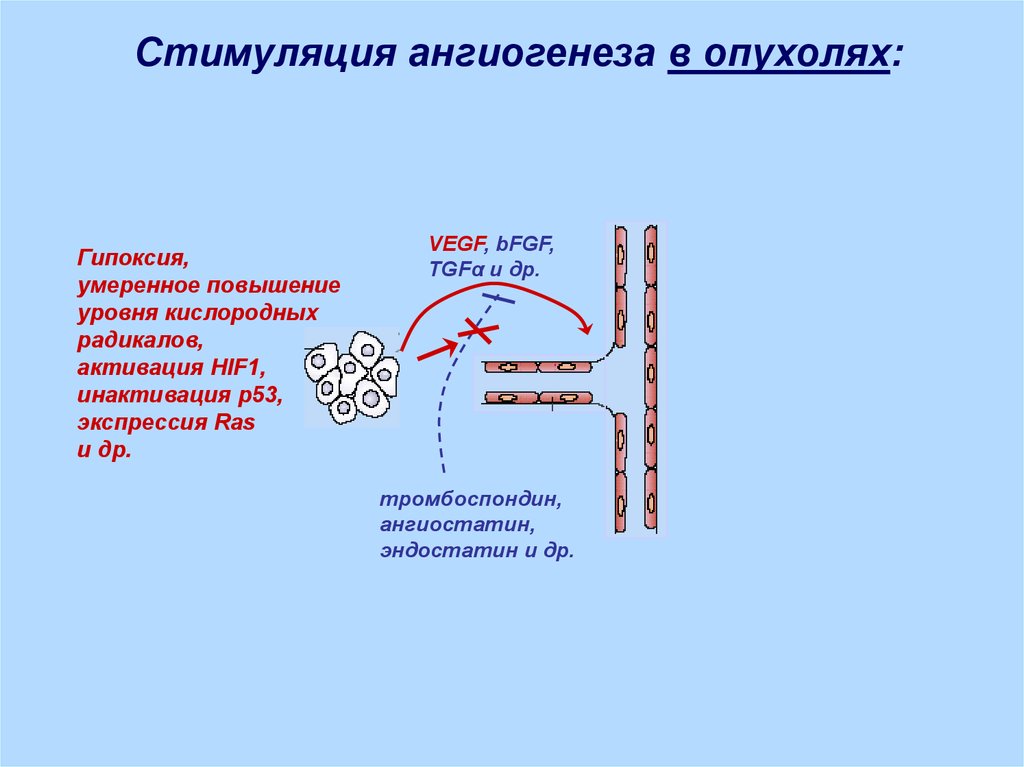
Стимуляция ангиогенеза в опухолях:Гипоксия,
умеренное повышение
уровня кислородных
радикалов,
активация HIF1,
инактивация р53,
экспрессия Ras
и др.
VEGF, bFGF,
TGFα и др.
тромбоспондин,
ангиостатин,
эндостатин и др.
24.
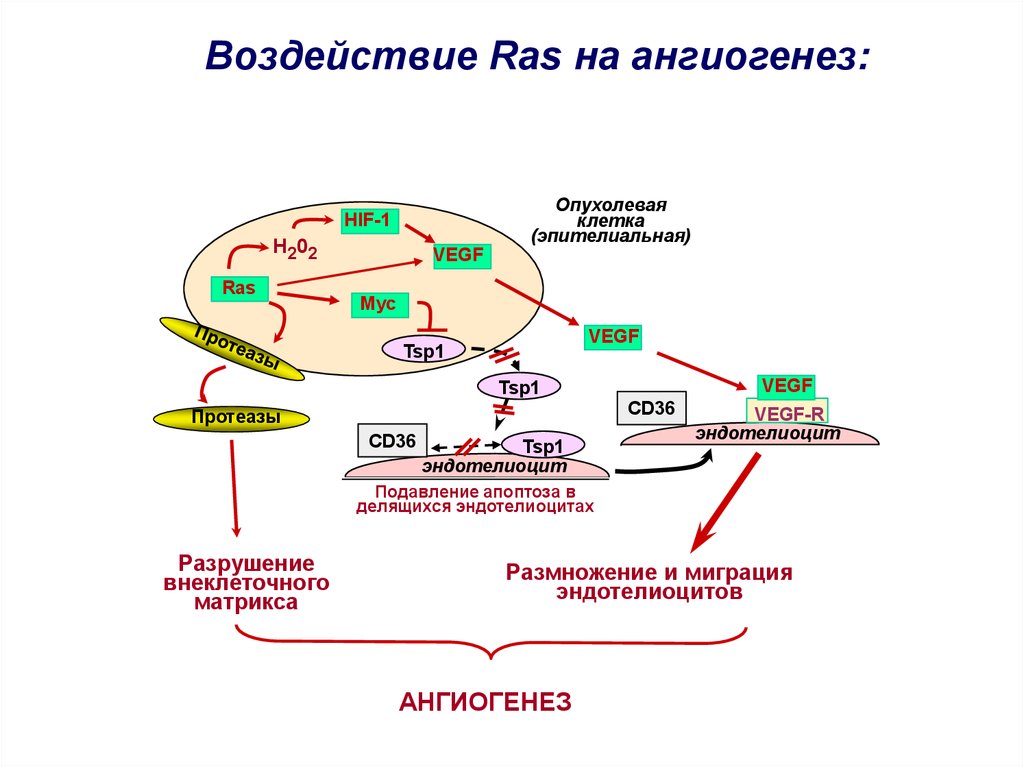
Воздействие Ras на ангиогенез:Опухолевая
клетка
(эпителиальная)
HIF-1
H202
Ras
VEGF
Myc
VEGF
Tsp1
VEGF
Tsp1
CD36
Протеазы
CD36
Tsp1
эндотелиоцит
VEGF-R
эндотелиоцит
Подавление апоптоза в
делящихся эндотелиоцитах
Разрушение
внеклеточного
матрикса
Размножение и миграция
эндотелиоцитов
АНГИОГЕНЕЗ
25.
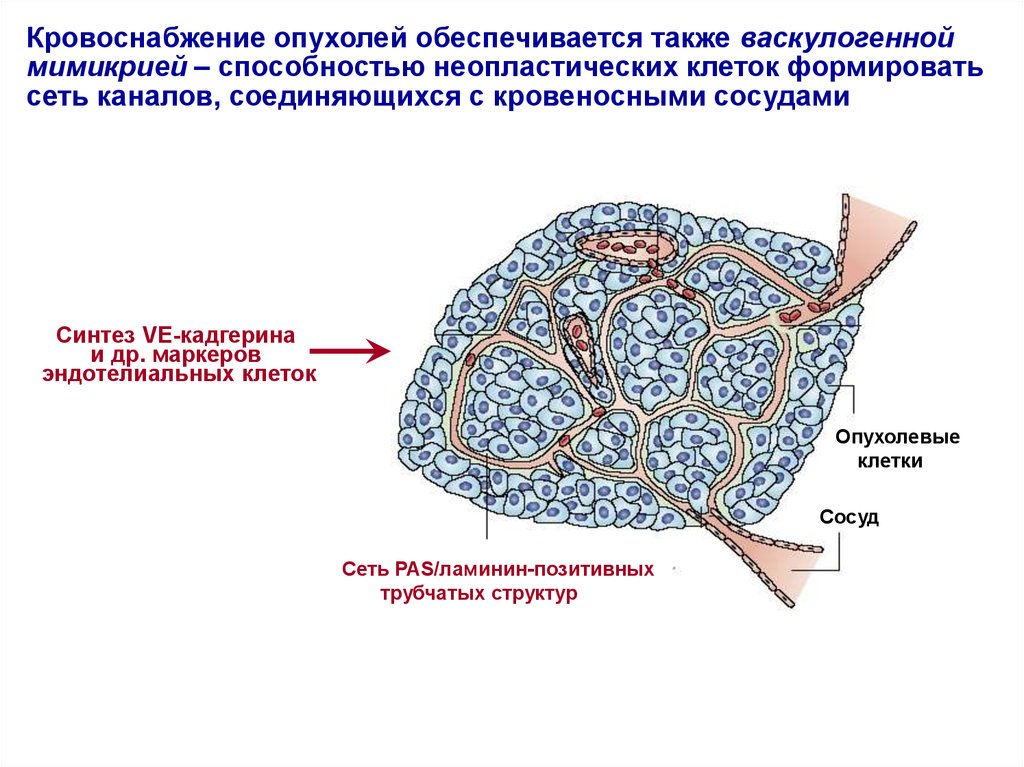
Кровоснабжение опухолей обеспечивается также васкулогенноймимикрией – способностью неопластических клеток формировать
сеть каналов, соединяющихся с кровеносными сосудами
Синтез VE-кадгерина
и др. маркеров
эндотелиальных клеток
Опухолевые
клетки
Сосуд
Сеть PAS/ламинин-позитивных
трубчатых структур
26.
Модификация микроокружения:Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения:
синтез/секреция провоспалительных цитокинов,
повышение содержания радикалов кислорода и азота
привлечение нейтрофилов, макрофагов и др.
стимуляция размножения и движения опухолевых
клеток, ангиогенез, мутагенез
27.
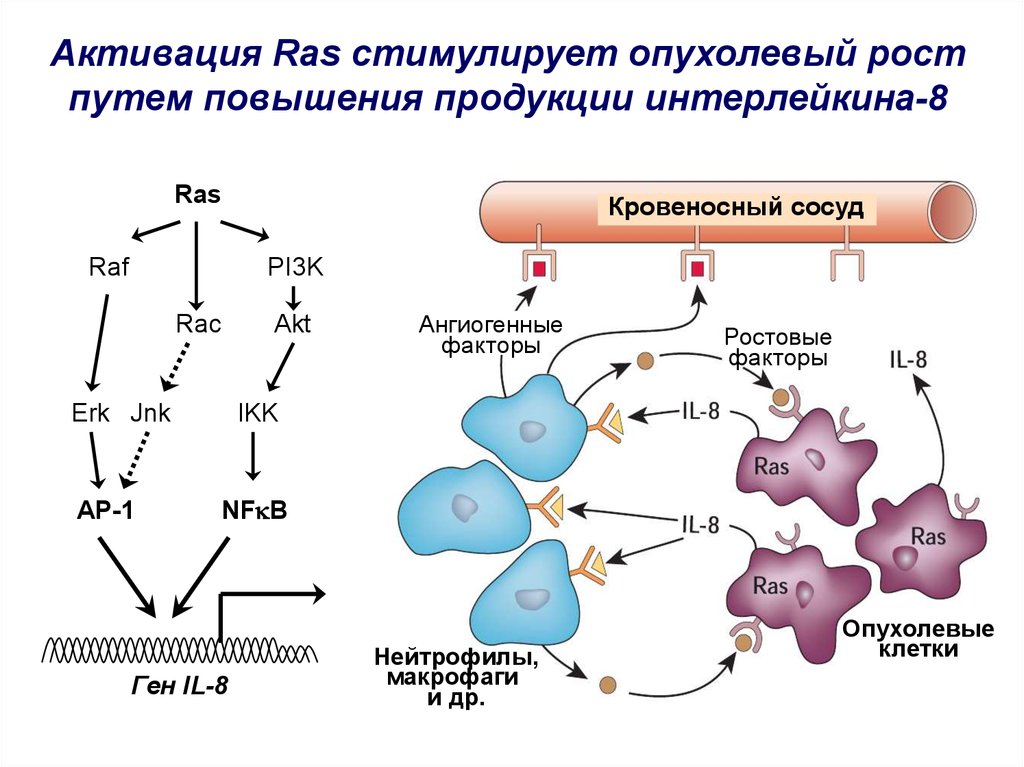
Активация Ras стимулирует опухолевый ростпутем повышения продукции интерлейкина-8
Ras
Кровеносный сосуд
Raf
PI3K
Akt
Rac
Erk Jnk
AP-1
Ангиогенные
факторы
Ростовые
факторы
IKK
NFkB
Ген IL-8
Нейтрофилы,
макрофаги
и др.
Опухолевые
клетки
28.
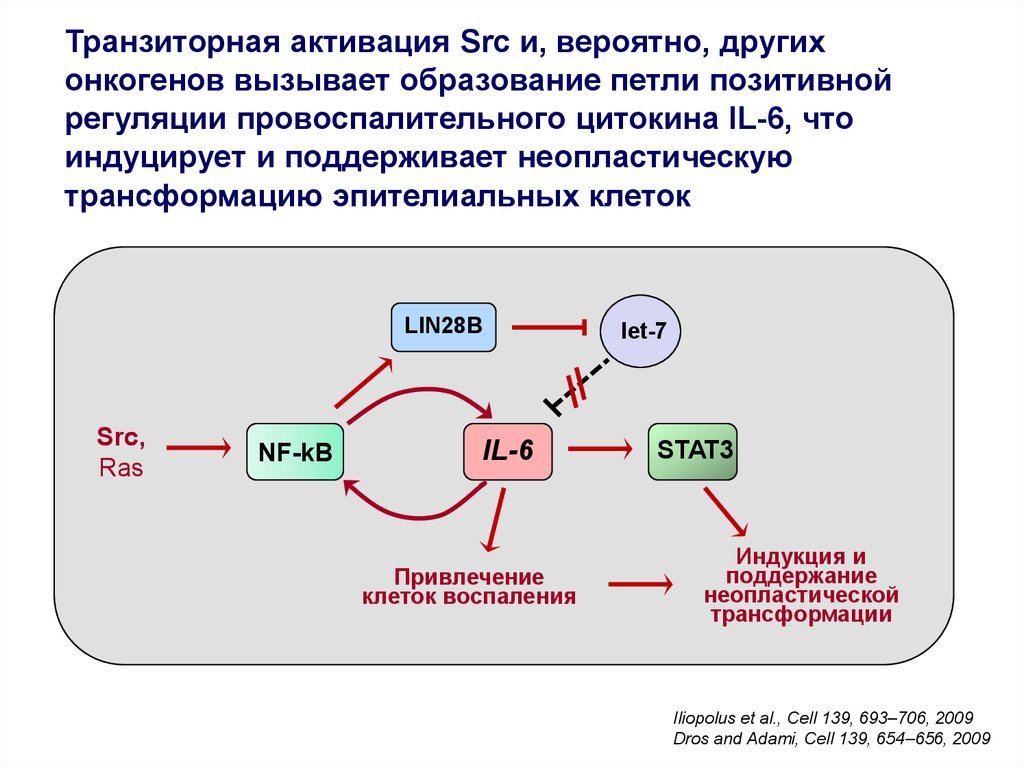
Транзиторная активация Src и, вероятно, другихонкогенов вызывает образование петли позитивной
регуляции провоспалительного цитокина IL-6, что
индуцирует и поддерживает неопластическую
трансформацию эпителиальных клеток
LIN28B
Src,
Ras
NF-kB
IL-6
Привлечение
клеток воспаления
let-7
STAT3
Индукция и
поддержание
неопластической
трансформации
Iliopolus et al., Cell 139, 693–706, 2009
Dros and Adami, Cell 139, 654–656, 2009
29.
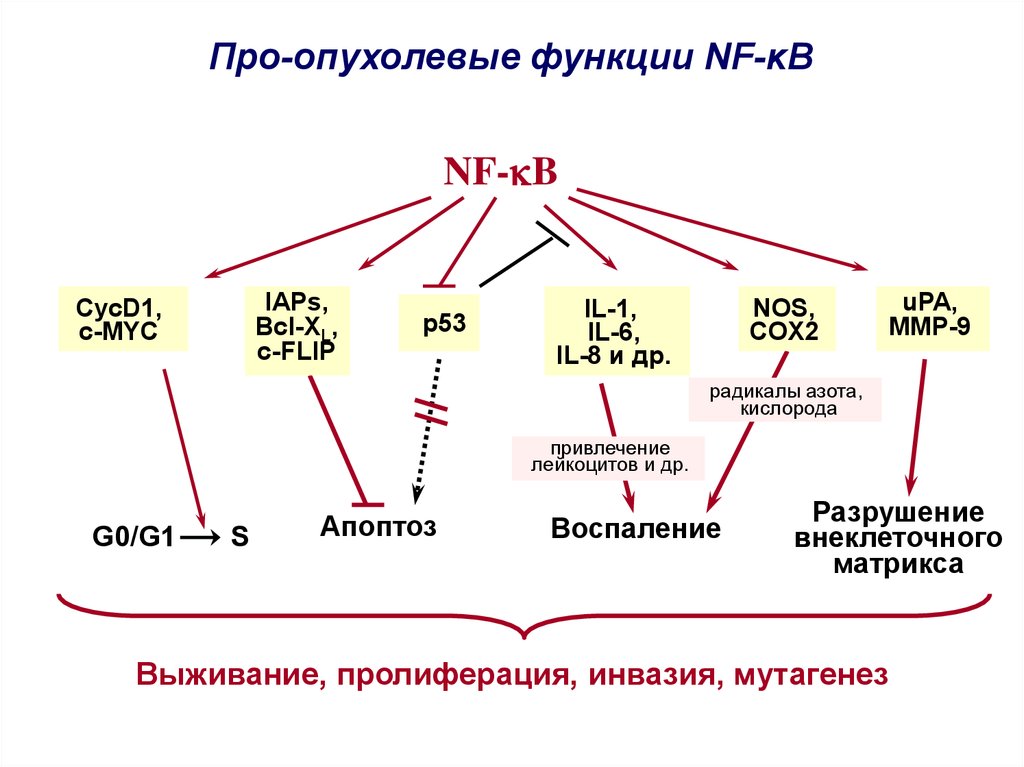
Про-опухолевые функции NF-κBNF-kB
IAPs,
Bcl-XL,
c-FLIP
CycD1,
c-MYC
р53
NOS,
COX2
IL-1,
IL-6,
IL-8 и др.
uPA,
MMP-9
радикалы азота,
кислорода
привлечение
лейкоцитов и др.
G0/G1
S
Апоптоз
Воспаление
Разрушение
внеклеточного
матрикса
Выживание, пролиферация, инвазия, мутагенез
30.
Модификация микроокружения:Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения
Модификация стромы
- опухоль-ассоциированные фибробласты (CAFs)
- мезенхимальные стромальные клетки из костного мозга (MSC)
Защита от иммунного ответа
31.
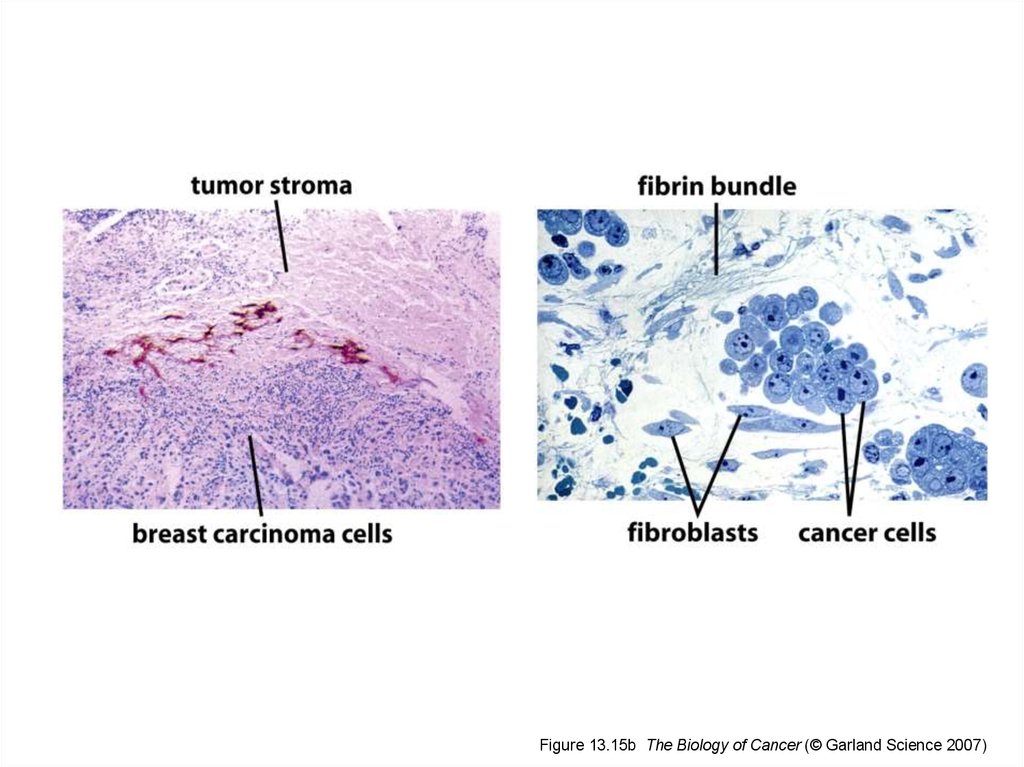
Figure 13.15b The Biology of Cancer (© Garland Science 2007)32.
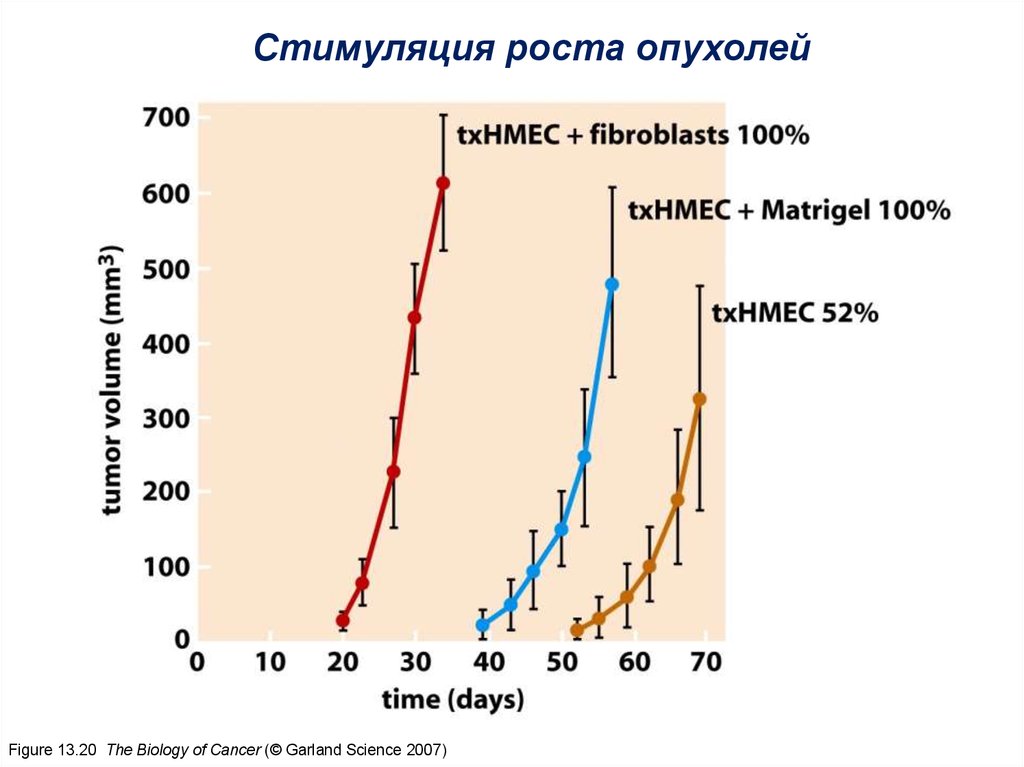
Стимуляция роста опухолейFigure 13.20 The Biology of Cancer (© Garland Science 2007)
33.
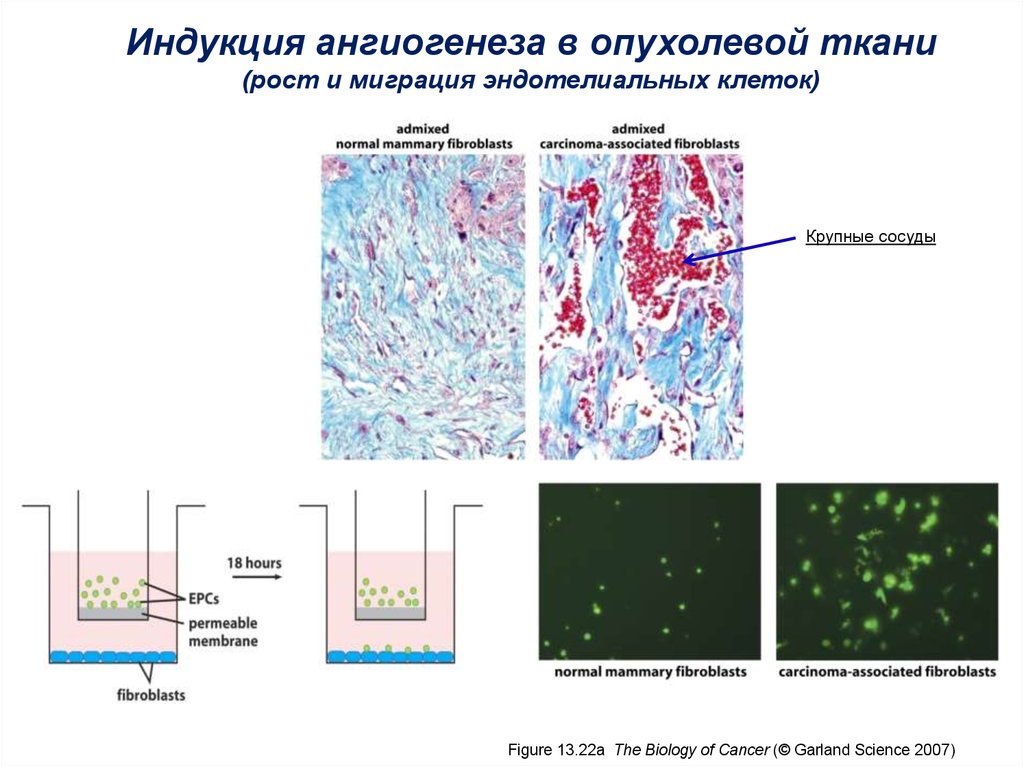
Индукция ангиогенеза в опухолевой ткани(рост и миграция эндотелиальных клеток)
Крупные сосуды
Figure 13.22a The Biology of Cancer (© Garland Science 2007)
34.
Модификация микроокружения:Модификация стромы опухолей
Привлечение в опухоль из костного мозга
мезенхимальных стволовых клеток, секретирующих
хемокины (CCL5), увеличивающие способность раковых
клеток мигрировать и образовывать метастазы.
Karnoub et. al., Nature, 2007; v.449, pp. 557-563
конверсия фибробластов в миофибробласты,
(стимуляция пролиферации и инвазии опухоли)
индукция продукции провоспалительных хемокинов
35.
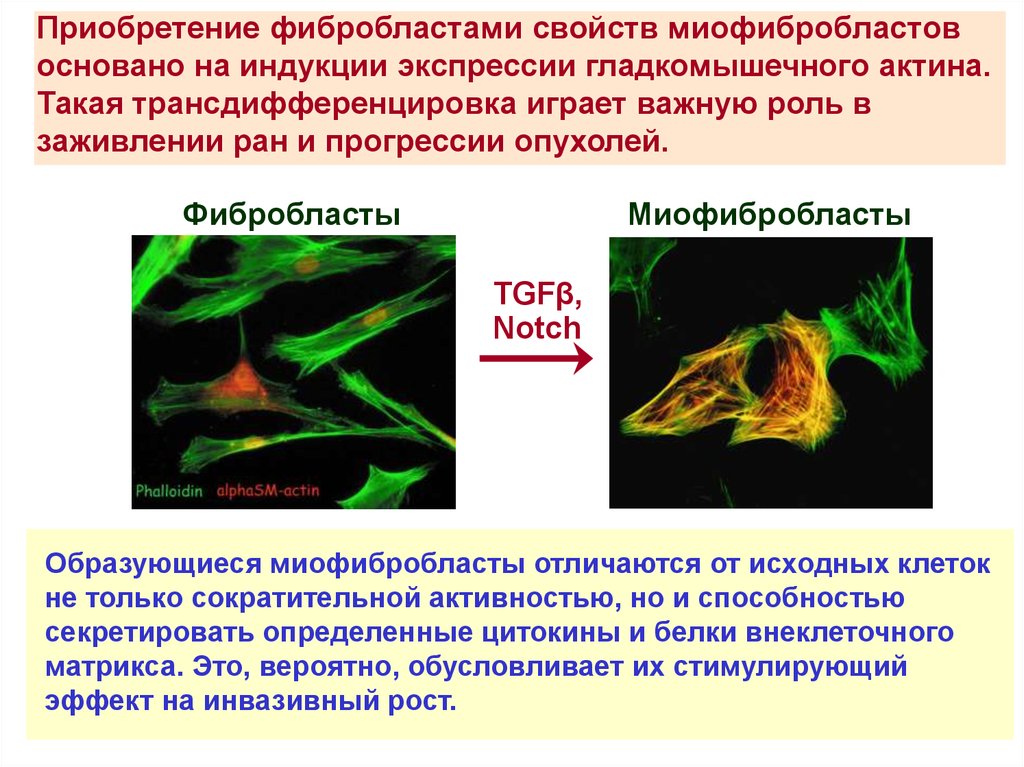
Приобретение фибробластами свойств миофибробластовосновано на индукции экспрессии гладкомышечного актина.
Такая трансдифференцировка играет важную роль в
заживлении ран и прогрессии опухолей.
Фибробласты
Миофибробласты
TGFβ,
Notch
Образующиеся миофибробласты отличаются от исходных клеток
не только сократительной активностью, но и способностью
секретировать определенные цитокины и белки внеклеточного
матрикса. Это, вероятно, обусловливает их стимулирующий
эффект на инвазивный рост.
36.
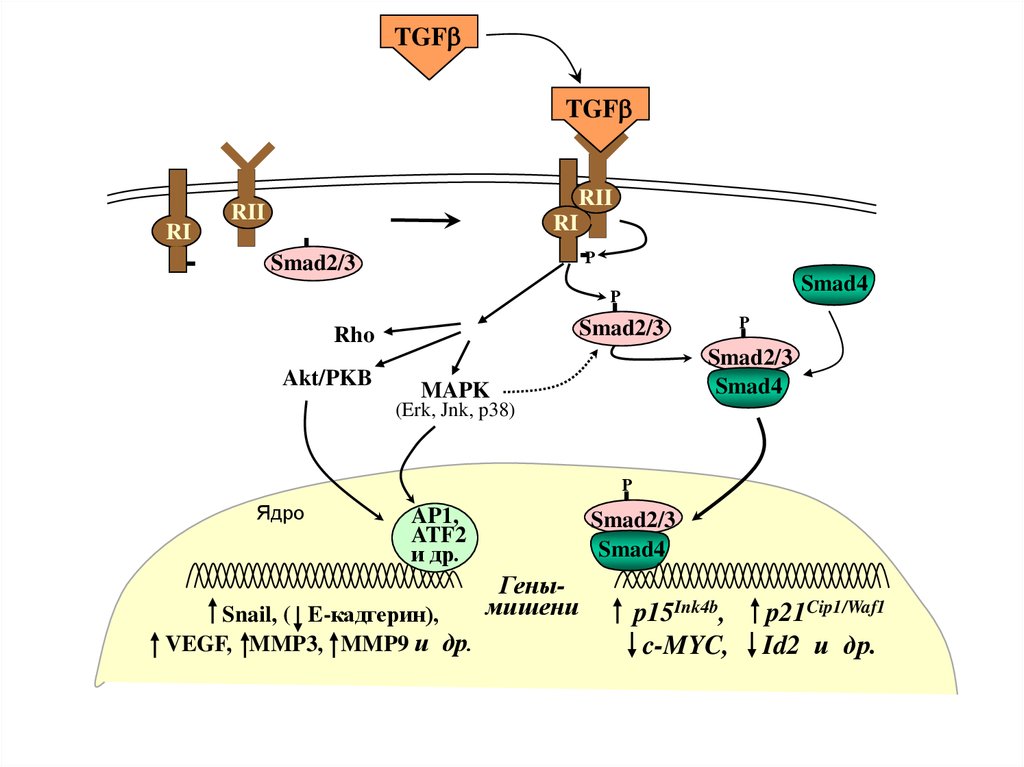
TGFbTGFb
RI
RII
RII
RI
P
Smad2/3
Smad4
P
Akt/PKB
P
Smad2/3
Rho
Smad2/3
Smad4
MAPK
(Erk, Jnk, p38)
P
Ядро
AP1,
ATF2
и др.
Snail, ( E-кадгерин),
VEGF, MMP3, MMP9 и др.
Smad2/3
Smad4
Генымишени
p15Ink4b,
c-MYC,
p21Cip1/Waf1
Id2 и др.
37.
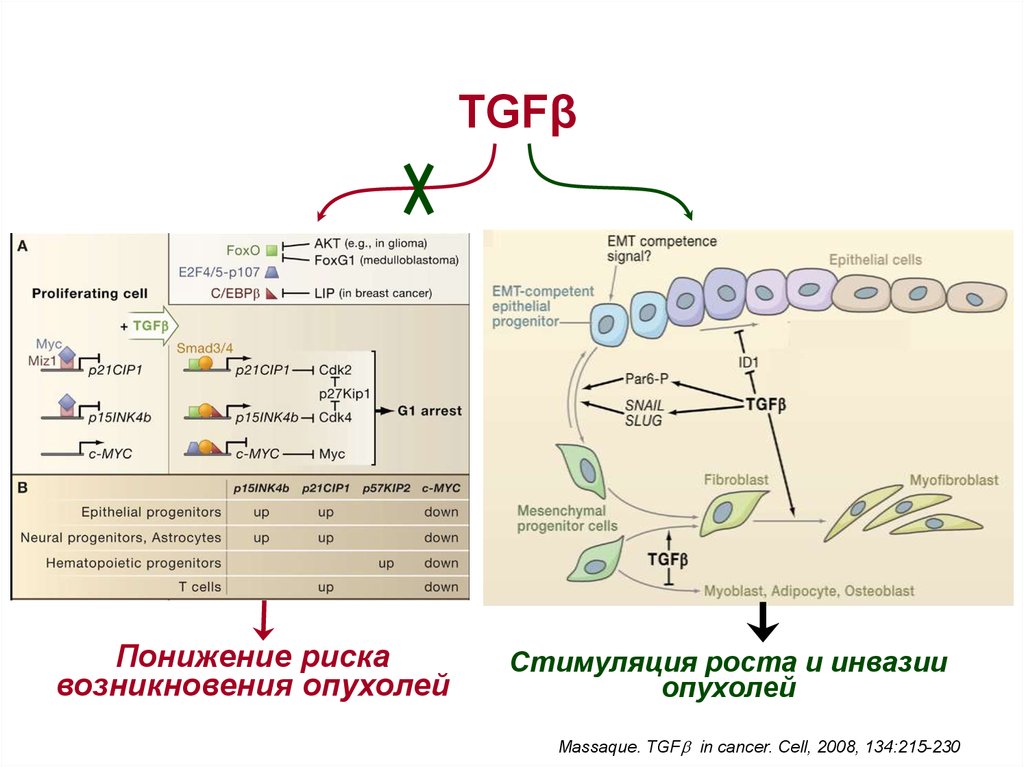
TGFβПодавление размножения
Локомоторный фенотип (ЭМП и др.),
секреция металлопротеаз
образование миофибробластов
Стимуляция инвазии и роста
возникших опухолей
Понижение риска
возникновения опухолей
Стимуляция роста и инвазии
опухолей
Massaque. TGFb in cancer. Cell, 2008, 134:215-230
38.
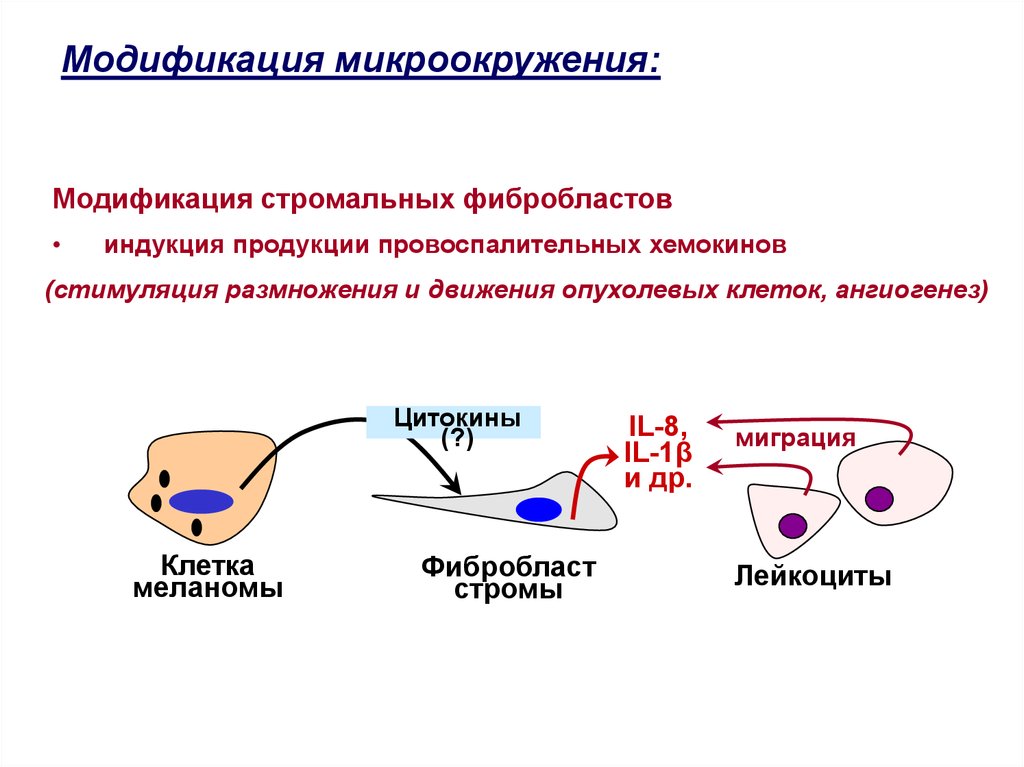
Модификация микроокружения:Модификация стромальных фибробластов
индукция продукции провоспалительных хемокинов
(стимуляция размножения и движения опухолевых клеток, ангиогенез)
Цитокины
(?)
Клетка
меланомы
Фибробласт
стромы
IL-8,
IL-1β
и др.
миграция
Лейкоциты
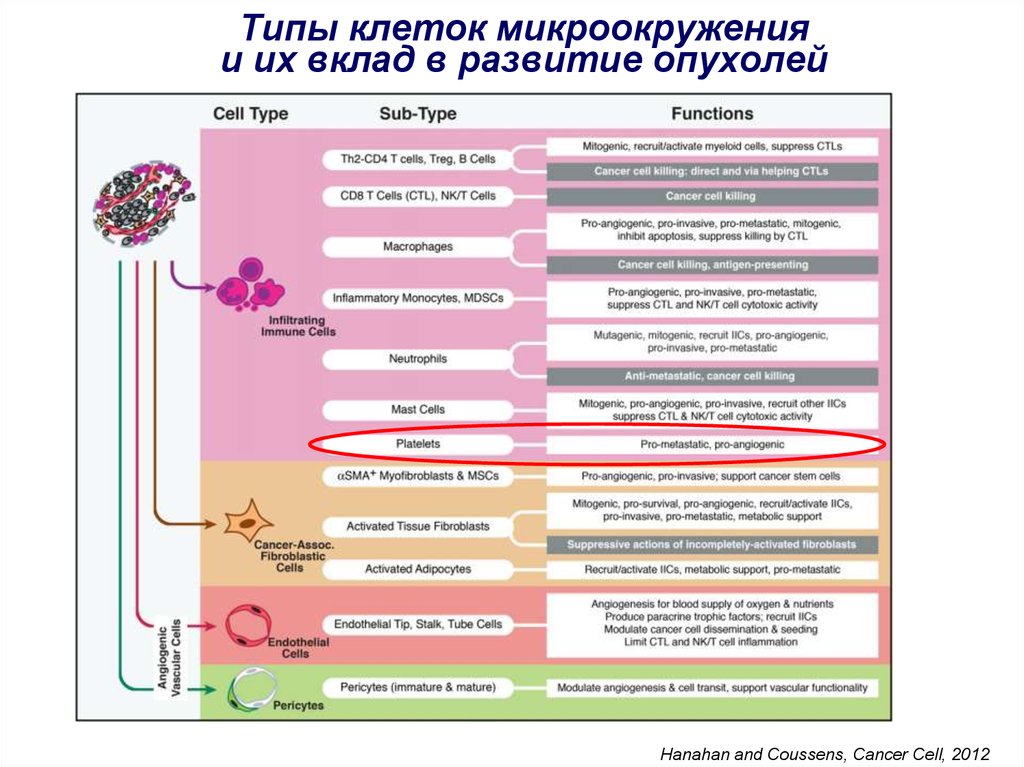
39. Типы клеток микроокружения и их вклад в развитие опухолей
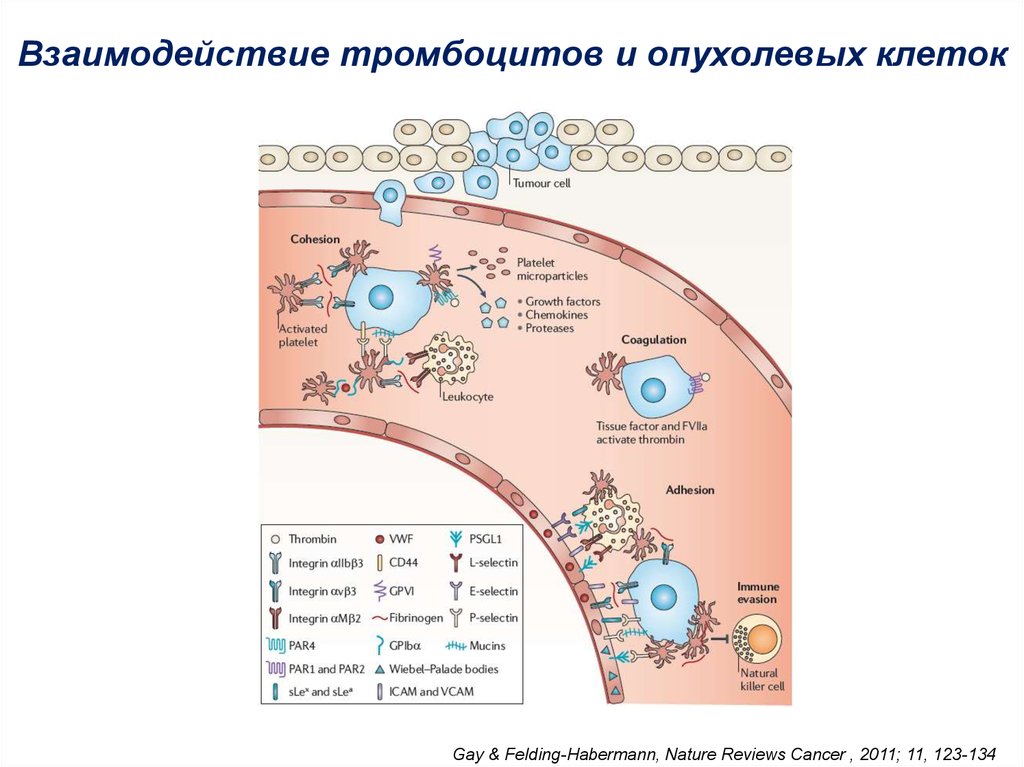
Hanahan and Coussens, Cancer Cell, 201240. Взаимодействие тромбоцитов и опухолевых клеток
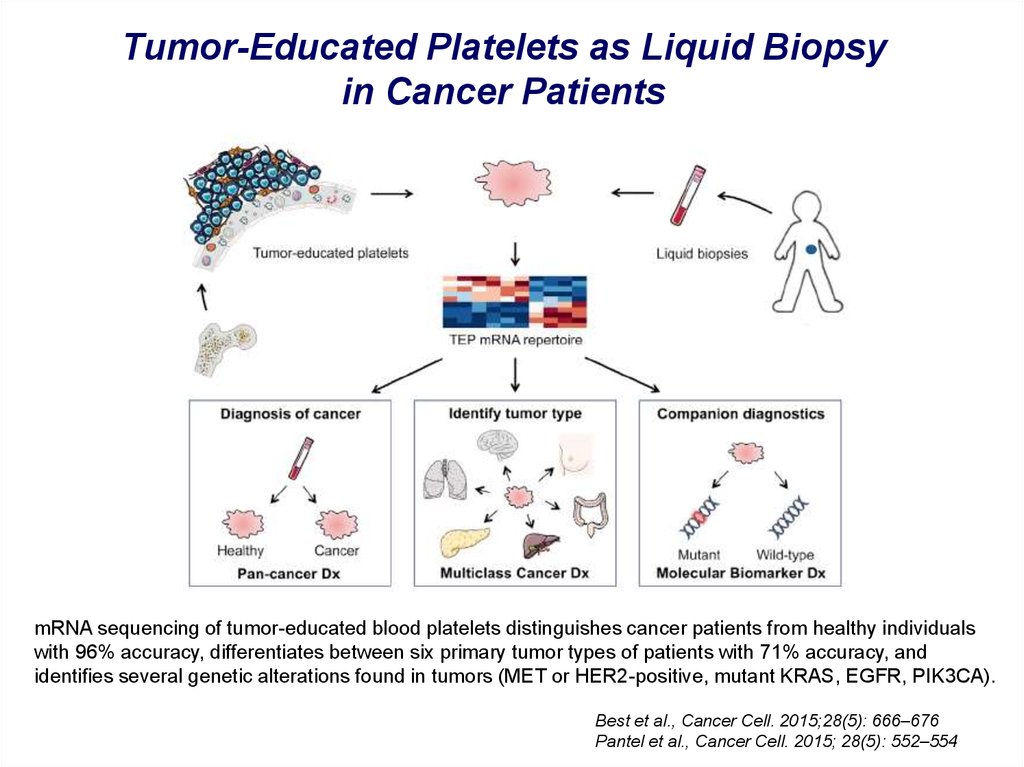
Gay & Felding-Habermann, Nature Reviews Cancer , 2011; 11, 123-13441. Tumor-Educated Platelets as Liquid Biopsy in Cancer Patients
mRNA sequencing of tumor-educated blood platelets distinguishes cancer patients from healthy individualswith 96% accuracy, differentiates between six primary tumor types of patients with 71% accuracy, and
identifies several genetic alterations found in tumors (MET or HER2-positive, mutant KRAS, EGFR, PIK3CA).
Best et al., Cancer Cell. 2015;28(5): 666–676
Pantel et al., Cancer Cell. 2015; 28(5): 552–554
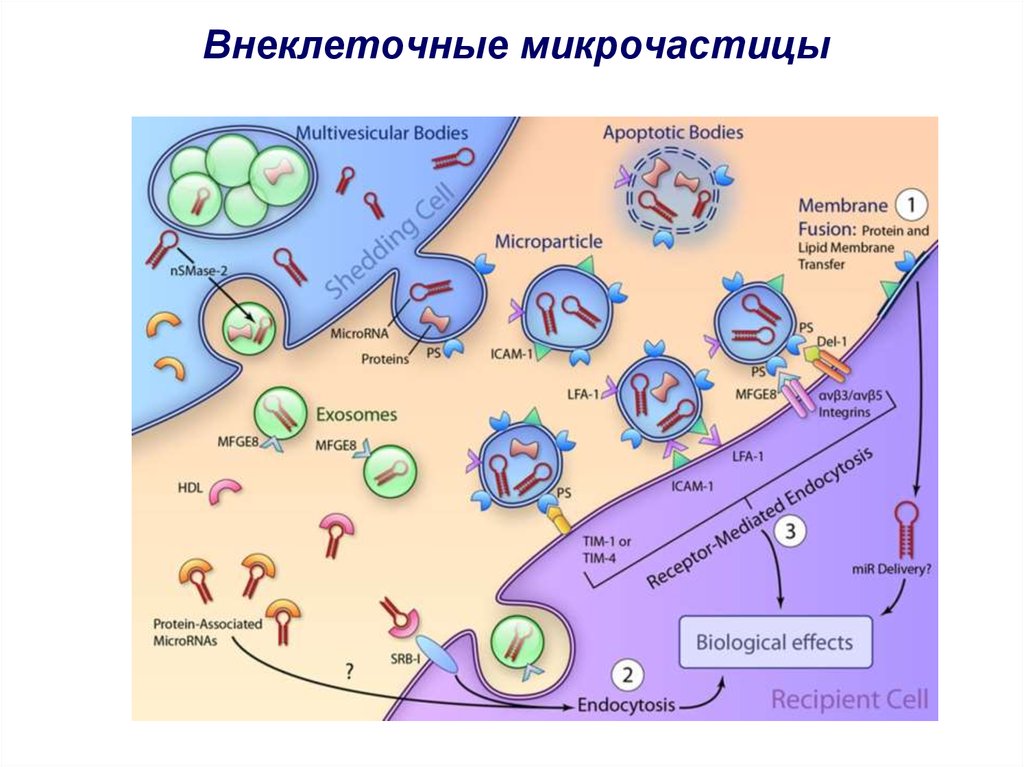
42. Внеклеточные микрочастицы (extracellular vesicles) – ещё один уровень регуляции взаимоотношений опухоли и микроокружения
43. Внеклеточные микрочастицы
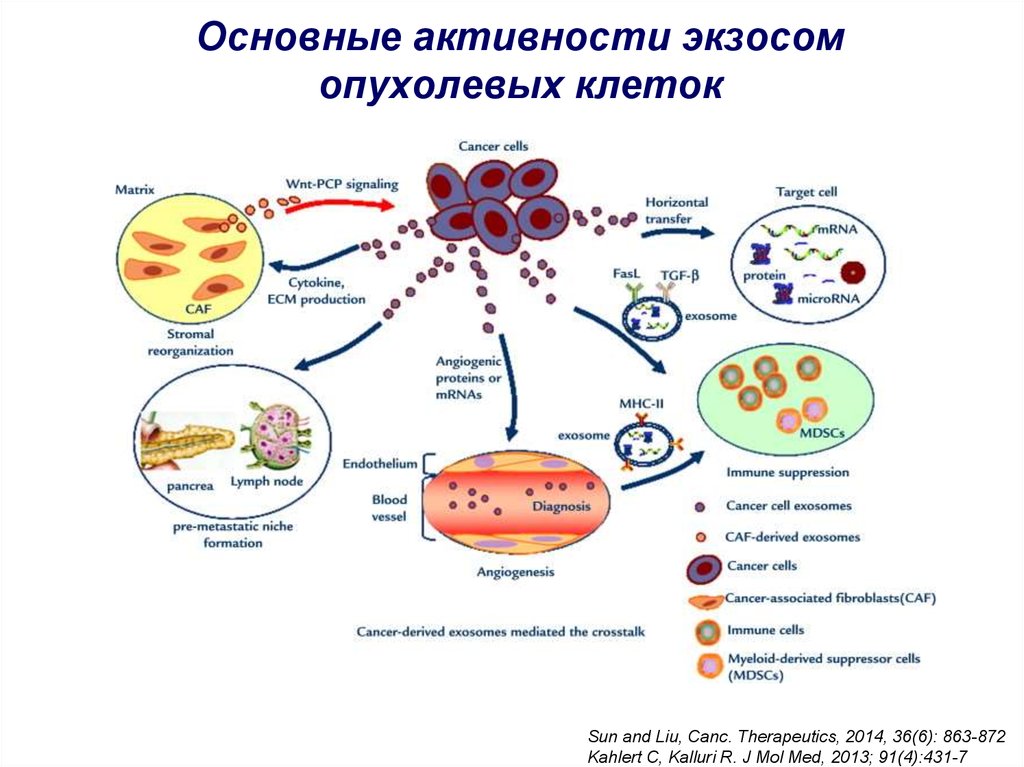
44. Основные активности экзосом опухолевых клеток
Sun and Liu, Canc. Therapeutics, 2014, 36(6): 863-872Kahlert C, Kalluri R. J Mol Med, 2013; 91(4):431-7
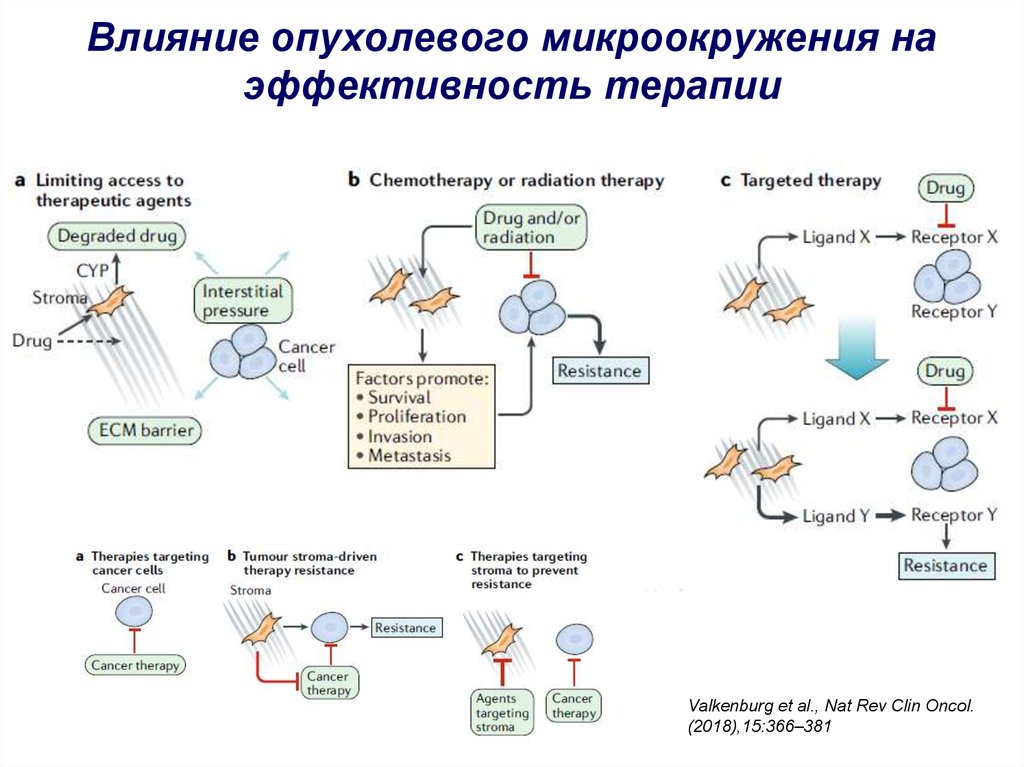
45. Влияние опухолевого микроокружения на эффективность терапии
Valkenburg et al., Nat Rev Clin Oncol.(2018),15:366–381
46.
Модификация микроокружения:Деградация белков внеклеточного матрикса
Стимуляция ангиогенеза
Создание воспалительного микроокружения
Модификация стромы
Защита от иммунного ответа (лекция 10)
47.
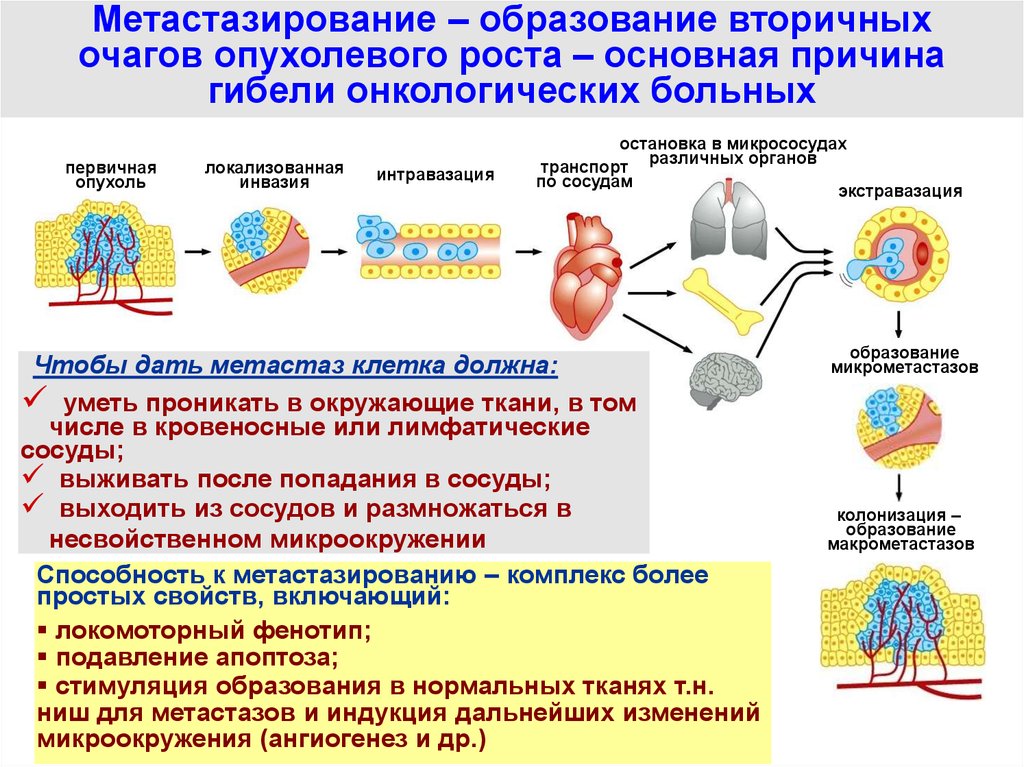
Метастазирование – образование вторичныхочагов опухолевого роста – основная причина
гибели онкологических больных
первичная
опухоль
локализованная
инвазия
интравазация
остановка в микрососудах
различных органов
транспорт
по сосудам
экстравазация
Чтобы дать метастаз клетка должна:
уметь проникать в окружающие ткани, в том
числе в кровеносные или лимфатические
сосуды;
выживать после попадания в сосуды;
выходить из сосудов и размножаться в
несвойственном микроокружении
Способность к метастазированию – комплекс более
простых свойств, включающий:
локомоторный фенотип;
подавление апоптоза;
стимуляция образования в нормальных тканях т.н.
ниш для метастазов и индукция дальнейших изменений
микроокружения (ангиогенез и др.)
образование
микрометастазов
колонизация –
образование
макрометастазов
48.
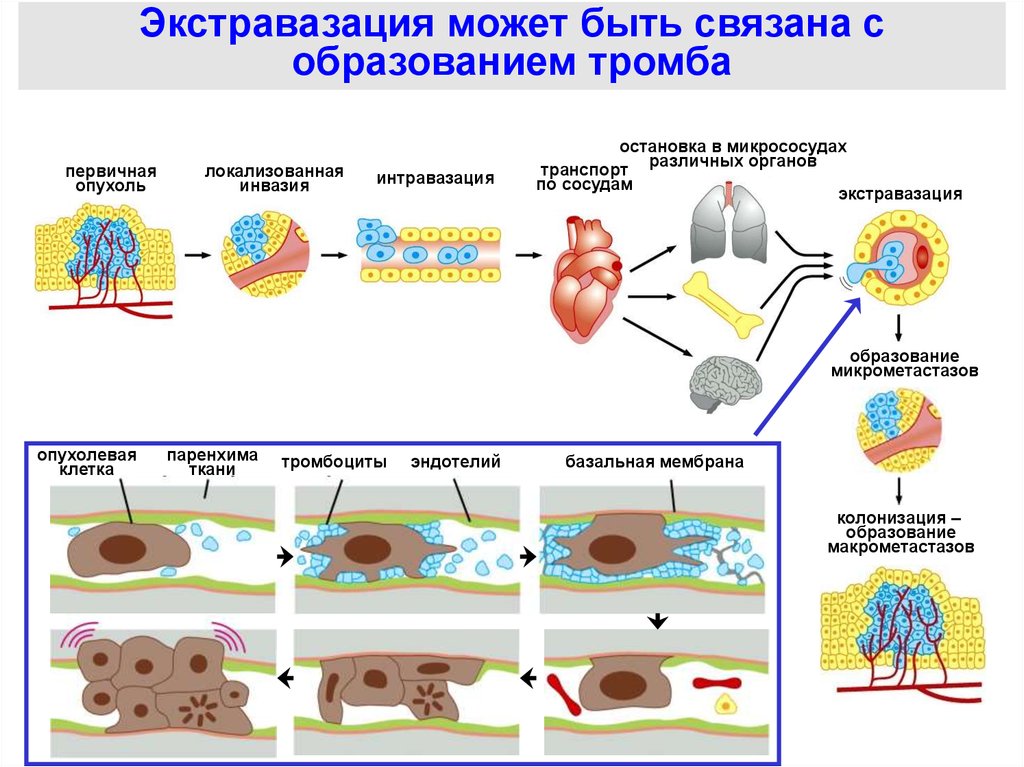
Экстравазация может быть связана собразованием тромба
первичная
опухоль
локализованная
инвазия
интравазация
остановка в микрососудах
различных органов
транспорт
по сосудам
экстравазация
образование
микрометастазов
опухолевая
клетка
паренхима
ткани
тромбоциты
эндотелий
базальная мембрана
колонизация –
образование
макрометастазов
49.
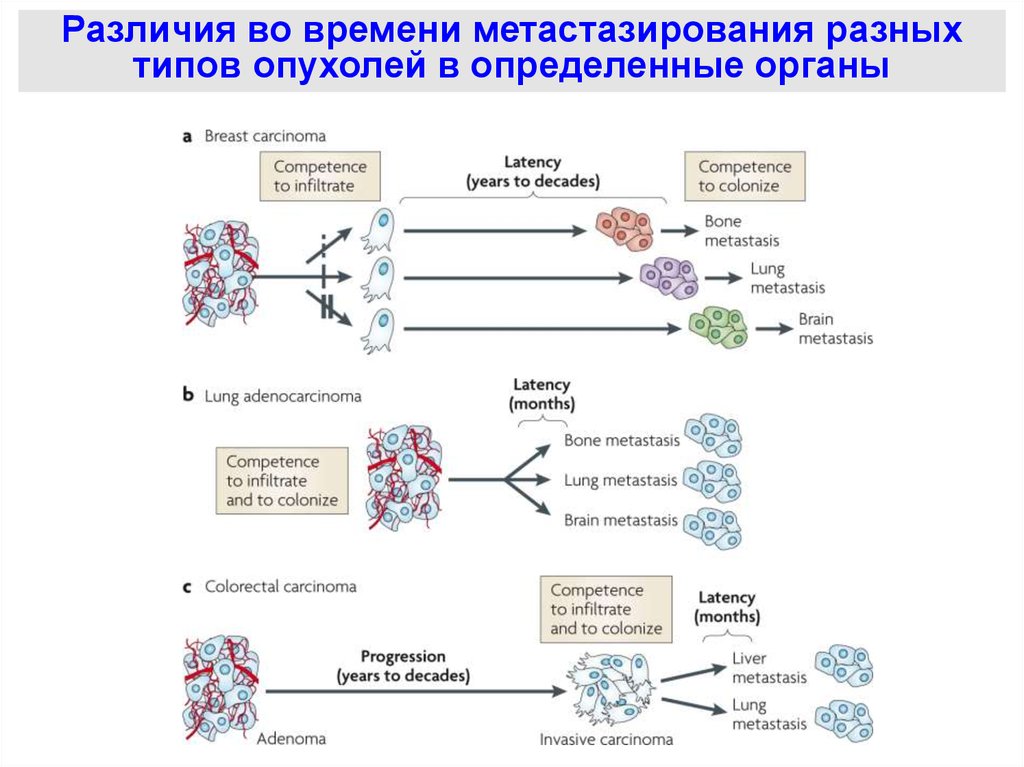
Различия во времени метастазирования разныхтипов опухолей в определенные органы
50.
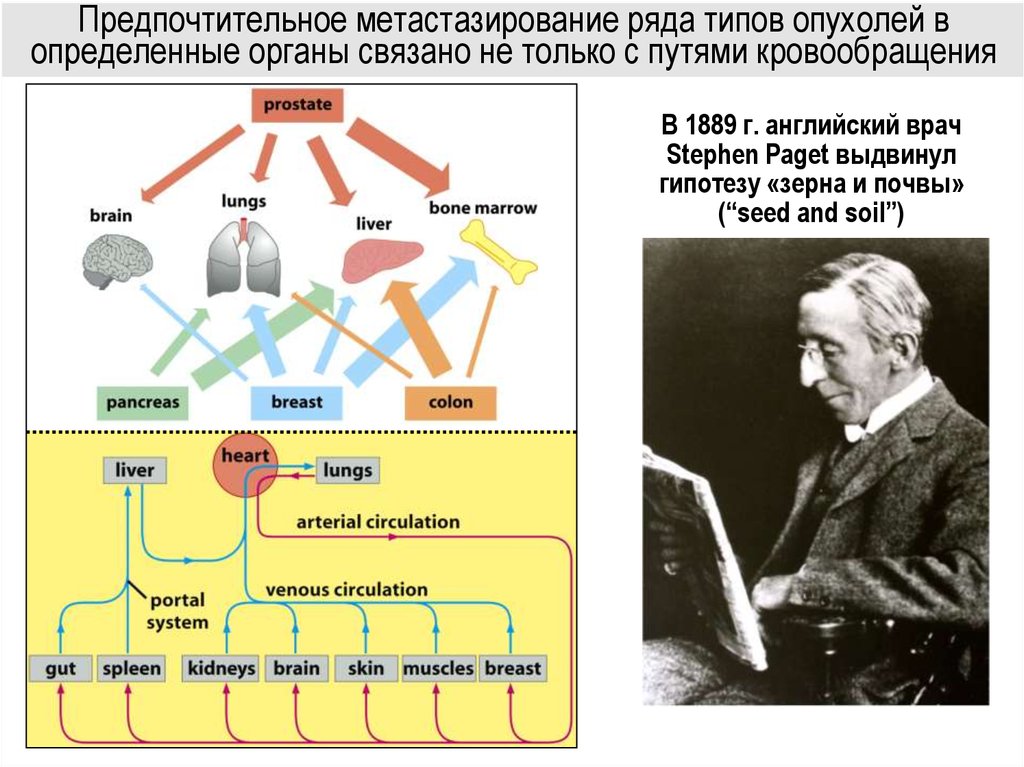
Предпочтительное метастазирование ряда типов опухолей вопределенные органы связано не только с путями кровообращения
В 1889 г. английский врач
Stephen Paget выдвинул
гипотезу «зерна и почвы»
(“seed and soil”)
51.
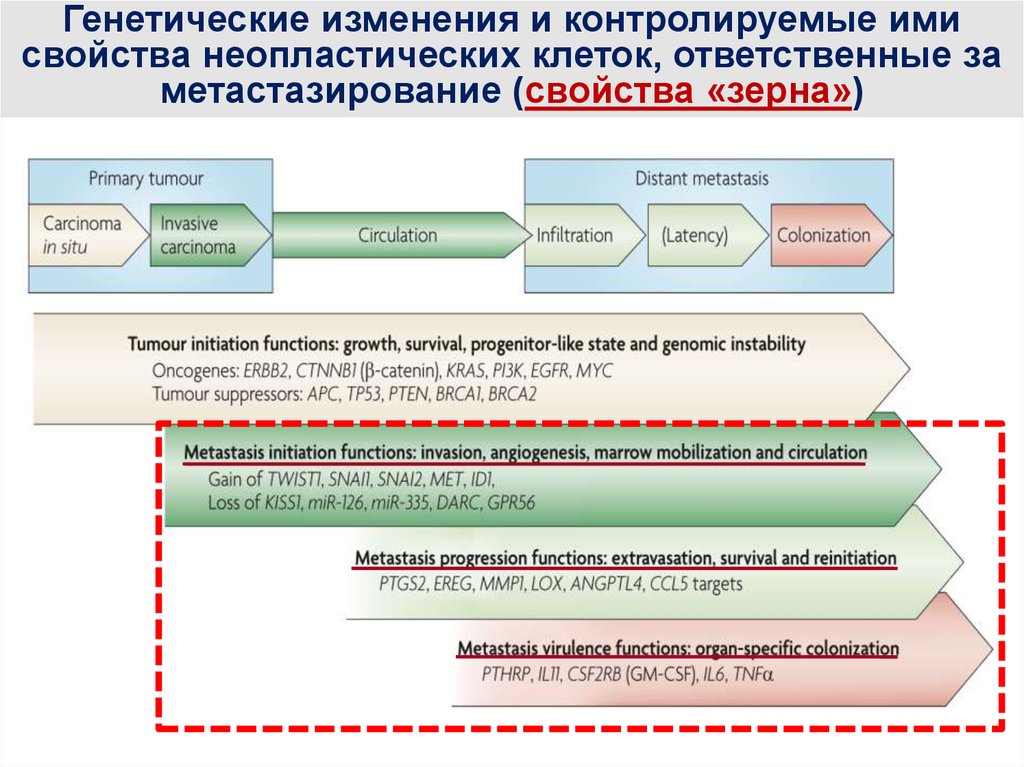
Генетические изменения и контролируемые имисвойства неопластических клеток, ответственные за
метастазирование (свойства «зерна»)
52.
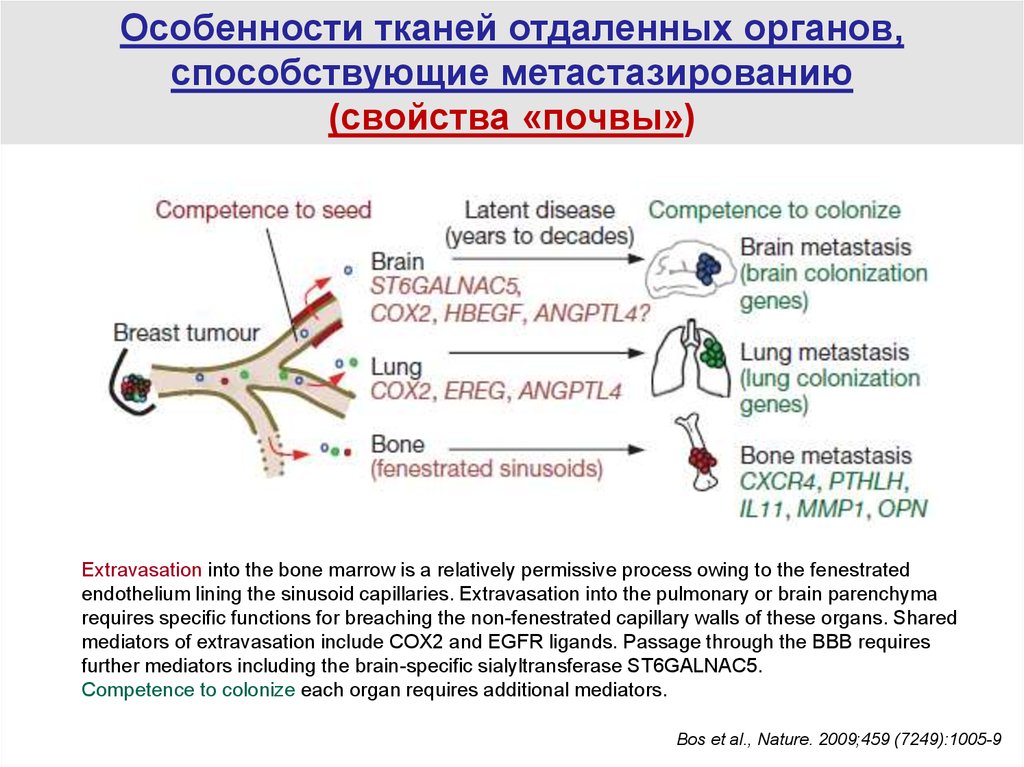
Особенности тканей отдаленных органов,способствующие метастазированию
(свойства «почвы»)
Extravasation into the bone marrow is a relatively permissive process owing to the fenestrated
endothelium lining the sinusoid capillaries. Extravasation into the pulmonary or brain parenchyma
requires specific functions for breaching the non-fenestrated capillary walls of these organs. Shared
mediators of extravasation include COX2 and EGFR ligands. Passage through the BBB requires
further mediators including the brain-specific sialyltransferase ST6GALNAC5.
Competence to colonize each organ requires additional mediators.
Bos et al., Nature. 2009;459 (7249):1005-9
53.
Модификация тканей отдаленных органов,способствующих метастазированию
(изменения «почвы»)
Ключевой этап метастазирования –
образование в нормальных тканях «ниш»,
привлекающих опухолевые клетки и
стимулирующих их дальнейшее размножение
(Kaplan et al., Nature, 2005, v.438, p.820-827;
Hiratsuka et al., Nature Cell Biol., 2006, v. 8, 1369-1375)
54.
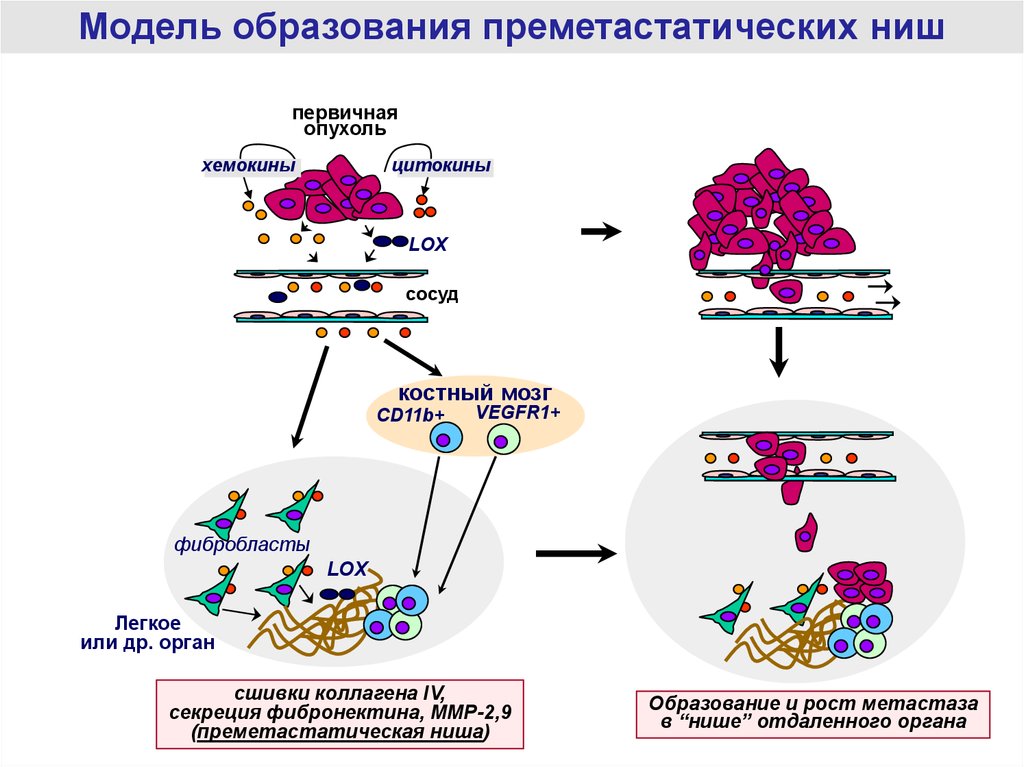
Модель образования преметастатических нишпервичная
опухоль
хемокины
цитокины
LOX
сосуд
костный мозг
CD11b+
VEGFR1+
фибробласты
LOX
Легкое
или др. орган
сшивки коллагена IV,
секреция фибронектина, MMP-2,9
(преметастатическая ниша)
Образование и рост метастаза
в “нише” отдаленного органа
55.
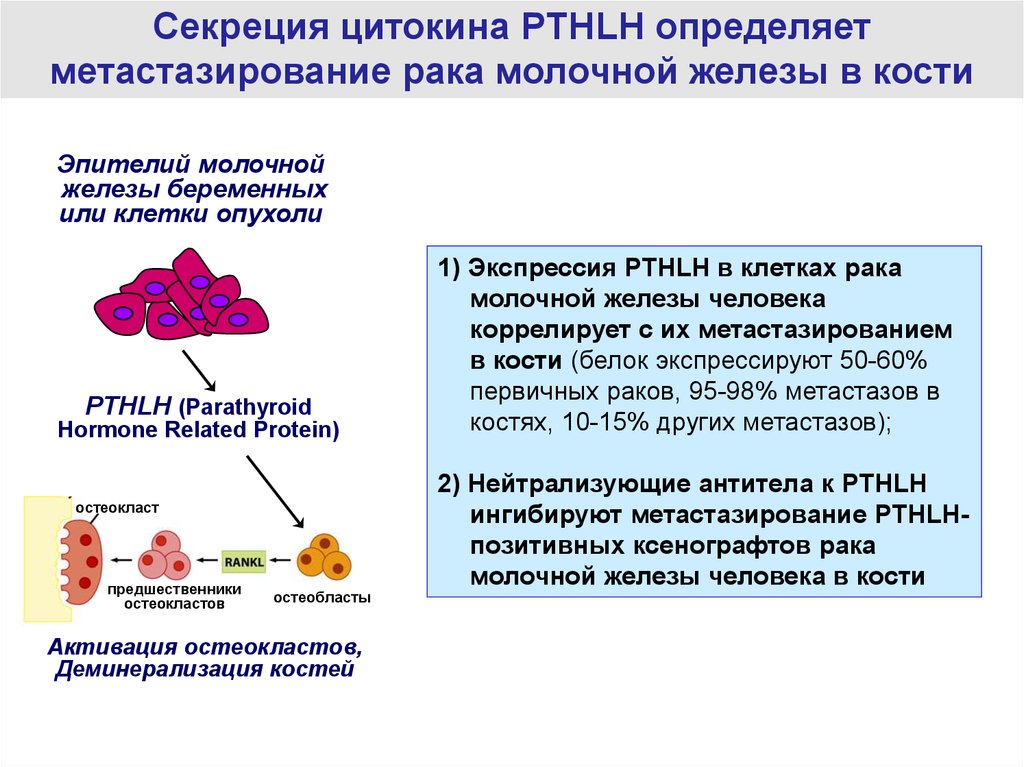
Секреция цитокина PTHLH определяетметастазирование рака молочной железы в кости
Эпителий молочной
железы беременных
или клетки опухоли
PTHLH (Parathyroid
Hormone Related Protein)
остеокласт
предшественники
остеокластов
остеобласты
Активация остеокластов,
Деминерализация костей
1) Экспрессия PTHLH в клетках рака
молочной железы человека
коррелирует с их метастазированием
в кости (белок экспрессируют 50-60%
первичных раков, 95-98% метастазов в
костях, 10-15% других метастазов);
2) Нейтрализующие антитела к PTHLH
ингибируют метастазирование PTHLHпозитивных ксенографтов рака
молочной железы человека в кости
56.
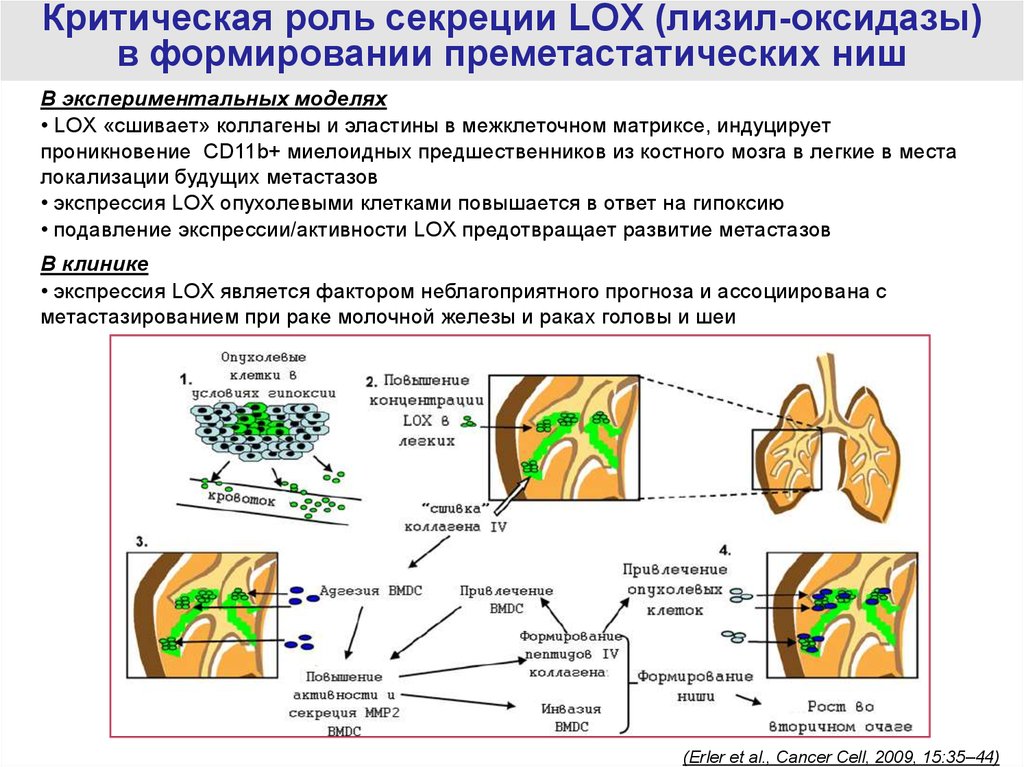
Критическая роль секреции LOX (лизил-оксидазы)в формировании преметастатических ниш
В экспериментальных моделях
• LOX «сшивает» коллагены и эластины в межклеточном матриксе, индуцирует
проникновение СD11b+ миелоидных предшественников из костного мозга в легкие в места
локализации будущих метастазов
• экспрессия LOX опухолевыми клетками повышается в ответ на гипоксию
• подавление экспрессии/активности LOX предотвращает развитие метастазов
В клинике
• экспрессия LOX является фактором неблагоприятного прогноза и ассоциирована с
метастазированием при раке молочной железы и раках головы и шеи
(Erler et al., Cancer Cell, 2009, 15:35–44)
57.
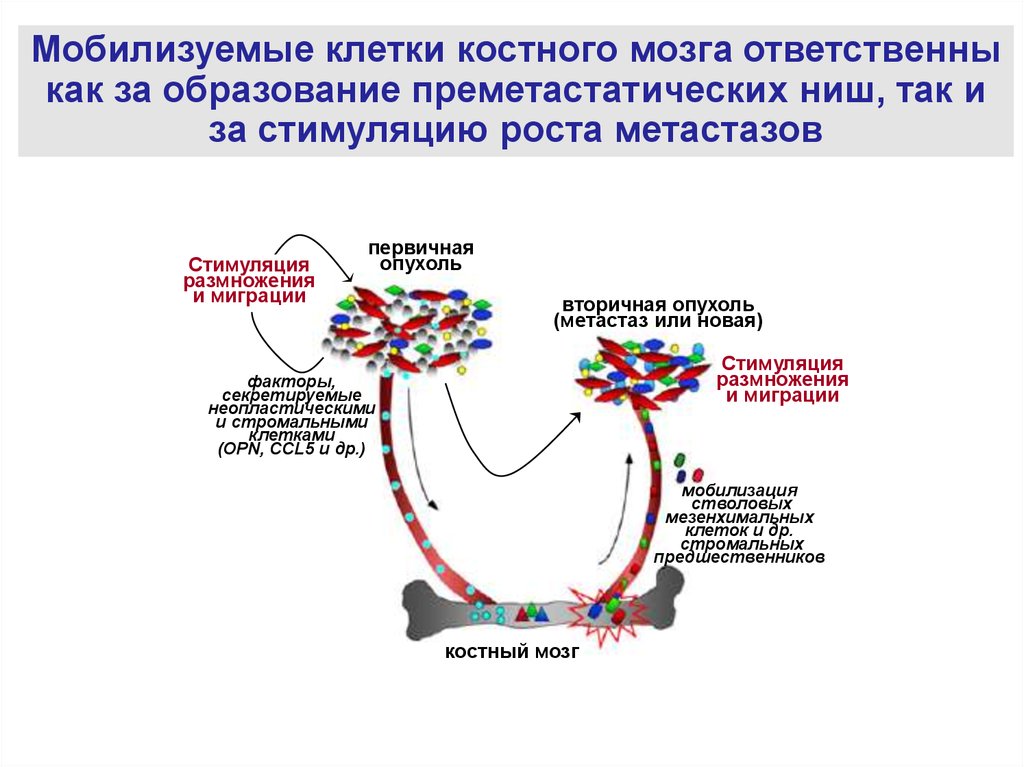
Мобилизуемые клетки костного мозга ответственныкак за образование преметастатических ниш, так и
за стимуляцию роста метастазов
Стимуляция
размножения
и миграции
первичная
опухоль
вторичная опухоль
(метастаз или новая)
Стимуляция
размножения
и миграции
факторы,
секретируемые
неопластическими
и стромальными
клетками
(OPN, CCL5 и др.)
мобилизация
стволовых
мезенхимальных
клеток и др.
стромальных
предшественников
костный мозг
58.
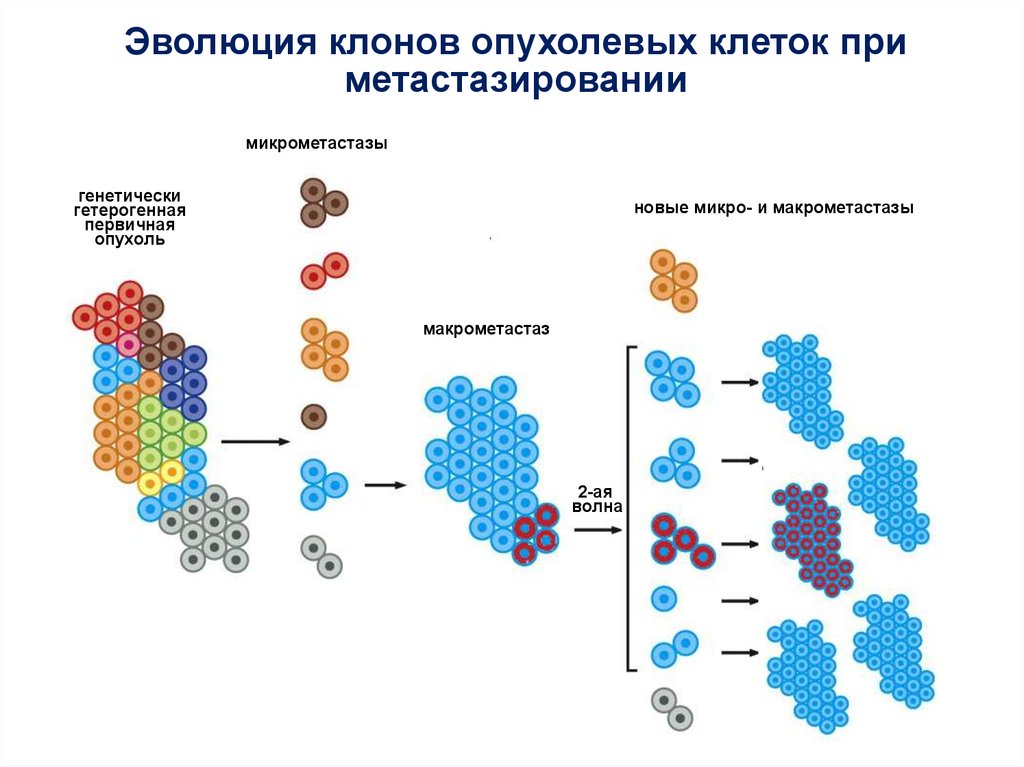
Эволюция клонов опухолевых клеток приметастазировании
микрометастазы
генетически
гетерогенная
первичная
опухоль
новые микро- и макрометастазы
макрометастаз
2-ая
волна
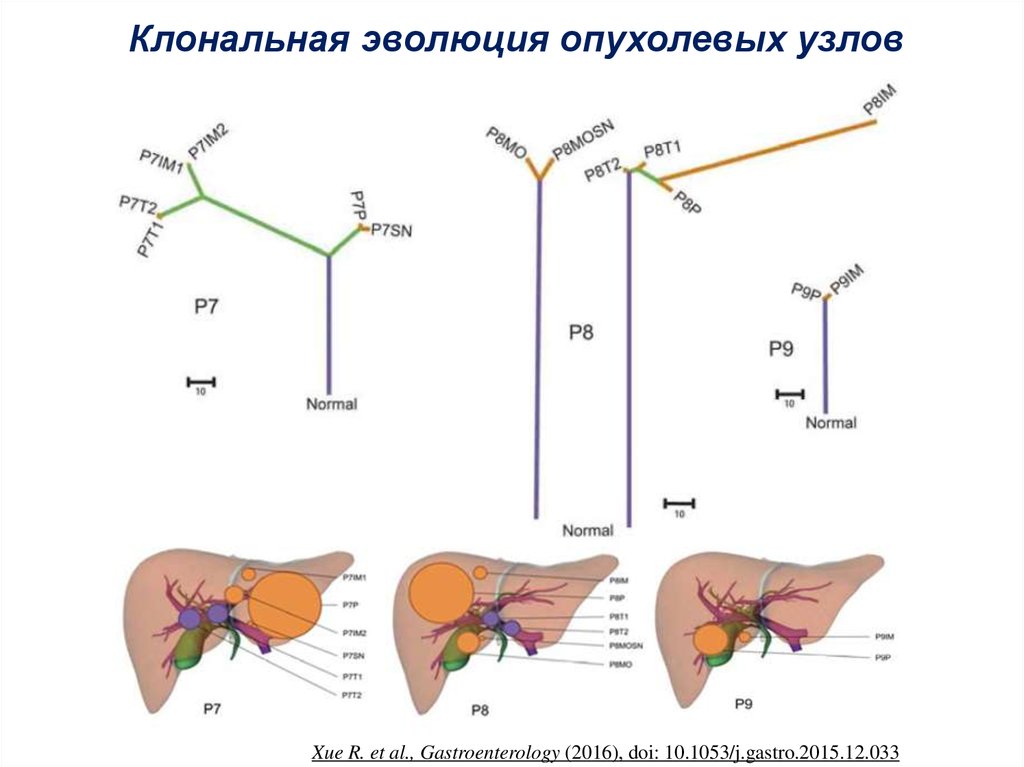
59. Клональная эволюция опухолевых узлов
Xue R. et al., Gastroenterology (2016), doi: 10.1053/j.gastro.2015.12.03360.
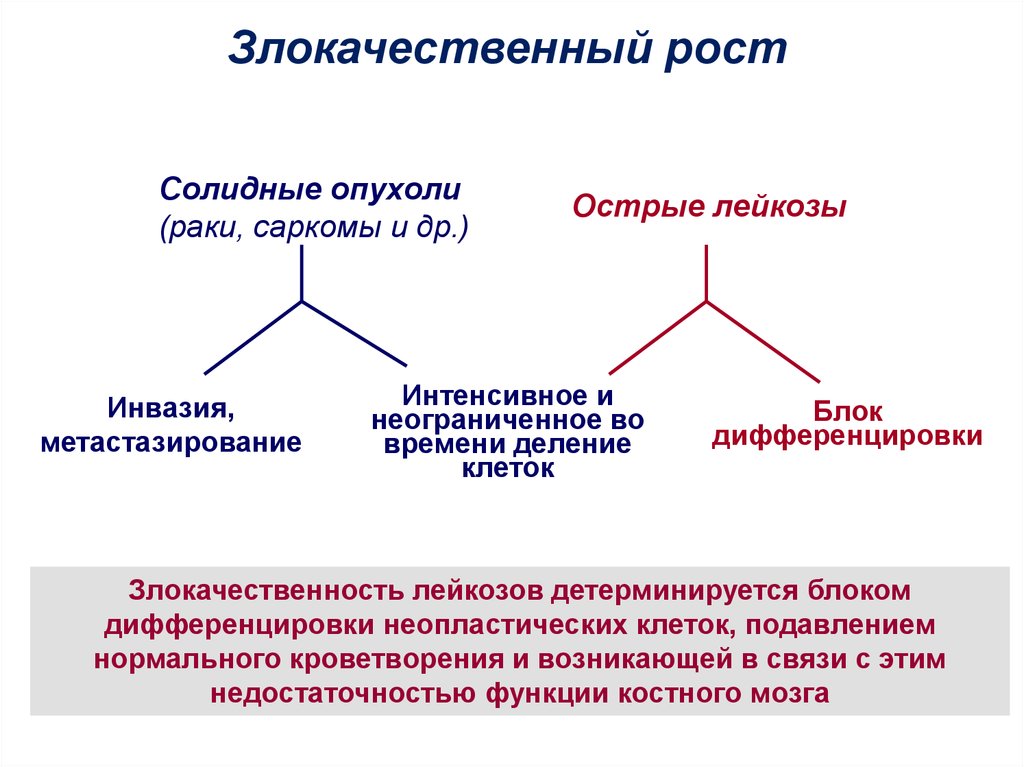
Злокачественный ростСолидные опухоли
(раки, саркомы и др.)
Инвазия,
метастазирование
Острые лейкозы
Интенсивное и
неограниченное во
времени деление
клеток
Блок
дифференцировки
Злокачественность лейкозов детерминируется блоком
дифференцировки неопластических клеток, подавлением
нормального кроветворения и возникающей в связи с этим
недостаточностью функции костного мозга
61.
Курс «Биология опухолевой клетки»(2019 г.)
Н.Л. Лазаревич
Лекция 8
Опухолевый супрессор р53: как один белок
контролирует многие аспекты канцерогенеза














 Медицина
Медицина








