Похожие презентации:
Химический элемент алюминий
1. Алюминий
АЛЮМИНИЙРаботу выполнил
Ученик 11-"В" класса
Филиппов Антон
2.
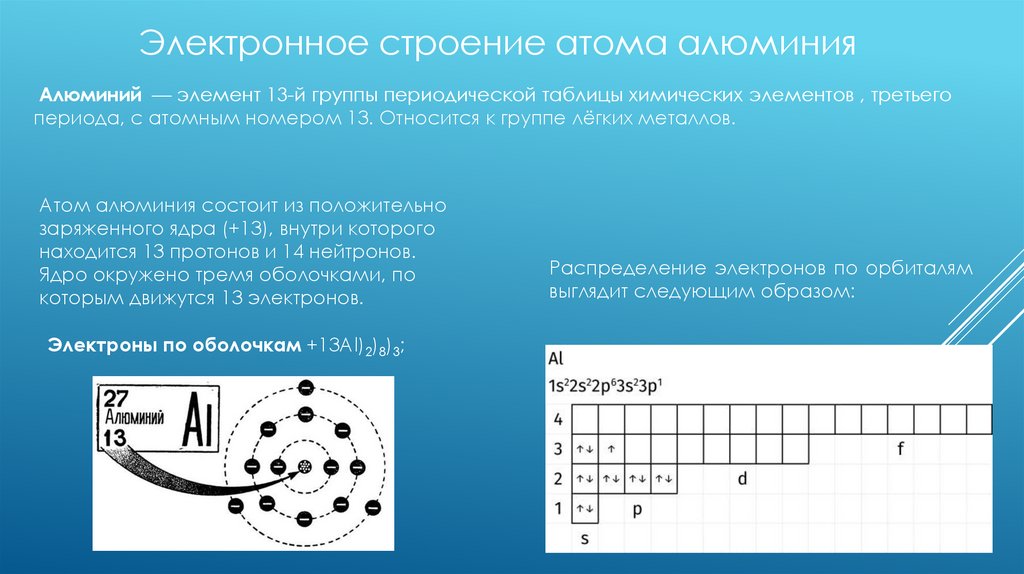
Электронное строение атома алюминияАлюминий — элемент 13-й группы периодической таблицы химических элементов , третьего
периода, с атомным номером 13. Относится к группе лёгких металлов.
Атом алюминия состоит из положительно
заряженного ядра (+13), внутри которого
находится 13 протонов и 14 нейтронов.
Ядро окружено тремя оболочками, по
которым движутся 13 электронов.
Электроны по оболочкам +13Al)2)8)3;
Распределение электронов по орбиталям
выглядит следующим образом:
3.
История открытия и названиеНазвание элемента образовалось
от лат. alumen - квасцы. Квасцы двойные соли, кристаллогидраты
сульфатов трёх и одновалентных
металлов.
Впервые алюминий был получен датским
физиком Гансом Эрстедом в 1825 году. Он
восстановил хлорид этого элемента амальгамой
калия при нагревании и выделил металл. Позже
способ Эрстеда был улучшен Фридрихом Вёлером,
он использовал для восстановления хлорида алюминия
до металла чистый металлический калий и он же
описал химические свойства алюминия.
Алюминиевый квасец
Ханс Кристиан Эрстед
Фридрих Вёлер
4.
Нахождение в природеПо распространённости в земной коре
занимает 1-е место среди металлов и 3-е
место среди элементов, уступая
только кислороду и кремнию. Массовая
концентрация алюминия в земной коре, по
данным различных исследователей,
оценивается от 7,45 до 8,14 %
В природе алюминий, в связи с высокой
химической активностью, встречается почти
исключительно в виде соединений. Некоторые
из природных минералов алюминия:
Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Глинозёмы (смеси каолинов с песком
SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд (сапфир, рубин, наждак) — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых
специфических
восстановительных условиях
(жерла вулканов) найдены
ничтожные
количества самородного
металлического алюминия
5.
Физические свойвстваАлюминий — серебристо-белый лёгкий металл. Решётка
алюминия кубическая гранцентрированная. Алюминий
высокой чистоты (99,996%) характеризуется следующими
физическими свойствами: плотность 2698,9 кг/м3, t
плавления 660,24°С, t кипения 2500°С, теплопроводность 343
Вт/м • К, удельная теплоёмкость 931,98 Дж/кг • Алюминий
обладает невысокими прочностью (предел прочности при
растяжении 50-60 МПа) и твёрдостью , но
высокой пластичностью (до 50%). Алюминий хорошо
полируется, анодируется и имеет высокую отражательную
способность (90%). На воздухе алюминий покрывается
тонкой прочной плёнкой, предохраняющей металл от
дальнейшего окисления и коррозии.
Микроструктура алюминия на протравленной
поверхности слитка, чистотой 99,9998 %
6.
Влияние на живые организмы, техника безопасностиНесмотря на широкую распространённость в природе, на
данный момент не известно ни одно живое существо,
использующее алюминий в метаболизме — это «мёртвый»
металл. Отличается слабым токсическим действием
(намного меньшим, чем у «тяжелых» металлов), но многие
растворимые в воде неорганические соединения алюминия
сохраняются в растворённом состоянии длительное время и
могут оказывать вредное воздействие на человека и
теплокровных животных через питьевую воду. Наиболее
ядовиты хлориды, нитраты, ацетаты, сульфаты и др.
Норматив содержания алюминия в воде хозяйственнопитьевого использования в России составляет 0,2 мг/л
7.
ПрименениеШироко применяется как конструкционный материал.
Популярный в производстве кухонной посуды, алюминиевой
фольги в пищевой промышленности и для упаковки, основным
сырьём в авиационной и авиакосмической промышленности (в
последнее время медленно вытесняется композитными
материалами, в первую очередь, углеволокном).
Когда алюминий был очень дорог, из него делали
разнообразные ювелирные изделия. В Японии алюминий
используется в производстве традиционных украшений,
заменяя серебро. Алюминий и его соединения используются в
качестве высокоэффективного ракетного горючего в
двухкомпонентных ракетных топливах и в качестве горючего
компонента в твёрдых ракетных топливах.
8.
Интересные фактыСоединения алюминия встречаются не только на Земле, но и на Луне и Марсе;
Уже сейчас используется «алюмированная» ткань, которая покрыта тонким слоем этого металла. Она
обладает свойствами последовательного согревания и охлаждения. Вещи из такой ткани являются
универсальными, одну и ту же вещь можно использовать как в жару, так и в холод!
Алюминий широко используется в производстве фейерверков, чтобы вызывать искрение и белое пламя, а
ещё он является ключевым компонентом такой праздничной забавы, как «бенгальские огни».






 Химия
Химия








