Похожие презентации:
Қазақстан Республикасының Мемлекеттік фармакопеясы
1.
Қазақстан Республикасының Мемлекеттік фармакопеясы - біздіңеліміздегі дәрілер мен медициналық мақсаттағы бұйымдар
сапасының басты стандарты
Орындаған: Жылқайдар Д.Ғ.
ТОбы:501 «А»
Тексерген: Тегисбаев Е.Т
2.
2015 жылдың желтоқсан айында Қазақстан Республикасының Мемлекеттік фармакопеясының екіншібасылымының (ГФ РК 2.0) I томын жариялау жүзеге асырылды [1], Еуропалық фармакопея,
Британдық фармакопея және АҚШ Фармакопея стандарттарымен үйлестірілген [2-4]. 2008 жылдан
бастап қолданылатын Қазақстан Республикасының Мемлекеттік фармакопеясының (ҚР МФ)
талаптары Республиканың фармацевтикалық нарығын нормативтік реттеудің ажырамас бөлігіне
айналды. ҚР МФ жұмыс істеу кезеңінде фармакопея талаптарында да, сондай-ақ оның еліміздегі
дәрілік заттар сапасының басты стандартының рөлін түсінуде да елеулі өзгерістер болды. ҚР МФ
екінші басылымының жарыққа шығуына байланысты фармакопея мәртебесін және оның орын алған
өзгерістер контексіндегі маңыздылығын қарастыру орынды болып табылады.ҚР МФ құру қазақ
мемлекеттілігінің қалыптасуы мен дамуының барлық ғасырлық тарихында алғаш рет жүзеге
асырылады. Қазақстанның Ресей құрамында, содан кейін КСРО құрамында қызмет еткен кезеңінде
дәрілік заттардың сапасын мемлекеттік бақылау мемлекеттік орыс фармакопеясының стандарттары
мен ережелерінің арқасында, ал 1926 жылдан бастап КСРО Мемлекеттік фармакопеясының (КСРО
МФ) стандарттары мен ережелерінің арқасында жүргізілді. Алайда жаңа экономикалық жағдайларда
Қазақстанның фармацевтикалық нарығын егеменді мемлекет ретінде дамыту бұрынғы құқықтық
актілермен, оның ішінде фармакопеяның кеңестік басылымдарымен толық көлемде регламенттей
алмайтын өз ерекшеліктері болды. Жаһандық деңгейдегі дәрілік заттар сапасының қазіргі заманғы
тұжырымдамасы, аналитикалық эксперимент техникасындағы айтарлықтай ілгерілеу КСРО МФ ХІ
көптеген ережелерінің ескіруіне әкеп соқтырды.
3.
Қалыптасқан тарихи жағдайларда ұлттық фармакопеялық стандарттарды құрудыМемлекет басшысы қоғам денсаулығын сақтау мақсатында уақыттың маңызды
талабы ретінде айқындаған. Алғаш рет ҚР МФ құру қажеттілігі Қазақстан
Республикасы Президентінің "дәрілік заттар туралы" 1995 жылғы 23 қарашадағы
№ 2655 заң күші бар Жарлығымен анықталған. Ұлттық фармакопеялық
стандарттарды әзірлеу мәселесін одан әрі дамыту 2004 жылғы 13 қаңтардағы №
522-II "дәрілік заттар туралы" ҚР Заңында көрініс тапты.Ұлттық фармакопеялық
стандарттар болмаған кезде республикада дәрілік заттардың сапасын мемлекеттік
бақылауды дамытудағы маңызды қадам әлемнің негізгі фармакопеясын Еуропалық фармакопеяны, Британ фармакопеясын, АҚШ фармакопеясын және
неміс гомеопатиялық фармакопеясын тану болып табылды (ҚР ДСӘДМ
Фармация, фармацевтика және медицина өнеркәсібі комитетінің 2004 жылғы 11
ақпандағы №21 "халықаралық фармакопеяларды және ҚР аумағында дәрілік
заттардың сыныптамасын тану туралы"бұйрығы)
4.
ҚР МФ құру мемлекеттік қолдау арқылы 2005 жылдан бастап жүзегеасырылады. Фармакопеяның алғашқы басылымы үш томда
мемлекеттік (қазақ) және орыс тілдерінде жарияланған [5-7]. I және II
том 2008 жылы, III том 2015 жылы бекітілді және қолданысқа
енгізілді. ҚР МФ заңнамалық мәртебесі "Халық денсаулығы және
денсаулық сақтау жүйесі туралы"ҚР Кодексінде белгіленген.
5.
ҚР МФ әзірлеуші ұйымы ҚР ДСӘДМ "Дәрілік заттарды, медициналық мақсаттағыбұйымдарды және медициналық техниканы сараптау ұлттық орталығы" ШЖҚ
РМК (бұдан әрі – ұлттық орталық) болып табылады. Ұлттық орталық жаһандық
деңгейде фармакопеялық және реттеуші органдарда ҚР МФ ұсынады. Ұлттық
фармакопеялық стандарттарды дамыту және оларды ЕЭО шеңберінде үйлестіру
мақсатында оның құрылымында ҚР МФ және ЕАЭО фармакопеясын әзірлеу және
жетілдіру
орталығы
құрылды.
Орталық
құрамында
фармакопеялық
монографиялардың
жобаларын
қарауға
және
мақұлдауға,
сондай-ақ
фармакопеялық стандарттау саласындағы кез келген мәселелерді шешуге арналған
фармакопеялық комиссия жұмыс істейді.
6.
Бүкіл әлемде фармакопеяның жұмыс істеуі олардың миссиясыменайқындалады. Оның тұжырымдамаларының айырмашылығы барлық
жағдайларда олардың қауіпсіздігін, тиімділігі мен сапасын қамтамасыз
ететін дәрілік заттар сапасының мемлекеттік стандарттарын жасау
жолымен, негізінен, қоғамның денсаулығын сақтауға түсетін мәнде
көрсетілмейді. Сол мағына оның мақсаттарына шынайы ізгілікті сипат
бере отырып, ҚР МФ миссиясына берілген.ҚР МФ талаптары әлемнің
көптеген фармакопеяларымен қатар дәрілік заттарға ғана емес,
медициналық мақсаттағы бұйымдарға да қолданылады. Осыған
байланысты, ҚР МФ бастапқы анықтамасы медициналық практикада
қолданылатын құралдардың көрсетілген санатын қамтитын өзгеріске
ұшырады. Осылайша, ҚР МФ дәрілік заттар мен медициналық
мақсаттағы бұйымдардың сапасын нормалайтын мемлекеттік
стандарттар мен ережелердің жиынтығы болып табылады.
7.
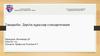
ҚР МФ дәрілік заттарды стандарттау жүйесінде орталық орын алады. Фармакопея мемлекеткепілдік беретін дәрілік заттар сапасының шекті рұқсат етілген деңгейін белгілейді.
Өндірушілердің ерекшеліктерімен регламенттелетін сапа деңгейі фармакопеялық талаптардан
төмен болмауы керек. Өндірушінің ерекшелігі негізінде уәкілетті органмен келісім бойынша
оның өмірлік циклінің барлық сатыларында сапаны бақылауға арналған дәрілік заттың сапасы
бойынша нормативтік құжат жасалады. Осылайша, фармакопея талаптары дәрілік заттардың
толық өмірлік циклін қамтиды. Жұмыс істеудің осындай тетігі дәрілік заттардың сапасын
мемлекеттік реттеудің басты құралы ретінде ҚР МФ рөлін айқындайды (1-сурет).
8.
9.
Фармакопея тиісті фармацевтикалық практикалармен тығыз байланысты(Gmp). Тиісті фармацевтикалық практикалар дәрілік нысанның әрбір
бірлігі үшін сериядан к сериясына фармакопея талаптарына сәйкестігін
қамтамасыз етуге арналған. Екінші жағынан, фармакопея талаптарын
орындау қажеттілігі дәрілік заттар айналымы саласында GxP енгізуді
және
тұрақты
қолдауды
ынталандырады.
ҚР
МФ
тиісті
фармацевтикалық практикаларымен қатар отандық Фарм өнімдерінің
бәсекеге қабілеттілігі мен экспортқа бағдарлануын қамтамасыз етудің
маңызды факторы болып табылады. Бұған ҚР МФ әлемнің негізгі
фармакопеяларымен үйлесуі де ықпал етеді.
10.
Әлемнің негізгі фармакопеяларының стандарттарымен үйлестіру ҚР МФ құруғанегізделген басты қағидат болып табылады. Ұлттық фармакопеялық
стандарттарды әзірлеу тәжірибесін алу үшін республика әлемнің жетекші
фармакопеялық ұйымдарына, мысалы Еуропа Кеңесінің Еуропа фармакопеялық
комиссиясына бақылаушы ел ретінде (2006 жылғы маусым), АҚШ
фармакопеялық конвенциясына алдымен бақылаушы ел ретінде (2009 жылғы
шілде), содан кейін толық құқықты мүше ретінде (2010 жылғы қараша) кіру
жөнінде бірқатар маңызды қадамдарды жүзеге асырды. Әлемнің жетекші
фармакопеялық ұйымдарындағы бақылаушы немесе мүше елдің мәртебесі,
фармакопеялық стандарттау тәжірибесінен басқа, мынадай міндеттерді шешуге
мүмкіндік береді:
11.
- осы саладағы ұлттық тәсілдер мен даму жолдарын анықтау;- - әлемнің негізгі фармакопеяларының талаптарымен үйлестіру
мүмкіндігі;- сараптама топтарын жұмысқа тарту;
- - білім беру немесе ғылыми бағдарламаларға қатысу;
- - сынақ зертханаларын аккредиттеу және олардың Еуропа Кеңесінің
дәрілік заттар сапасын бақылау ресми зертханаларының
(OMCLGEON);
- - жаһандық фармакопеялық қызметке қосу (мысалы, жаһандық
фармакопея индексін құру, ДДҰ басшылығын "тиісті
фармакопеялық практика" (GPhP) дайындауға қатысу және т. б.);
- - ҚР МФ тәуелсіз мемлекеттің ұлттық фармакопеясының позициясы.
12.
Әлемнің негізгі фармакопеяларымен үйлестірудің міндетті шарты олардыңпатент иеленушілерінің авторлық құқықтарын сақтау болып табылады, бұл
фармакопеялық мәтіндерді үйлестіруге ресми рұқсатты талап етеді. Осы
Шартқа сәйкес 2007 жылы Еуропа Кеңесінің дәрілік заттардың сапасын бақылау
жөніндегі Еуропалық Директоратының (EDQM) рұқсаты алынды, 2010 жылы
АҚШ фармакопеялық конвенциясымен (USP) және 2014 жылы Ұлыбритания
дәрілік заттар мен денсаулық сақтау өнімдерінің айналымын реттеу жөніндегі
агенттігімен (MHRA) келісімдер жасалды. Осылайша, қазіргі уақытта ҚР МФ
әлемнің үш негізгі фармакопеясына – Еуропалық фармакопея, Британдық
фармакопея және АҚШ Фармакопеясына Үйлестірілген [2-4].
13.
Республикада қолданыстағы фармакопея стандарттарынқолдану олардың басымдылығы қағидаты бойынша жүзеге
асырылады. Бірінші басымдық деңгейі ҚР МФ дәрілік заттар
сапасының басты ұлттық стандарты ретінде беріледі. Онда
жеке монографиялар болмаған кезде немесе олар кеш
өзектендірілген жағдайда ҚР МФ Үйлестірілген басқа
фармакопеялардың тиісті монографиялары қолданылады (2сурет).
14.
15.
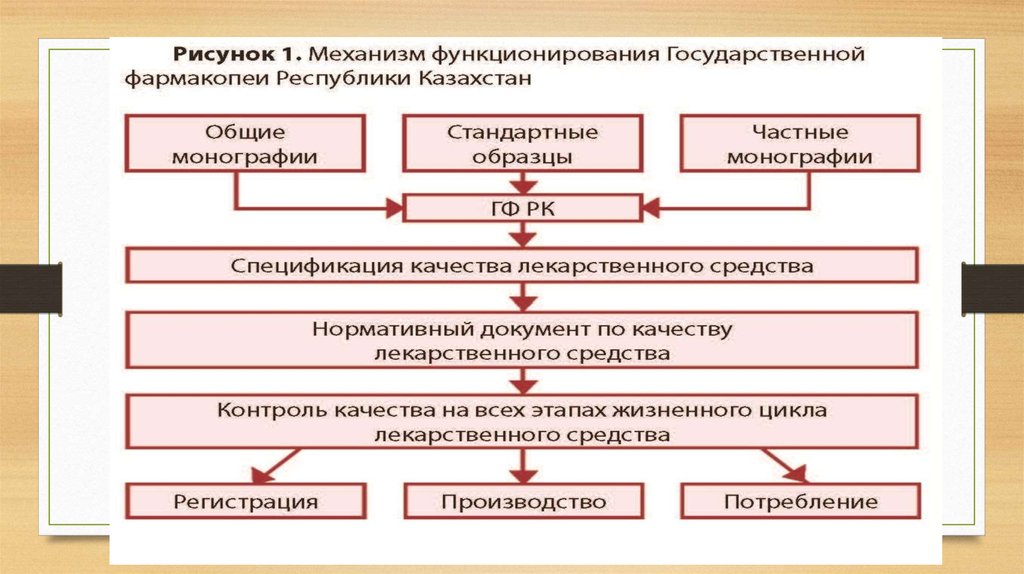
Қазіргі уақытта ҚР МФ 191 жалпы бөлім, 24 жалпы мәтін және 90 жалпымонографияны қамтиды (3-сурет). Оларда баяндалған жалпы талаптар мыналарға
қолданылады::
- сынау және сынау әдістері;
- - реактивтер;- сапа көрсеткіштері;
- - буып-түю материалдары мен контейнерлер;
- - фармацевтикалық қолдануға арналған субстанциялар;
- - дәрілік түрлер;
- - дәрілік препараттар, оның ішінде гомеопатиялық препараттар,
радиофармацевтикалық препараттар;
- - биологиялық өнімдер;
- - дәрілік өсімдік заттары;
- - дәрілік өсімдік шикізатының морфологиялық топтары;
- - медициналық мақсаттағы бұйымдар (ыдыс ішіндегі катетерлер, тігіс
материалдары).
16.
17.
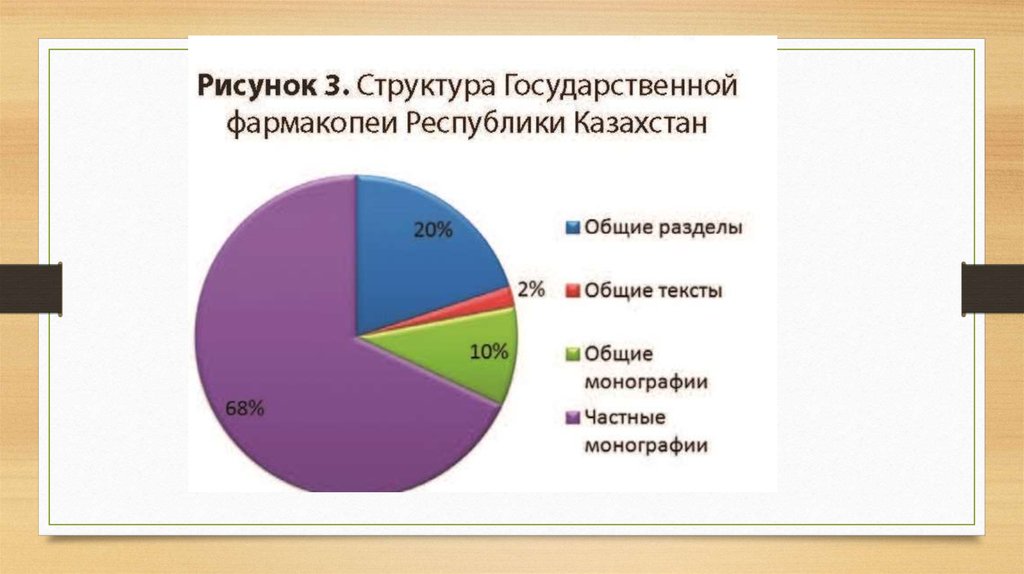
ҚР МФ жалпы монографияларымен қатар сапа көрсеткіштеріне, сынауәдістемелеріне және олардың қолайлылық өлшемдеріне қойылатын талаптарды
регламенттейтін 646 жеке монография бар (4-сурет).
Жеке монографиялар келесілерге таратылады:- фармацевтикалық қолдануға
арналған субстанциялар, оның ішінде белсенді субстанциялар және қосалқы
заттар;- әртүрлі дәрілік түрлердегі дәрілік препараттар;- дәрілік өсімдік шикізаты
және дәрілік өсімдік препараттары;- - радиофармацевтикалық препараттар және
радиофармацевтикалық
препараттарға
арналған
шығыс
материалдары;медициналық
иммунобиологиялық
препараттар
(вакциналар,
иммуноглобулиндер).Фармакопеяның негізгі пайдаланушылары дәрілік заттарды
әзірлеушілер, өндірушілер және дистрибьюторлар, дәріханалық ұйымдар, сапаны
бақылау зертханалары, реттеуші және сараптамалық органдар, ғылыми және білім
беру мекемелері болып табылады.
18.
19.
ҚР МФ талаптары дәрілік заттарды өндірумен,дайындаумен, өткізумен, сақтаумен, сараптаумен,
тіркеумен, бақылаумен және қолданумен айналысатын
Қазақстан Республикасының барлық кәсіпорындары
мен ұйымдары үшін міндетті.
20.
ҚР МФ құру маңызды әлеуметтік, экономикалық және ғылыми мәнге ие, өйткенібелгіленген стандарттардың арқасында фармакопея:
- Республика нарығында дәрілік заттар мен медициналық мақсаттағы
бұйымдардың сапасын мемлекеттік реттеудің басты құралы;
- - реттеуші және сараптамалық органдар үшін дәрілік заттар мен медициналық
мақсаттағы бұйымдардың сапасын сараптау мен бақылаудың негізі;
- - отандық фармацевтикалық өнімнің бәсекеге қабілеттілігін және экспортқа
бағдарлануын анықтайтын фактор;
- - нарықты сапасыз және жалған өнімдерден қорғаудың тиімді құралы;
- - дәрілік заттар мен медициналық мақсаттағы бұйымдарды әзірлеу бойынша
ғылыми зерттеулерді дамытуды ынталандыратын фактор;
- - жоғары және орта арнаулы оқу орындарында фармацевтер мен химиктерді
даярлау кезінде оқу және анықтамалық құралдармен қамтамасыз ету.
ҚР МФ құру Тәуелсіз Қазақстанның маңызды жетістігі, мемлекеттің қоғамның
денсаулығы туралы қамқорлығының көрінісі болып табылады.
21.
Әдебиет1.Қазақстан Республикасының Мемлекеттік фармакопеясы. Екінші басылым. I. Том-Алматы:
"Жібек жолы" Баспа Үйі, 2015. – 720 Б.
2.European Pharmacopoeia 8.0. Vol. I, II. - Strasbourg: Council of Europe, EDQM, 01/2014. – 3655 p.
3.British Pharmacopoeia 2016. – London: The Stationary Office on behalf of the Medicines and
Healthcare products Regulatory Agency (MHRA).
4.Қазақстан Республикасының Мемлекеттік фармакопеясы. І. Том-Алматы: "Жібек жолы" Баспа
үйі, 2008. – 592 б.
5.Қазақстан Республикасының Мемлекеттік фармакопеясы. II Том. – Алматы: "Жібек жолы" Баспа
үйі, 2008. – 804 Б.
6.Қазақстан Республикасының Мемлекеттік фармакопеясы. III Том. – Алматы: "Жібек жолы" Баспа
үйі, 2014. – 872 Б.


















 Медицина
Медицина