Похожие презентации:
Свойства фенолов. Свойства карбоновых кислот
1.
2.
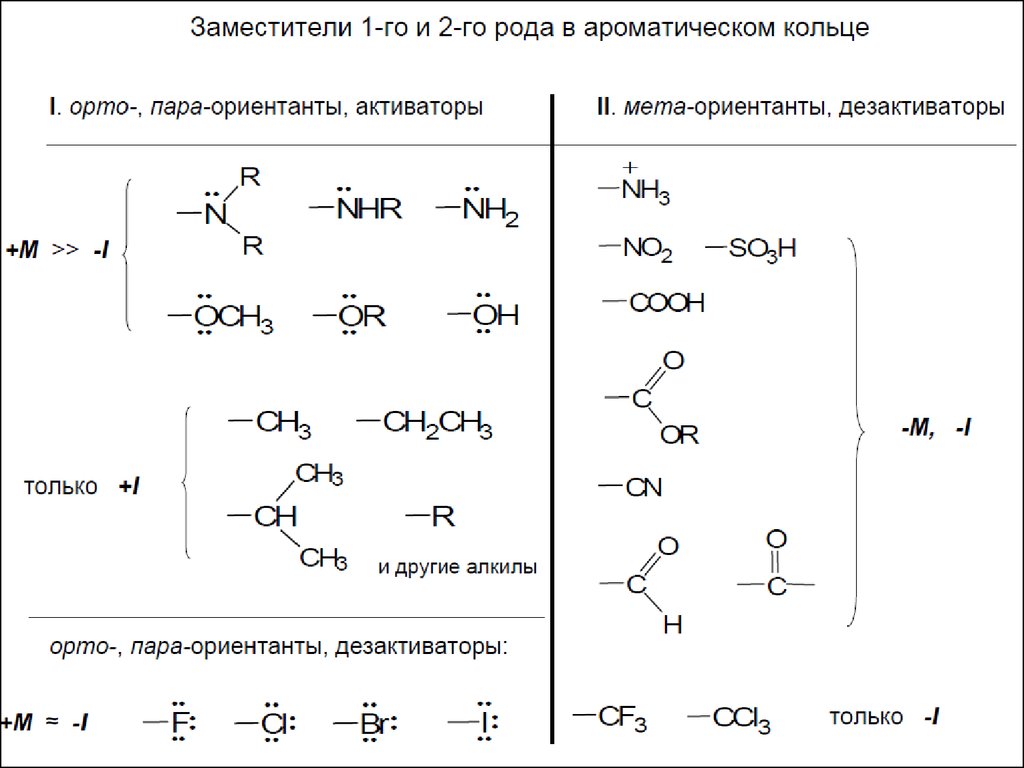
22Свойства фенолов
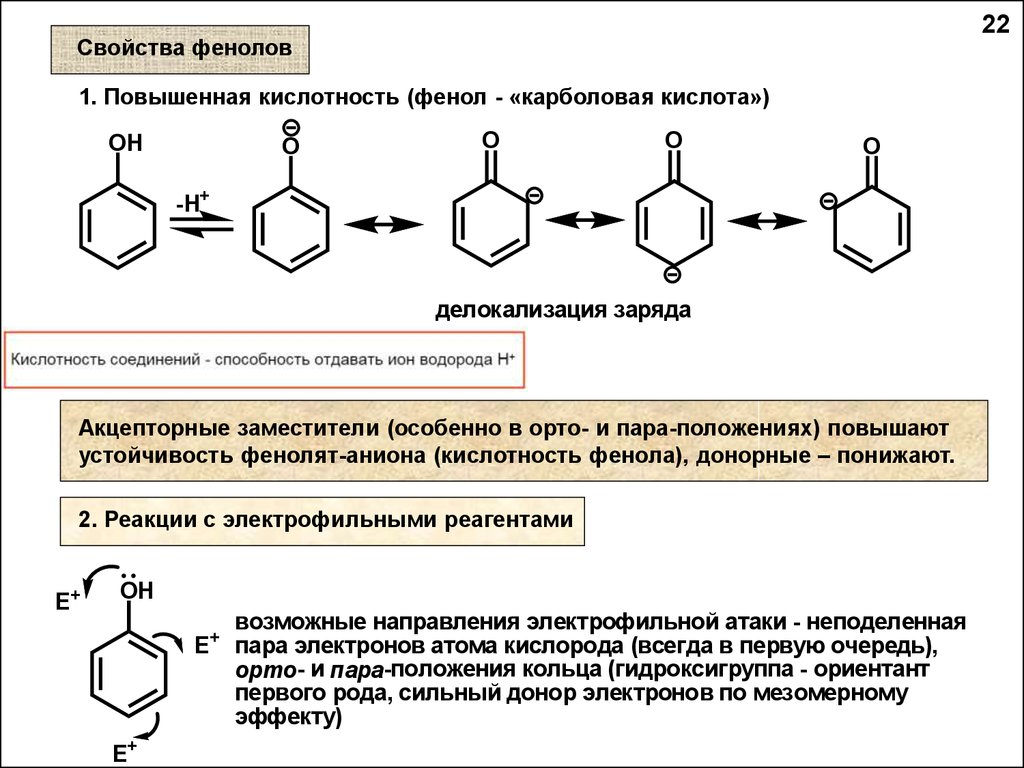
1. Повышенная кислотность (фенол - «карболовая кислота»)
OH
O
O
O
O
-H+
делокализация заряда
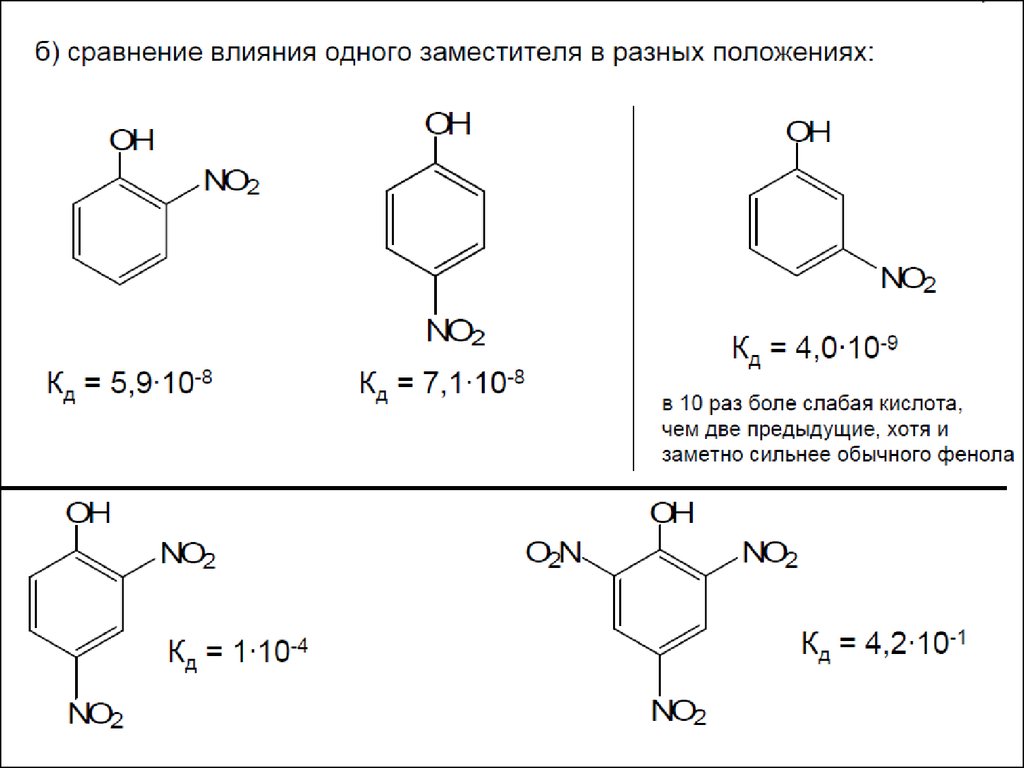
Акцепторные заместители (особенно в орто- и пара-положениях) повышают
устойчивость фенолят-аниона (кислотность фенола), донорные – понижают.
2. Реакции с электрофильными реагентами
E+
OH
+
E
E+
возможные направления электрофильной атаки - неподеленная
пара электронов атома кислорода (всегда в первую очередь),
орто- и пара-положения кольца (гидроксигруппа - ориентант
первого рода, сильный донор электронов по мезомерному
эффекту)
3.
4.
5.
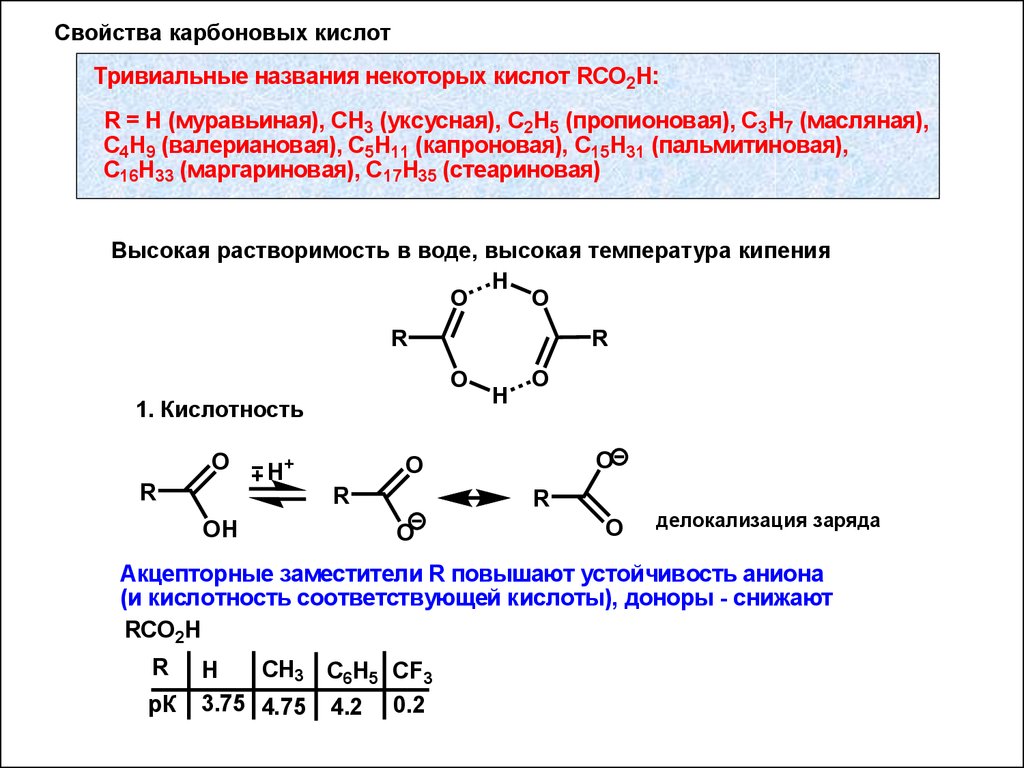
40Свойства карбоновых кислот
Тривиальные названия некоторых кислот RCO2H:
R = Н (муравьиная), CH3 (уксусная), C2H5 (пропионовая), C3H7 (масляная),
C4H9 (валериановая), C5H11 (капроновая), C15H31 (пальмитиновая),
C16H33 (маргариновая), C17H35 (стеариновая)
Высокая растворимость в воде, высокая температура кипения
H
O
O
R
R
O
1. Кислотность
R
±
O
O
O
O
H+
R
OH
H
R
O
O
делокализация заряда
Акцепторные заместители R повышают устойчивость аниона
(и кислотность соответствующей кислоты), доноры - снижают
RCO2H
R
рК
CH3 C6H5 CF3
H
3.75 4.75 4.2 0.2
6.
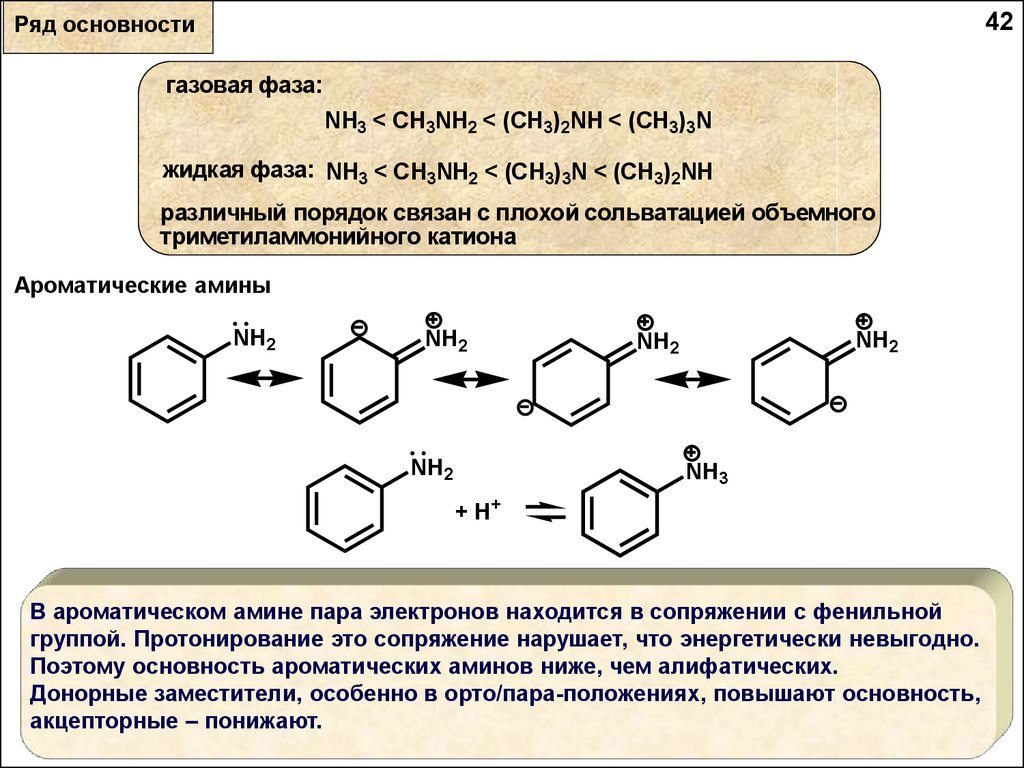
42Ряд основности
газовая фаза:
NH3 < CH3NH2 < (CH3)2NH < (CH3)3N
жидкая фаза: NH3 < CH3NH2 < (CH3)3N < (CH3)2NH
различный порядок связан с плохой сольватацией объемного
триметиламмонийного катиона
Ароматические амины
NH2
NH2
NH2
NH2
NH2
NH3
+ H+
В ароматическом амине пара электронов находится в сопряжении с фенильной
группой. Протонирование это сопряжение нарушает, что энергетически невыгодно.
Поэтому основность ароматических аминов ниже, чем алифатических.
Донорные заместители, особенно в орто/пара-положениях, повышают основность,
акцепторные – понижают.

 Химия
Химия