Похожие презентации:
Карбоновые кислоты и их производные
1.
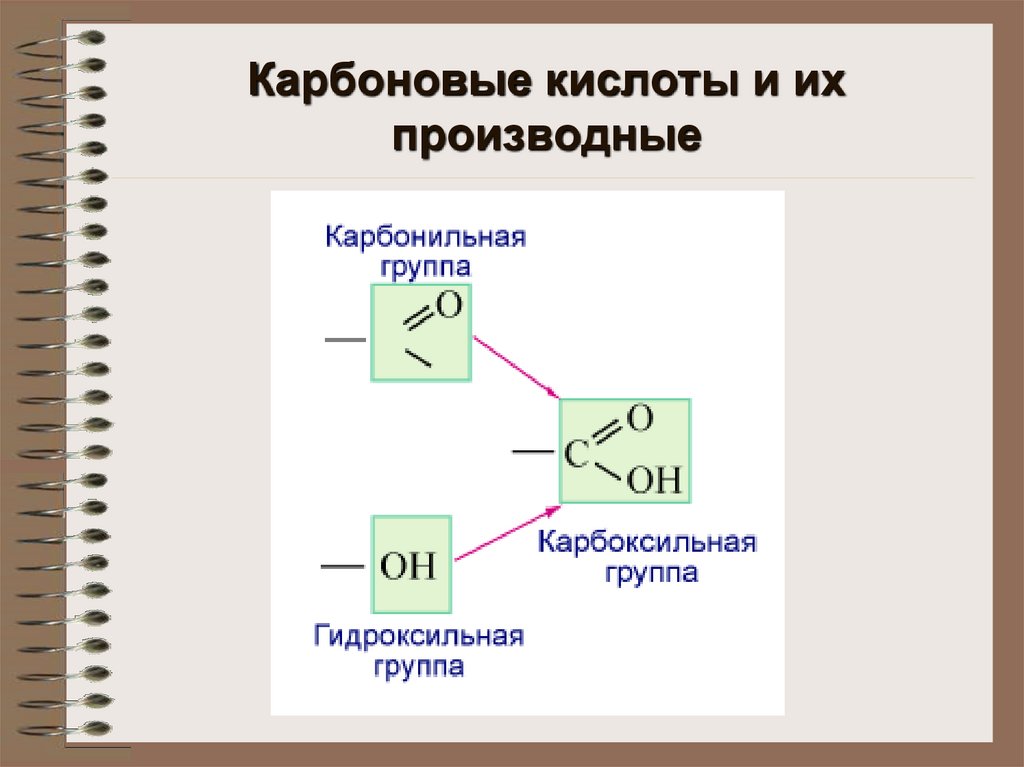
Карбоновые кислоты и ихпроизводные
2.
3.
Гомологический ряд4.
Номенклатура4
3
2
1
CH2 - CH - CH - COOH
5
CH3 CH3 CH3
2,3-диметилпентановая кислота
4 3
2
1
HOOC - CH - CH - COOH
CH3 CH3
2,3-диметилбутандиовая кислота
5.
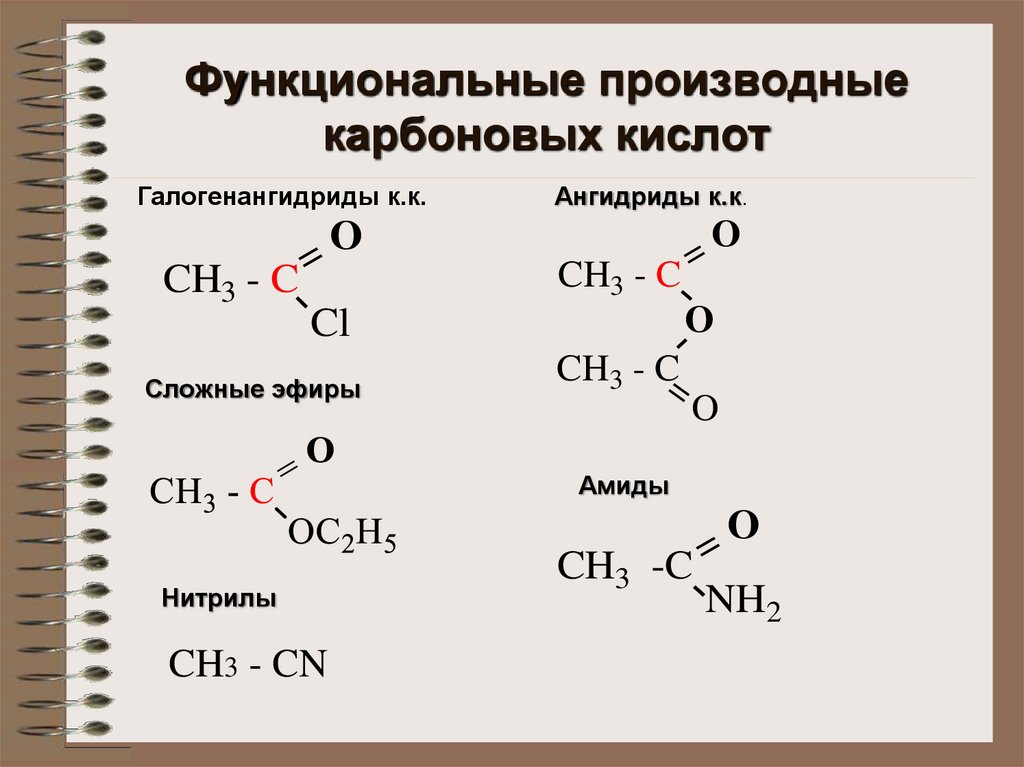
Функциональные производныекарбоновых кислот
Галогенангидриды к.к.
O
CH3 - C =
Cl
Сложные эфиры
Ангидриды к.к.
O
CH3 - C =
O
CH3 - C=
O
Амиды
O
Нитрилы
CH3 - CN
CH3 -C =
NH2
6.
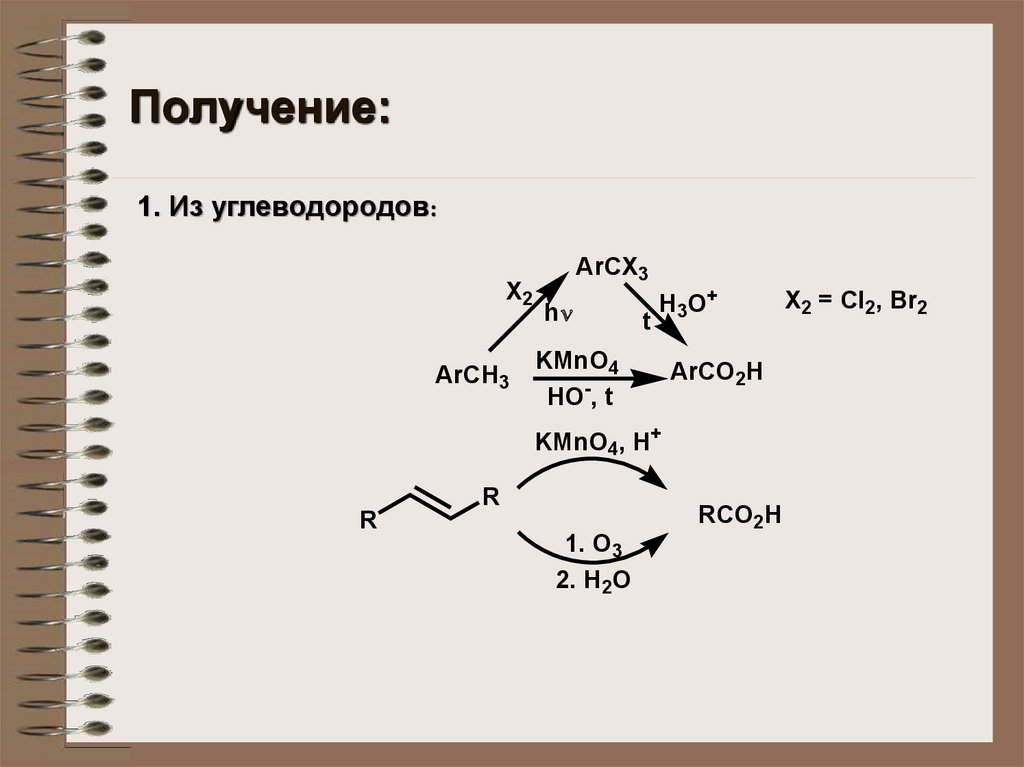
Получение:1. Из углеводородов:
X2
ArCH3
ArCX3
h
t
H 3 O+
KMnO4
HO-, t
ArCO2H
KMnO4, H+
R
RCO2H
R
1. O3
2. H2O
X2 = Cl2, Br2
7.
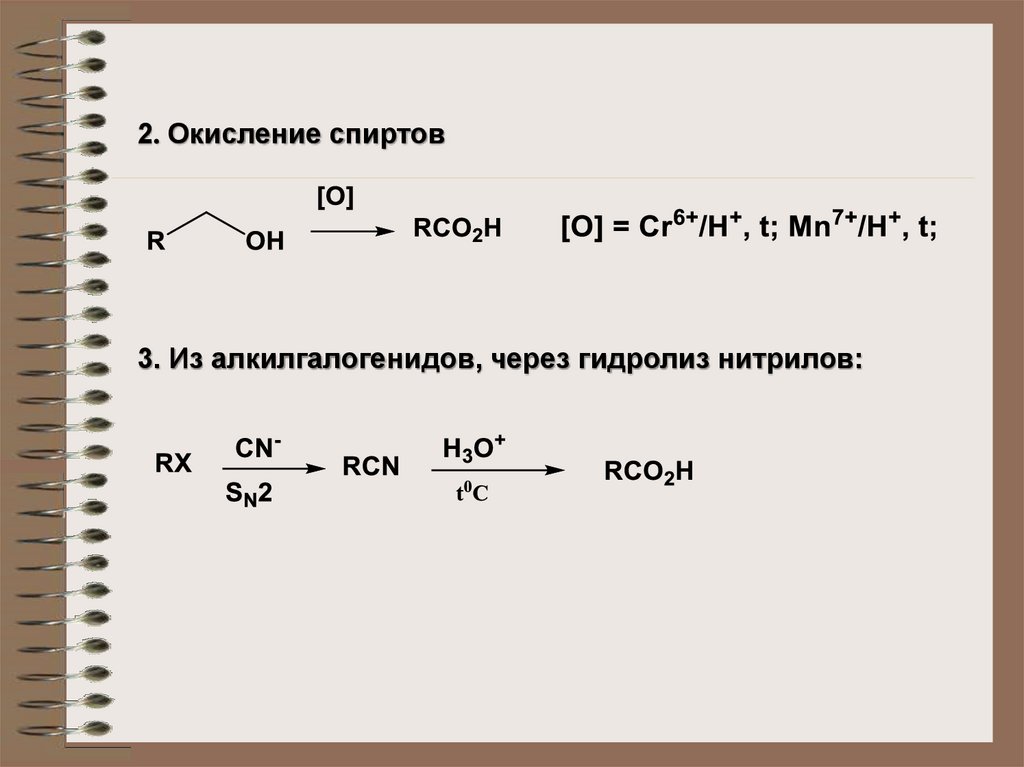
2. Окисление спиртов3. Из алкилгалогенидов, через гидролиз нитрилов:
8.
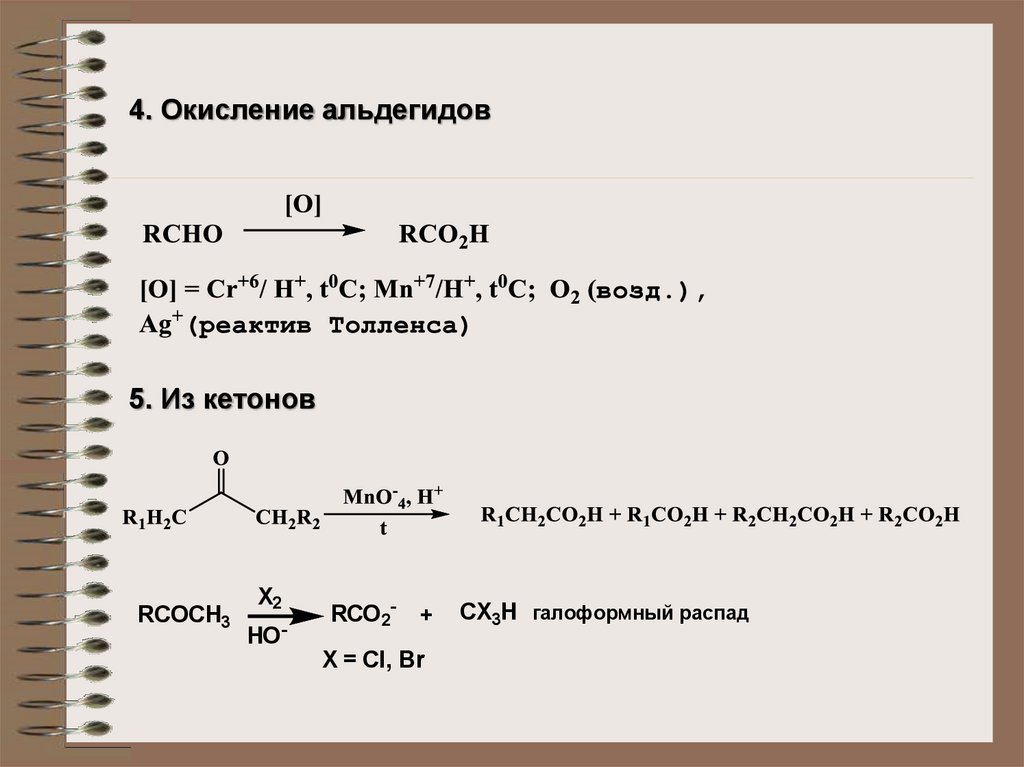
4. Окисление альдегидов5. Из кетонов
RCOCH3
X2
HO-
RCO2-
+
X = Cl, Br
CX3H галоформный распад
9.
6. Гидролиз сложных эфиров:7. Использование металлоорганических
соединений:
1. CO2
RMgX
RCO2H
+
2. H3O
8. Синтез муравьиной кислоты (в промышленности):
NaOH
CO
p, t
HCO2Na
H3O+
HCO2H
10.
Физические свойстваС1 – С9 жидкости
С10 - … твердые вещества
11.
Строение и химические свойства12.
1. КислотностьR
±
O
O
O
H+
R
OH
R
O
O
делокализация заряда
Акцепторные заместители R повышают устойчивость аниона
(и кислотность соответствующей кислоты), доноры - снижают
RCO2H
R
рК
CH3 C6H5 CF3
H
3.75 4.75 4.2 0.2
Образование солей
PhOH NaOH
O
R
OH
NaHCO3
PhONa
RCO2Na
13.
Сила кислоты Х-C6H2CO2HX
pK
2-CO2H 2-OH 4-NO2 4-CO2H 3-CO2H 2-CH3 H 3 (4)-CH3 4-OCH3 4-NH2
3.62
3.9
4.49
2.95
3.54
4.2 4.3
2.98 3.4
4.92
"Косвенное" влияние мезомерных заместителей
X
X
донор
CO2-
CO2-
CO2-
CO2O
O2N
N
акцептор
O
14.
Прокаливание солей карбоновых кислот:15.
Образование сложных эфиров(реакция этерификации)
R
R
OH
R
R
O
R'
OH
O
R'
R
OH2
± H+
O
O
OH
H2O
R
O
OH
R
O
O
OH
H+
R'
R'
R'
H+
R'
OH
±
OH
OH
R
R'OH
H
±
R
OH
OH
OH
H+
±
O
OH
Все стадии процесса обратимы. Положение равновесия
определяется количеством воды - при проведении
этерификации воду необходимо удалять. В избытке воды
в кислой среде происходит гидролиз эфира по той же самой схеме.
16.
Реакции с галогенидами фосфора и серы(образование галогенангидридов)
Образование ангидридов
RCO2Na
RCO2H
RCOCl
SOCl2 (0.5 моль)
O
R
O
P2O5
RCO2H
не всегда возможно
R
O
17.
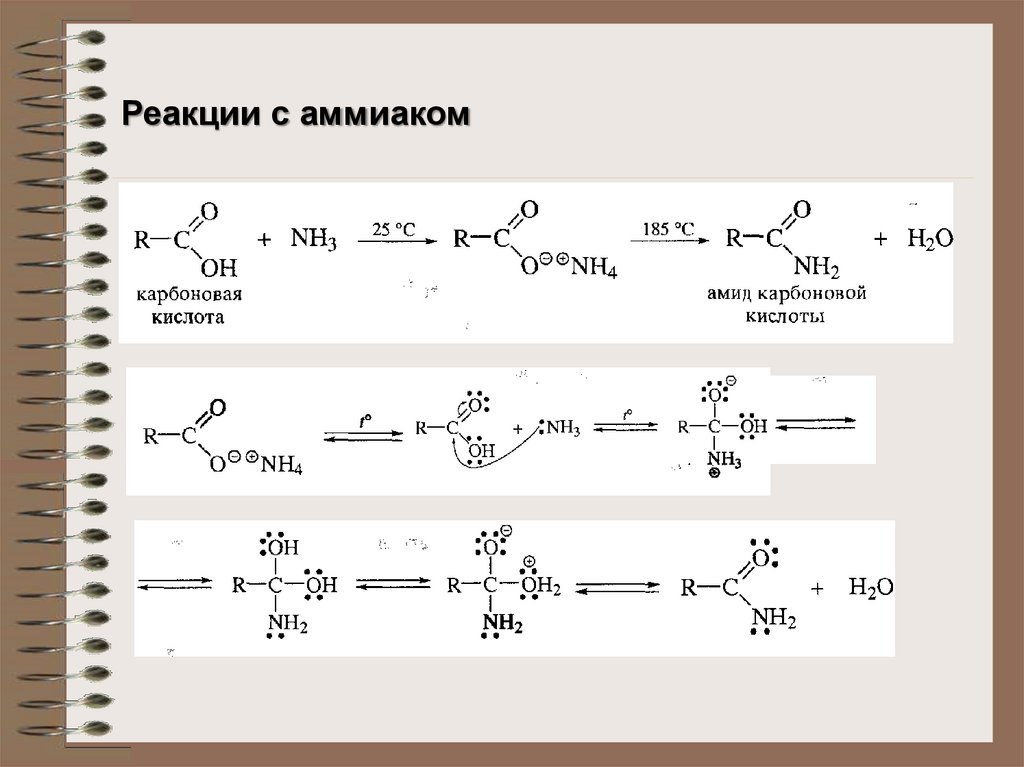
Реакции с аммиаком18.
ДекарбоксилированиеТермическое декарбоксилирование:
Сплавление солей к.к. с твердым гидроксидом натрия
(реакция Дюма):
В присутствии катализаторов содержащих медь:
19.
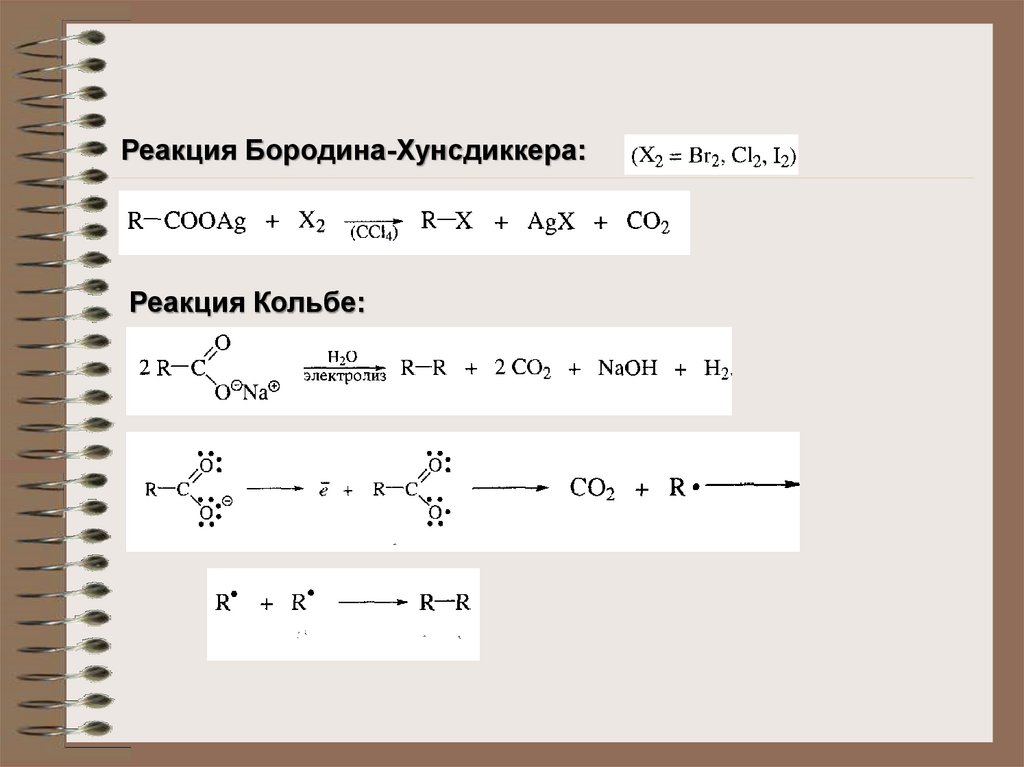
Реакция Бородина-Хунсдиккера:Реакция Кольбе:
20.
Галогенирование по α-атому углеродаРеакция Гелля-Фольгарда-Зелинского
RCH2CO2H
Br2
RCHBrCOBr или RCHBrCO2H
P
Br2 + P
PBr3
PBr3
RCH2CO2H
-P(OH)3
HO
HO
Br
Br
Br
O
+
Br
R
-H
Br
RCH2COBr
R
Br
RCH2CO2H
R
Br
-Br-
RCHBrCO2H
-RCH2COBr
При использовании 1/3 моля красного фосфора продуктом реакции
является галогензамещенный галогенангидрид, в случае
каталитических количеств фосфора –бромзамещённая кислота
21.
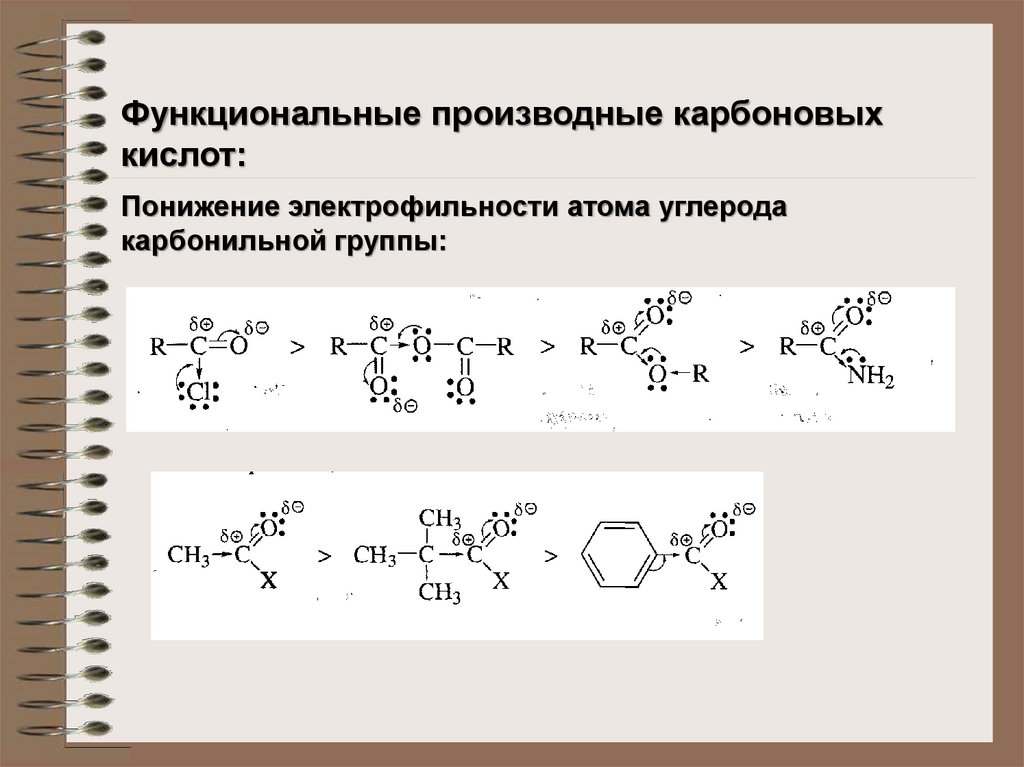
Функциональные производные карбоновыхкислот:
Понижение электрофильности атома углерода
карбонильной группы:
22.
Механизм реакции нуклеофильного замещения:Стадия 1 – присоединение нуклеофила по карбонильной группе:
Стадия 2 – отщепление аниона с образованием продукта
замещения:
23.
Восстановление:RCO2H
[H]
RCH2 OH
[H] = LiAlH4, H2/катализатор - в жестких условиях
NaBH4 - нет
[H]
RCH2OH + R'OH [H] = LiAlH4, Na/EtOH
H2/катализатор - в жестких условиях
NaBH4 - нет
LiAlH4
RCO2NH2
RCH2NH2
RCO2R'
RCOCl
[H]
RCHO
[H] = LiAlH(OR')3, H2 / Pd/BaSO4
24.
Галогенангидриды:O
=
CH3 - C
OH
карбоновые кислоты
O
RO - H
=
CH3 - C
OR
сложные эфиры
H - OH
O
=
CH3 - C
Br
O
=
RCOO - Na CH3 - C
O
R - C=
O
ангидрид
NH3
O
=
CH3 - C
амид NH2
25.
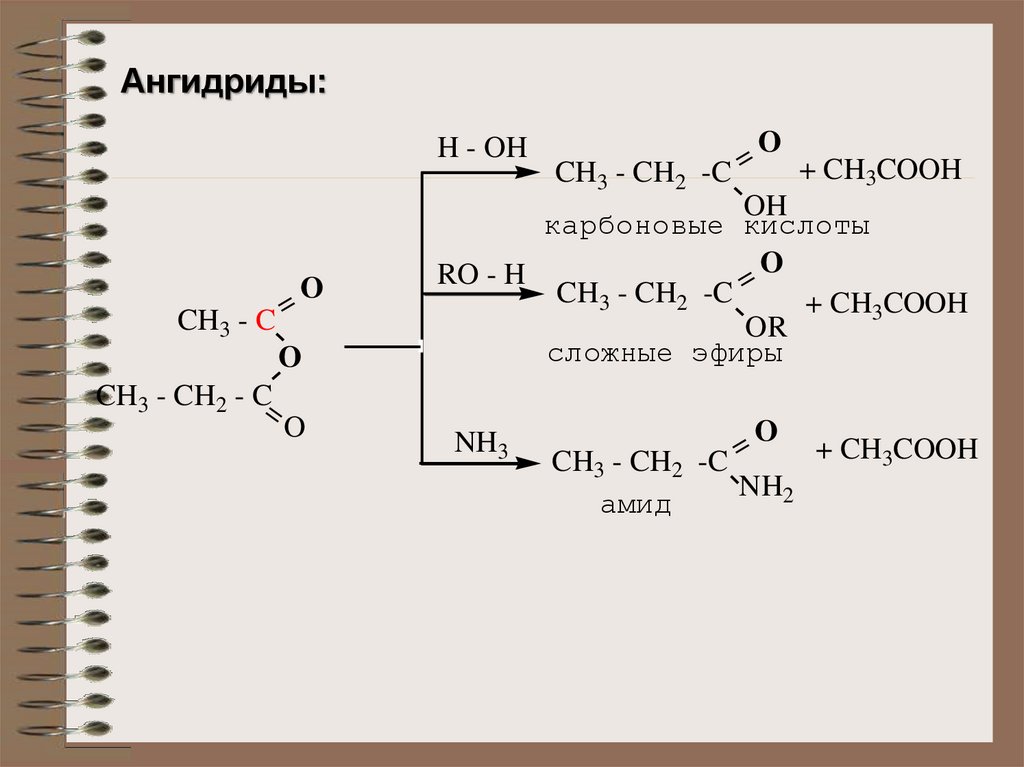
Ангидриды:O
=
+ CH3COOH
CH3 - CH2 -C
OH
карбоновые кислоты
O
RO - H
=
CH3 - CH2 -C
+ CH3COOH
OR
сложные эфиры
H - OH
O
=
CH3 - C
O
CH3 - CH2 - C=
O
NH3
O
=
+ CH3COOH
CH3 - CH2 -C
NH2
амид
26.
Сложные эфиры:O
=
CH3 - C
OH кислоты
карбоновые
O
C3H7OH
=
CH3 - C
OC3H7
H - OH
O
=
CH3 - C
OC2H5
NH3
O
=
CH3 -C
NH2
амид
27.
Амиды:H - OH
O
CH3 -C =
NH2
O
=
CH3 - C
OH
NaOH
O
CH3 - C =
ONa
28.
Перегруппировка ГоффманаДегидратация (образование нитрилов)



















 Химия
Химия








