Похожие презентации:
Классификация химических реакций в неорганической химии
1.
Классификацияхимических реакций
в неорганической химии
2.
1) Первый признак классификации – по изменениюстепени окисления элементов, образующих реагенты и
продукты.
а) окислительно-восстановительные
+2
+5
+3
+6
+4
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
б) без изменения степени окисления
CaO + 2HCl = CaCl2 + H2O
3.
Окислительно-восстановительныминазывают реакции, сопровождающиеся изменением степе
ней окисления химических элементов, входящих в состав
реагентов.
К
окислительно-восстановительным
в
неорганической химии относятся все реакции замещения и
те реакции разложения и соединения, в которых участвует
хотя бы одно простое вещество. К реакциям, идущим без
изменения степеней окисления элементов, образующих
реагенты и продукты реакции, относятся все реакции
обмена.
4.
2) Химические реакции классифицируются по характерупроцесса, т.е по числу и составу реагентов и продуктов.
-реакции соединения или присоединения в органической
химии.
Для того чтобы вступить в реакцию присоединения,
органическая молекула должна иметь кратную связь (или
цикл), эта молекула будет главной (субстрат). Молекула
попроще (часто неорганическое вещество, реагент)
присоединяется по месту разрыва кратной связи или
раскрытия цикла.
NH3 + HCl = NH4Cl
CaO + CO2 = CaCO3
5.
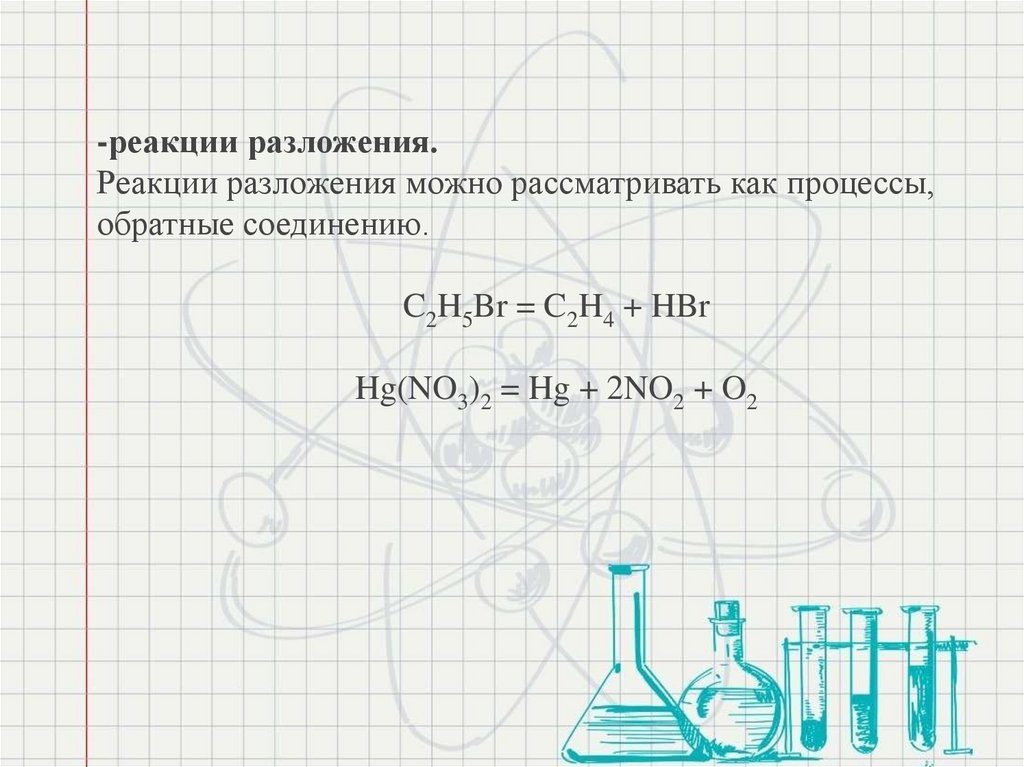
-реакции разложения.Реакции разложения можно рассматривать как процессы,
обратные соединению.
C2H5Br = C2H4 + HBr
Hg(NO3)2 = Hg + 2NO2 + O2
6.
– реакции замещения.Их отличительный признак — взаимодействие простого
вещества со сложным. Такие реакции есть и в органической
химии.
Однако понятие «замещение» в органике шире, чем в
неорганической химии. Если в молекуле исходного вещества
какой-либо атом или функциональная группа заменяются на
другой атом или группу, это тоже реакции замещения, хотя с
точки зрения неорганической химии процесс выглядит как
реакция обмена.
Zn + CuSO4 = Cu + ZnSO4
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
7.
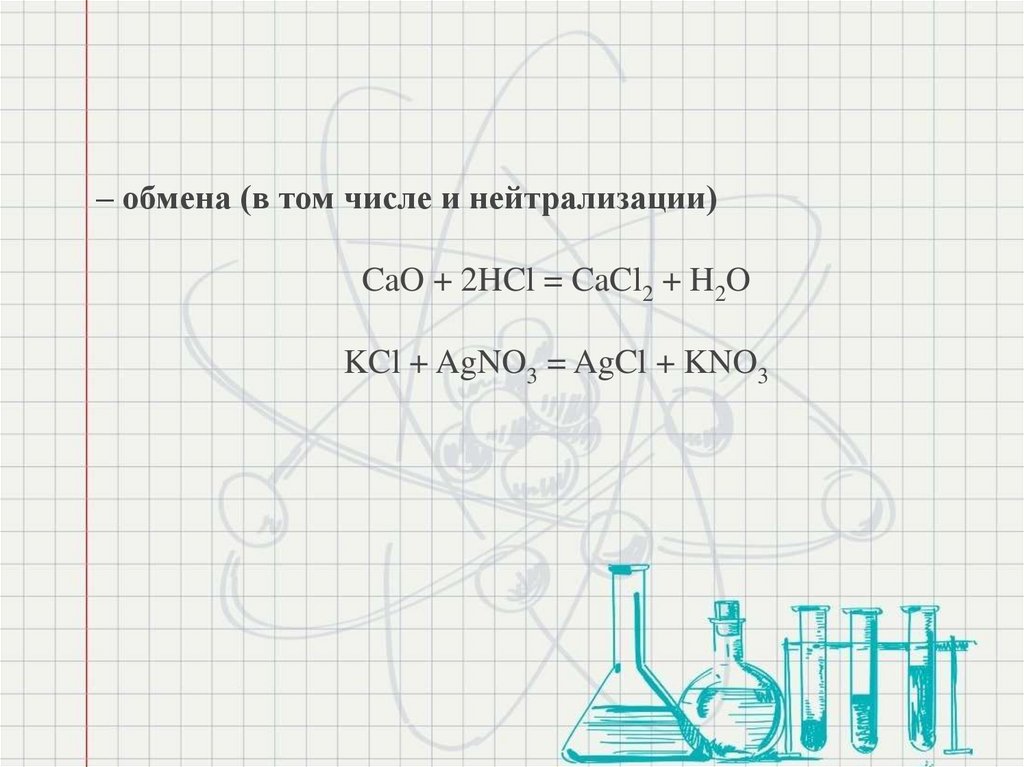
– обмена (в том числе и нейтрализации)CaO + 2HCl = CaCl2 + H2O
KCl + AgNO3 = AgCl + KNO3
8.
3) По возможности протекать в обратном направлении-обратимые
H2 + N2 → NH3
SO3 → SO2 + O2
- необратимые
KClO3 → KCl + O2;
H2S + O2 → SO2 + H2O.
9.
4) По типу разрыва связей- гомолитические (равный разрыв, каждый атом
получает по 1 электрону, образуя радикалы)
-гетеролитический (неравный разрыв – одному
достается пара электронов, при этом образуется
катион и анион)
10.
5) По тепловому эффектуэкзотермические (выделение тепла) и эндотермические
(поглощение тепла). Реакции соединения как правило
будут реакциями экзотермическими, а реакции
разложения — эндотермическими.
Редкие исключения
- Эндотермические реакции соединения:
N2 + О2 → 2NO – Q
H2+I2 → 2HI – Q
-Экзотермические реакции соединения:
2HI→H2+I2
11.
6) По фазеа) Гомогенные (однородные вещества, в одной фазе,
например г-г, реакции в растворах)
H2 + Cl2 = 2HCl
2NaOH + H2SO4 = Na2SO4 + 2H2O
б) Гетерогенные (г-ж, г-тв, ж-тв, реакции между
несмешивающимися жидкостями)
Zn + CuSO4 = ZnSO4 + Cu
FeS(тв.) + 2HCl(р-р) = FeCl2(р-р) + H2S↑
12.
7) По использованию катализатора. Катализатор – веществоускоряющее химическую реакцию.
а) каталитические (в том числе и ферментативные) – без
использование катализатора практически не идут.
N2 + 3H2 = 2NH3
2SO2 + O2 = 2SO3
б) некаталитические
2NaOH + H2SO4 = Na2SO4 + 2H2O
AgNO3(р-р) + NaCl(р-р) = AgCl↓ + NaNO3(р-р)










 Химия
Химия








