Похожие презентации:
Окислительно-восстановительные реакции
1. Тема урока: «Окислительно-восстановительные реакции»
Тема урока: «Окислительновосстановительные реакции»«
Кто-то теряет, а кто-то находит.»
2. Повторение изученного ранее
Что такое атом?Что такое ион?
Чем отличается ион от атома?
Какие типы реакций вам
знакомы?
Что такое степень окисления?
Как определять степень
окисления?
3.
Правила вычисления степени окисления(СО) элементов:
4. Задание № 1 Выполните работая в группе
Определите степени окисления атомовхимических элементов по формулам их
соединений:
H2S, O2, NH3, HNO3, Fe, K2Cr2O7
5. Выполните проверку
+1 -20
H2S
O2
0
Fe
-3 +1
NH3
+1 +7
-2
K2Cr2O7
+1 +5 -2
HNO3
6.
Расставьте степени окисления элементов в реакциях.Сравните, как ведут себя степени окисления в
процессе реакции.
+1
+1
-1
-2 +1
+1
-1
+1
-2
HCl + NaOH = NaCl + H2O
+1
-1
0
+2
-1
0
Окислительновосстановительная
2
реакция
2 HCl + Zn = ZnCl2 + H
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
7.
H+Zn0
- 2 е-
окисление
+ 2 е-
восстановление
- окислитель
- восстановитель
атомы
процессы
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + H2200
8.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
9.
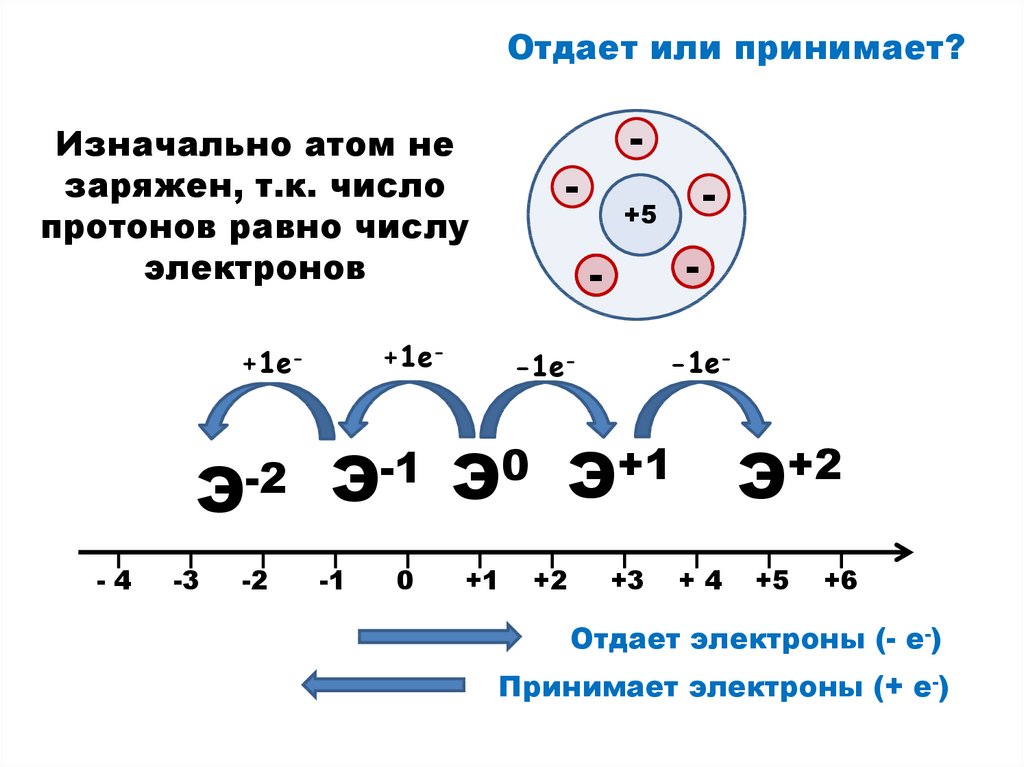
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
Э-2
-4
-3
-2
-
-1
Э
-1
0
-
+5
-
-
+1е-
+1е-
-
-1е-
-1е-
Э0 Э+1
+1
+2
+3
Э+2
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
10.
Отдает или принимает?Задание № 2
Определите число принятых или отданных
электронов
Установите,какой процесс вследствие этого
протекает(окисление или восстановление)
S+6 S0
S+6 S-2
Cu0 Cu+2
C0 C+4
11.
Отдает или принимает?Задание № 2
Определите число принятых или отданных
электронов
Установите,какой процесс вследствие этого
протекает(окисление или восстановление)
+ 6 e-
S+6 S0
S+6
+ 8 e-
S-2
- 2 e-
восстановление
восстановление
Cu0 Cu+2
- 4 e-
C0
C+4
окисление
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает е-
принимает е-
12.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
+5е
2Cl-1
-2е
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
5
окисление
10
13.
План составления уравнений ОВР иэлектронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов
изменяют степень окисления.
3. Составить электронные уравнения
процессов окисления и восстановления.
4. Подобрать общее делимое для отданных
и принятых электронов и коэффициенты
для электронных уравнений.
5. Перенести эти коэффициенты в
уравнение ОВР и подобрать коэффициенты
перед формулами других веществ.
14.
Физкультминутка15.
Вспомним правила техникибезопасности
1)При работе с кислотами необходимо
помнить, что эти вещества опасны
2)Оборудование должно быть чистым
3)В пробирку не стоит помещать большое
количество вещества
4)Этикетку под ладонь
5)Крышку от открытого сосуда
необходимо переворачивать
6)Пробирку держать тремя пальцами
16. Это полезно знать
• Степени окисления элементов в составе аниона соли такиеже, как и в кислоте, например: (NH4)2Cr2+6O7 и H2Cr2+6O7
• Степень окисления кислорода в пероксидах
равна -1
• Степень окисления серы в некоторых сульфидах равна -1,
например: FeS2
• Фтор- единственный неметалл, не имеющий в
соединениях положительной степени окисления
• В соединениях NH3, CH4 и др. знак электроположительного
элемента водорода на втором месте
17.
• Напроявление
окислительновосстановительных свойств влияет такой
фактор, как устойчивость молекулы или иона.
Чем прочнее частица, тем в меньшей степени
она
проявляет
окислительновосстановительные свойства
18.
• Например,азот
имеет
высокую
электроотрицательность и мог бы быть
сильным окислителем в виде простого
вещества, но в его молекуле тройная связь,
молекула очень устойчивая, азот химически
пассивен.
19.
• Или НСLO более сильный окислитель врастворе, чем НСLO4, так как НСLO – менее
устойчивая кислота.
20.
• Если химический элемент находится впромежуточной степени окисления, то он
проявляет свойства и окислителя, и
восстановителя.
21.
Опыт №1Карбонат кальция+соляная кислота=
CaCO₃ + 2HCl(разб.) → CaCl₂ + CO₂↑ + H₂O
Опыт №2
Нитрат серебра + Медь=
AgNO3 + Cu → Cu(NO3)2 + Ag↓
Задание найти окислительновосстановительную реакцию и уравнять ее
методом электронного баланса
22.
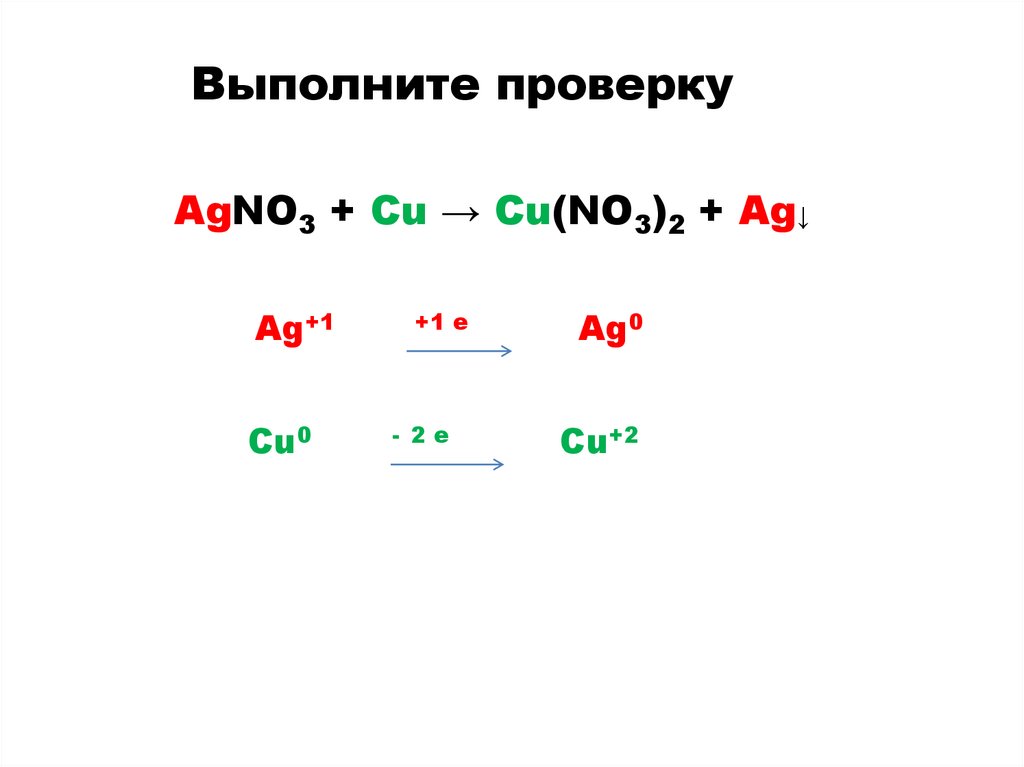
Выполните проверкуAgNO3 + Cu → Cu(NO3)2 + Ag↓
Ag+1
Cu0
+1 e
- 2e
Ag0
Cu+2
23.
ОВР в быту24.
Цель работы:Выяснить, как окислительновосстановительные реакции применяются в
быту.
25.
Горение газа на кухнеГаз метан горит бесцветным пламенем с образованием
воды и углекислого газа
СН4+2О2=СО2+2Н2О
26.
Отбеливание тканиПри обработке персолью отбеливание
происходит за счет окисления
загрязнений
2H2O2=2H2O+O2.
Для того чтобы образующийся
кислород не улетучивался
из емкости, лучше
держать ее
закрытой.
27.
Коррозия металлаПри взаимодействии железа и кислорода
образуется ржавчина.
4Fe+ 2O2= 2Fe2O3
28.
Вывод:Мы часто сталкиваемся с окислительновосстановительными реакциями в быту:
• при горении газа;
• при коррозии металлов;
• при отбеливании ткани
• при промывания ран.
29. Задание №3 Выполните 1. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР 2. найдите в реакциях
ОВР восстановитель иукажите его степень окисления
• СаСО3
=>
СаО + СО2
• KMnO4 > K2 MnО4 + MnО2 + О2
• CuS + О2 =>
СuО + SО2
30. Выполните проверку
• KMnO4 > K2 MnО4 + MnО2 + О2О-2 Восстановитель
• CuS + О2 => СuО + SО2
S-2 Восстановитель
































 Химия
Химия








