Похожие презентации:
Окислительно-восстановительные реакции
1. Тема урока: «Окислительно-восстановительные реакции»
Тема урока: «Окислительновосстановительные реакции»2. Цель урока:
отработать умение записывать процессы изменениястепеней окисления частиц с целью определения
коэффициентов, необходимых для уравнивания
окислительно – восстановительных реакций.
3.
Правила вычисления степени окисления(СО) элементов:
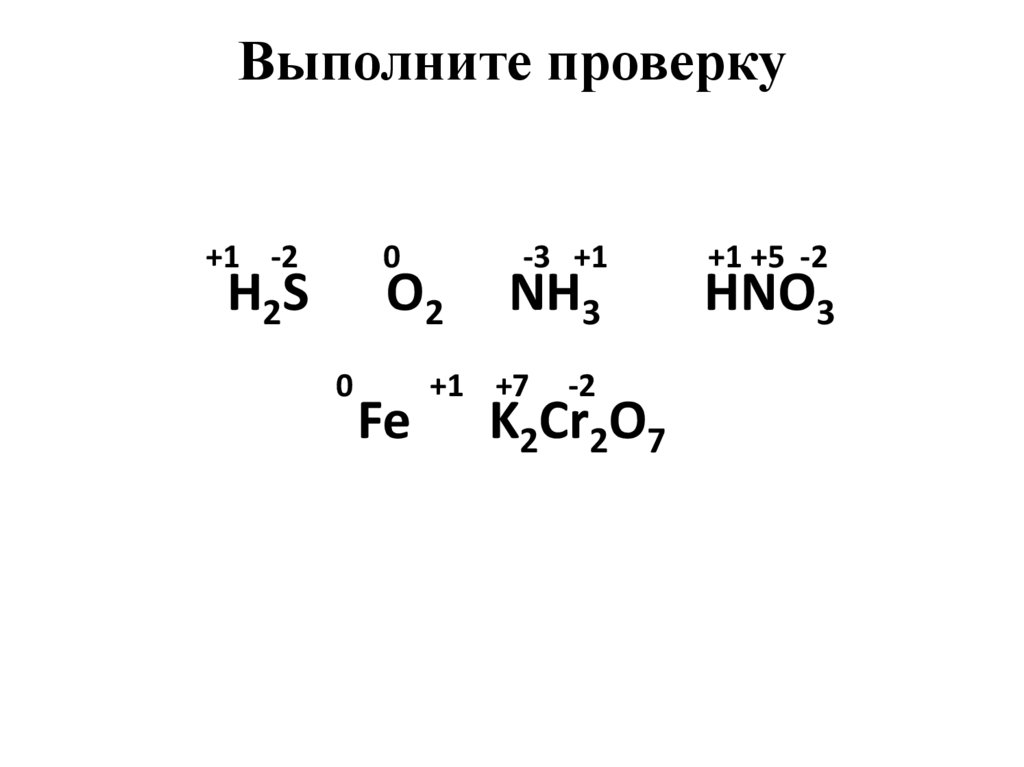
4. Задание № 1
Определите степени окисления атомовхимических элементов по формулам их
соединений:
H2S, O2, NH3, HNO3, Fe, K2Cr2O7
5. Выполните проверку
+1 -20
H2S
O2
0
Fe
-3 +1
NH3
+1 +7
-2
K2Cr2O7
+1 +5 -2
HNO3
6.
Расставьте степени окисления элементов в реакциях.Сравните, как ведут себя степени окисления в
процессе реакции.
+1
+1
-1
-2 +1
+1
-1
+1
-2
HCl + NaOH = NaCl + H2O
+1
-1
0
+2
-1
0
Окислительновосстановительная
2
реакция
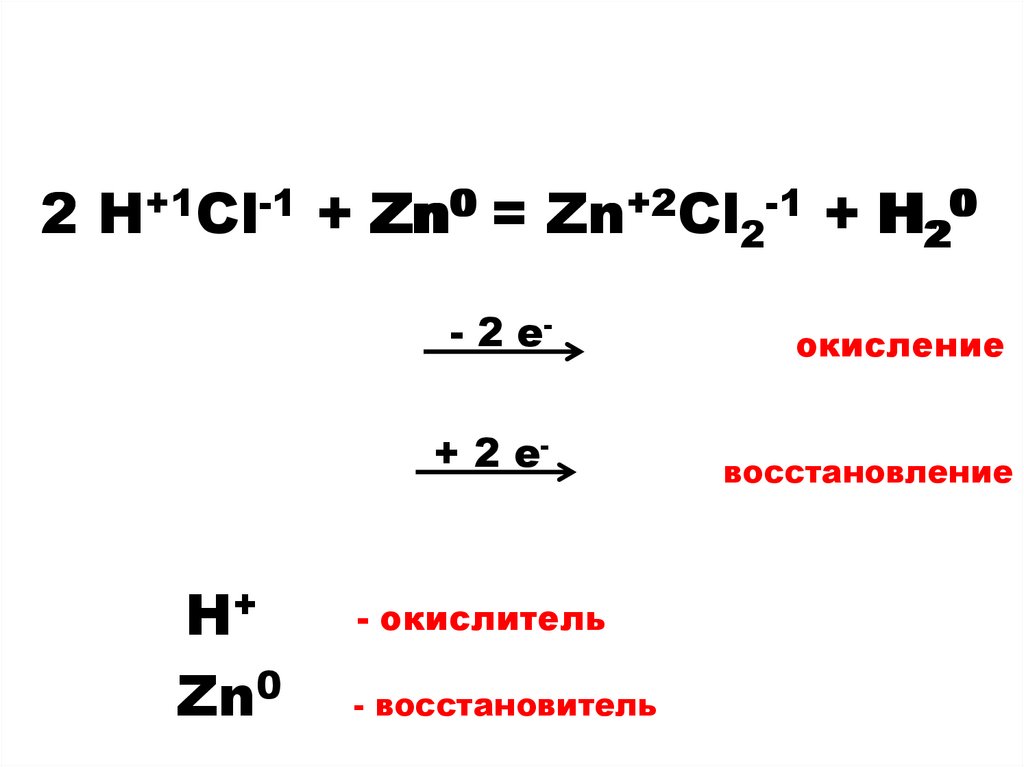
2 HCl + Zn = ZnCl2 + H
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
7.
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + H2200H+
Zn0
- 2 е-
окисление
+ 2 е-
восстановление
- окислитель
- восстановитель
8.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
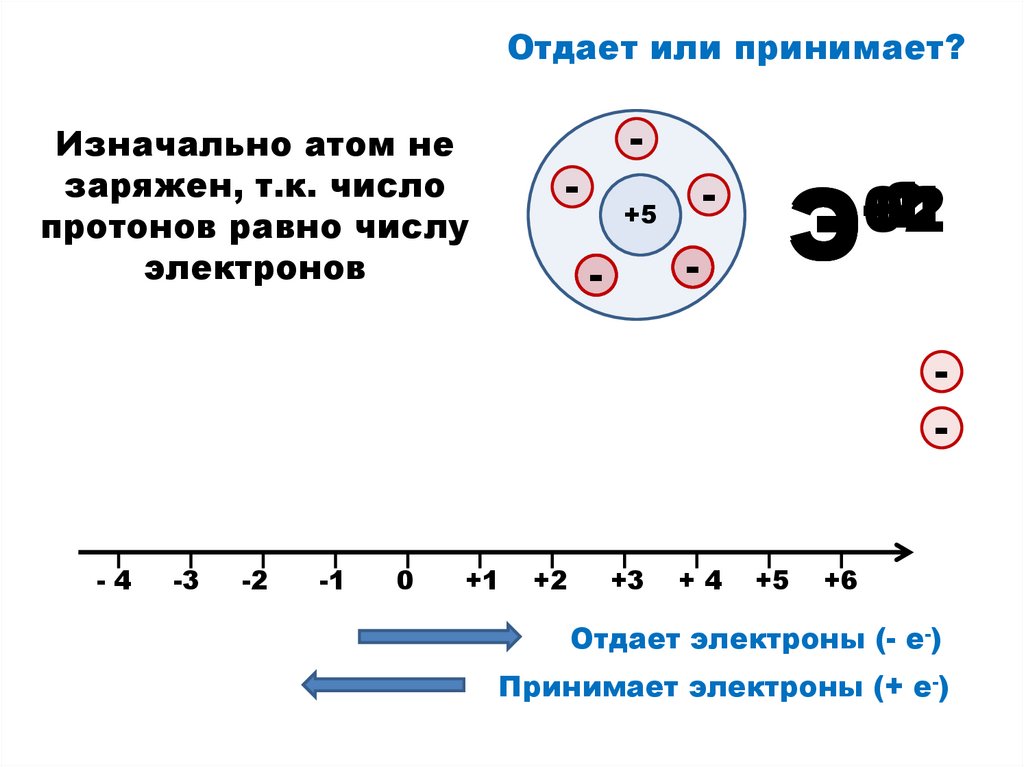
9.
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-2
-1
+1
+2
0
Э
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
10.
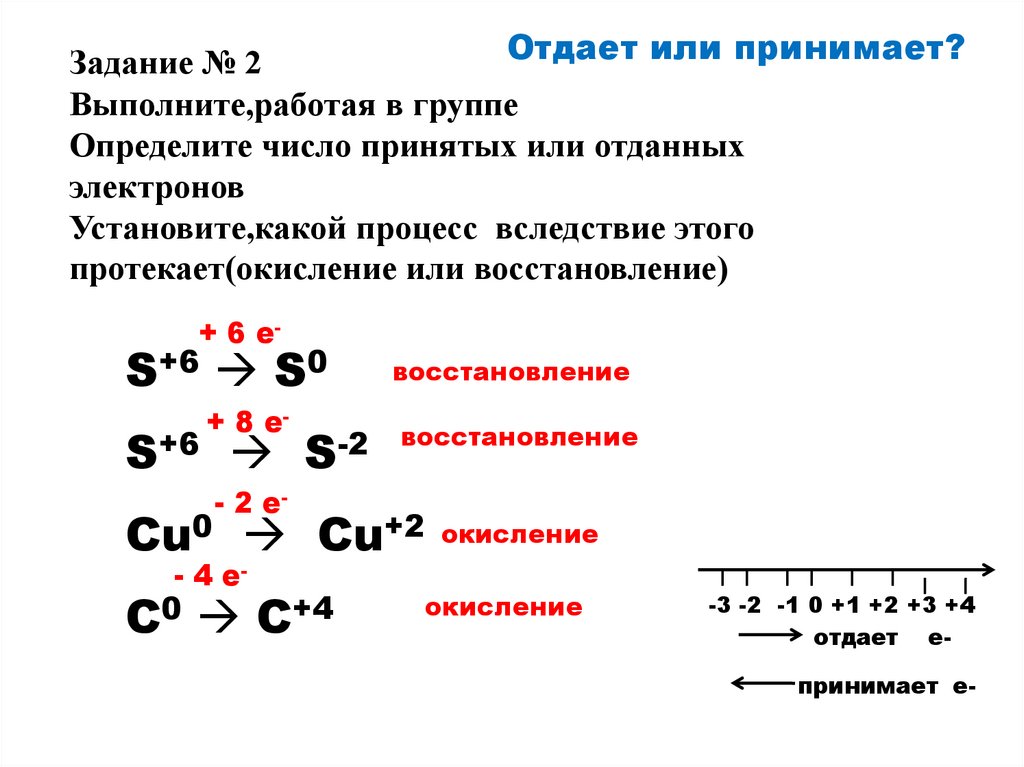
Отдает или принимает?Задание № 2
Выполните,работая в группе
Определите число принятых или отданных
электронов
Установите,какой процесс вследствие этого
протекает(окисление или восстановление)
+ 6 e-
S+6 S0
S+6
+ 8 e-
S-2
восстановление
восстановление
- 2 e-
Cu0 Cu+2 окисление
- 4 e-
C0 C+4
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает е-
принимает е-
11.
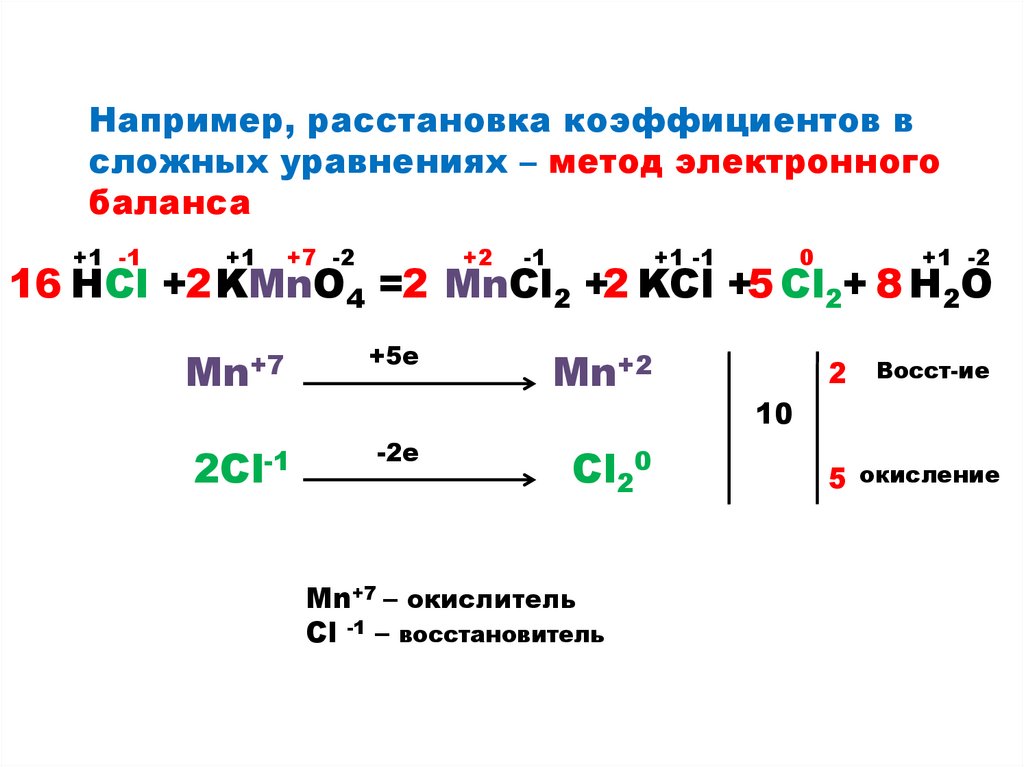
Например, расстановка коэффициентов всложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
+5е
2Cl-1
-2е
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
10
5 окисление
12.
План составления уравнений ОВР иэлектронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов
изменяют степень окисления.
3. Составить электронные уравнения
процессов окисления и восстановления.
4. Подобрать общее делимое для отданных
и принятых электронов и коэффициенты
для электронных уравнений.
5. Перенести эти коэффициенты в
уравнение ОВР и подобрать коэффициенты
перед формулами других веществ.
13.
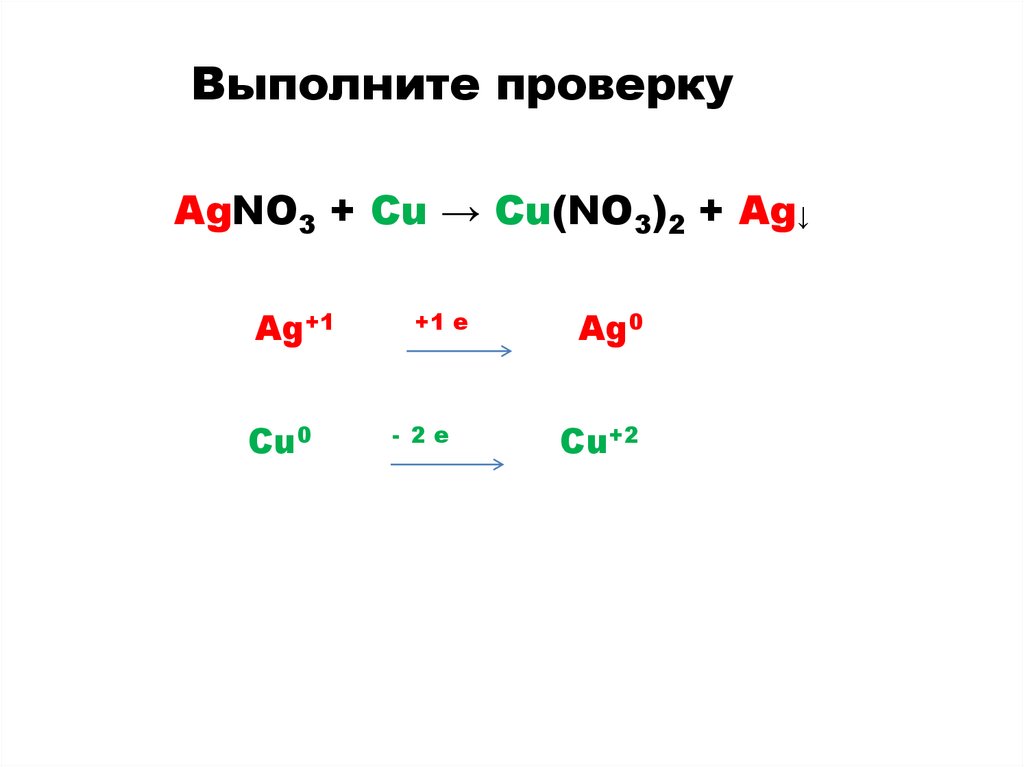
Выполните проверкуAgNO3 + Cu → Cu(NO3)2 + Ag↓
Ag+1
Cu0
+1 e
- 2e
Ag0
Cu+2
14.
Горение газа на кухнеГаз метан горит бесцветным пламенем с образованием
воды и углекислого газа
СН4+2О2=СО2+2Н2О
15.
Отбеливание тканиПри обработке персолью отбеливание
происходит за счет окисления
загрязнений
2H2O2=2H2O+O2.
Для того чтобы образующийся
кислород не улетучивался
из емкости, лучше
держать ее
закрытой.
16.
Коррозия металлаПри взаимодействии железа и кислорода
образуется ржавчина.
4Fe+ 2O2= 2Fe2O3
17.
Вывод:Мы часто сталкиваемся с окислительновосстановительными реакциями в быту:
• при горении газа;
• при коррозии металлов;
• при отбеливании ткани
• при промывания ран.
18. Задание №3 1. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР 2. найдите в реакциях ОВР
восстановитель иукажите его степень окисления
• СаСО3
=>
СаО + СО2
• KMnO4 > K2 MnО4 + MnО2 + О2
• CuS + О2 =>
СuО + SО2
19. Выполните проверку
• KMnO4 > K2 MnО4 + MnО2 + О2О-2 Восстановитель
• CuS + О2 => СuО + SО2
S-2 Восстановитель













 Химия
Химия








