Похожие презентации:
Углеводы. Моносахариды
1. УГЛЕВОДЫ. Моносахариды
2.
Углеводы – класс природных кислородсодержащих органическихсоединений, состав которых обычно соответствует эмпирической формуле
Сn(H2O)m (т.е. углерод + вода), где n и m≥3.
Моносахариды – углеводы, не подвергающиеся гидролизу с образованием
более простых соединений, являются основной составной частью
олигосахаридов и полисахаридов.
Олигосахариды – состоят из нескольких остатков молекул моносахаридов
(как правило, от 2 до 10). По свойствам напоминают моносахариды.
При гидролизе превращаются в моносахариды.
Полисахариды – высокомолекулярные соединения, молекулы которых состоят
из сотен и тысяч остатков молекул моносахаридов. По свойствам существенно
отличаются от моносахаридов. Полный гидролиз полисахаридов приводит к
моносахаридам.
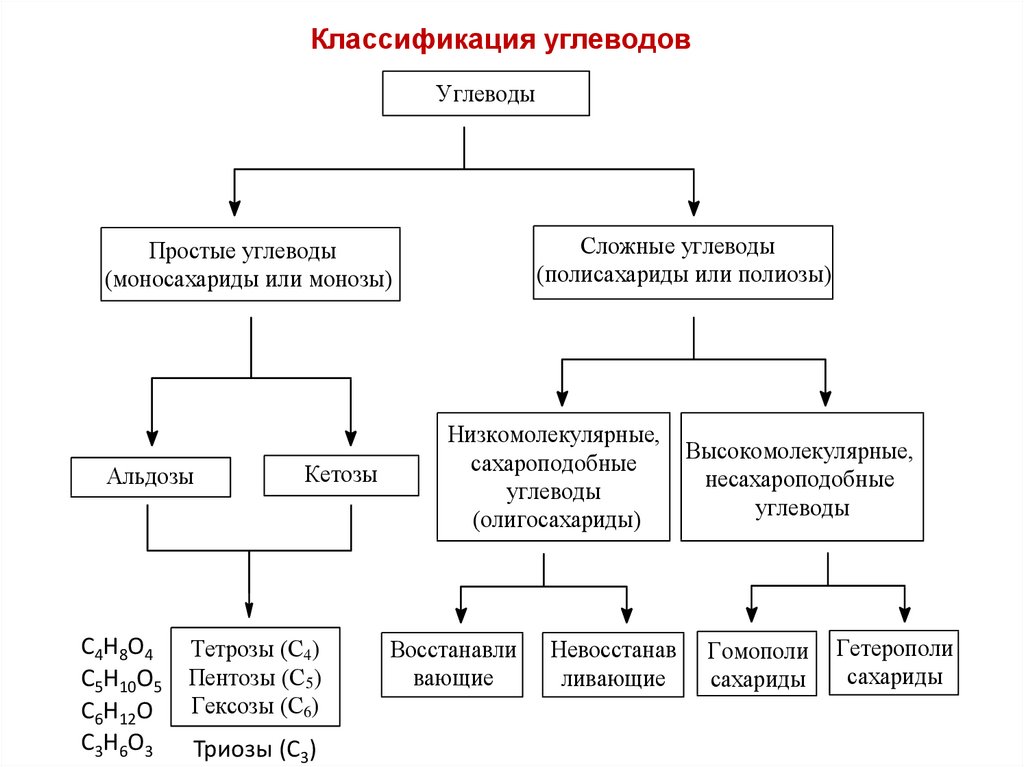
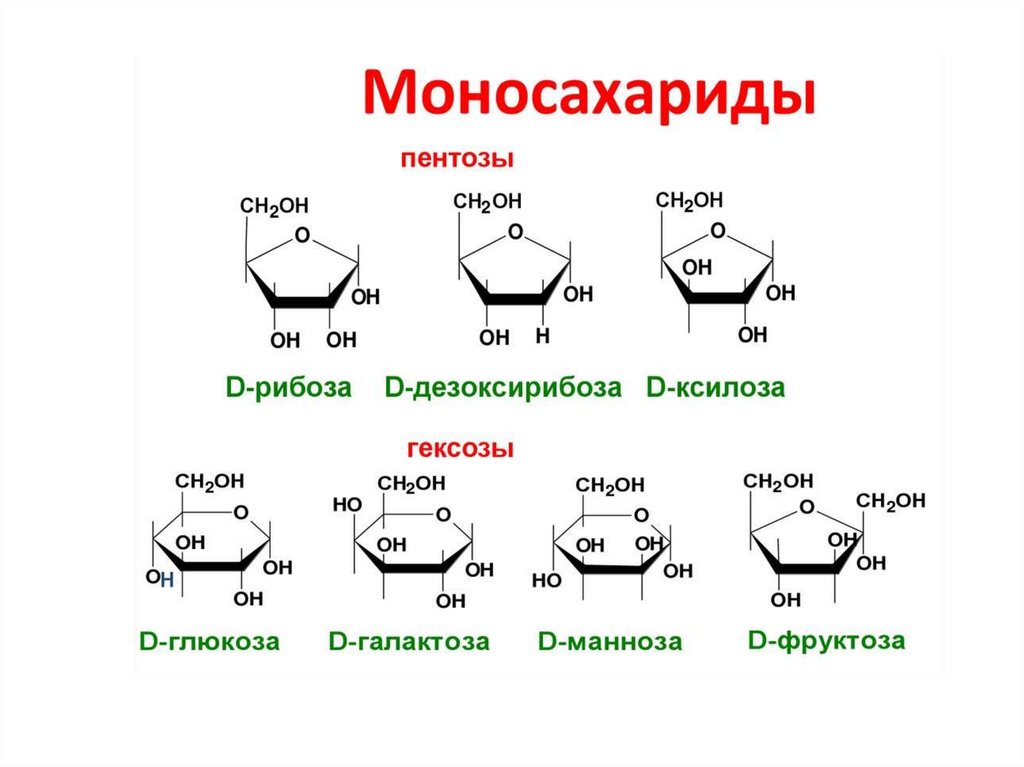
3. Классификация углеводов
УглеводыСложные углеводы
(полисахариды или полиозы)
Простые углеводы
(моносахариды или монозы)
Альдозы
C4H8O4
C5H10O5
C6H12O
C3H6O3
Кетозы
Тетрозы (С4)
Пентозы (С5)
Гексозы (С6)
Триозы (С3)
Низкомолекулярные,
сахароподобные
углеводы
(олигосахариды)
Восстанавли
вающие
Невосстанав
ливающие
Высокомолекулярные,
несахароподобные
углеводы
Гомополи
сахариды
Гетерополи
сахариды
4.
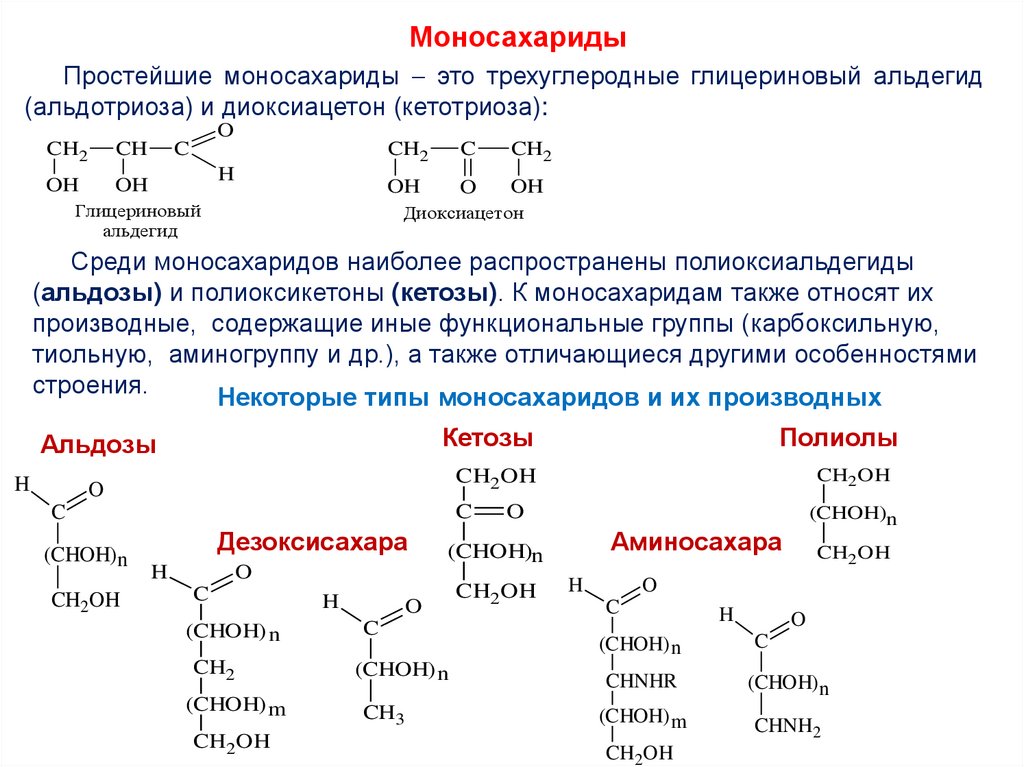
МоносахаридыПростейшие моносахариды это трехуглеродные глицериновый альдегид
(альдотриоза) и диоксиацетон (кетотриоза):
O
CH2
CH
OH
OH
C
H
Глицериновый
альдегид
CH2
C
CH2
OH
O
OH
Диоксиацетон
Среди моносахаридов наиболее распространены полиоксиальдегиды
(альдозы) и полиоксикетоны (кетозы). К моносахаридам также относят их
производные, содержащие иные функциональные группы (карбоксильную,
тиольную, аминогруппу и др.), а также отличающиеся другими особенностями
строения.
Некоторые типы моносахаридов и их производных
Кетозы
Альдозы
H
C
C
CH2OH
CH2OH
CH2OH
O
(CHOH)n
Полиолы
Дезоксисахара
H
O
C
(CHOH) n
CH2
(CHOH) m
CH2OH
H
C
(CHOH) n
CH2OH
(CHOH)n
Аминосахара
(CHOH)n
O
CH3
O
H
CH2OH
O
C
(CHOH) n
H
O
C
CHNHR
(CHOH) n
(CHOH) m
CHNH2
CH2OH
5.
Стероизомерия углеводовВ качестве конфигурационного стандарта используют глицериновый альдегид.
O
*
CH2
CH
OH
OH
Общее число оптических изомеров : N = 2n
C
H
Для представления оптических изомеров используют формулы Фишера:
H
*
OH
CH2OH
D-Глицериновый
альдегид
HO
*
H
CH2OH
L-Глицериновый
альдегид
D
D
CHO
А
C
E
B
зеркало
CHO
B
C
А
E
Построение проекционных формул:
1) Формулу соединения проецируют на плоскость таким образом, чтобы
цепь углеродных атомов располагалась вертикально.
2) С-атом с наименьшим порядковым номером (входящий в состав старшей
функциональной группы) должен быть вверху.
3) Два заместителя у асимметрического атома углерода должны
располагаться слева и справа.
4) Если OH-группа находится справа, то это D-изомер, если слева
L-изомер.
5) При этом символы D и L не имеют никакого отношения к знаку
вращения, т. е. возможны случаи D (+) и D ( ), а также L (+) и L ( ).
6.
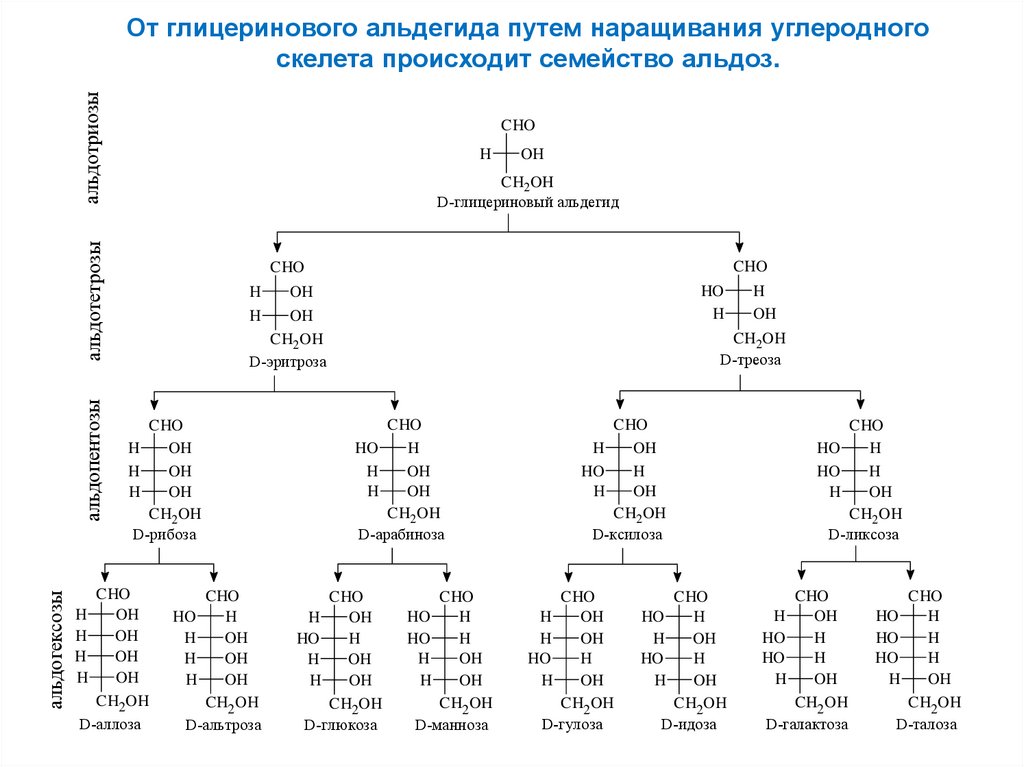
альдотриозыОт глицеринового альдегида путем наращивания углеродного
скелета происходит семейство альдоз.
CHO
H
альдогексозы
альдопентозы
альдотетрозы
CH2OH
D-глицериновый альдегид
CHO
CHO
H
HO
H
OH
H
OH
CH2OH
D-эритроза
CHO
H
OH
H
OH
H
OH
CH2OH
D-рибоза
CHO
OH
OH
OH
OH
CH2OH
D-аллоза
H
H
H
H
OH
CHO
HO
H
H
OH
H
OH
H
OH
CH2OH
D-альтроза
H
OH
CH2OH
D-треоза
CHO
HO
H
H
OH
H
OH
CH2OH
D-арабиноза
CHO
H
OH
HO
H
H
OH
H
OH
CH2OH
D-глюкоза
CHO
HO
H
HO
H
H
OH
H
OH
CH2OH
D-манноза
CHO
H
OH
HO
H
H
OH
CH2OH
D-ксилоза
CHO
H
OH
H
OH
HO
H
H
OH
CH2OH
D-гулоза
CHO
HO
H
H
OH
HO
H
H
OH
CH2OH
D-идоза
CHO
HO
H
HO
H
H
OH
CH2OH
D-ликсоза
CHO
H
OH
HO
H
HO
H
H
OH
CH2OH
D-галактоза
CHO
HO
H
HO
H
HO
H
H
OH
CH2OH
D-талоза
7.
При помощи проекций Фишера изображаются, в основном, моносахариды,имеющие открытое, незамкнутое строение.
CHO
H
OH
HO
H
H
OH
H
OH
CH2OH
D-глюкоза
CHO
HO
H
H
OH
HO
H
HO
H
CH2OH
L-глюкоза
!! Если конфигурация наиболее
удаленного атома С* совпадает с
конфигурацией D – глицеринового
альдегида, то углевод относят к D ряду,
другой – к L-ряду.
Среди оптических изомеров различают:
1) Энантиомеры пространственные изомеры, молекулы которых
являются несовместимыми зеркальными антиподами.
Энантиомеры имеют одинаковые физические и химические свойства, но
отличаются по оптической и биологической активности.
H
O
C
H
H
H
H
O
C
OH
OH
OH
CH2OH
D-рибоза
HO
HO
HO
H
H
H
CH2OH
L-рибоза
Смесь энантиомеров в соотношении 1:1 оптической активностью не обладает
и называется рацемической.
8.
2) Эпимеры пространственные изомеры, молекулы которых различаютсяконфигурацией заместителей у одного асимметрического атома углерода.
Эпимеры отличаются по физическим и химическим свойствам.
H
O
C
2
H
H
H
O
C
OH
OH
OH
CH 2OH
D-рибоза
H
H
O
2
HO
H
H
CH 2OH
D-арабиноза
H
HO
O
C
C
H
H
OH
OH
OH
HO
H
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза
CH2OH
D-манноза
эпимеры по 2-му
атому углерода
9.
3) Диастереомеры пространственные изомеры, молекулы которыхразличаются конфигурацией заместителей у двух и более асимметрических
атомов углерода.
Диастереомеры также отличаются по физическим и химическим свойствам.
H
O
H
O
C
C
OH
HO
H
HO
H
HO
H
HO
H
H
OH
OH
H
OH
H
H
CH2OH
D-галактоза
диастереомеры
по 2-му и 4-му
атомам углерода
CH2OH
D-манноза
Асимметрия молекул приводит к тому, что низшие моносахариды трудно
кристаллизуются. Так, для включения молекулы в кристаллическую решетку
требуется ее единственная конфигурация, а в рацемической смеси
присутствует набор по-разному ориентированных молекул.
10.
Циклические формы.Построение проекций Хеуорса
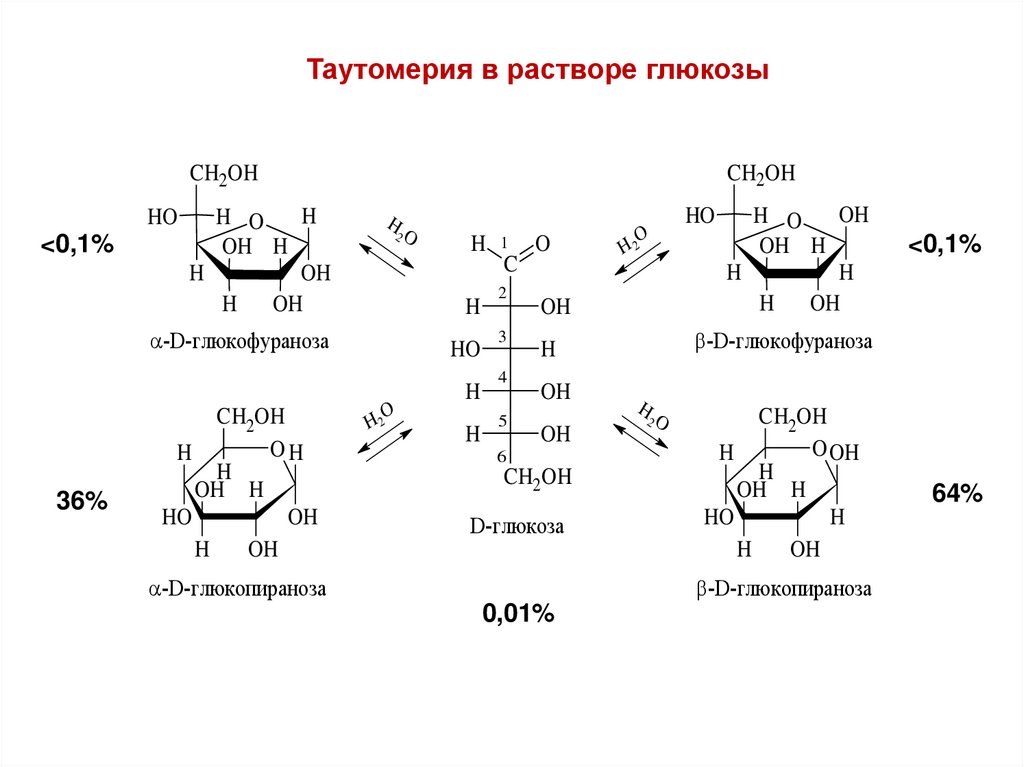
Истинное строение моносахаридов не отражается открытыми формулами, так
как они являются таутомерными смесями открытой и циклической форм с
преобладанием последних. Так, в растворе глюкозы содержится около 0,024%
открытой, альдегидной формы, в растворе рибозы - 8,5% альдегидной
формы. Кетозы содержат открытую форму в большей степени, чем альдозы.
Впервые предположение о внутримолекулярном присоединении гидроксильной
группы по карбонильной группе глюкозы с образованием трехчленного
этиленоксидного цикла сделал А. Колли (1870), а Б. Толленс (1883) предложил
формулу с пятичленным циклом. У. Хеуорс в 1925-1930 годах экспериментально
определил размер цикла для некоторых моносахаридов.
11.
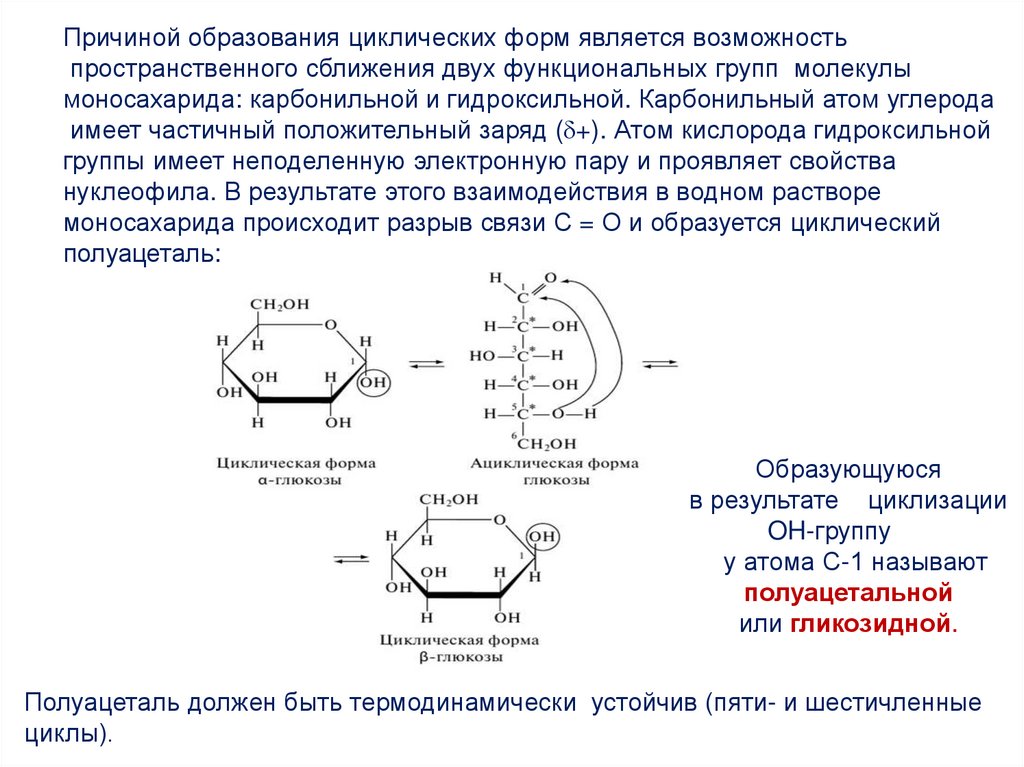
Причиной образования циклических форм является возможностьпространственного сближения двух функциональных групп молекулы
моносахарида: карбонильной и гидроксильной. Карбонильный атом углерода
имеет частичный положительный заряд ( +). Атом кислорода гидроксильной
группы имеет неподеленную электронную пару и проявляет свойства
нуклеофила. В результате этого взаимодействия в водном растворе
моносахарида происходит разрыв связи С = О и образуется циклический
полуацеталь:
Образующуюся
в результате циклизации
OH-группу
у атома С-1 называют
полуацетальной
или гликозидной.
Полуацеталь должен быть термодинамически устойчив (пяти- и шестичленные
циклы).
12.
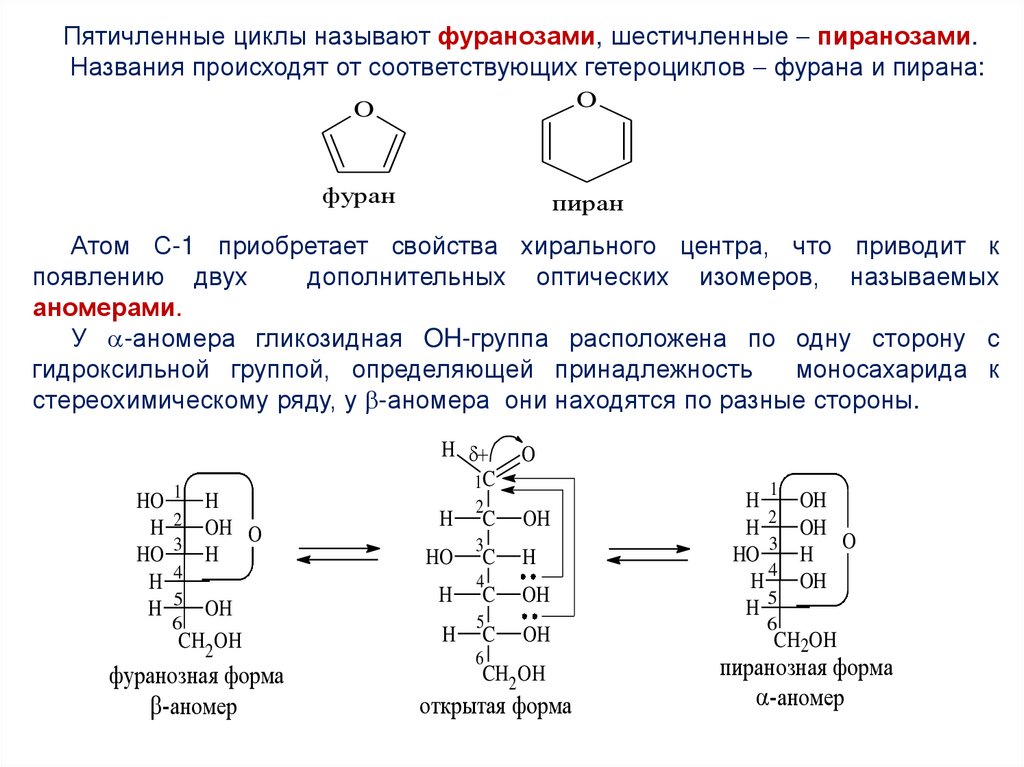
Пятичленные циклы называют фуранозами, шестичленные пиранозами.Названия происходят от соответствующих гетероциклов фурана и пирана:
O
O
фуран
пиран
Атом С-1 приобретает свойства хирального центра, что приводит к
появлению двух
дополнительных оптических изомеров, называемых
аномерами.
У -аномера гликозидная OH-группа расположена по одну сторону с
гидроксильной группой, определяющей принадлежность
моносахарида к
стереохимическому ряду, у -аномера они находятся по разные стороны.
HO
H
HO
H
H
1
H
2 OH
O
3
H
4
5
6
OH
CH2OH
фуранозная форма
-аномер
H
1C
H
HO
H
H
2
C
3
C
4
C
5
C
O
1
OH
H
OH
OH
6
CH2OH
открытая форма
H
OH
2
H
OH
O
3
HO
H
4
H
OH
5
H
6
CH2OH
пиранозная форма
-аномер
13.
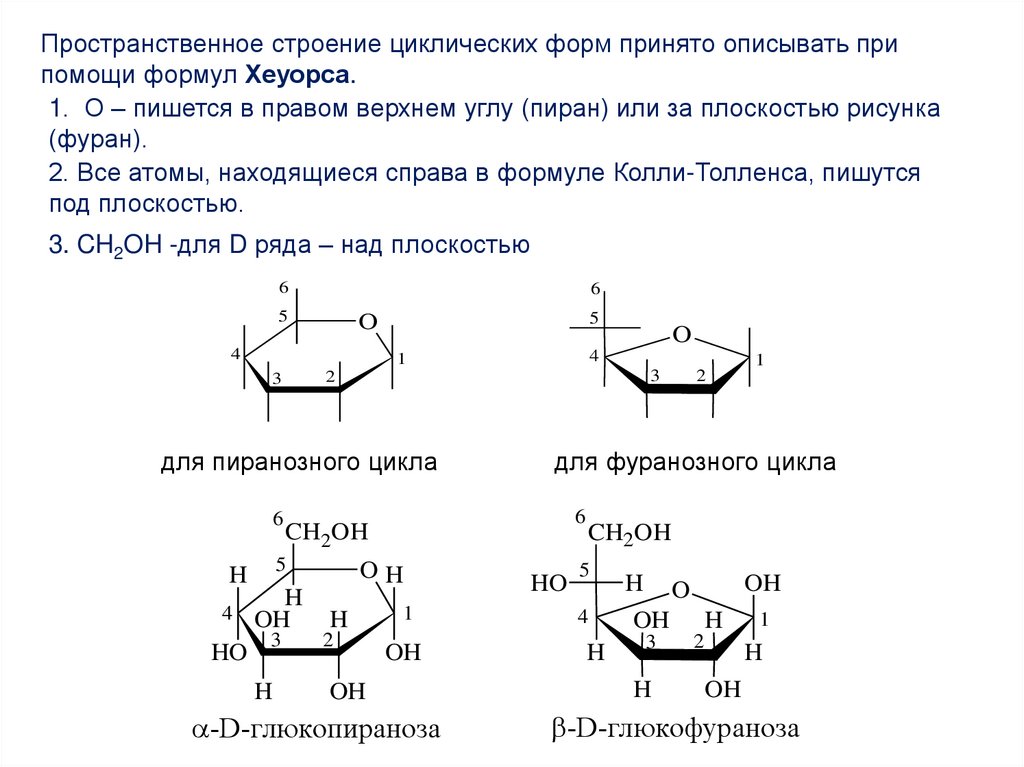
Пространственное строение циклических форм принято описывать припомощи формул Хеуорса.
1. О – пишется в правом верхнем углу (пиран) или за плоскостью рисунка
(фуран).
2. Все атомы, находящиеся справа в формуле Колли-Толленса, пишутся
под плоскостью.
3. CH2OH -для D ряда – над плоскостью
6
6
5
5
O
4
1
для пиранозного цикла
H
4 OH
H
3
2
HO
H
6
OH
1
OH
OH
-D-глюкопираноза
2
для фуранозного цикла
CH2OH
5
H
1
3
2
3
6
O
4
HO
CH2OH
5
4
H
H
OH
O
OH
3
H
H
2
1
H
OH
-D-глюкофураноза
14.
Названия циклических форм строятся следующим образом:* сначала указывают положение полуацетального гидроксила ( - или -),
* затем принадлежность сахарида к стереохимическому ряду (D- или L-),
* далее в корень тривиального названия сахарида вставляют
смысловую часть названия цикла (-фуран- или -пиран-),
* заканчивая название суффиксом -оза.
В случаях, когда аномеризация не уточняется или речь идет о равновесной
смеси аномеров, положение гликозидной группы обозначается
волнистой линией:
CH2OH
O
H
H
OH
OH H
HO
H
OH
- и (или) -D-глюкопираноза
15.
Таутомерия моносахаридов. МутаротацияВ целом, пиранозные циклы более устойчивы, чем фуранозные, а в
полярных растворителях более устойчивы -аномеры благодаря
экваториальной конформации заместителей.
В водном растворе возможны взаимные превращения фуранозных
циклов в пиранозные, а -аномеров в -аномеры, и наоборот.
Такое динамическое равновесие между открытой и циклическими формами
моносахарида называется цикло-оксо-таутомерией.
Взаимопревращение - и -аномеров называется аномеризацией.
Внешним проявлением этого процесса является постепенное изменение угла
оптического вращения раствора до достижения равновесного значения.
Изменение угла вращения плоскости поляризованного света в растворе
моносахарида называется мутаротацией.
Поляриметр
Автоматический цифровой поляриметр
16.
17.
Таутомерия в растворе глюкозыCH2OH
CH2OH
HO
<0,1%
H
H O
OH H
H
OH
H
OH
HO
H
2O
H
H
-D-глюкофураноза
HO
H
36%
CH2OH
OH
H
H
OH H
HO
OH
H
OH
H
O
2
H
1
C
2
3
4
5
O
H
O
2
OH
OH
6
CH2OH
D-глюкоза
H
2O
CH2OH
O OH
H
H
OH H
HO
H
H
OH
-D-глюкопираноза
-D-глюкопираноза
0,01%
<0,1%
-D-глюкофураноза
H
OH
OH
H O
OH H
H
H
H
OH
64%
18.
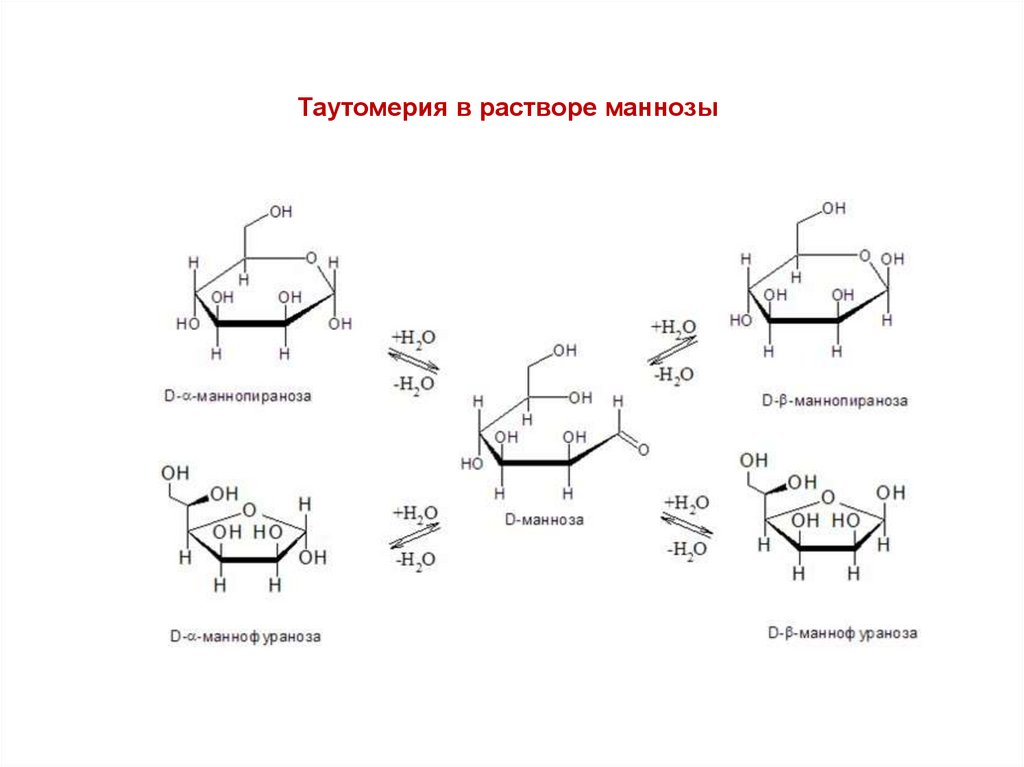
Таутомерия в растворе маннозы19.
Таутомерия в растворе галактозы20.
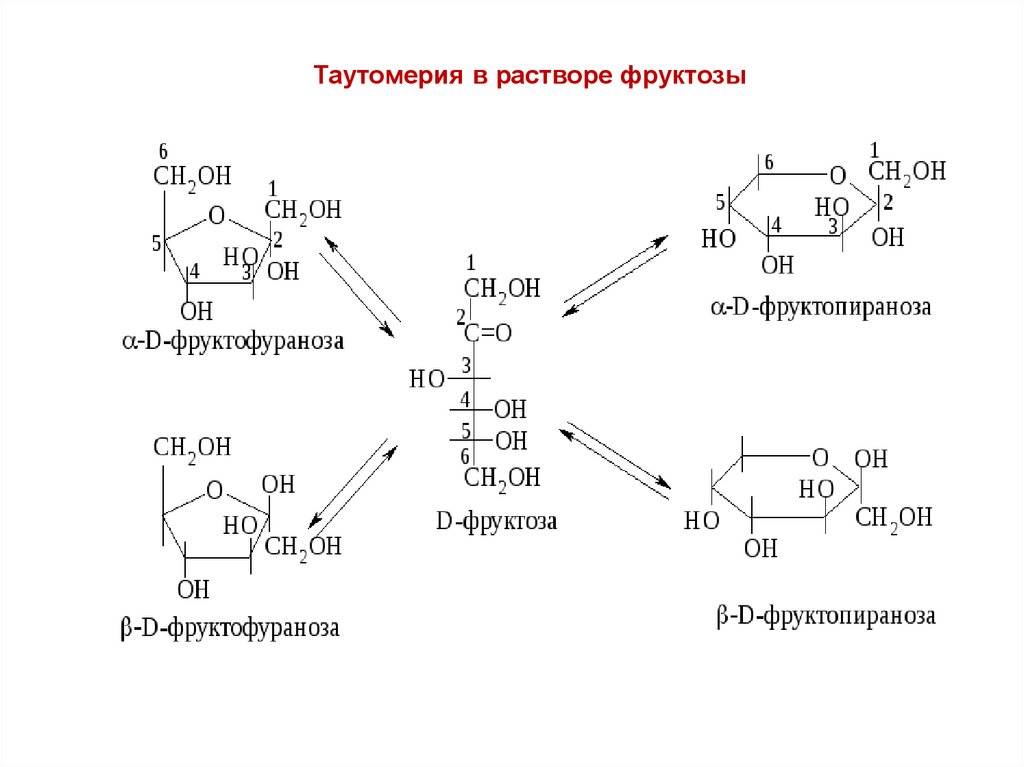
Таутомерия в растворе фруктозы21.
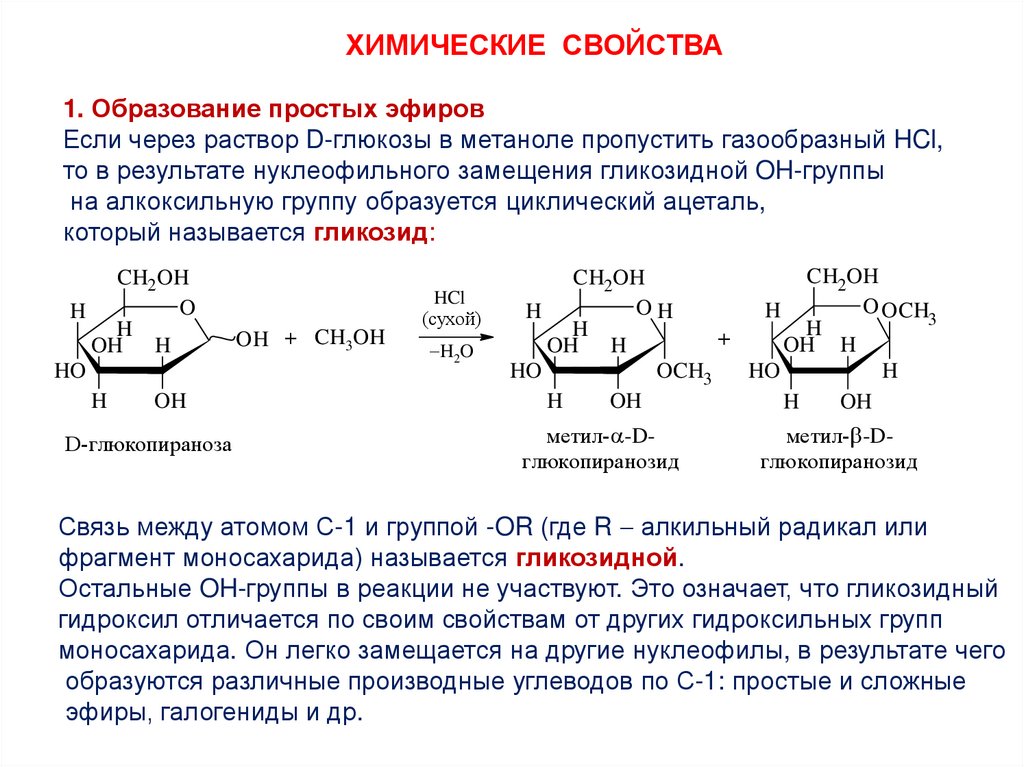
ХИМИЧЕСКИЕ СВОЙСТВА1. Образование простых эфиров
Если через раствор D-глюкозы в метаноле пропустить газообразный HCl,
то в результате нуклеофильного замещения гликозидной OH-группы
на алкоксильную группу образуется циклический ацеталь,
который называется гликозид:
CH2OH
O
H
H
OH H
HO
H
OH
D-глюкопираноза
OH + CH3OH
HCl
(сухой)
H2O
CH2OH
CH2OH
O OCH
OH
H
H
3
H
H
+
OH H
OH H
HO
OCH3
HO
H
H
OH
H
OH
метил- -Dглюкопиранозид
метил- -Dглюкопиранозид
Связь между атомом С-1 и группой -OR (где R алкильный радикал или
фрагмент моносахарида) называется гликозидной.
Остальные OH-группы в реакции не участвуют. Это означает, что гликозидный
гидроксил отличается по своим свойствам от других гидроксильных групп
моносахарида. Он легко замещается на другие нуклеофилы, в результате чего
образуются различные производные углеводов по С-1: простые и сложные
эфиры, галогениды и др.
22.
Нуклеофильной атаке подвергается атом С-1, который является хиральнымцентром. В отсутствии специфических условий протекания реакции (н.р.,
ферментативного катализа) это приводит к образованию рацемической смеси, в
данном состоящей из двух аномеров.
В названии гликозида указываются алкильный заместитель (н.р., метил-),
аномер ( - или -), моносахарид (например, глюко-) и циклическая форма
(пирано- или фурано-), суффикс -оза заменяется на -озид.
В отсутствие свободной полуацетальной OH-группы переход в открытую
форму невозможен. Следовательно, гликозиды не способны к цикло-оксотаутомерии и их растворы не мутаротируют.
В более жестких условиях в реакцию вступают все гидроксильные группы
углевода.
CH2OH
O
OH
H
OH
OH
H
H
H
OH
D-галактопираноза
+ 5CH3I
5 KOH
-5 КI
-5 Н2О
CH2OCH 3
CH3O
O
H
OCH 3 H
H
OCH 3
H
OCH 3
метил-2,3,4,6-тетра-O-метил - (или -) D-галактопиранозид
23.
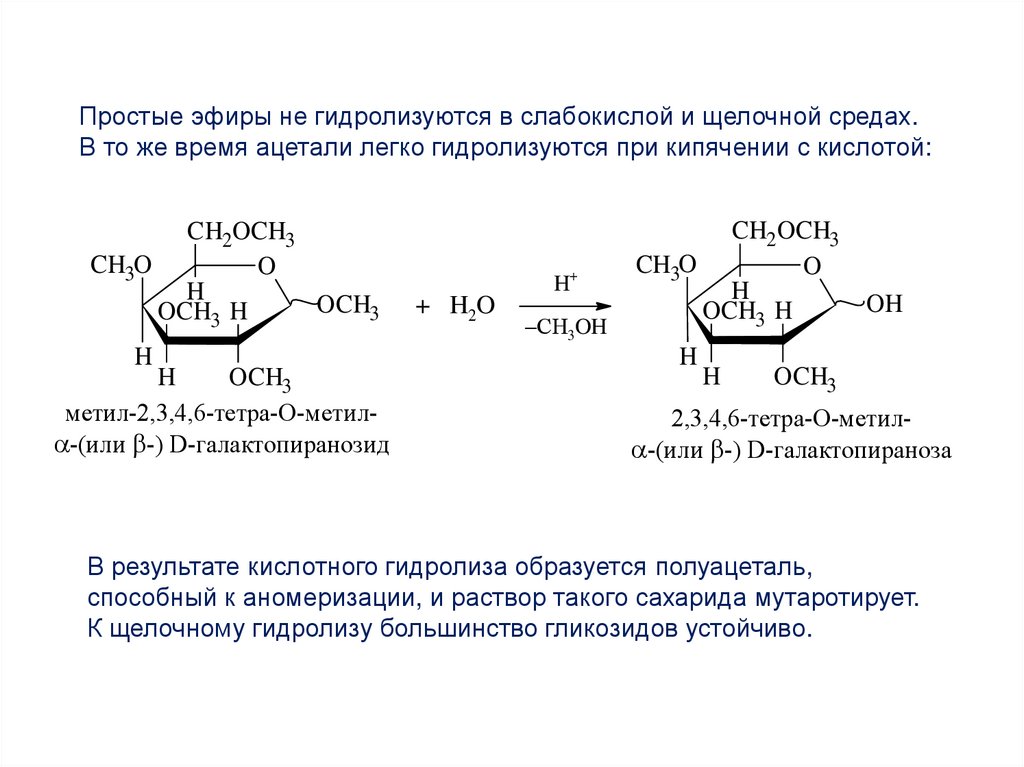
Простые эфиры не гидролизуются в слабокислой и щелочной средах.В то же время ацетали легко гидролизуются при кипячении с кислотой:
CH2OCH3
CH3O
O
H
OCH3
OCH3 H
H
H
OCH3
метил-2,3,4,6-тетра-O-метил -(или -) D-галактопиранозид
+ H2O
H+
СH3OH
CH2OCH3
CH3O
O
H
OCH3 H
H
H
OH
OCH3
2,3,4,6-тетра-O-метил -(или -) D-галактопираноза
В результате кислотного гидролиза образуется полуацеталь,
способный к аномеризации, и раствор такого сахарида мутаротирует.
К щелочному гидролизу большинство гликозидов устойчиво.
24.
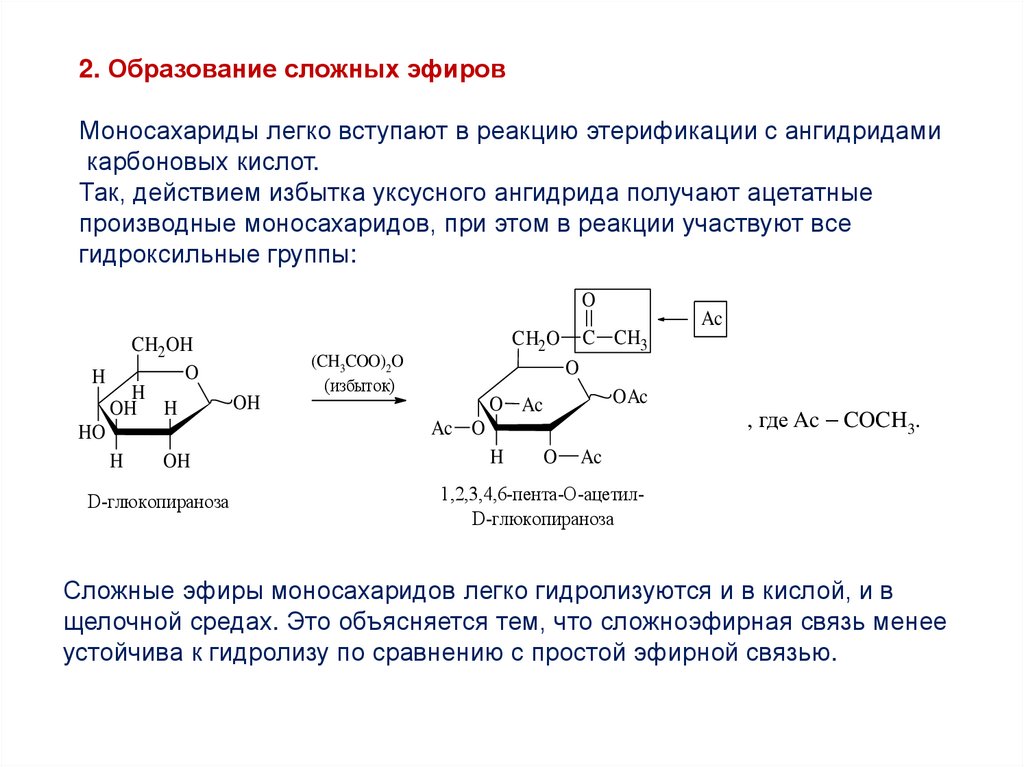
2. Образование сложных эфировМоносахариды легко вступают в реакцию этерификации с ангидридами
карбоновых кислот.
Так, действием избытка уксусного ангидрида получают ацетатные
производные моносахаридов, при этом в реакции участвуют все
гидроксильные группы:
O
Ac
CH2OH
O
H
H
OH H
HO
H
OH
D-глюкопираноза
C CH3
CH2O
OH
(CH3COO)2O
(избыток)
O
OAc
O Ac
Ac O
H
O
, где Ac COCH3.
Ac
1,2,3,4,6-пента-O-ацетилD-глюкопираноза
Сложные эфиры моносахаридов легко гидролизуются и в кислой, и в
щелочной средах. Это объясняется тем, что сложноэфирная связь менее
устойчива к гидролизу по сравнению с простой эфирной связью.
25.
3. Реакции по карбонильной группе.Укорачивание цепи моносахарида
Несмотря на то, что в смеси таутомерных форм равновесие сдвинуто в
сторону образования
циклических форм, в растворе моносахарида
присутствует некоторое количество ациклической (открытой) формы, что
позволяет ему вступать в реакции, характерные для альдегидов и кетонов.
Так, при взаимодействии сахаридов с гидроксиламином образуется смесь
оксимов циклических и ациклических форм.
При действии на них уксусного ангидрида одновременно происходят
ацетилирование и дегидратация с образованием нитрила.
Обработка полученного нитрила метилатом натрия приводит к
дезацетилированию и отщеплению молекулы HCN:
H
HO
HO
H
CHO
OH
NH2 OH
H
H
OH
CH2OH
D-галактоза
HC N OH
H
OH
HO
H
(CH3COO)2O
HO
H
H
OH
CH2OH
оксим
C
H
AcO
AcO
H
N
OAc
H
CH3ONa
H
HCN
OAc
CH2OAc
CHO
HO
H
HO
H
H
OH
CH2OH
нитрил
Таким способом углеродная цепь альдозы укорачивается на один атом углерода.
D-ликсоза
26.
Удлинение цепи моносахаридаУдлинение углеродной цепи можно осуществить циангидринным методом.
Взаимодействие альдозы с цианидом натрия приводит к образованию смеси
двух изомерных нитрилов, которые легко гидролизуются в альдоновые
кислоты. Последние при восстановлении амальгамой натрия
дают альдозы:
CHO
H
OH
HO
H
HO
H
CH2OH
L-арабиноза
H2 O
H
H
HO
HO
NaCN
COOH
OH
OH
+
H
H
CH2OH
L-манноновая
кислота
H
H
HO
HO
HO
H
HO
HO
CN
OH
OH +
H
H
CH2OH
COOH
H
OH
H
H
CH2OH
L-глюконовая
кислота
Na/Hg
HO
H
HO
HO
CN
H
OH
H
H
CH2OH
H
H
HO
HO
H2O
CHO
OH
OH
+
H
H
CH2OH
L-манноза
HO
H
HO
HO
CHO
H
OH
H
H
CH2OH
L-глюкоза
В обоих случаях конфигурация хиральных центров, не участвующих
в превращениях, сохраняется.
27.
4. Реакции окисления-восстановленияПри восстановлении альдегидной или кето-группы моносахаридов образуются
многоатомные спирты. Альдозы образуют один полиол, кетозы дают
смесь двух стереоизомеров.
CHO
CH2OH
H
OH
HO
H
H
OH
H2/Pt
H
HO
OH
H
H
OH
CH2OH
CH2OH
D-ксилоза
D-ксилит
CH2OH
C
CH2OH
O
HO
H
H
OH
H
OH
CH2OH
D-фруктоза
NaBH4
H
OH
HO
H
H
OH
H
OH
CH2OH
D-сорбит
CH2OH
+
HO
H
HO
H
H
OH
H
OH
CH2OH
D-маннит
Спирты представляют собой кристаллические вещества, хорошо
растворяются в воде, обладают сладким вкусом и используются как заменители
сахара при сахарном диабете (ксилит, сорбит).
28.
В щелочной среде моносахариды при нагревании окисляются реактивамиТолленса, Бенедикта и Фелинга. Окисление в щелочной среде, как правило,
приводит к разрушению молекулы моносахарида, поэтому эти реакции
используются только для их качественного обнаружения. Принцип действия
реактивов основан на восстановлении катионов Ag+ (реактив Толленса)
и Cu2+ (реактивы Бенедикта и Фелинга), что сопровождается образованием
характерных осадков Ag и Cu2О (красно-кирпичного цвета):
O
HOH 2C
(CHOH) n C
альдоза
+
H
2+
Cu
t0C
реактив
Бенедикта
Cu2O
+
осадок
краснокирпичного
цвета
продукты окисления
+
продукты окисления
O
HOH2C
(CHOH)n C
+
H
альдоза
[Ag(NH3)2]OH
Ag
реактив
Толленса
Реактивы Толленса, Бенедикта и Фелинга используются в биохимических
лабораториях как тесты для обнаружения альдоз и кетоз в биологических
жидкостях (крови, моче). Гликозиды в такие реакции не вступают.
29.
Окисление в нейтральной или кислой среде позволяет сохранить углеродныйскелет.
При окислении в мягких условиях, н.р., бромной водой, окисляется
карбонильная группа до карбоксильной, при этом гидроксильные группы
не затрагиваются. Образующиеся при этом кислоты называют альдоновыми.
CHO
Br2/H2O
COOH
(CHOH)n
(CHOH)n
CH2OH
CH2OH
альдоза
альдоновая кислота
Использование сильного окислителя, н.р., разбавленной азотной кислоты,
позволяет окислить обе концевые группы карбонильную и первичную
спиртовую до карбоксильных. Образующиеся при этом кислоты называют
альдаровыми.
H
HO
H
H
CHO
OH
H
OH
OH
CH2OH
D-глюкоза
HNO3
разб.
H
HO
H
H
COOH
OH
H
OH
OH
COOH
D-глюкаровая кислота
30.
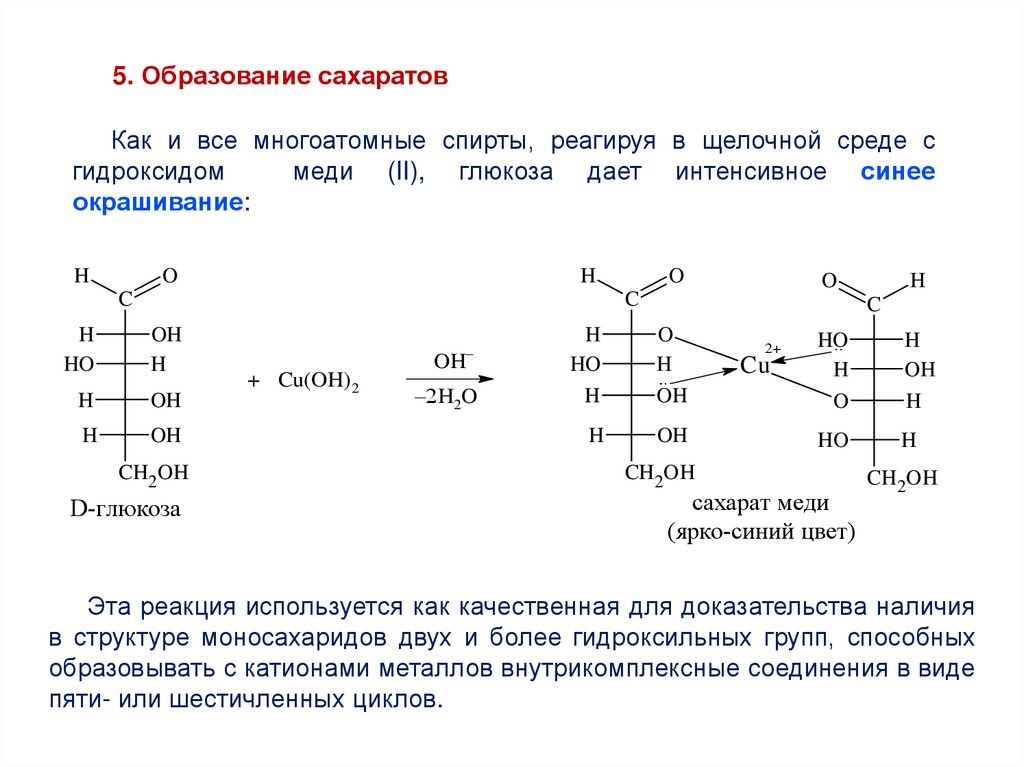
5. Образование сахаратовКак и все многоатомные спирты, реагируя в щелочной среде с
гидроксидом
меди (II), глюкоза дает интенсивное синее
окрашивание:
H
O
H
C
O
O
C
H
HO
OH
H
H
OH
H
OH
CH2OH
D-глюкоза
+ Cu(OH)2
OH
H2O
H
C
H
HO
H
O
H
OH
H
OH
CH2OH
2+
Cu
HO
H
O
H
OH
H
HO
H
сахарат меди
(ярко-синий цвет)
CH2OH
Эта реакция используется как качественная для доказательства наличия
в структуре моносахаридов двух и более гидроксильных групп, способных
образовывать с катионами металлов внутрикомплексные соединения в виде
пяти- или шестичленных циклов.
31.
6. Специфические реакции моносахаридовОтдельные представители могут принимать участие в специфических
процессах. Таковым является, н.р., брожение ферментативное расщепление
молекул сахаров. Брожению подвергаются сахара с числом углеродных атомов,
кратным трем. Н.р., для глюкозы существует несколько видов брожения:
спиртовое, молочнокислое, маслянокислое и лимоннокислое.
В результате спиртового брожения гексоз (для пентоз эта реакция не
характерна) образуется этиловый спирт:
C6H12O6
зимаза
2C2H5OH
Молочнокислое брожение
молочнокислых продуктов:
C6H12O6
молочнокислые
бактерии
+
2CO2
протекает
при
O
2 H3C
CH
C
OH
OH
молочная кислота
выработке
различных
32.
Задания1. Для моносахарида, представленного в открытой форме:
H
1
O
C
H
HO
HO
H
2
3
4
5
OH
H
H
OH
6
CH2OH
1) Дайте название по международной и тривиальной номенклатуре.
2) Определите число асимметрических атомов углерода (хиральных центров) в
молекуле моносахарида и общее число его оптических изомеров.
3) Приведите примеры его энантиомера, а также эпимера и диастереомера
(по одному в пределах D-ряда) в проекциях Фишера и назовите их по тривиальной
номенклатуре.
4) Представьте его α-D-фуранозную и β-D-пиранозную формы в проекциях Хеуорса
33.
2. Осуществите следующую цепочку превращений:исчерпывающее
кислотный
гидролиз
метилирование
α-D-маннопираноза
метилгликозид
А
В
3. В двух пробирках находятся растворы D-глюкозы и D-фруктозы.
Предложите способ, при помощи которого можно распознать содержимое
пробирок. Ответ подтвердите схемами реакций.
4. Проведите реакции окисления D-маннозы до альдоновой, альдаровой
кислот, а также реакцию восстановления альдегидной группы.



















 Химия
Химия








